Manual básico de laboratorio clínico
- Servicios del laboratorio
clínico - Bioseguridad
- Microorganismos
- Sangre
- Anticoagulantes
- Recolección de muestras
de sangre - Cuadro
hemático - Uroanálisis
- Coproanálisis
- Valores de
referencia de analisis bioquimicos - Enfermedades
de tractos reproductores - Enfermedades
de transmisión sexual (ets) - Bibliografía
El Laboratorio
Clínico es una herramienta primordial para el área
medica, ya que por medio de este se diagnostican diferentes
patologías y además se realizan estudios para
establecer el tipo de tratamiento que se debe administrar al
paciente, al igual que el seguimiento del mismo.
En este curso de Laboratorio Clínico, se pretende
dar a conocer todas las áreas manejadas en un laboratorio,
la lectura de
los diferentes exámenes, el procesamiento y toma de las
muestras, sin olvidar la parte humana que definitivamente es tan
importante como cualquier otra.

El paciente o usuario llega al Laboratorio para
realizarse sus exámenes clínicos, del
Bacteriólogo y del Auxiliar depende que este usuario
reciba el servicio
adecuado en todo sentido, ya sea científico o humano, el
profesional de la salud debe estar en
condiciones de proporcionar una ayuda integral.
Con la guía y ayuda del docente se pretende
resolver a cabalidad las dudas que los alumnos puedan presentar,
se espera cumplir con las expectativas de fructificar y
enriquecer el
conocimiento en el área de la salud, para colocar en
practica lo aprendido en cualquier situación, prestando
una ayuda al paciente.
SERVICIOS DEL
LABORATORIO CLINICO
Cada examen de laboratorio clínico debe ser
realizado a los pacientes de forma individual, guiándose
siempre por los parámetros profesionales y éticos.
Básicamente, el trabajo en
el laboratorio clínico se clasifica en tres grandes
grupos
temáticos:
1. Toma de muestras.
2.Análisis de las muestras.
3.Entrega de resultados.
En cada uno de estos temas, se requiere de numerosas
medidas de atención y cuidado, con el fin de minimizar
al máximo los errores factibles de ser cometidos en la
práctica diaria. Se debe enfatizar que el trabajo en
el laboratorio clínico, como cualquier tipo de trabajo, es
realizado por seres humanos y no se esta exento de cometer
equivocaciones. Pero estas equivocaciones pueden ser erradicadas
de los laboratorios clínicos, si se mantienen eficientes
actitudes
éticas, profesionales y de procedimiento.
RAZONES PARA UTILIZAR LOS SERVICIOS DEL
LABORATORIO CLÍNICO
1.Descubrir enfermedades en etapas
subclínicas
2.Ratificar un diagnostico sospechado clínicamente.
3.Obtener información sobre el pronóstico de
una enfermedad.
4.Establecer un diagnóstico basado en una sospecha bien
definida.
5.Vigilar un tratamiento o conocer una determinada respuesta
terapéutica.
6.Precisar factores de riesgo.
Son todos los procedimientos y
acciones que
garantizan una mejor calidad de
vida, tanto del profesional, del paciente y del medio
ambiente.
METODOS DE BARRERA
- Bata
- Guantes
- Tapabocas
- Gorro
- Gafas
- Careta
- Peto
CONSIDERACIONES PARA SU PROTECCIÓN
PERSONAL
Todas las muestras de especimenes biológicos
deben considerarse potencialmente infecciosas.
Vacunarse contra los principales agentes
infecciosos.
Procurar no producir "salpicaduras" con la muestra obtenida.
Debe limpiarse y desinfectarse cualquier superficie contaminada
por algún espécimen biológico.
Lavarse las manos correctamente, después de haber
tenido contacto con cada paciente y al concluir cualquier
procedimiento.
No deben ingerirse comidas, bebidas, goma de mascar o
fumar durante los diferentes procedimientos en
el Laboratorio.
Vigile que los elementos de trabajo estén en
perfectas condiciones físicas. Algún elemento en
mal estado,
podría causarle una herida.
ESTERILIZACIÓN
Proceso mediante el cual se eliminan todas las formas de
vida de los microorganismos de un objeto o de una sustancia para
evitar su reproducción.
ASEPSIA: Libre de microorganismos.
MÉTODOS DE
ESTERILIZACIÓN
Comprende todos los procedimientos físicos,
mecánicos y preferentemente químicos, que se
emplean para destruir gérmenes patógenos. A
través de esta, los materiales
quirúrgicos y la piel del
enfermo alcanzan un estado de
desinfección que evita la
contaminación operatoria. Hay varias formas de
esterilizar como:
MÉTODOS QUÍMICOS
Estos métodos
provocan la perdida de viabilidad de los
microorganismos.
Hipoclorito de Sodio: Es el mas utilizado por su
fácil adquisición y por su efectividad en la
desinfección. Vida media 20 minutos.
Oxido de etileno: Destruye todos los microorganismos incluso
virus.
Aldehídos: Son agentes alquilantes que
actúan sobre las proteínas.
Estos compuestos destruyen las esporas. Glutaraldehído:
Este método
tiene la ventaja de ser rápido y ser el único
esterilizante efectivo frío. Formaldehído: Las
pastillas de formalina a temperatura
ambiente
esterilizan en 36 horas. Gas-plasma de
Peróxido de Hidrógeno: Es proceso de
esterilización a baja temperatura la
cual consta en la transmisión de peróxido de
hidrógeno en fase plasma.
Alcohol: Esteriliza superficies, pero se evapora
fácilmente.
MÉTODOS FÍSICOS
Calor: La utilización de este método y
su eficacia depende
de dos factores: el tiempo de
exposición y la temperatura. Todos los
microorganismos son susceptibles, en distinto grado, a la
acción del calor. El
calor provoca
desnaturalización de proteínas,
fusión
y desorganización de las membranas y/o procesos
oxidantes irreversibles en los microorganismos.
Calor Húmedo: El calor húmedo produce
desnaturalización y coagulación de
proteínas.
Autoclave
Se realiza la esterilización por el vapor de agua a
presión. El modelo
más usado es el de Chamberland. Esteriliza a 121º C,
15Lb de presión,
por 20 minutos.
Calor seco: El calor seco produce desecación de
la
célula, es esto tóxico por niveles elevados de
electrolitos, fusión de
membranas.
Estufas -Hornos
Doble cámara, el aire caliente
generado por una resistencia,
circula por la cavidad principal y por el espacio entre ambas
cámaras, a temperatura de 170º C para el instrumental
metálico y a 140º C para el contenido de los
tambores.
Radiaciones: Su acción depende de:
- El tipo de radiación
- El tiempo de
exposición - La dosis
Rayos Ultravioletas: Afectan a las moléculas de
DNA de los microorganismos. Son escasamente penetrantes y se
utilizan para superficies, se utilizan para la
esterilización en quirófanos. Rayos Gamma: Su
empleo esta
basado en los conocimientos sobre la energía
atómica. Filtración: Se usan membranas filtrantes
con poros de un tamaño determinado. El tamaño del
poro dependerá del uso al que se va a someter la muestra.
Microorganismo, ser vivo que sólo se puede
observar utilizando microscopios ópticos o
electrónicos. Los microorganismos se clasifican en:
bacterias y
cianobacterias (o algas verde azuladas) pertenecen al reino
Móneras. Son organismos con células
procarióticas y presentan una gran variedad de formas de
vida. Los hongos y las
levaduras, son microorganismos que pertenecen al reino Hongos. Estos
seres tienen una gran importancia económica por el uso
industrial en la fabricación de antibióticos y
productos
alimenticios como el pan o el vino, o por las pérdidas que
producen al descomponer alimentos. Los
virus son un
tipo de microorganismo peculiar. No tienen metabolismo y
son parásitos intracelulares que causan un gran
número de enfermedades en las
personas, los animales y las
plantas. Y por
ultimo los parásitos, los cuales viven a expensas de otros
microorganismos.
BACTERIAS

Bacteria (del griego, bakteria,
‘bastón’), nombre que reciben los organismos
unicelulares y microscópicos, que carecen de núcleo
diferenciado y se reproducen por división celular
sencilla.
Las bacterias son
muy pequeñas, entre 1 y 10 micrómetros (µm)
de longitud, y muy variables en
cuanto al modo de obtener la energía y el alimento.
Están en casi todos los ambientes: en el aire, el suelo y el agua, desde
el hielo hasta las fuentes
termales; incluso en las grietas hidrotermales de las
profundidades de los fondos marinos pueden vivir bacterias
metabolizadoras del azufre. También se pueden encontrar en
algunos alimentos o
viviendo en simbiosis con plantas, animales y otros
seres vivos.
CLASIFICACIÓN
Las bacterias se suelen clasificar siguiendo varios
criterios: por su forma, en cocos (esféricas), bacilos
(forma de bastón), cocobacilos, espiroquetas (con forma
espiral); según la estructura de
la pared celular; por el comportamiento
que presentan frente a la tinción de Gram; en función de
que necesiten oxígeno
para vivir o no (aerobias o anaerobias, respectivamente);
según sus capacidades metabólicas o fermentadoras;
por su posibilidad de formar cápsulas y esporas
resistentes cuando las condiciones son adversas, y en función de
la identificación serológica de los componentes de
su superficie y de sus ácidos
nucleicos.

No todas las bacterias tienen capacidad de movimiento,
pero las que lo hacen se desplazan gracias a la presencia de
apéndices filamentosos denominados pilis y flagelos.
Éstos pueden localizarse a lo largo de toda la superficie
celular o en uno o ambos extremos, y pueden aparecer aislados o
en grupo.
Dependiendo de la dirección en que gire el flagelo, la
bacteria puede moverse avanzando o agitándose en una
dirección concreta. Los pilis son
vellosidades que se sitúan alrededor de la bacteria y su
movimiento es
de lado de forma ondulante.
HONGOS

Es un grupo diverso
de organismos unicelulares o pluricelulares que se alimentan
mediante la absorción directa de nutrientes. Los alimentos
se disuelven mediante enzimas que
secretan los hongos; después se absorben a través
de la fina pared de la célula y
se distribuyen por difusión simple en el protoplasma.
Junto con las bacterias, los hongos son los causantes de la
putrefacción y descomposición de toda la materia
orgánica. Hay hongos en cualquier parte en que existan
otras formas de vida. Algunos son parásitos de organismos
vivos y producen graves enfermedades en plantas y animales. La
disciplina
científica que estudia los hongos se llama
micología. Hay unas cien mil especies conocidas de hongos.
Se cree que los grupos más
complejos derivan de los tipos más primitivos, los cuales
tienen células
flageladas en alguna etapa de su ciclo vital. E n el hombre
tienen gran afinidad por el cabello las uñas y la piel.
Recoleccion De Muestras Para Estudios De
Hongos
Piel Y Escamas
Interrogar al paciente sobre uso de talcos o cremas que
interfieren con el examen.
Abstenerse de tratamiento antimicótico 10
días previos al estudio.
Limpiar el área de toma de la muestra con gasa
humedecida en agua destilada
estéril o alcohol. ( No
se debe utilizar algodón en la limpieza del área
afectada ).
Raspar cuidadosamente cuchilla estéril de
bisturí los bordes de la lesión. (Tomar muestras de
diferentes lesiones).
Colocar las escamas desprendidas sobre un portaobjetos
de vidrio
estéril o dentro de caja Petri estéril.
Si existen vesículas, deben romperse con la punta
de la cuchilla o de una lanceta estéril y su contenido en
los recipientes indicados.
Puede colocarse también cinta pegante
transparente sobre la lesión y después de haber
presionado la lesión con la misma, retirarla y
posteriormente pegar la cinta en el portaobjetos.
Procurar tomar muestras suficientes para examen directo
y cultivos.
Procesar las muestras antes de dos (2) horas.
Uñas
Remover esmaltes de la uña tres (3) días
antes del estudio.
Abstenerse de tratamiento antimicotico local 15
días previos al estudio. ( En caso de tratamiento
sistémico, suspenderlo y realizar el estudio entre dos y
seis meses después).
Limpiar el área de toma de muestra con gasa
humedecida en agua destilada estéril o alcohol. (No
utilizar algodón)
Raspar con cuchilla estéril de bisturí la
zona de la placa ungueal afectada, de extremo distal o
proximal.
Si la lesión se encuentra en la región
distal de la uña, cortar con tijeras o cortauñas
estériles la porción afectada.
Colocar el material recolectado en una caja Petra
estéril.
Procurar tomar muestras suficientes para examen directo
y cultivos.
Procesar las muestras antes de dos (2) horas.
Cabellos
Elegir con lupa los cabellos afectados ( Opacos,
descoloridos, con nódulos, quebradizos, etc.)
Cortar con tijeras los cabellos elegidos y depositarlos
en caja de Petri estéril.
Si se aprecia descamación de cuero cabelludo,
recolectar escamas del mismo.
Deben recolectarse por lo menos cinco (5)
cabellos
Procesar la muestra antes de dos (2) horas.
VIRUS

Virus (en latín, ‘veneno’), entidades
orgánicas compuestas tan sólo de material
genético, rodeado por una envuelta o envoltura protectora.
El término virus se utilizó en la última
década del siglo XIX para describir a los agentes
causantes de enfermedades más pequeños que las
bacterias. Carecen de vida independiente, pero se pueden replicar
en el interior de las células vivas, perjudicando en
muchos casos a su huésped en este proceso. Los
cientos de virus conocidos son causa de muchas enfermedades
distintas en los seres humanos, animales, bacterias y plantas.
Los virus son parásitos intracelulares
submicroscópicos, compuestos por ARN o por ácido
desoxirribonucleico (ADN) —nunca
ambos— y una capa protectora de proteína o de
proteína combinada con componentes lipídicos o
glúcidos. La cubierta externa de proteína se llama
cápsida, y las subunidades que la componen,
capsómeros. Se denomina nucleocápsida al conjunto
de todos los elementos anteriores. Algunos virus poseen una
envuelta adicional que suelen adquirir cuando la
nucleocápsida sale de la célula
huésped. La partícula viral completa se llama
virión. El tamaño y forma de los virus son muy
variables. Hay
dos grupos estructurales básicos: isométricos, con
forma de varilla o alargados, y virus complejos, con cabeza y
cola. Los virus más pequeños son
icosaédricos (polígonos de 20 lados) que miden
entre 18 y 20 nanómetros de ancho (1 nanómetro = 1
millonésima parte de 1 milímetro). Los de mayor
tamaño son los alargados; algunos miden varios
micrómetros de longitud, pero no suelen medir más
de 100 nanómetros de ancho. Así, los virus
más largos tienen una anchura que está por debajo
de los límites de
resolución del microscopio
óptico, utilizado para estudiar bacterias y otros
microorganismos.
PARASITOS
Parásito, cualquier organismo que vive sobre o
dentro de otro organismo vivo, del que obtiene parte o todos sus
nutrientes, sin dar ninguna compensación a cambio al
hospedador. En muchos casos, los parásitos dañan o
causan enfermedades al organismo hospedante. Los parásitos
permanentes pasan la mayor parte de su ciclo vital dentro o sobre
el organismo al que parasitan. Los parásitos temporales
viven durante un breve periodo en el huésped, y son
organismos de vida libre durante el resto de su ciclo
vital.
CLASIFICACION
ENDOPARÁSITOS: Parásitos que están
dentro del huésped.
NEMATODOS: Gusano redondo. Se aloja en el intestino y a
veces se abre camino hasta otras partes del cuerpo, son de
color
blanquecino, rosa y cafe. Sus
huevos se desarrollan en el agua o en
tierra
húmeda, y es probable que sus embriones entren en el
cuerpo por ingestión directa. Los gusanos pueden
expulsarse por medio de purgantes.
FILARIAS: Pertenecen a la clase Nematoda. El nombre
científico de la filaria endémica en partes de
África, España,
Sudamérica, este de Asia, islas del
Caribe, varias islas del Pacífico y América
del Norte, es Wuchereria bancrofti, el del gusano causante de la
loaiasis Loa loa, el del gusano de Guinea Dracunculus medinensis
y el de la filaria que causa la oncocercosis, Onchocerca
volvulus.
CESTODOS: Gusano plano, también platelminto,
nombre común de un grupo de animales de cuerpo blando. Son
los animales más sencillos entre los que poseen cabeza.
Presentan simetría bilateral y son un tanto aplanados
dorsoventralmente. La mayoría son alargados. El filo al
que pertenecen los gusanos planos o platelmintos comprende: las
tenias, que en su fase adulta son parásitos del tracto
digestivo de los animales; Existen dos especies que pueden dar
lugar a la enfermedad, la tenia porcina o Taenia solium y la
tenia del ganado vacuno o Taenia saginata. las duelas, que
parasitan diversos órganos de distintos animales; y los
gusanos planos de vida libre.
TREMATODOS: Gusanos planos. El nombre científico
de la duela del hígado del cordero es Fasciola hepatica.
Las duelas conocidas como duelas de la sangre pertenecen
al género
Schistosoma. Tanto la duela del hígado del cordero como
las duelas de la sangre pertenecen
a la clase Trematodos.

PROTOZOARIOS – PROTISTA: Ameba o Amiba, organismo
unicelular perteneciente al filo Sarcodinos (Sarcodina) y al
reino Protistas. La célula se
compone de una membrana delgada, una capa semirrígida de
ectoplasma, un endoplasma granular de aspecto gelatinoso y un
núcleo oval. El tamaño medio es de 0,025
milímetros. Hay especies que viven en las plantas
acuáticas, en la tierra
húmeda y otras que son parásitas de animales. Las
amebas se desplazan extendiendo el citoplasma hacia fuera y
forman un pseudópodo o pie falso. La formación de
pseudópodos se produce como respuesta a los
estímulos químicos generados por los
microorganismos que constituyen su alimento; de manera que dos
pseudópodos engloban al microorganismo y lo introducen en
una cavidad o vacuola. Un ácido secretado en la cavidad
descompone este alimento en sustancias químicas solubles
que son difundidas desde la cavidad al citoplasma. El material de
desecho y los restos no digeridos son eliminados a través
del ectoplasma, el cual también absorbe oxígeno
del medio líquido en que se encuentra la ameba y elimina
dióxido de carbono
originado en el metabolismo;
se trata de una forma de respiración. Tras un periodo de
crecimiento, la ameba se reproduce por división en dos
partes iguales. Al menos seis formas de amebas son
parásitas del hombre. De
éstas, la más importante es Entamoeba histolytica,
que causa la amebiasis y la disentería; la enfermedad
aparece en brotes epidémicos, cuando las aguas residuales
contaminan los suministros de agua o cuando el suelo se
fertiliza con desechos humanos sin tratar.
ECTOPARASITOS: Parásitos que están encima
del huésped. Como las pulgas, piojos y
garrapatas.
Sangre, sustancia líquida que circula por las
arterias y las venas del organismo. La sangre es roja brillante o
escarlata cuando ha sido oxigenada en los pulmones y pasa a las
arterias; adquiere una tonalidad más azulada cuando ha
cedido su oxígeno para nutrir los tejidos del
organismo y regresa a los pulmones a través de las venas y
de los pequeños vasos denominados capilares. En los
pulmones, la sangre cede el dióxido de carbono que ha
captado procedente de los tejidos, recibe
un nuevo aporte de oxígeno e inicia un nuevo ciclo. Este
movimiento circulatorio de sangre tiene lugar gracias a la
actividad coordinada del corazón,
los pulmones y las paredes de los vasos sanguíneos. El
cuerpo humano
posee cinco litros de sangre en su totalidad.
COMPOSICIÓN DE LA SANGRE: En una persona normal
sana, el 45% del volumen de su
sangre son células, glóbulos rojos (la
mayoría), glóbulos blancos y plaquetas. Un fluido
claro y amarillento, llamado plasma, constituye el resto de la
sangre. El plasma, del cual el 95% es agua, contiene
también nutrientes como glucosa, grasas, proteínas,
vitaminas,
minerales y
los aminoácidos necesarios para la síntesis
de proteínas.
GLÓBULOS ROJOS, ERITROCITOS O
HEMATÍES:
Son células de forma discoidea y bicóncava
con un diámetro promedio de 7,5 µm y un espesor que
llega a 2 µm en sus bordes y que no alcanza 1 µm en
el centro y constituyen el 99% del total de células en la
sangre.

El eritrocito maduro no es una verdadera célula:
no posee núcleo, no se reproduce y consume una cantidad
mínima de oxígeno. Su membrana está
compuesta de una combinación de lípidos y
proteínas, que le confieren propiedades especiales de
permeabilidad. La función principal de la célula
roja es transportar oxígeno hacia los tejidos y traer de
vuelta dióxido de carbono de éstos hacia los
pulmones. Contiene alrededor de un 60% de agua, el ión
predominante en su interior es el potasio y el 34% de su peso
corresponde a la hemoglobina, la cual constituye
el 90% de las sustancias sólidas contenidas en
éste. Además, contiene numerosas enzimas que son
necesarias para el transporte de
oxígeno y la viabilidad de la célula. La
hemoglobina es el pigmento respiratorio de la sangre, está
contenida exclusivamente dentro de los eritrocitos y se une
aproximadamente al 97% de todo el oxígeno en el cuerpo. Es
una proteína conjugada formada por la globina, un grupo
hem y un átomo de
hierro. Cada
molécula de hemoglobina puede unir cuatro moléculas
de oxígeno, por lo que le permite a la sangre humana
transportar más de 70 veces la cantidad de dicho gas que pudiera
acarrearse de cualquier otra manera.
La forma particular bicóncava del glóbulo
rojo le permite una absorción de oxígeno en los
pulmones, así como su liberación eficiente en los
capilares de todos los tejidos del cuerpo. De hecho, se calcula
que un eritrocito se satura totalmente de oxígeno en menos
de un centésimo de segundo.
GLÓBULOS BLANCOS O LEUCOCITOS:

Los glóbulos bláncos son una vital
fuerza de
defensa contra organismos extraños. También
funcionan como nuestro "aseo urbano" ya que limpian y eliminan
células muertas y desechos tisulares que de otra manera se
acumularían. Los leucocitos son células de forma
redondeada mientras circulan en la sangre y adoptan formas muy
variadas cuando salen de los vasos sanguíneos y su
diámetro oscila entre 6 y 18 µm.
Muchas infecciones estimulan a la médula
ósea a liberar a la corriente sanguínea grandes
números de leucocitos que normalmente están en
reserva, lo que se evidencia como un aumento en el número
de células blancas en la sangre periférica. Este
incremento es fácilmente detectado con una simple
hematología y contribuye notablemente en una primera
aproximación diagnóstica. Algunas células
blancas pueden morir en el proceso de lucha contra una
infección y sus cuerpos muertos se acumulan y contribuyen
a formar una sustancia blanca que es comúnmente vista en
el sitio de una infección, llamada "pus". No todas las
infecciones llevan a un incremento en el número de
células blancas; el virus responsable por el SIDA conlleva
a su reducción, específicamente en el número
de linfocitos y a una consiguiente minusvalía en la
habilidad para luchar contra otras infecciones. De acuerdo a su
apariencia al microscopio luego
de su tinción, existen 5 clases de leucocitos:
granulocitos (neutrófilos,
eosinófilos y
basófilos),
linfocitos y
monocitos.
NEUTROFILO: La principal función de los
neutrófilos es la de detener o retardar la acción
de agentes infecciosos o materiales
extraños. Su propiedad
más importante es la fagocitosis y son capaces de ingerir
bacterias y pequeñas partículas.
En muchas oportunidades, cuando se trata de combatir
infecciones bacterianas severas, pueden aumentar su
número, ya que la médula ósea los libera en
virtud de la emergencia, antes de terminar su maduración.
Los neutrófilos, además de defender el organismo
contra las infecciones, pueden ser dañinos también,
al liberar los componentes de sus gránulos tóxicos
en diversos tejidos.
EOSINÓFILOS: Los
eosinófilos tienen una igual actividad motriz que los
neutrófilos y aunque poseen propiedades
fagocíticas, participan menos en la ingestión y
muerte de las
bacterias. Un aumento en su número frecuentemente
acompaña a reacciones alérgicas o procesos
inmunológicos, al igual que presencia de
parasitos.
BASÓFILOS : son los
que tienen menos movilidad y menor capacidad fagocítica.
Participan en reacciones de hipersensibilidad
(picaduras).
LINFOCITOS: El linfocito es una
de las células más intrigantes de la sangre humana
y bajo ese nombre se engloban varios tipos diferentes de
células linfoides, que encierran diferencias estructurales
y funcionales aún no bien esclarecidas. Las funciones del
sistema
linfático son en general la producción de anticuerpos circulantes y la
expresión de la inmunidad celular, refiriéndose
esto último al autorreconocimiento inmune,
hipersensibilidad retardada, rechazo de los injertos y reacciones
injerto contra huésped.
Dos tipos funcionalmente diferentes de linfocitos han
sido descritos: los linfocitos T o timo-dependientes y los
linfocitos B o médula ósea dependientes.
Aproximadamente el 70 a 80% de los linfocitos en sangre
periférica muestran características de células T. Estos
tienen una vida media de varios años, así como una
gran capacidad y velocidad para
recircular entre la sangre y los tejidos. También
almacenan y conservan la "memoria
inmunológica" (células T de memoria).
Además, una vez activadas, son las células
efectoras o ejecutoras (células asesinas) de la inmunidad
celular y secretan sustancias biológicamente activas
(linfoquinas) que sirven de mediadores solubles de inmunidad en
la respuesta inflamatoria.
MONOCITOS: Los monocitos son los
grandes fagocitos mononucleares de la sangre periférica.
Son un sistema de
células fagocíticas producidas en la médula
ósea, que viajan como tales por la sangre, para luego
emigrar a diferentes tejidos como hígado, bazo, pulmones,
ganglios linfáticos, hueso, cavidades serosas, etc., para
convertirse en esos tejidos en macrófagos libres o fijos,
cuyas funciones se
corresponden con lo que se conoce como sistema
mononuclear-fagocitario.
LAS PLAQUETAS O TROMBOCITOS:

Las plaquetas son framentos de citoplasma de
megacariocitos, que circulan como pequeños discos en la
sangre periférica. En promedio, tienen un diámetro
entre 1 a 4 µm, su citoplasma se tiñe azul claro a
púrpura y es muy granular. No tienen núcleo y
su concentración normal en sangre periférica es
entre 150.000 y 450.000/µl. Su duración en
circulación es de 8 a 11 días Plaqueta,
también denominada trombocito, fragmento
citoplasmático de un megacariocito (la célula de
mayor tamaño presente en la médula ósea),
que se encuentra en la sangre periférica, donde interviene
en el proceso de coagulación de la sangre. Si se produce
un daño a un vaso sanguíneo, las plaquetas
circulantes inmediatamente quedan atrapadas en el sitio de la
lesión, formándose un tapón, primer paso en
el control del
daño vascular. Este mecanismo es suplementado por el
sistema de coagulación sanguínea, el cual es el
más importante medio de defensa contra las
hemorragias.
GRUPO ABO
Existen principalmente dos tipos de proteínas que
determinan el tipo de sangre, la proteína A y la
B.
Diferentes combinaciones de las mismas resultan en los 4
grupos sanguíneos:
Grupo A: Tiene proteína A en la superficie del
góbulo rojo. Reactivo anti – A.
Grupo B: Tiene proteína B en la superficie del
góbulo rojo. Reactivo anti – B.
Grupo AB: Tiene ambas proteínas A y B.
Grupo O: No tiene ninguna (A o B) en la superficie del
góbulo rojo.
El Rh es otra proteína que si está
presente en la superficie del góbulo rojo será Rh
positivo y si está ausente, es rh negativo. Reactivo anti
– D y se confirma con anti – CDE.
ANTICUERPOS |
A | B | AB | O | |
Tipo de anticuerpos | Anti-B | Anti-A | Ninguno | Anti-A y anti-B |
COMPATIBILIDAD ENTRE TRANSFUSIONES | ||||
Donante | Receptor | |||
A | B | AB1 | O | |
A | Sí | No | Sí | No |
B | No | Sí | Sí | No |
AB | No | No | Sí | No |
O2 | Sí | Sí | Sí | Sí |
Sí: compatible No: incompatible 1 Receptor universal 2 Donante universal | ||||
TOMA DE MUESTRA PARA HEMOCLASIFICACION
La puncion se realiza en la yema indice
preferiblemente.
Apretar la pulpa del dedo seleccionado de manera tal que
la extremidad muestre congestión venosa.
Desinfectar el sitio de la punción.
Tomar una lanceta nueva estéril desechable y
realizar una punción rápida y segura.
Recolectar las gotas de sangre necesarias evitando
presionar demasiado fuerte la pulpa.
Existen múltiples factores involucrados en el
proceso de coagulación de la sangre. Los anticoagulantes
son sustancias que previenen la formación de
coágulos. Existen diferentes tipos de ellos en polvo o
líquidos. Deben seleccionarse siempre el anticoagulante
apropiado según el estudio que se quiera
realizar.
Los anticoagulantes mas comunes son:
EDTA: ( ETILEN-DIAMINO-TETRA-ACETATO) Este tipo de
anticoagulante es utilizado principalmente cuando se realizan
estudios en donde se cuentan células.
CITRATO DE SODIO: Generalmente en concentraciones al 3.8
% y ser utiliza comúnmente en estudios de
coagulación.
HEPARINA: Se utiliza tanto en algunos estudios de rutina
como especializados. Su presentación puede incluir
heparina con concentraciones de sodio o litio. En general, la
heparina con tilio es utilizada para estudios de química y la heparina
sódica se utiliza para estudios de linfocitos.
OXALATOS: Son anticoagulantes menos comunes, utilizados
ocasionalmente en las determinaciones de glucosa.
Los tubos deben mezclarse inmediatamente, una vez que la
sangre ha entrado en ellos. Invertir suavemente ( 10 – 15
veces) o colocarlos en rotores especiales, para así
obtener mezclas
homogéneas.
Existen códigos de colores
internacionalmente conocidos, para las diferentes presentaciones
de tubos colectores de nuestras sanguíneas.
Tapa
roja……………………..
Sin anticoagulante (Tubo seco ).
Tapa
violeta………………….
Con EDTA.
Tapa azul
……………………
Con CITRATO DE SODIO
Tapa verde o blanca……….. Con
HEPARINA.
RECOLECCION DE
MUESTRAS DE SANGRE
Para una gran cantidad de estudios que requieren
muestras sanguíneas, en algunos casos se debe conservar
condiciones de ayuno, el cual puede prolongarse como
mínimo seis (6) horas y en ocasiones durante doce (12)
horas. En cualquiera de los casos, deben seguirse las siguientes
indicaciones generales, a saber:
La sangre debe recolectarse en tubos de vidrio o plástico
estériles ( preferiblemente tubos al vacío). En
caso de recolectar la sangre con jeringa y agujas
estériles, deben llenarse los tubos con precisión y
agilidad, evitando en todo momento realizar procedimientos
bruscos que puedan producir rompimiento de las células
sanguíneas (hemólisis). En otro tipo de estudios,
la sangre no se deposita en tubos, sino en otro tipo de
recipientes (frascos de hemocultivo ).
Al recolectar la sangre, debe permitirse que se coagule,
si es el caso, o someter los tubos con la muestra a ciertas
maniobras recomendadas para evitar su
coagulación.
En otras ocasiones, tan solo se colocan unas
pequeñas gotas de sangre en láminas portaobjetos de
vidrio, (extendidos de sangre periférica), en capilares de
vidrio o en placas de vidrio o plástico
de origen comercial para la realización de algunos
estudios.
SELECCIÓN DEL SITIO DE
PUNCIÓN
Asegúrese que el paciente se ubique en una
posición segura y cómoda.
Nunca practique una punción sanguínea en
un paciente que se encuentre de pie ( La posición de pie
es inestable y en caso que el paciente pierda el conocimiento o
se desmaye, será mas difícil evitar que se lesione
).
No elija una extremidad en donde esté colocada
algún tipo de venoclisis.
Inspecciones la vena que se va a puncionar.
Coloque el torniquete con suficiente tensión. No
se exceda (Un torniquete muy apretado produce hemólisis,
colapso venoso, dolor, etc.)
Si la vena no es muy visible ni palpable, realice un
suave masaje en el antebrazo (si es el caso), con movimientos
desde la muñeca hacia el codo.
Observe siempre las dos extremidades superiores
(brazos), para elegir el mejor sitio de
punción.
Al finalizar el procedimiento, indíquele al
paciente que debe hacer presión en el sitio punzado por lo
menos durante cinco (5) minutos. Coloque finalmente una banda
adhesiva sobre la herida de la punción.
Si el sangrado no se detiene, aplique presión
constante sobre la herida durante 10 minutos más. Si el
problema aún no se soluciona, comuníquese con sus
superior inmediato o directamente con el medico
tratante.
Deposite y destruya todo el material desechable en los
recipientes diseñados para este
propósito.
Asegúrese de que los recipientes que contengan
las muestras del paciente estén debidamente rotulados,
marcados o identificados antes de atender a un nuevo paciente o
realizar cualquier tarea.
QUE HACER SI UN PACIENTE PIERDE EL
CONOCIMIENTO DURANTE EL PROCEDIMIENTO?
Retire inmediatamente la aguja del lugar de la
punción.
Sostenga al apaciente con fuerza para
evitar que caiga y se golpee. Solicite ayuda.
Coloque sobre la herida de la punción, un
apósito, algodón o gasa con sostenida
presión, para evitar que siga sangrando.
Puede acostarse al paciente en el suelo o en una camilla
y deben levantarse sus piernas (Posición de
Trendelemburg).
Coloque un algodón impregnado con alcohol frente
a la nariz del paciente.
Permita que el paciente tenga buena ventilación.
Abra el cuello de su camisa y desajuste la corbata si es el
caso.
El paciente por si solo sabrá cuando podrá
incorporarse.
Si las circunstancias lo permiten, haga medición de la presión
sanguínea.
OBTENCIÓN DE MUESTRAS DE SANGRE EN NIÑOS
Seguir correctamente las indicaciones propuestas
anteriormente.
Realizar el procedimiento valiéndose de ayuda de
compañeros (as) de trabajo.
Sujetar firmemente el brazo del niño, aun cuando
el pequeño paciente no oponga resistencia al
procedimiento, usualmente los niños
tienden a reaccionar bruscamente al someterlos a procedimientos
de extracción de sangre. Esta reacción puede
producir una herida mayor en el niño, como el rompimiento
de la aguja dentro de la vena.
OBTENCIÓN DE MUESTRAS DE SANGRE EN
BEBÉS
Si la punción de la vena del antebrazo del
bebé no es viable, se pueden recolectar muestras de sangre
en la punción del talón de uno de los pies. Debe
sujetarse firmemente el pie del paciente, aplicar algo de
presión en el talón del mismo y esperar a que haya
congestión venosa evidente. Realizar la punción con
la lanceta estéril desechable y recolectar las gotas de
sangre en tubo, en capilar o simplemente colocarlas en una lamina
portaobjetos, según sean las necesidades.
Es recomendable, en la medida que sea posible, que la
madre del bebé no presencie el procedimiento.
Es uno de los exámenes de laboratorio que
más se solicitan, comprende numerosas pruebas o
parámetros, los cuales proporcionan individualmente o en
conjunto un resultado de enorme valor para
numerosas entidades clínicas.
VELOCIDAD DE SEDIMENTACIÓN GLOBULAR (VSG ) :
La diferencia de gravedad especifica entre eritrocitos y plasma
ocasiona la precipitación de los primeros en el fondo del
tubo que contiene sangre anticoagulada con una velocidad que
es medida en determinada cantidad de tiempo.
Se llena el tubo de wintrobe con la aguja de pasteur y se coloca
en un soporte de manera que quede completamente recto, observar a
la hora que tanto han descendido los glóbulos rojos,
midiendo en esa distancia en la escala del tubo
de wintrobe cuya marca superior
sea cero.
Valores Normales : Varían de acuerdo con la
edad, el género y
el método.
– Hombres menores de 50 años : 0 – 15 mm/hora
– Hombres mayores de 50 años : 0 – 20 mm/hora.
– Mujeres menores de 50 años : 0 – 25 mm/hora
– Mujeres mayores de 50 años : 0 – 30
mm/hora
La eritrosedimentación se encuentra elevada en
infecciones, enfermedades inflamatorias, autoinmunes y malignas,
especialmente las discrasias de células
plasmáticas. La eritrosedimentación es
particularmente útil en las enfermedades
reumatológicas, especialmente en artritis reumatoidea, en
la evaluación
de artritis temporal y en la polimialgia reumática, pueden
haber variaciones fisiológicas que se deben tener en
cuenta ya que la VSG se puede acelerar en caso de niños y
ancianos, en la mujer se
aumenta antes y después de la menstruación, durante
el embarazo y
puede estar elevada uno o dos meses después del parto, la toma
de anticonceptivos orales puede también
acelerar la velocidad.
HEMATOCRITO :Este mide el tanto por ciento del
volumen total
de una muestra de sangre venosa ocupado por los hematíes o
expresado de otra manera es la relación entre el volumen
de eritrocitos y el de la sangre total. Se expresa como
porcentaje (%).
Valores Normales :
Al nacer: 44 – 62 %
Niños de 1 año: 35 % +/- 5
Niños 10 años: 37% +/- 5
Hombres: 40 – 54 %
Mujeres: 36 – 47 %
Se aumenta en : Quemaduras, infecciones,
intoxicaciones, policitemia, insuficiencia respiratoria
crónica.
Disminuye en : Concentración baja del volumen
globular, anemias crónicas, cirrosis, insuficiencias
cardíacas, ciertas hiperproteinemias.
HEMOGLOBINA :Es el componente principal de los
glóbulos rojos, es una proteína conjugada que sirve
de vehículo para el transporte de
O2 y CO2. Se aumenta en hemoconcentración, en estados de
shock, quemaduras, por diarrea, vomito y poliglobulina
primaria.
Se disminuye en casos de anemia.
Valores Normales :
Neonatos, sangre de cordón: 13.6 – 19.6 g/dl
Niños de 1 año: 11.2 dl
Niños de 10 años: 12.9 g/dl
Hombres: 13.5 – 18.0 g/dl
Mujeres: 12.0 – 16.5 g/dl
RECUENTO TOTAL DE LEUCOCITOS : Los leucocitos se
dividen en cinco grupo:
NEUTROFILOS : 60 – 70 %
LINFOCITOS: 30 – 40%
MONOCITOS: 0-5%
EOSINOFILOS: 0 – 5 %
BASOFILOS: 0 – 1%
Es el número de leucocitos por mm3 de sangre,
enumera todos los tipos de células nucleadas en la sangre,
se debe tener en cuenta que esto incluye eritrocitos nucleados
los cuales después del reporte se deben
descontar.
Valores Normales : 5.000 – 10.000 /
mm3
Cifras mayores de 10.000 indican leucocitosis, aunque
algunas personas normales pueden tener cifras superiores. El
ejercicio produce leucocitosis fisiológicas, a veces de
consideración, de ahí, que el recuento de
leucocitos debe hacerse en condiciones básales. Hay
leucopenia cuando el recuento es inferior a 5.000 por mm3. Una
recomendación útil en la valoración del
recuento de leucocitos en que una sola cifra puede ser
equívoca y en caso de duda debe hacerse por lo menos dos
veces.
RECUENTO DIFERENCIAL Y FROTIS DE SANGRE
PERIFERICA : Es una de las partes más importantes del
cuadro hemático, se coloca una gota de sangre
anticoagulada en una lámina que debe ser preferiblemente
nueva o en su defecto láminas completamente desengrasadas
y con una lámina (Extensora) en un ángulo de 30 –
45 grados sobre la primera de forma tal que la sangre se extienda
por capilaridad a lo largo del ángulo agudo formado por
dos láminas y se deja secar. El extendido de sangre debe
hacerse máximo una hora después de que se tome la
muestra.
Técnica de Coloración : Cubrir la
lámina con wright por cinco minutos, luego se le agrega
una solución tampón (Agua destilada) y se deja por
dos minutos, se lava la lámina con agua de chorro.
Tener en cuenta que cada vez que se empiece un colorante nuevo se
debe standarizar los tiempo de coloración, y filtrar los
colorantes cada vez que sea necesario.
RECUENTO DE PLAQUETAS : Este resultado es
importante ya que desempeñan un papel vital
en la hemostasis.
El método utilizado es un método directo en el que
se utiliza Oxalato de amonio al 1% 1.98 ml y 0.02ml (20
landas) de sangre anticoagulada con EDTA, Se mezcla bien y se
deja en reposo aproximadamente durante 10 minutos para permitir
la lisis total del resto de las células, se monta la
cámara de neubauer y se deja en reposo por otros 10
minutos en cámara húmeda para evitar que la muestra
ya montada se vaya a secar. Se lee con objetivo de 40
X contando las plaquetas que se encuentran en el cuadrante de
rojos (CENTRO), luego el resultado obtenido se multiplica por
1.000.
Valor Normal : 150.000 – 450.000/ mm3
Se disminuye en : Radiaciones, cáncer, leucemia,
mielomas, síndromes asociados a anemias y leucopenias,
infecciones bacterianas, lupus eritematoso, mononucleosis,
varicela, paperas, anemias megaloblasticas y aplasicas,
tratamientos con determinadas drogas.
Se aumentan en leucemia mieloide crónica, enfermedades
inflamatorias, ferropenias.
RECUENTO DE RETICULOCITOS : Son eritrocitos no
nucleados inmaduros, que contienen RNA y que continúan
sintetizando hemoglobina después de la pérdida
del núcleo.
Se mezcla en un tubo tres gotas de azul de cresil brillante y
tres gotas de sangre, se incuban durante 15 minutos a 37 grados,
se hacen dos extendidos en lámina y se miran con objetivo de
100 X. Se cuentan aproximadamente 1.000 hematies y se saca el
promedio de reticulocitos.
Valor Normal :
Neonatos: Hasta 2.6%
Adultos : Hasta 2.0%
Aumenta en anemias regenerativas, hemolíticas, hemorragias
internas o externas. Disminuyen frente a una médula
ósea no respondedora como en una anemia aplasica en
leucemias.
PRUEBAS DE COAGULACIÓN
TIEMPO DE PROTROMBINA ( P.T ó TIEMPO DE
QUICK) : Se define como el tiempo en segundos necesario para
la formación del coágulo después de la
adición de calcio y tromboplastina al plasma. La prueba
mide la integridad de la vía extrínseca del sistema
de coagulación sanguínea. La principal
aplicación clínica de la prueba es el control de la
anticoagulación oral con warfarínicos.
El plasma debe ser separado de las células lo más
rápido posible y refrigerarlo si no es procesado
inmediatamente, teniendo en cuenta que su procesamiento debe
hacerse antes de cuatro horas después de haber tomado la
muestra.
Técnica : Incubar 0.2 ml de plasma a 37 grados,
agregar 0.2 ml de simplastin mezclar y cronometrar, hasta la
formación de hilos de fibrina.
Valor de
Referencia : De 10 13 segundos, en los recién nacidos
es más largo y solo a partir de los seis meses el
resultado es similar al de los adultos. Hay tres formas de
reportar los resultados en segundos, como una razón y
como un índice.
En segundos: Se expresa en segundos y se compara con el
resultado, también en segundos del control que puede ser
una persona *Normal*
, o preferiblemente un plasma normal obtenido comercialmente.
Como una Razón : Se expresa como el producto de
dividir el valor en segundos del tiempo de protrombina del
paciente por el tiempo de protrombina del control. El valor de
referencia oscila entre 0.8 y 1.2.
Como un índice : Debido a la variabilidad de la
tromboplastina y de los instrumentos es imposible comparar los
resultados del tiempo de protrombina, de un laboratorio a otro,
cuando se utiliza el reporte en segundos o en
razón.
Un valor no coagulante mayor de 20 segundos en personas
sin anticoagulación es crítico, y en personas
anticoaguladas un valor por encima de tres veces el valor de
referencia.
TIEMPO DE TROMBOPLASTINA PARCIAL ACTIVADA (KPTT, PTT,
APTT): Se define como el tiempo en segundos necesario para
formación de coágulo después de la
adición de calcio y fosfolípidos al plasma
citratado pobre en plaquetas. El PTT mide la integridad de la
vía intrínseca de la coagulación,
encontrándose alargado también en
coagulación Intravascular diseminada, disfibrinogenemias,
afibrinogrenemia, hepatopatías severas, deficiencia de
vitamina K, también es utilizado en control de la
anticoagulación con heparina.
Técnica : Incubar por 2 min. Reactivo, agregar 0.1
mil del plasma, incubar por 5 min, agregar el cloruro de calcio
0.1 mil cronometrar hasta la formación del coagulo.
Valor de referencia : 25 – 39 segundos con una diferencia no
mayor de 10 segundos con el control. En los recién nacidos
es mas largo y solo a partir de los seis meses el resultado es
similar al de los adultos.
Un valor es considerado crítico cuando el resultado es
mayor de 70 segundos. El PTT reemplaza el tiempo de
coagulación que en la actualidad no tiene ninguna utilidad
clínica.
Orina, líquido excretado por los riñones a
través de las vías urinarias, con el cual se
eliminan sustancias innecesarias para el organismo.
Desempeña un papel
importante en la regulación del balance de líquidos
y electrolitos y del equilibrio
entre ácidos y
bases. La cantidad de orina producida diariamente es de 1 a 1,5
litros, valor que aumenta si se ingieren muchos líquidos y
disminuye en caso de sudoración intensa. Las muestras de
orina son biopsias líquidas de los tejidos del tracto
urinario, recolectadas en forma indolora que permiten tener
información rápida y
económica.
COMPOSICIÓN DE LA ORINA
En los seres humanos la orina normal suele ser un
líquido transparente o amarillento. Se eliminan
aproximadamente 1,4 litros de orina al día. La orina
normal contiene un 96% de agua y un 4% de sólidos en
solución. Cerca de la mitad de los sólidos son
urea, el principal producto de
degradación del metabolismo de las proteínas. El
resto incluye nitrógeno, cloruros, cetosteroides,
fósforo, amonio, creatinina y ácido
úrico.
RECOLECCIÓN DE LA
MUESTRA :
La muestra se recoge normalmente por micción
espontanea, tener en cuenta que se debe recoger la primera de la
mañana, el paciente debe levantarse, asearse muy bien los
genitales y en un recipiente estéril recoger la
micción intermedia.
Ultimamente se esta utilizando el estudio del parcial de orina
fraccionado que consiste en pedir al paciente que recoja la
primera orina de la mañana fraccionada en tres muestra que
deben llegar al laboratorio correctamente marcadas :
Fracción I, II, II. Este tipo de examen es principalmente
para descartar hematúrias. Cuando se presenta hemoglobina
en la fracción I indica sangrado a nivel uretral, si hay
hemoglobina en las tres fracciones el sangrado es a nivel renal,
pero si solo se encuentra hemoglobina en la muestra III el
sangrado es a nivel vesical.
EXÁMEN FÍSICO :
Aspecto: Es considerado como normal un aspecto
transparente, pero es aceptado hasta un aspecto ligeramente
turbio ya que este puede ser debido a contaminaciones.
El aspecto de una orina turbia ya es considerado como anormal,
esto puede ser debido a presencia de leucocitos, glóbulos
rojos, bacterias , cristales, grasa (Por obstrucción de
linfáticos).
Color: En condiciones normales el color de la orina
va de amarillo hasta ámbar. Se pueden encontrar colores anormales
debido a la presencia de elementos anormales en la orina como por
ejemplo sangre, medicamentos, alimentos y otros
pigmentos.
Incolora: se conoce como
HIDRURICA característica de una diabetes
insípida se presenta por baja en la producción de Hormona
antidiurética.
Rosado o Rojo: Se presenta por la
presencia aumentada de Urobilinogeno, porfobilinogeno.
Azul: después de procesos
quirúrgicos.
Amarillo intenso: pigmentos
biliares.
Negro: melanomas productores de
melanina.
pH: Es el reflejo de la capacidad del
riñón para mantener la concentración normal
de hidrogeniones. El pH normal va
de 5.5 – 6.5. Influyendo el régimen dietético el
cada paciente.
En una alcalosis metabólica y respiratoria se produce una
orina alcalina mientras que en una acidosis se produce una orina
ácida.
Densidad: Esta varia en razón directa a la
cantidad de sólidos, principalmente cloruros, urea,
sulfatos, la densidad normal
va de 1.015 – 1.025.
EXAMEN QUÍMICO:
Este examen se hace por medio de una tira reactiva
producida por diferentes casas comerciales.
Proteínas: Se pueden encontrar varias
clases de proteínas pero la más importante es la
albúmina. Hay proteinurias llamadas fisiológicas
asociadas a fiebres, exposición al frío, stress emocional,
ejercicio intenso.
Hemoglobina: Es una proteína sanguínea que
no se debe encontrar en orinas normales, su presencia puede ser
causada por procesos hemoliticos, agentes tóxicos,
accidentes
transfusionales, quemaduras, etc. Fisiológicamente puede
presentarse por ejercicio intenso. La presencia de hemoglobina y
proteínas ambas altas indican que hay un daño
glomerular.
Glucosa: En condiciones normales se elimina por la orina
cantidades no detectables por los métodos
usuales, cuando el nivel de glucosa sobrepasa el umbral renal
(180 mg/dl ) se detecta. En el sindrome de cushing se presentan
glucosurias.
Cetonas: Cuando el metabolismo hepático se acelera
por carencia de glucocidos, exceso de grasas o en diabetes, los
cuerpos cetonicos aparecen en abundancia en la orina y sangre. La
prueba se basa en la reacción del ácido
acetoacetico con el nitraprusiato.
La presencia aumentada de cetonas y glucosa se presenta en una
acidosis diabética.
Bilirrubina y Urobilinogeno: La bilirrubnina es un
producto resultante de la descomposición de hemoglobina.
Normalmente no se encuentra, su eliminación se presenta
por ictericia obstructiva intra y extrahepatica aguda o
crónica, cirrosis. En Colestasis se presenta aumento de
bilirrubinas con un urobilinogeno normal, en ictericias
hepáticas se presenta aumento de bilirrubinas menor que en
las colestasis con un urobilinogeno aumentado o normal, en las
ictericias producidas por anemias hemolíticas se presenta
una bilirrubina normal con un urobilinogeno aumentado.
Nitritos: Se deben analizar en orinas recién
emitidas para que su valor tenga algún significado
clínico.
EXAMEN MICROSCÓPICO:
El examen microscópico del sedimento urinario no
solo evidencia una enfermedad renal, sino también indica
la clase de lesión presente.
Leucocitos: Indican una pielonefritis,
también se encuentran en enfermedades autoinmunes,
lesión en vía renal o infecciones cerca al aparato
urinario. Se debe tener en cuenta si la muestra esta contaminada
principalmente en mujeres en este caso el informe de
laboratorio se debe reportar como : Contaminación vaginal, se siguiere recoger
nueva muestra previo aseo y micciónmedia.
Hematies: Indican sangrado a nivel de vías
urinarias. Se debe mirar si los hematies son intactos los que son
hematurias bajas, crenados que se observan en orinas
hipertonicas, hematies dimorfos que indican una hematuria
glomerular.
Células epiteliales: Se pueden encontrar algunas
células en la orina como consecuencia del desprendimiento
normal de las células envejecidas. Un marcado aumento
puede indicar inflamación del conducto del tracto
urinario.
Los cuerpos ovales son celulas epiteliales redondas llenas de
grasa que se observan en nefrosis debido a perdida de
proteínas.
CILINDROS: Se forman en la luz del tubulo
renal, cuando las proteínas se precipitan originando un
gel.
Cilindros hialinos: Son incoloros homogéneos y
transparentes, se observan en una deshidratación y
enfermedad renal, se pueden observar en condiciones
normales.
Cilindros Eritrocitarios: Son cilindros en los que se ven
glóbulos rojos, indican lesiones glomerulares.
Cilindros hemáticos: Se ven menos glóbulos
rojos se encuentra la hemoglobina, son cilindros que
microscópicamente se observan de un color rojo.
También indican lesión glomerular.
Cilindros epiteliales: Se observan en necrosis tubular.
Cilindros leucocitarios : Se observan en infección
renal y procesos inflamatorios de causa no infecciosa.
Cilindros granulosos: Se observan en enfermedad renal
significativa, también se observan después de
ejercicio intenso.
Cilindros cereos: Se observan en infección renal
crónica, hipertensión, nefropatia,
inflamación y degeneración tubular, éxtasis
urinaria alta.
CRISTALES: No tienen mayor significado
clínico, solo en casos de trastornos metabólicos,
se debe correlacionar su presencia con los hábitos
alimenticios. Se forman cuando la orina después de
recogida se deja por mucho tiempo sin analizar, por eso son
importantes cuando se observan en orinas recién emitidas.
Su formación se ha visto que tiene una correlación
genética a
formarlos.
Cristales de orinas ácidas: Acido urico:
Se encuentran en gota, estados febriles y litiasis.
Microscópicamente se ven como un precipitado rosado.
Uratos amorfos : Se observan en estados de sudoración
profunda, enfermedades febriles.
Acido hipurico: No tienen significado
clínico.
Cistina: Se observan en cálculos renales, son
solubles en ácido clorhídrico e insolubles en
ácido acético.
Tirosina: Aparecen en enfermedades hepáticas
graves, formas graves de fiebre tifoidea y leucemias.
Leucina: En enfermedades hepáticas
graves.
Cristales de orinas alcalinas: Fosfato triple: En
cistitis crónica, retención urinaria.
Fosfatos amorfos: En trastornos metabólicos,
osteopatía.
Uratos de amonio: Son anormales solo si se encuentran en
orinas recién emitidas.
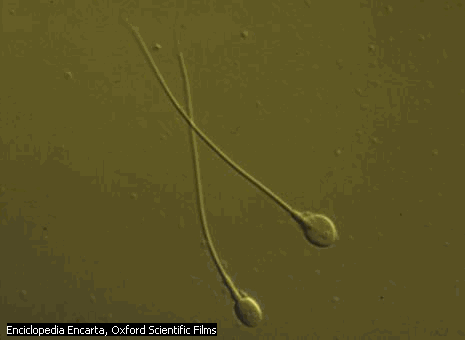
Otras estructuras:
Hongos: Se observan en infecciones del tracto
urinario, sobre todo en pacientes diabéticos pero pueden
estar presentes por contaminación cutánea o vaginal en
la orina.
Espermatozoides: Se informan cuando se trata de muestras
de hombres su elevación indica alteración de
órganos reproductores.
Moco: Se encuentra aumentado en procesos inflamatorios o
irritación del tracto urinario.
Parásitos: Se observan debido a
contaminación fecal.
RECOLECCCION DE MUESTRAS DE ORINA
Examen parcial de orina y urocultivo
Normalmente, se encuentran bacterias en la
porción distal de la uretra y el perineo. Estos
microorganismos son contaminantes de la orina y deben evitarse
mediante técnicas
de recolección asépticas.
Limpiar la región periuretral (Extremidad del
pene, labios, vulva) por medio de los lavados sucesivos con agua
y jabón o un detergente liviano, enjuagando muy bien con
agua esterilizada para quitar el detergente, mientras se mantiene
retraído el prepucio o los pliegues de la
vagina.
Limpiar la uretra, dejando pasar la primera parte de la
micción la cual se desecha.
Recoger directamente en un frasco estéril la
orina que se emite a continuación (Orina de segunda parte
de la micción ).
La orina recolectada se utiliza para cultivo y recuento
de colonias.
En la mujer, se
recomienda recolectar de esta manera (2) muestras sucesivas para
alcanzar un 95 % de seguridad si se
emplea el recuento bacteriano de 10.5/mL como índice de
bacteriuria, aun cuando este no es el procedimiento de rutina en
la práctica, a menos que exista duda con respecto al
diagnóstico.
En el hombre,
contando con la cooperación del paciente, basta un solo
cultivo de orina para establecer la existencia de
bacteriuria.
Como generalmente la orina favorecerá el
crecimiento de la mayoría de los gérmenes urinarios
patógenos (Al igual que los medios de
cultivo rutinarios) es absolutamente necesario que el cultivo de
orina se realice dentro de la primera hora posterior a su
recolección o que se mantenga en refrigeración (4º Centígrados)
hasta el momento de su procesamiento. Algunos estudios demuestran
que se pueden mantener las muestras de orina en refrigeración durante periodos prolongados,
sin que se reduzca considerablemente su contenido bacteriano y
los recuentos permanecen estables por lo menos 24 horas a la
temperatura del refrigerado (4ºC).
Si en el laboratorio se reciben durante el día
diferentes muestras, se podrán colocar en
refrigeración a medida que van llegando, para analizarlas
todas en un determinado momento.
Existen métodos comerciales, con un preservador
que elimina la necesidad de refrigeración. Este
método, contiene un preservador de ácido borrico,
glicerol y formato de sodio.
Recolección de muestras de orina en
niños
En niños, puede utilizarse una bolsa de
plástico estéril colectora de orina. La bolsa se
colocará después de haber lavado los genitales
adhiriéndola a la piel por medio de un anillo adhesivo. Si
no es posible recolectar orina en los siguientes 45 minutos,
deberá cambiarse la bolsa por una nueva. Si no se dispone
de bolsa recolectora, podrá acudirse a un guante
estéril desechable, cuidando que no contenga talco:
adherir el guante desechable con esparadrapo.
Punción suprapúvica
Ocasionalmente, la aspiración por punción
suprapúbica de la vagina puede ser necesaria y está
a cargo del médico su recolección. Comprende la
punción directa de la vejiga a través de las
paredes abdominal con aguja y jeringa estériles. (Debe
asegurarse que el paciente tenga la vejiga llena antes de iniciar
el procedimiento).
RECOLECCION DE ORINA DE 12 HORAS
Orinar por la mañana al levantarse y anotar
exactamente la hora (Esta muestra no se recolecta).
Recolectar las muestras posteriores de orina
(Mañana y tarde), hasta cumplir 12 horas de haber
desechado la primera muestra de la mañana.
El recipiente debe ser preferiblemente de color opaco.
Conservar el frasco en nevera durante el estudio. (Temperatura de
4º. Centígrados).
Es importante tener cuidado al vaciar la orina en el
frasco para que no se pierda nada de ella. En caso de olvidar
recolectar parcial o totalmente alguna muestra, deberá
iniciarse nuevamente el estudio.
RECOLECCION DE ORINA DE 24 HORAS
Orinar por la mañana al levantarse y anotar
exactamente la hora (Esta muestra no se recolecta ).
Recolectar las muestras posteriores de orina
(Mañana, tarde y noche), el recipiente debe ser
preferiblemente de color opaco. Conservar el frasco en nevera
durante el estudio. (Temperatura de 4º.
Centígrados).
Al día siguiente, exactamente a la misma hora en
que la orina fue desechada el día anterior, se recoge la
última muestra.
Conservar el frasco en nevera durante el
estudio.
Es importante tener cuidado al vaciar la orina en el
frasco para que no se pierda nada de ella. En caso de olvidar
recolectar parcial o totalmente alguna muestra, deberá
iniciarse nuevamente el estudio.
Página siguiente  |