Equilibrios de Precipitación

1. Generalidades
Equilibrios de solubilidad
Equilibrios químicos heterogéneos
Existen dos fases en contacto
Fase líquida:
Disolución acuosa
que contiene iones
Fase sólida:
Compuesto químico de composición
constante y fórmula conocida
¿Cuándo se emplean las reacciones de precipitación?
PROCEDIMIENTOS VOLUMÉTRICOS
Separación química
Identificación de iones
Análisis químico cuantitativo
1

2
SOLUBILIDAD Y PRODUCTO DE SOLUBILIDAD
Solubilidad (s) de un soluto (AB) en un disolvente dado: cantidad de soluto necesaria
para formar una disolución saturada en una cantidad dada de disolvente. La solubilidad
se expresa en unidades de concentración y es un valor característico y constante (a una
temperatura fija) para cada especie química.
(Gp:) AB(s) AB(ac) A+ + B-
Producto de solubilidad termodinámico
Dentro de los límites de las disoluciones
diluidas: actividad ˜ concentración
Kps = [A+] [B-]
Producto de solubilidad
Producto de las concentraciones de los iones de un sólido
poco soluble en una disolución saturada, elevadas a una
potencia igual a su coeficiente estequiométrico

3
(Gp:) AmBn(s) mAn+ + nBm-
Kps = [An+]m [Bm-]n
De forma general,
[An+]m [Bm-]n > Kps Condición de precipitación. Disolución sobresaturada.
Condiciones de precipitación y disolución:
[An+]m [Bm-]n = Kps Condición de equilibrio. Disolución saturada.
[An+]m [Bm-]n < Kps Condición de disolución. Disolución insaturada.

Factores que afectan a la solubilidad de los precipitados
Temperatura
Naturaleza del disolvente
Factores cristalográficos o morfológicos: tamaño de partícula, grado de hidratación, envejecimiento.
Presencia de electrolitos:
Electrolito inerte: Efecto salino
Electrolito no inerte: Efecto del ión común
Influencia de otros equilibrios iónicos
4

Fundamento de una volumetría de precipitación:
Reacción de precipitación: aparece un precipitado en el transcurso de la valoración
Requisitos que ha de cumplir la reacción química para poder ser aplicada a una volumetría de precipitación:
Cuantitativa: KS ?
Estequiométrica
Rápida
Disponibilidad de un sistema indicador
(Gp:) mAn+ + nBm- AmBn (s) Keq= 1/K ps Kps= [An+]m[Bm-]n
Pocas reacciones cumplen simultáneamente estos requisitos
Las aplicaciones de este tipo de volumetrías son muy limitadas:
Reactivo valorante más empleado: AgNO3 para X-, CN-, SCN-, CNO-, R-SH, S2-, SO42-…
5

2. Curvas de valoración
(Gp:) mAn+ + nBm- AmBn(s)
(Gp:) pX = – log [Bm-]
Representando volumen de reactivo
valorante frente a pAnalito:
El salto en el pto de equivalencia
es más perceptible
(Gp:) Ag+ + Cl- AgCl(s)
(Gp:) pCl- = – log [Cl-]
Punto de
equivalencia
Zona de pre-equivalencia:
(Exceso de analito)
Zona de post-
equivalencia
(Exceso de valorante)
Curva de valoración de la especie
Bm- con An+ como valorante
6

Valoración de 25 mL de X- (Cl-, Br- y I-)
0,1 M con Ag+ 0,05 M
Puntos de equivalencia
7
Efecto de la constante del producto de solubilidad del precipitado
AgI es la especie más insoluble
AgCl es la especie de mayor solubilidad
I- (Kps = 8,3 • 10-17)
Br- (Kps = 5,0 • 10-13)
Cl- (Kps = 1,8 • 10-10)
2.1. FACTORES QUE INFLUYEN EN LA FORMA DE LA CURVA DE VALORACIÓN
Kps
Concentraciones de las disoluciones de reactivo valorante y de analito
F1
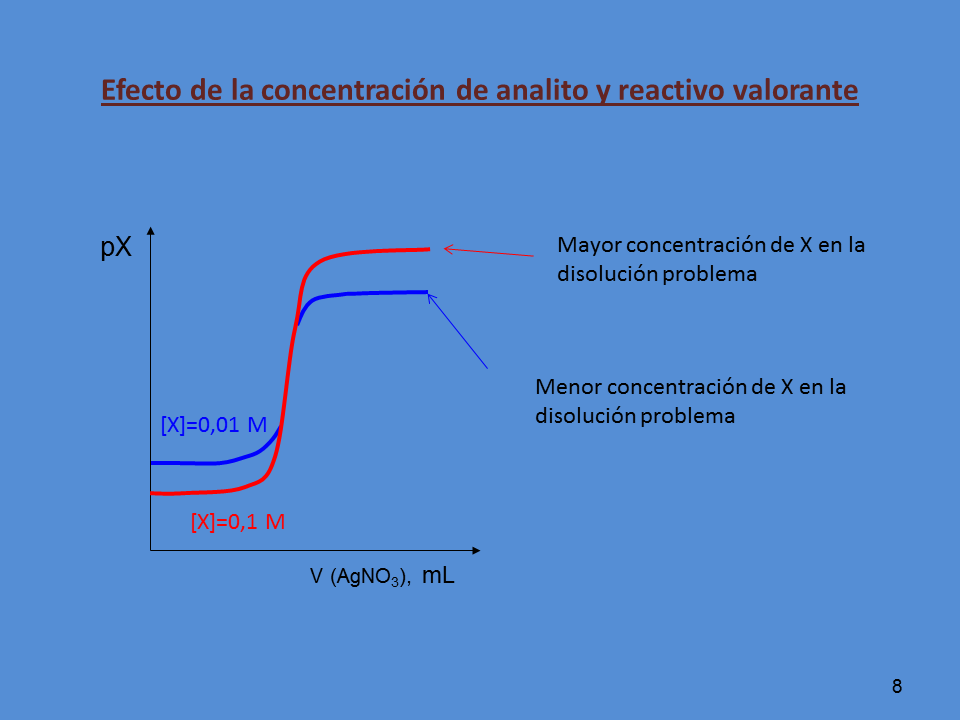
Efecto de la concentración de analito y reactivo valorante
V (AgNO3), mL
pX
Mayor concentración de X en la
disolución problema
Menor concentración de X en la
disolución problema
[X]=0,1 M
[X]=0,01 M
8

Otro ej. para visualizarel efecto de la dilución de los reactivos
25 mL de I- 0,1M con Ag+ 0,05M
25 mL de I- 0,01M con Ag+ 0,005M
25 mL de I- 0,001M con Ag+ 0,0005M
9
Punto de equivalencia
Región de exceso de Ag+
Región de exceso de I-
F1
0,1 M I-
0,01 M I-
0,001 M I-
0,001 M I-
0,01 M I-
0,1 M I-

10
2.2. Construcción de una curva de valoración
Ejemplo:
Valoración de 50 mL de NaCl aproximadamente 0,1 M con una disolución de AgNO3 0,1000 M
Kps AgCl = 1,78 • 10-10
1. Reacción química de valoración:
Ag+ + Cl- ? AgCl(s)
2. Cálculo del volumen de valorante en el punto de equivalencia: 50 mL
3. Establecimiento de los puntos donde calcularemos pCl:
– Punto inicial: V(AgNO3) = 0
– Antes del punto de equivalencia: Ej: V(AgNO3)= 10 mL
V(AgNO3)= 49,99 mL
– Punto de equivalencia: V(AgNO3 )= 50 mL
– Tras el punto de equivalencia: Ej: V(AgNO3) = 50,5 mL
V(AgNO3) = 60 mL

11
? Punto inicial: Volumen de valorante agregado al medio de valoración igual a 0
pCl = 1,0
? Antes del punto de equivalencia: V(AgNO3)= 10 mL
En este punto ya ha comenzado a precipitar el AgCl de acuerdo con la reacción de valoración y la
concentración total de cloruro se calcula según la ecuación:
[Cl-] = [Cl-]sin valorar + [Cl-]por solubilidad del AgCl
[Cl-] = 0,067 M
pCl = 1,18
siendo [Cl-]sin valorar >> [Cl-]por solubilidad del AgCl

12
? Antes del punto de equivalencia: V(AgNO3)= 49,99 mL
[Cl-] = 1,92 • 10-5 M
[Cl-] = [Ag+] = (Kps)1/2 = 1,34 • 10-5
pCl = 4,87
? En el punto de equivalencia: V(AgNO3)= 50 mL
pCl = 4,72
Todo el Cl- ha sido precipitado como AgCl, así que el Cl- que existe en disolución es producto de la disociación del AgCl precipitado, gobernada por su Kps
[Cl-] = 1,0 • 10-5 M
pCl = 5,0
Para volúmenes muy cercanos al del punto de equivalencia, la cantidad de Cl- presente en la
disolución, como consecuencia de la solubilidad del precipitado ,puede ser apreciable
respecto de la que queda de Cl- sin valorar
Valor correcto
Si despreciamos 2º término de la ecuación:
Valor incorrecto
13
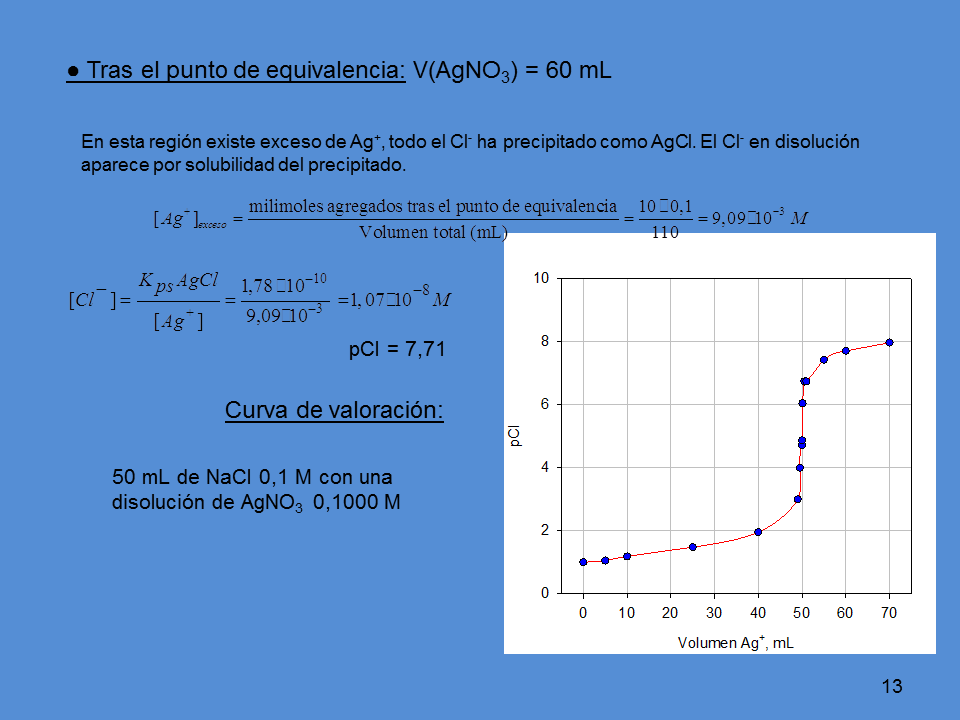
? Tras el punto de equivalencia: V(AgNO3) = 60 mL
En esta región existe exceso de Ag+, todo el Cl- ha precipitado como AgCl. El Cl- en disolución
aparece por solubilidad del precipitado.
pCl = 7,71
Curva de valoración:
50 mL de NaCl 0,1 M con una
disolución de AgNO3 0,1000 M

14
Siguiendo con el mismo ejemplo:
Valoración de 50 mL de NaCl aproximadamente 0,1 M con una disolución de AgNO3 0,1000 M
Representación de pAg frente al volumen de Ag+
? Punto inicial: Volumen de valorante agregado al medio de valoración igual a 0.
No es posible calcular pAg
? Antes del punto de equivalencia: V(AgNO3)= 10 mL
pAg = 8,57
[Cl-] = [Ag+] = (Kps)1/2 = 1,34 • 10-5 M
? En el punto de equivalencia: V(AgNO3)= 50 mL
pAg = pCl = 4,87
Página siguiente  |