
15
? Tras el punto de equivalencia: V(AgNO3) = 60 mL
pAg = 2,04
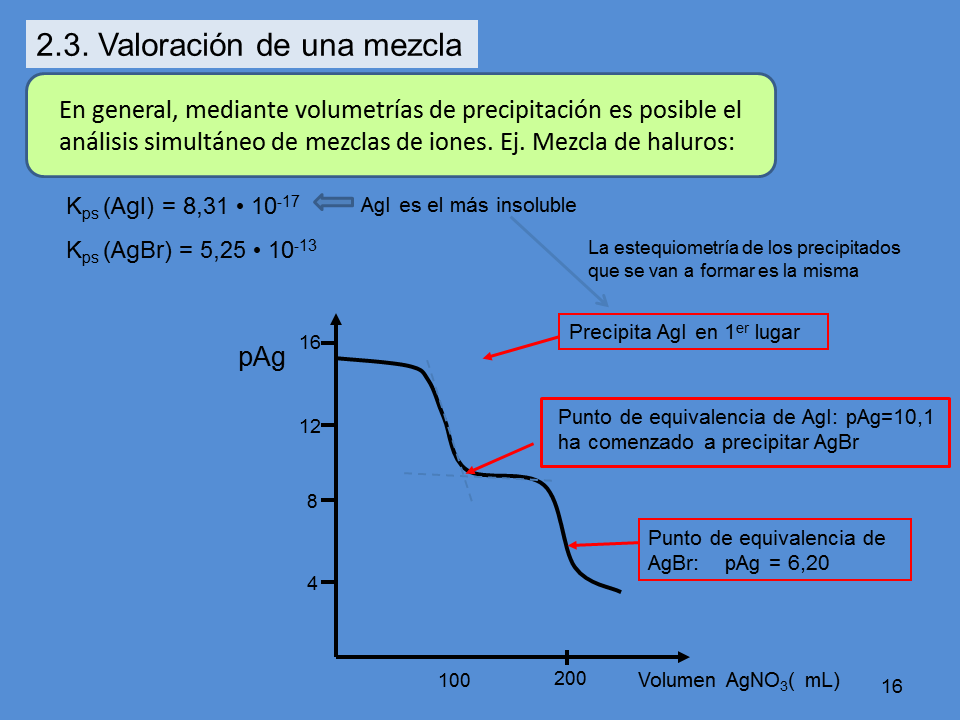
Kps (AgI) = 8,31 • 10-17
Kps (AgBr) = 5,25 • 10-13
pAg
Volumen AgNO3( mL)
Precipita AgI en 1er lugar
Punto de equivalencia de AgBr: pAg = 6,20
4
16
8
12
100
200
En general, mediante volumetrías de precipitación es posible el
análisis simultáneo de mezclas de iones. Ej. Mezcla de haluros:
2.3. Valoración de una mezcla
AgI es el más insoluble
Punto de equivalencia de AgI: pAg=10,1
ha comenzado a precipitar AgBr
La estequiometría de los precipitados
que se van a formar es la misma
16

Fig. 7.8 Harris
40 mL de I- 0,0502M y
Cl- 0,05M con Ag+
0,0845 M
20 mL de I- 0,1004 M
con Ag+ 0,0845 M
Detalle de la región del 1er
punto de equivalencia (a)
Región de la curva donde pAg+ está controlado por el exceso de I-
Región de la curva donde pAg+ está controlado por el exceso de Cl-
Punto final de I-
Punto final de Cl-
17
F1

3. Detección del punto final
Ejemplo 1: Potenciometría
Uso de Electrodos Selectivos de Iones (ESI):
Electrodo selectivo de Ag+
E medido = cte + 0,059 log [Ag+]
E medido = cte + 0,059 log KPS/[Cl-]
responde directamente a la concentración de Ag+ e indirectamente a la de Cl-
(Gp:) Posibilidad de registrar la curva de valoración de forma automática
Ejemplo 2: Turbidimetría
Determinación de SO42- empleando Ba2+ como valorante
3.A. Vía instrumental
18
Disolución acuosa
saturada de KCl y AgCl
Contacto con la disolución externa
(Gp:) Pasta de AgCl
(Gp:) KCl sólido con AgCl
(Gp:) Al potenciómetro
(Gp:) Alambre de Ag
(Gp:)
Entrada de aire
F1

– Por formación de un compuesto coloreado
– Empleando indicadores de adsorción
– Método de Fajans
– Método de Mohr: Determinación de Cl- y Br-
– Método de Volhard: – Determinación directa de Ag+
– Determinación indirecta de haluros
En cualquier caso la reacción volumétrica es una argentometría:
Ag+ + X- AgX(s)
3.B. Mediante el empleo de indicadores químicos
19

3.B.1. Valoración por el método de Mohr
Analito: Cl-
Reactivo valorante: Ag+
Indicador: CrO42-
Ks (AgCl) = 1,8 • 10-10
Ks (Ag2CrO4) = 1,2 • 10-12
Reacción de valoración: Ag+ + Cl- ? AgCl(s)
Reacción indicadora del punto final:
2 Ag+ + CrO42- ? Ag2CrO4(s)
Reacciones químicas implicadas
Blanco
Rojo
7 < pH < 10
Si pH > 10, Ag+ precipita como AgOH antes que como Ag2CrO4
Si pH < 7, Ag2CrO4 se solubiliza al protonarse los iones CrO42-
pH adecuado:
saturando
con NaHCO3
Este método también es aplicable para la determinación de Br- y CN- pero no para I- ó SCN-
20
F1
F2
En el punto de equivalencia:
[Ag+] = Kps(AgCl)½ = 1,34 • 10-5 M
¿Qué concentración de indicador es necesaria para formar el precipitado rojo? [CrO42-] = 6,7 • 10-3 M
Disolución amarilla intensamente coloreada
Difícil observar el precipitado rojo
Se usa [CrO42-] < 6,7 • 10-3 M
Conclusión:
Exceso de Ag+ en el punto final
que se corrige con la valoración
de un blanco.
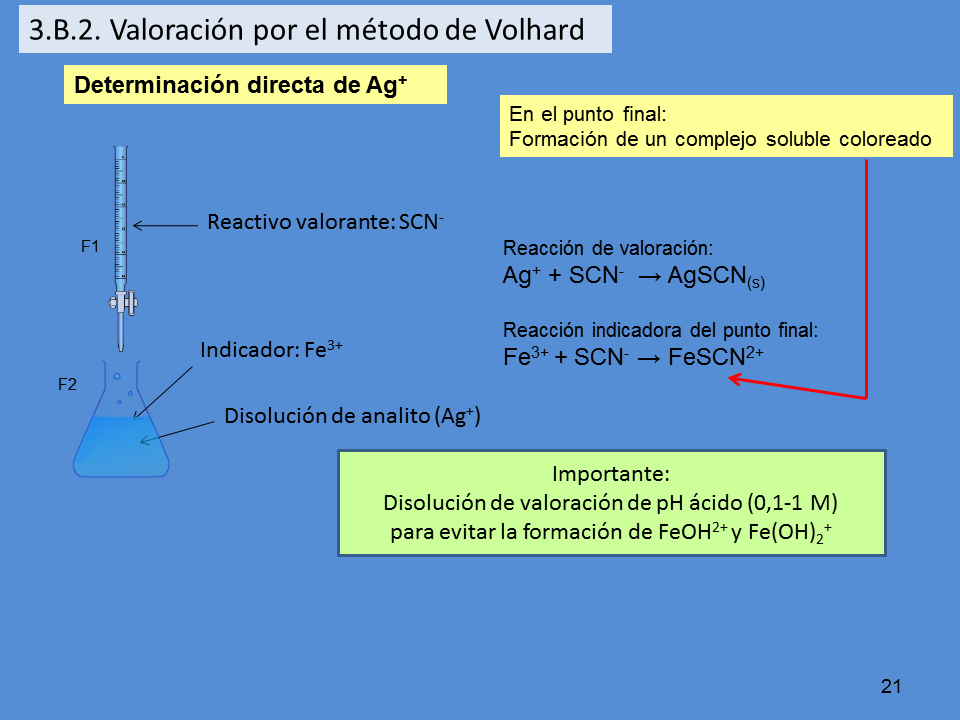
Determinación directa de Ag+
Disolución de analito (Ag+)
Reactivo valorante: SCN-
Indicador: Fe3+
Reacción de valoración:
Ag+ + SCN- ? AgSCN(s)
Reacción indicadora del punto final:
Fe3+ + SCN- ? FeSCN2+
Importante:
Disolución de valoración de pH ácido (0,1-1 M)
para evitar la formación de FeOH2+ y Fe(OH)2+
3.B.2. Valoración por el método de Volhard
21
F1
F2
En el punto final:
Formación de un complejo soluble coloreado
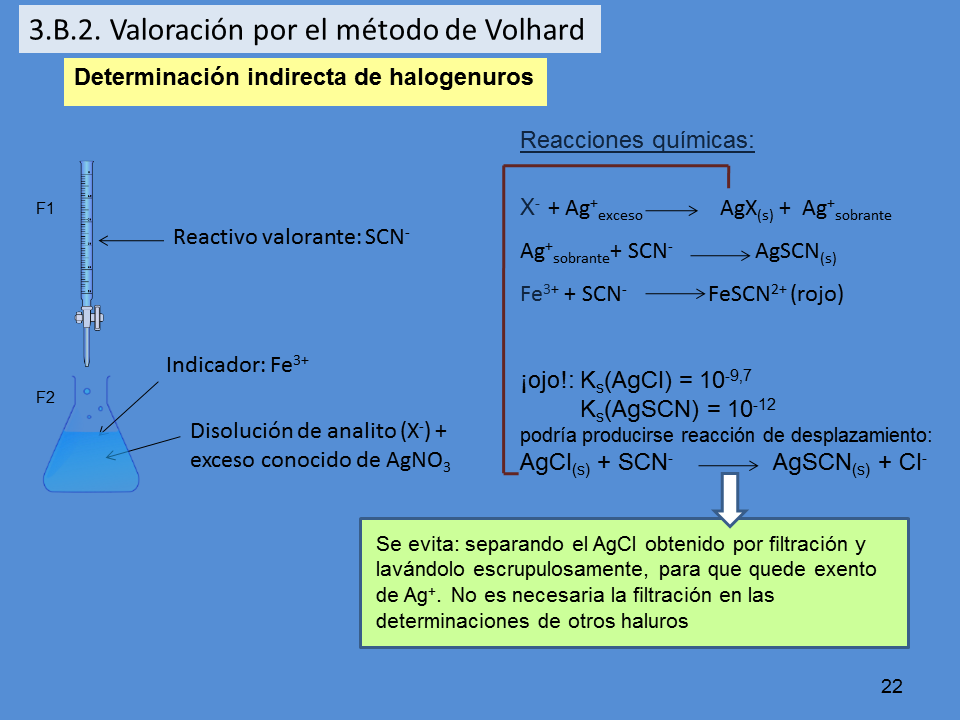
Determinación indirecta de halogenuros
Disolución de analito (X-) +
exceso conocido de AgNO3
Reactivo valorante: SCN-
Indicador: Fe3+
Reacciones químicas:
X- + Ag+exceso AgX(s) + Ag+sobrante
Ag+sobrante+ SCN- AgSCN(s)
Fe3+ + SCN- FeSCN2+ (rojo)
¡ojo!: Ks(AgCl) = 10-9,7
Ks(AgSCN) = 10-12
podría producirse reacción de desplazamiento:
AgCl(s) + SCN- AgSCN(s) + Cl-
Se evita: separando el AgCl obtenido por filtración y
lavándolo escrupulosamente, para que quede exento
de Ag+. No es necesaria la filtración en las
determinaciones de otros haluros
3.B.2. Valoración por el método de Volhard
22
F1
F2

Indicadores de adsorción:
Son compuestos orgánicos con tendencia a ser adsorbidos en la superficie del sólido en una
valoración por precipitación. Pueden tener carácter aniónico o catiónico.
23
F1
3.B.3. Valoración por el método de Fajans
Aniónicos
Catiónicos

Detección del punto final: Aparición o desaparición de un color en la superficie
del precipitado, implicando adsorción o desorción del indicador. El indicador no
precipita, sufre un proceso físico de adsorción o desorción.
Analito: Cl-
Reactivo valorante: Ag+
Indicador: fluoresceína
Este método también es aplicable para la determinación
de Br-, I-, SCN-, Fe(CN)64-
En el punto
de equivalencia:
(Gp:) AgCl
(Gp:) Cl-
(Gp:) Antes del punto de
equivalencia:
(Gp:) AgCl
(Gp:) Cl-
(Gp:) Cl-
(Gp:) Cl-
(Gp:) Cl-
(Gp:) Cl-
(Gp:) Disolución verdoso-amarillenta
debido a la forma aniónica del indicador
(Gp:) Cl-
(Gp:) Fluoresceinato-
(Gp:) Fluoresceinato-
(Gp:) Fluoresceinato-
(Gp:) Fluoresceinato-
(Gp:) Ag+
(Gp:) Tras el punto
de equivalencia:
(Gp:) AgCl
(Gp:) Ag+
(Gp:) Ag+
(Gp:) Ag+
(Gp:) Ag+
(Gp:) Ag+
(Gp:) Ag+
(Gp:) Fluoresceinato-
(Gp:) Fluoresceinato-
(Gp:) Fluoresceinato-
Ejemplo:
3.B.3. Valoración por el método de Fajans
24
F1
F2

25
Métodos de Fajans no argentométricos
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |