La configuración electrónica III

¿ Cómo están distribuidos los electrones de
un átomo entre sus niveles energéticos ?

Los niveles energéticos en un átomo se pueden
visualizar como un hotel en el cual las mejores habitaciones
dobles están en el primer piso. Los Niveles de
Energía Los Niveles de Energía
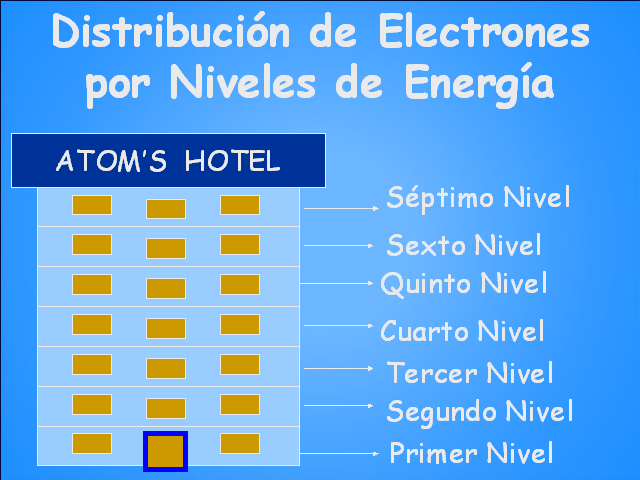
ATOM’S HOTEL Distribución de Electrones por Niveles
de Energía Séptimo Nivel Sexto Nivel Quinto Nivel
Cuarto Nivel Tercer Nivel Segundo Nivel Primer Nivel
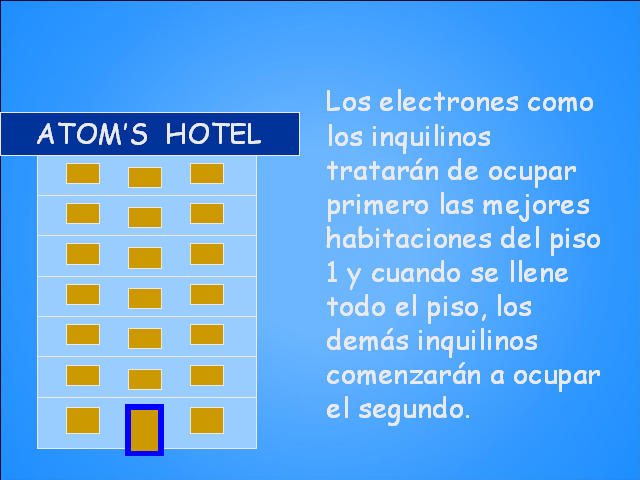
ATOM’S HOTEL Los electrones como los inquilinos
tratarán de ocupar primero las mejores habitaciones del
piso 1 y cuando se llene todo el piso, los demás
inquilinos comenzarán a ocupar el segundo.

Núcleo Niveles de Energía Primero Segundo Tercero
Cuarto Algunos niveles de energía que rodean a un
átomo son:

Repasemos algunos conceptos y principios necesarios para
representar las configuraciones electrónicas de los
átomos.

Partículas subatómicas Cuando trabajamos con la
configuaración electrónica de un elemento la
partícula principal es el electrón.

Definición de configuración electrónica: es
la distribución de electrones a través de los
orbitales de un átomo.

Niveles y subniveles Los niveles de energía tienen ciertos
subniveles como: s, p, d y f. EL primer nivel de energía
consta de un solo subnivel(1s), el segundo nivel tiene dos
subniveles (2s y 2p), el nivel 3 posee tres subniveles(3s,3p y
3d) y así sucesivamente.

Capacidad de electrones en cada subnivel

Diagrama de relación entre los niveles, subniveles y
orbitales Veamos la próxima página.


El principio de exclusión de Pauli establece que un
máximo de dos electrones pueden ocupar un mismo orbital
atómico, pero si los electrones tienen espines
opuestos.

El primer electrón se representa con una flecha hacia
arriba , describiendo el giro del electrón a favor de las
manecillas del reloj y el segundo se representa con una flecha
hacia abajo, indicando que el espín del electrón es
en contra de las manecillas del reloj.

Espín o giro para los dos electrones que ocupan un mismo
orbital + 1/2 – 1/2

Regla de Hund establece que electrones cuyo giro es igual deben
ocupar todos los orbitales que tienen igual energía, antes
de que electrones adicionales que tengan espines opuestos puedan
ocupar los mismos orbitales.

Ejemplos: Nitrógeno (Z=7) 1s2 2s2 2p3

1s2 2s2 2p6 3s2 3p1 1s2 2s2 2p6 3s2 3p6 Argón (Z-18)
Aluminio (Z-13)

Orden para llenar los orbitales según la Regla Diagonal:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6
7s2 5f14 6d10 7p6

Germanio (Z=32) Configuración electrónica de Ge:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p2

Practiquemos lo aprendido: Si sigues la regla diagonal no hay
razón para que te exaltes o te sientas inquieto(a).

Ejercicios: A. Identifica a que elemento pertenece cada una de
las siguientes configuraciones: 1s2 2s2 2p1= 2. 1s2 2s2 2p4= 3.
1s2 2s2 2p6 3s2 3p6= 4. 1s2 2s2 2p6 3s2 3p6 4s2 3d1=

B. Escribe la configuración electrónica de los
siguientes elementos: 1. Galio (Z=31) 2. Niquel (Z=28) 3.
Circonio (Z=40) 4. Indio (Z=49)