 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Foram utilizados os isolados UEL50 e CB116 do fungo Metarhizium anisopliae (Metsch.) e UNIOESTE02 e UEL25 do fungo Beauveria bassiana (Bals.) Vuill., todos provenientes de coleções de entomopatógenos do Laboratório de Zoologia da Unioeste, Campus de Cascavel, PR, do Instituto Biológico de São Paulo e do Departamento de Agronomia/UEL/PR.
Viabilidade dos conídios. Placas de Petri contendo ágar-água + 0,05% de tetraciclina foram inoculadas com 0,1 ml de uma suspensão contendo 1 x 106 conídios/ml, sendo preparadas quatro placas por tratamento (quatro isolados e duas temperaturas de incubação), de forma que cada uma das placas constituiu uma repetição. Em seguida, as placas foram incubadas por 16 horas a 26°C e 32°C, avaliando-se após esse período a porcentagem de conídios germinados e não germinados, utilizando-se microscópio óptico com aumento de 400 vezes, contando-se 200 a 500 conídios por placa.
Crescimento vegetativo. O crescimento foi avaliado em placas de Petri com meio de cultura para produção de esporos (Alves et al. 1998), sendo inoculada a superfície do meio em três pontos eqüidistantes, com conídios dos isolados a serem avaliados e o número de placas foi o mesmo utilizado anteriormente. As placas foram incubadas nas mesmas condições citadas anteriormente. Após 10 dias, foram feitas duas medições perpendiculares nas colônias, obtendo-se o diâmetro médio.
Produção de conídios em meio de cultura. As colônias obtidas anteriormente foram colocadas individualmente em tubos de vidro contendo água destilada + espalhante adesivo Tween 80 (0,01%). Em seguida, com auxílio de um pincel, os conídios da superfície das mesmas foram removidos e obtidas suspensões que foram agitadas em vórtex por um minuto e, a seguir, o número de conídios foi quantificado em câmara de Neubauer.
Virulência de isolados de M.anisopliae e B. bassiana para larvas e adultos do cascudinho. Larvas e adultos de cascudinho foram transferidos para copos plásticos descartáveis onde foram imersos em 1,0 ml de uma suspensão contendo 1 x 108 conídios/ ml por 10 segundos, sob agitação leve e constante. Para cada um dos isolados e temperatura (26°C e 32°C) foram utilizadas quatro repetições de 15 larvas e 15 adultos do inseto.
Em seguida, as larvas foram individualizadas em caixas circulares de acrílico (2,5 cm de diâmetro x 1,5 cm de altura) e os adultos em placas de Petri, ambas contendo papel filtro e ração esterilizada para frangos.
As caixas e as placas foram fechadas, armazenadas em potes plásticos tampados contendo espuma de poliuretano umedecida, e incubados em câmaras B.O.D (26°C e 32°C, ambas com 14h de fotofase).
Os insetos foram observados diariamente durante 10 dias e os indivíduos mortos foram retirados, imersos em álcool 70% e em água destilada durante 30 segundos cada e transferidos para câmara úmida, constituída de uma placa de Petri com papel filtro esterilizado e umedecido com água destilada, e incubados a 26°C e 32°C a fim de permitir a conidiogênese, para confirmar a mortalidade pelo fungo.
Produção de conídios em cadáveres. Foram selecionados cinco larvas e cinco adultos de cada uma das repetições, tendo como critério de seleção a plena conidiogênese e destes foram extraídos os conídios, imergindo-os em tubos de vidro contendo água destilada + espalhante adesivo Tween 80 (0,01%) sendo agitados por um minuto. Para determinar a produção de conídios nos cadáveres, foi realizado o mesmo procedimento utilizado nas colônias.
Efeito da cama nova e usada sobre a mortalidade de larvas e adultos do cascudinho por B. bassiana. Larvas e adultos do cascudinho foram imersos em 1 ml de suspensão de conídios contendo 1x108 de conídios/ml, sendo que na testemunha os insetos foram imersos somente em solução de água destilada + Tween 80 (0,01%), ambos foram mantidos sob agitação leve e constante durante 10 segundos.
Após a inoculação, os insetos foram divididos em grupos de três repetições de 15 indivíduos, sendo transferidos para caixas de acrílico (larvas) ou placas de Petri (adultos) com o fundo recoberto por papel filtro e também para copos plásticos contendo cama nova e cama usada, sendo alimentados com ração esterilizada para aves.
Assim, foram constituídos seis tratamentos: 1, 2 e 3 formados por insetos imersos em água destilada + espalhante adesivo e mantidos em caixas de acrílico (larvas) ou placas de Petri (adultos) e copos plásticos com cama nova e usada, respectivamente; e 4, 5 e 6 formados por insetos imersos na suspensão de conídios e mantidos caixas de acrílico (larvas) ou placas de Petri (adultos) e copos plásticos com cama nova e copos com cama usada, respectivamente. Em seguida, os insetos foram mantidos a 26°C e 32°C e fotofase de 14h.
Dez dias após a inoculação do fungo, determinou-se o número de insetos mortos. Em seguida os insetos foram transferidos para câmara úmida e mantidos nas mesmas condições de temperatura e fotofase do experimento, por até 10 dias, para a confirmação da mortalidade pelo fungo.
![]()
Todos os experimentos foram inteiramente casualizados num fatorial 4 x 2. As médias e a interação da temperatura diferentes fungos (espécies e/ou isolados) e estágio de desenvolvimento e temperatura sobre cama nova e usada e estágios de desenvolvimento foram analisados pelo teste F e as médias comparadas entre si pelo teste de Tukey, ambos com 5% de significância, utilizando-se programas estatísticos SISVAR 4.3 e MINITAB 12.2. Quando necessário, os dados foram transformados em arcsen
Viabilidade dos conídios. As temperaturas de incubação influenciaram a germinação dos conídios dos isolados de B. bassiana, sendo que à temperatura de 26ºC a germinação atingiu 70%, e a 32ºC foi totalmente inibida. Entretanto, ocorreu atraso na germinação dos isolados, observando-se crescimento vegetativo do fungo a 32ºC. Os isolados de M. anisopliae, por outro lado, apresentaram 100% de viabilidade, em ambas temperaturas (Tabela 1).
Resultados semelhantes foram obtidos por Inglis et al. (1996), que mostraram que a 35°C a germinação dos conídios dos isolados de B. bassiana foi baixa em relação aos isolados de M. anisopliae. Por outro lado, Ekesi et al. (1999), testando a germinação desses fungos em temperaturas entre 15°C e 35°C, verificaram que não houve diferença significativa na germinação na faixa de 20 e 30°C, porém, em 35°C todos os isolados apresentaram baixa germinação.
Crescimento vegetativo. Os fungos testados apresentaram crescimento vegetativo em ambas temperaturas avaliadas. Contudo, a 26°C o crescimento vegetativo foi significativamente maior para todos os isolados a 26°C do que a 32°C (Tabela 1). Entretanto, houve diferenças entre os isolados a 26°C, pois UEL50 e CB116 de M. anisopliae apresentaram maior crescimento vegetativo se comparados aos dois isolados de B. bassiana, podendo ser este crescimento uma característica da espécie. Além disso, a 26°C houve diferença significativa entre os dois isolados de M. anisopliae, visto que as colônias do isolado CB116 foram cerca de 1,3 vezes maiores do que as do isolado UEL50 (Tabela 1).
Da mesma forma que a 26°C, os isolados UEL50 e CB116 a 32°C apresentaram o diâmetro médio de colônia maior que os isolados de B. bassiana. Isto pode estar relacionado à maior sensibilidade deste fungo a altas temperaturas, visto que, de acordo com Alves & Leucona (1998), a faixa ideal de desenvolvimento dos isolados de M. anisopliae está entre 24°C e 32°C, enquanto que para os isolados de B. bassiana, a temperatura favorável está entre 22°C e 26°C.
Resultados semelhantes foram obtidos por Inglis et al. (1996), Ekezi et al. (1999)e por Fargues et al. (1997) com o fungo B. bassiana, que verificaram maior crescimento vegetativo deste fungo na faixa de 25°C e 28°C.
Produção de conídios em meio de cultura. A produção de conídios/colônia variou de acordo com a temperatura de incubação, sendo maior quando os fungos foram mantidos a 26°C (Tabela 1). Observou-se também que os dois isolados de M. anisopliae foram mais produtivos e não diferiram entre si, com valores próximos a 7 ´ 108 conídios/colônia. Os isolados e B. bassiana produziram cerca de 15 vezes menos conídios.
Ressalta-se que à temperatura de 32°C, apenas o isolado UEL50 de M. anisopliae apresentou conidiogênese, não sendo esta redução proporcional à redução no diâmetro da colônia, confirmando a influência da temperatura apenas na conidiogênese (Tabela 1).
A comparação de tais resultados com os de outros trabalhos na literatura demonstra a grande variação existente entre os isolados, haja vista que Pachamuthu et al. (1999), Oliveira et al. (2003) e Andaló et al. (2004), obtiveram entre 4,9 ´ 107 a 1,6 ´ 109 conídios/colônia, provavelmente em decorrência da variabilidade genética entre os isolados.
Virulência de isolados de M. anisopliae e B. bassiana para larvas e adultos do cascudinho. Os dados de mortalidade obtidos apresentaram grande variabilidade, explicitando as diferenças na atividade entomopatogênica dos fungos B. bassiana (UNIOESTE02 e UEL25) e M. anisopliae (UEL50 e CB116) nas duas temperaturas testadas. Os isolados testados foram patogênicos em ambas as temperaturas avaliadas. Contudo, a 26°C, a mortalidade foi maior para todos os isolados quando comparada com a mortalidade obtida a 32°C, tanto para larvas como para adultos. Além disso, não houve diferença significativa na mortalidade larval nessa temperatura, para M. anisopliae. Em relação ao estágio adulto, na temperatura de 26°C, o isolado CB116 não causou mortalidade e o isolado UEL25 foi significativamente superior em relação aos demais. Já na temperatura de 32°C, apenas o isolado UEL25 apresentou mortalidade (26,6%) (Tabela 2).
Com relação à diferença de suscetibilidade entre o estágio larval e adulto a 26°C, observou-se que os isolados de M. anisopliae foram, em média, cerca de 10 vezes mais efetivos para os insetos no estágio larval que para os adultos. Em relação a B. bassiana, não foi observada diferença na suscetibilidade entre larvas e adultos. Entretanto, a suscetibilidade entre estágio larval e adulto a 32°C apresentou maior diferença, pois excetuando-se os isolados UNIOESTE02 e UEL25, os demais isolados foram significativamente mais eficientes contra larvas, não causando mortalidade de adultos (Tabela 2).
Maior suscetibilidade larval do cascudinho para B. bassiana também foi observada por Steinkraus et al. (1991), Crawford et al. (1998) e por Geden et al. (1998). Mais recentemente, Chernaki-Leffer (2004) também avaliou a suscetibilidade de A. diaperinus a fungos entomopatogênicos, verificando também maior suscetibilidade larval. Contudo, de maneira contrária ao aqui observado, os maiores percentuais de mortalidade foram obtidos com isolados de M. anisopliae.
Um outro estudo realizado por Rohde (2004, não publicado) com 58 isolados de B. bassiana e 41 de M. anisopliae para o controle de larvas e adultos de A. diaperinus, indicou que todos isolados de B. bassiana foram patogênicos para larvas e adultos, não sendo o mesmo observado para M. anisopliae. Além disso, verificou-se que as larvas também foram mais suscetíveis que os adultos.
O grau de virulência pode variar com o patógeno, capacidade de replicação e germinação, inoculo, hospedeiro, formulação, nutrição do patógeno, entre outros (Alves & Lecuona 1998). Também, Neves & Hirose (2005) atribuíram essas variações na virulência entre os isolados, possivelmente à forma de inoculação, à concentração da suspensão de conídios, e à variabilidade natural entre os isolados.
Os dados do presente estudo indicam que os isolados de M. anisopliae apresentaram maior resistência à temperatura de 32°C. Sendo assim, provavelmente nas áreas mais quentes do aviário, esse fungo pode ser mais eficiente no controle dos insetos. Já os isolados de B. bassiana, sendo mais sensíveis à temperatura mais elevada, seriam mais eficazes quando aplicados na região do aviário onde se dá o crescimento das aves.
Produção de conídios de cadáveres de cascudinho. A temperatura apresentou influência direta na conidiogênese em cadáveres. A 26°C, os isolados de B. bassiana foram mais produtivos tanto em larvas como nos adultos. Os isolados de M. anisopliae, por sua vez, à mesma temperatura, apresentaram valores significativamente menores, próximos a zero, não sendo possível determinar este valor pela baixa concentração na suspensão obtida. Na temperatura de 32°C, apenas os isolados de M. anisopliae apresentaram conidiogênese e somente em cadáveres de larvas (Tabela 3).
Os efeitos dos fatores físicos e bióticos na conidiogênese de B. bassiana sobre cadáveres de Cerotoma arcuata (Olivier) foram avaliados por Fernandes et al. (1989), mostrando que a mesma não ocorreu a 30°C pela presença de outros microrganismos no cadáver, especialmente bactérias e fungos contaminantes, como Aspergillus sp., que favorecidos pelas temperaturas mais altas, colonizaram o hospedeiro mais rapidamente que B. bassiana. Dessa forma, o fungo entomopatogênico pôde infectar e matar o inseto, mas seu desenvolvimento micelial e a conidiogênese foram inibidos por antagonismo com contaminantes, principalmente quando as condições de temperatura foram desfavoráveis ao entomopatógeno. No presente trabalho, também se observou em muitos cadáveres, a presença de Aspergillus sp., o que provavelmente afetou a produção de conídios nos insetos incubados a 32°C.
Os resultados aqui obtidos são confirmados por estudos feitos por Luz et al. (1998), que verificaram variabilidade entre isolados de B. bassiana com relação a conidiogênese sobre cadáveres de triatomíneos, e determinaram que a temperatura ideal de incubação é entre 20 e 25°C. De modo semelhante, Arthus & Thomas (2001) determinaram que a temperatura ideal para a esporulação do M. anisopliae, em cadáveres de Schistocerca gregaria (Forskal) está na faixa de 20 a 30°C, confirmando a adaptação deste fungo a temperaturas mais altas.
Comparando-se a virulência dos isolados com a respectiva produção de conídios em cadáveres, verificou-se que os isolados de B. bassiana, na temperatura de 26°C, além de serem mais virulentos, propiciaram maior concentração de conídios nos cadáveres de larvas e adultos do cascudinho. Contudo, o mesmo não ocorreu no trabalho de Luz et al. (1998). Segundo os autores, apesar de terem sido verificados quatro isolados virulentos contra Triatoma infestans (Klug), apenas um deles se destacou na produção de conídios em cadáveres, sendo este isolado considerado o mais promissor para o controle de triatomíneos.
Visando comparar a produção de conídios de B. bassiana em cadáveres de insetos imaturos e adultos e o efeito de diferentes temperaturas de incubação, Sosa-Gómez & Alves (2000) verificaram que a produção de conídios em cadáveres de Nezara viridula (L.) e Piezodorus guildinii (Westwood) foi maior em ninfas de 5º estágio (100% de esporulação, entre 22°C e 30ºC), em relação aos adultos, demonstrando que a fase imatura do inseto foi mais suscetível ao isolado de B. bassiana que os adultos. Segundo os autores, à temperatura mais alta (34ºC) não ocorreu conidiogênese, o que também foi observado neste trabalho.
Efeito cama nova e usada e da temperatura na mortalidade de larvas e adultos do cascudinho por B. bassiana. A temperatura de incubação e os diferentes substratos apresentaram interferência na mortalidade de larvas e adultos, sendo esta maior quando os insetos foram mantidos na cama nova e incubados a 26°C (Tabela 4). Além disso, na fase larval houve diferença significativa entre as camas, sendo maior a eficiência do fungo na cama nova, quando comparada à cama usada (respectivamente 15,7% e 2,3% de mortalidade confirmada). A mesma tendência foi observada para os insetos adultos, com 66,7% de mortalidade confirmada na cama nova e apenas 8,9% da mortalidade de insetos na cama usada. Como não houve confirmação da mortalidade por fungo à temperatura de 32ºC, não foi possível avaliar o efeito das camas nessa temperatura. De acordo com Alves & Leucona (1998), os microrganismos não possuem mecanismos biológicos para se defender das grandes variações de temperatura. Esse fator, atuando direta ou indiretamente, pode ser limitante para a maioria dos entomopatógenos porque afeta seu metabolismo, alterando os processos de produção de enzimas, toxinas e germinação dos conídios.
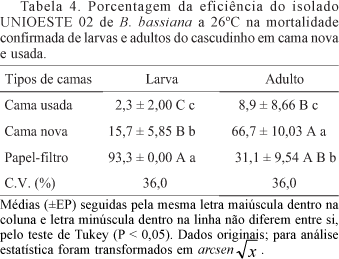
Resultados semelhantes foram obtidos por Crawford et al. (1998), com mortalidade larval próxima de 90% em cama nova (usando isolados de B. bassiana sobre o cascudinho em aplicações na ordem 1011 conídios/m2) e apenas de 60% de mortalidade em cama usada. Em adultos, os valores de mortalidade observados por esses autores variaram de 33% a 38% em cama nova e menores porcentagens para cama velha.
Grande variação na eficiência de alguns isolados de B. bassiana foram verificados por Geden et al. (1998) quando aplicados sobre a cama e solo, sendo a maior mortalidade de larvas e adultos do cascudinho igualmente em cama nova.
Essa variação entre cama usada e nova deve-se a vários fatores levantados por Crawford et al. (1998), como alterações físicas na cama em decorrência da presença das aves no aviário, incluindo a diminuição no tamanho das partículas e, conseqüente compactação da cama, ou ainda a formação de agregados de maravalha e fezes que formam placas na superfície da cama. Nessas condições, a dispersão dos conídios pela cama pode ser severamente reduzida, pois a cama torna-se um meio denso e heterogêneo.
Deve-se levar em consideração ainda que alterações químicas e biológicas também ocorrem, pois a presença de matéria orgânica (excremento, ração e restos de animais) favorece o crescimento de microganismos que ao decomporem o ácido úrico presente nos excrementos liberam amônia, produto sabidamente com ação fungistática (Bacon 1985).
A mudança do pH na cama à medida que ela é utilizada pode afetar a viabilidade do fungo, como ressaltado por Jones & Hagler (1982). Neste sentido, Groden & Lockwood (1991) observaram, especificamente para o fungo B. bassiana, que o efeito fungistático aumenta exponencialmente com a elevação do pH. Além disso, os autores também observaram que a competição no meio de cultura inibe a germinação de conídios do fungo.
Concluindo, os resultados aqui obtidos indicam o potencial dos isolados UNIOESTE02 e UEL25 de B. bassiana em um futuro programa de controle do cascudinho. Os resultados indicam, ainda, que ao elaborar um projeto de pesquisa visando ao controle biológico de uma praga, é necessário incluir a seleção de isolados baseado na virulência e na influência de fatores ambientais físicos e químicos tais como, temperatura, luz, umidade relativa, pH, entre outros, de forma a garantir o sucesso na aplicação desses fungos no campo. Além disso, evidenciou-se que a seleção de isolados, além de avaliar a virulência dos mesmos, deve levar em consideração a produção de conídios em cadáveres e não apenas produção em meio de cultura in vitro para que se possa apontar os melhores fungos para o controle da praga em questão.
Aos estagiários do Laboratório de Zoologia/Unioeste/CCBS, pelo auxílio nas avaliações e ao CNPq pela concessão de Bolsa de Iniciação Científica e de Produtividade em Pesquisa.
Talita M. AlexandreI, II; Luis F.A. AlvesIII, V; Pedro M.O.J. NevesI, V; Sérgio B. AlvesIV, V
sebalves[arroba]esalq.usp.br
I. Depto. Agronomia, Univ. Estadual de Londrina, C. postal 6001, 86051-970, Londrina, PR
II. Programa de Pós-Graduação, Depto. Agronomia /UEL, Mestrado, C. postal 6001, 86051-970, Londrina, PR
III. Lab. Zoologia, Univ. Estadual do Oeste do Paraná/CCBS, C. postal 000711, 85819-110, Cascavel, PR
IV. Depto. Entomologia, Fitopatologia e Zoologia Agrícola, Escola Superior de Agricultura "Luiz de Queiroz", USP C. postal 9, 13400-970, Piracicaba, SP
V. Bolsista de Produtividade em Pesquisa/CNPq
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|