 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
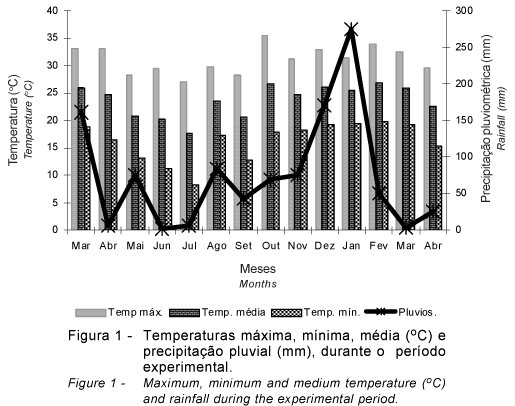
O experimento foi desenvolvido em uma área experimental pertencente ao Instituto de Zootecnia, Nova Odessa - SP (22º42' latitude Sul, 47º18' longitude Oeste e 528m). O período experimental foi de 21/05/2002 a 14/03/2003 e os dados climáticos referentes ao período foram coletados no posto meteorológico do Instituto de Zootecnia, Nova Odessa/SP (Figura 1).
A área experimental situou-se num solo classificado como Argissolo Vermelho-Amarelo Distrófico (Empresa Brasileira de Pesquisa Agropecuária, 1999) e foi constituída de quatro piquetes com, aproximadamente, 1500 m2 cada, estabelecidos em dezembro de 2000 – dois com capim-aruana (Panicum maximum Jacq. cv. Aruana) e dois com capim-tanzânia (Panicum maximum Jacq. cv. Tanzânia), perfazendo dois blocos experimentais. De acordo as análises químicas do solo antes do experimento (Tabelas 1 e 2), não havia necessidade de calagem ou aplicação de nutrientes, exceto nitrogênio, em relação às exigências das espécies em estudo (Werner et al., 2001) e, por isso, não foi realizada prática de correção do solo.


Em cada bloco, os piquetes foram divididos com cerca eletrificada, para se aumentar o número de parcelas experimentais (repetição). Cada parcela (metade do piquete) foi considerada a repetição dentro do bloco. As quatro parcelas de cada capim foram pastejadas seqüencialmente em sistema intermitente de três a sete dias de pastejo (para atingir 20 cm de altura do resíduo pós-pastejo em ambos os capins) por dois lotes de ovinos (mob grazing). O período de descanso foi variável. Os tratamentos utilizados foram os capins aruana e tanzânia (parcelas) e as doses de nitrogênio de 150 e 300 kg ha-1 de N, subparcelas pastejadas simultaneamente (sem separação por cercas). A aplicação de cada dose de N foi parcelada com 1/3 no início das águas (novembro e dezembro/2003) e os outros 2/3 no final das águas (março e abril/2002), conforme Werner et al. (2001). Utilizou-se delineamento de blocos completos casualizados, em parcelas subdivididas, com quatro repetições e medidas repetidas no tempo. Os capins constaram das parcelas principais e o nitrogênio, das subparcelas. A análise de variância dos dados foi realizada por meio do procedimento MIXED do pacote estatístico SAS (Statistical Analysis System) (SAS, 1999) versão 8.02 para Windows. As interações significativas foram comparadas pelo teste Tukey a 10%.
Foram coletadas, antes da entrada dos animais, quatro amostras de raízes de cada unidade experimental, na profundidade de zero a 20 cm, utilizando-se uma sonda de dois cm de diâmetro, sendo o volume de terra coletado de 62,8 cm3. Dessas amostras, foram feitas amostras compostas com volume de terra total de 251,2 cm3. A coleta foi realizada ao lado da base de touceiras representativas da área, selecionadas por meio do método da reta transecta (Carvalho et al., 2003), de maneira que representassem o tamanho médio das touceiras presentes na unidade experimental. Segundo estudo realizado na área experimental por Carvalho et al. (2003), a área de solo coberta por plantas, na média dos dois capins, foi de 47%. Por isso, optou-se por não extrapolar os dados para hectare, evitando-se super estimativa de raízes, expressando os resultados das amostragens em relação a cm3 de solo. As datas de amostragem foram: C1 = 21/05 a 11/06 (outono); C2 = 17/07 a 07/08 (inverno); C3 = 05/09 a 25/09 (primavera); C4 = 08/01 a 06/02 (verão), sendo realizadas oito coletas por período.
Após a saída dos animais, foram avaliados os períodos de rebrotação, que abrangeram as seguintes datas: R1 = 30/05 a 17/07/02 (outono/inverno), R2 = 22/07 a 12/09/02 (inverno), R3 = 11/09 a 28/10/02 (primavera), e R4 = 14/01 a 14/03/03 (verão). Em cada unidade experimental, foram selecionadas e identificadas com estacas de madeira quatro touceiras representativas da área (Carvalho et al., 2003), foram feitos dois buracos ao lado da base de cada touceira (oito buracos cilíndricos no perfil do solo por unidade experimental) com sonda de dois cm de diâmetro, na profundidade de 0 a 20 cm. O solo foi retirado, os buracos preenchidos com areia de rio lavada e cobertos, então, com uma camada de argila de aproximadamente 15 mm, pressionada no topo de cada buraco para agir como lacre, conforme Matthew (1992). A cada sete dias, foi sorteada uma das quatro touceiras e retirado o material contido nos dois buracos, para formar uma amostra composta com volume de 125,6 cm3.
Todo o material coletado foi lavado em água corrente, utilizando-se uma peneira de malha de 0,25 mm, separando as raízes do solo. Após lavagem, foram feitas a limpeza e a separação das raízes, que foram acondicionadas em uma solução contendo 70% de álcool etílico, para análises posteriores.
As raízes foram retiradas do álcool e coradas em uma solução de 0,5% de azul de metileno por cinco minutos e, em seguida, foram distribuídas em bandeja de vidro de 36 x 23 cm e 3,5 cm de altura, com 150 mL de água, que foi colocada sobre um escâner de mesa com resolução de 300 dpi. As imagens das raízes, obtidas pela varredura efetuada pelo escâner e transferidas automaticamente para um arquivo no computador, foram consideradas imagens já digitalizadas, prontas para o processamento do cálculo do comprimento total e da superfície radicular. O comprimento total e a superfície das raízes foram estimados pelo sistema Delta T SCAN Image Analisys Software, que fornece medidas acuradas do comprimento e da superfície de raízes (Greenwood & Hutchinson, 1998; Bouma et al., 2000) expresso em unidade por volume de solo. Seqüencialmente, as amostras de raízes foram colocadas em estufa com circulação forçada a 65ºC até peso constante e pesadas para determinação dos teores de matéria seca. Posteriormente, foram transferidas para mufla a 650ºC, por 4 horas, para determinação da matéria mineral, necessária para o cálculo da massa da matéria orgânica (MSMO) das raízes.
Na avaliação de raízes pré-pastejo, foram determinados a massa seca da matéria orgânica, o comprimento e a superfície de raízes. Os valores foram expressos em mg cm-3, cm cm-3 e cm2 cm-3 de solo, respectivamente. Na avaliação do crescimento radicular pós-pastejo, os valores de MSMO, comprimento e superfície de raízes foram expressos em mg 100 cm-3, cm 100 cm-3 e cm2 100 cm-3 de solo, respectivamente.
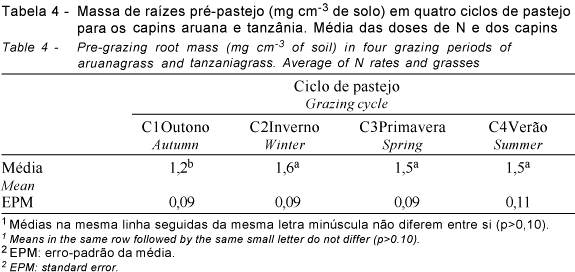
Para massa seca da matéria orgânica (mg cm-3 de solo) de raízes, houve interação capins x doses de N (Tabela 3). O capim-tanzânia apresentou maior MSMO para a dose de 300 em relação à de 150 kg ha-1 de N, enquanto a MSMO do capim-aruana não diferiu (p>0,10) entre as doses de N estudadas.

O capim-tanzânia, na média entre doses de N e ciclos de pastejo, teve maior quantidade de MSMO (1,7 mg cm-3 de solo) que o capim-aruana (1,2 mg cm-3 de solo), provavelmente em virtude de seu maior porte. Isso pôde ser observado visualmente, pois, em períodos de seca mais prolongados, o capim-tanzânia demoroou mais tempo para mostrar estresse hídrico (enrolamento de folhas).
A maior MSMO observada para a dose de 300 kg ha-1 de N difere dos resultados obtidos por Cecato et al. (2003), que avaliaram o peso seco de raízes do capim-tanzânia adubado com quatro doses de nitrogênio (50, 100, 200 e 400 kg ha-1 de N, fracionadas em quatro aplicações durante a primavera e verão), porém trabalhando apenas no período das águas (setembro a maio), com pastejo sob lotação contínua e taxa de lotação variável, mantendo altura média do dossel forrageiro em 50 cm. Esses autores reportaram que a produção de MS de raízes foi semelhante entre as doses de N utilizadas, sendo de 51, 50, 47 e 40 mg de raízes/687 cm3 de solo para as doses de 50, 100, 200 e 400 kg ha-1 de N, respectivamente, o que, segundo os autores, decorreu do manejo adequado, mantendo-se a altura média do dossel forrageiro em 50 cm para todos os tratamentos e elevado índice de área foliar, o que resultou em pesos semelhantes. No entanto, não foi mencionada a profundidade de coleta, apenas o volume de solo coletado. Esse fato, juntamente com a época do ano e o manejo do pastejo adotado, podem ser motivos pelos quais os valores diferiram dos encontrados neste trabalho.
A MSMO do sistema radicular diferiu (P<0,10) entre os ciclos de pastejo (Tabela 4). No C1 (outono), a MSMO de raízes foi menor (P<0,10) que nos demais ciclos avaliados que, por sua vez, não diferiram entre si (P>0,10). Pagotto (2001), por sua vez, avaliando o sistema radicular do capim-tanzânia irrigado, não verificou diferença entre massa de raízes pré-pastejo entre os períodos de primavera, verão e outono. Tosi (1999), avaliando o sistema radicular do capim-tanzânia em pastejo, em São Carlos (SP), reportou que maior massa de raízes foi observada durante os meses de janeiro e fevereiro (verão). No período C2, houve elevada massa de raízes, diferindo do comportamento por esses autores. Mas, no período anterior a C2, ocorreram as menores precipitações e temperaturas (Figura 1), que causaram menor crescimento da parte aérea. Portanto, esse é um período de menor acúmulo de forragem (Giacomini, 2003), quando os compostos de reserva não estão sendo utilizados para o crescimento da parte aérea, podendo ser empregados pelo sistema radicular, favorecendo seu crescimento. Lupinacci (2002), estudando capim-marandu em lotação contínua, registrou maiores massas de raízes nos meses de setembro e outubro, explicando esse comportamento pela ausência de condições climáticas favoráveis ao crescimento da parte aérea da planta forrageira.
As variáveis comprimento (Tabela 5) e superfície (Tabela 6) das raízes no pré-pastejo apresentaram comportamento semelhante: por isso, optou-se por discuti-las simultaneamente. Ambas as variáveis diferiram (P<0,10) entre capins, doses de N e ciclos de pastejo, havendo interação capins x doses de N, ciclos de pastejo x doses de N, e ciclos de pastejo x capins x doses de N. O desdobramento dessa última interação foi utilizado para mostrar os resultados obtidos (Tabelas 5 e 6).
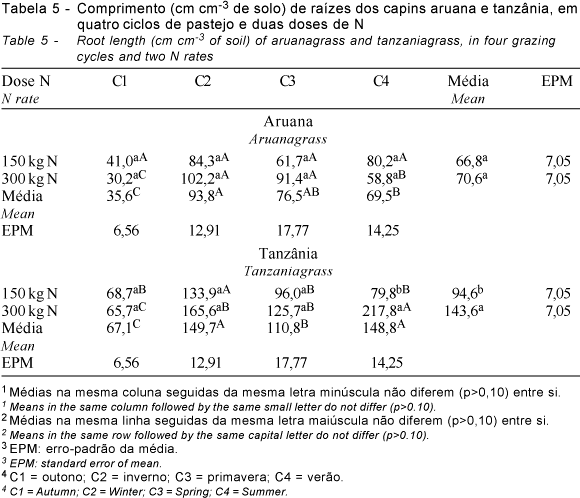
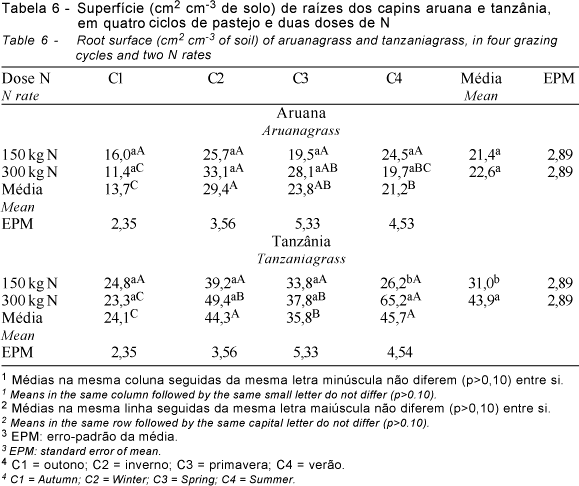
O comportamento dos dois capins foi diferente quanto ao comprimento e superfície do sistema radicular ao longo dos ciclos de pastejo, de modo que, para o capim-aruana, essas variáveis foram superiores no C2 e C3 (inverno e primavera), enquanto, para o capim-tanzânia, isso ocorreu no C4 (verão) (Tabelas 5 e 6), comprovando diferenças morfofisiológicas entre eles. As características em comum para ambos os capins foram menores MSMO, comprimento e superfície do sistema radicular no C1 (outono).
Na média entre doses de N e ciclos de pastejo, o comprimento do sistema radicular pré-pastejo do capim-tanzânia foi maior (P<0,10) (119,1 cm cm-3 de solo) que do capim-aruana (68,7 cm cm-3 de solo). Na média entre capins e ciclos de pastejo, a dose de 300 kg ha-1 de N contribuiu para maior comprimento do sistema radicular (P<0,10) (107,1 cm cm-3 de solo) que a dose de 150 kg ha-1 de N (80,7 cm cm-3 de solo). O mesmo aconteceu para a superfície do sistema radicular pré-pastejo, com o capim-tanzânia apresentando maior superfície (P<0,10) (37,4 cm2 cm-3 de solo) que o capim-aruana (22,0 cm2 cm-3 de solo), assim como a dose de 300 kg ha-1 de N contribuiu para maior superfície do sistema radicular (P<0,10) (33,3 cm2 cm-3 de solo) que a dose de 150 kg ha-1 de N (26,2 cm2 cm-3 de solo).
O crescimento do sistema radicular nos períodos de rebrotação pós-pastejo teve sua dinâmica quantificada por meio da análise do crescimento de raízes em buracos preenchidos com areia (refilled cores), conforme Matthew (1992).
Na Figura 2, constam os resultados de crescimento de raízes quanto à massa seca da matéria orgânica (MSMO) (mg 100 cm-3), obtidos em quatro períodos de rebrotação e nas quatro idades de crescimento pós-pastejo (médias de capins e doses de N). Houve diferença entre períodos de rebrotação (P<0,10) e idades de crescimento pós-pastejo (P<0,10), assim como houve interação períodos de rebrotação x idades de crescimento pós-pastejo (P<0,10). Não foram observadas diferenças entre capins (P>0,10) e entre doses de N (P>0,10) e não houve interação capins x doses de N.
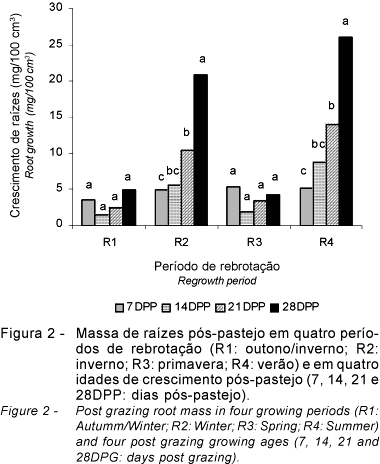
Os períodos em que houve maior crescimento de raízes foram o R2 e o R4, equivalentes às amostragens efetuadas nas estações de inverno e verão, ao passo que, nos períodos R1 e R3 (outono/inverno e primavera), não houve variação de crescimento de raízes (P>0,10). Confrontando esses dados com os de precipitação (Figura 1), percebe-se que os períodos de maior crescimento (R2 e R4) coincidem com os de maior precipitação (o mês de agosto, que coincide com o R2, foi bastante chuvoso), enquanto os dois períodos de menor crescimento (R1 e R3) correspondem às épocas de menor precipitação (o R3 ocorreu na primavera, que, nesse ano, apresentou precipitação abaixo do normal).
Entretanto, Matthew (1992), estudando azevém perene sob pastejo na Nova Zelândia, observou que a MSMO de raízes elevou durante o período seco (verão neozelandês), ao contrário do que ocorreu no presente estudo.
Nas idades de crescimento pós-pastejo avaliadas, pode-se observar a dinâmica cronológica de desenvolvimento radicular para 7, 14, 21 e 28 dias. Nos períodos de avaliação R1 e R3, não houve diferença para MSMO de raízes (P>0,10) entre as idades de crescimento, coincidindo com os períodos em que houve menor crescimento do sistema radicular. Nos períodos R2 (inverno, porém com agosto chuvoso) e R4, houve diferenças para a massa de raízes (P<0,10) entre as idades de crescimento, sendo que, aos 7 e 14 dias, a massa de raízes foi semelhante, assim como aos 14 e 21 dias, e se acentuou dos 14 aos 28 dias pós-pastejo.
O comprimento de raízes (Figura 3) diferiu (P<0,10) nas doses de N e nos períodos de rebrotação, assim como houve interação (P<0,10) doses de N x períodos de rebrotação e períodos de rebrotação x idades de crescimento pós-pastejo. Entretanto, não foram observadas diferenças entre capins e nem interação entre capins e doses de N (P>0,10). O crescimento em comprimento de raízes no pós-pastejo (cm 100 cm-3) (Figura 3) apresentou comportamento semelhante à MSMO dessas mesmas raízes (Figura 2), mostrando que ambas as variáveis podem fornecer subsídios para avaliação do comportamento do sistema radicular.
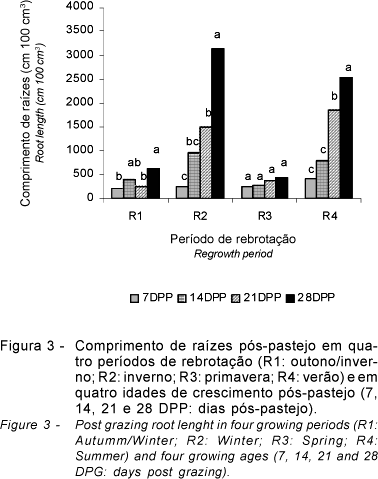
Os períodos de rebrotação em que se mensurou o maior crescimento em comprimento de raízes foram os de inverno (porém com agosto chuvoso) e verão (R2 e R4), à semelhança do que ocorreu para a variável MSMO, com a diferença de que o crescimento foi maior no período de inverno chuvoso, seguido pelo de verão. Nos períodos R1 e R3, referentes a outono/inverno e primavera, com a limitação de chuvas, foi constatado menor crescimento do sistema radicular.
Com as idades de crescimento pós-pastejo, observou-se o crescimento, em comprimento das raízes, aos 7, 14, 21 e 28 dias. No R1, os comprimentos aos 7, 14 e 21 dias pós-pastejo não diferiram entre si (P>0,10), mas aos 28 dias foi maior (P<0,10) que aos 7 e 21 dias (Figura 3). No R3, porém, à semelhança do ocorrido com MSMO (Figura 2), as avaliações nas idades de crescimento não diferiram entre si (P>0,10).
Nos períodos de rebrotação R2 e R4, houve diferenças acentuadas para comprimento de raízes (P<0,10) entre as idades de crescimento. Para ambos os períodos de rebrotação, as avaliações aos 7 e 14 dias pós-pastejo não diferiram entre si (P>0,10). No R2, o comprimento das raízes aos 14 e 21 dias pós-pastejo não foi diferente (P>0,10), mas diferiu acentuadamente do comprimento aos 28 dias. No R4, os crescimentos em comprimento aos 7 e 14 dias pós-pastejo também não diferiram entre si (P>0,10), enquanto, aos 14 dias diferiu (P<0,10) daquele aos 21 e 28 dias pós-pastejo, indicando que o comprimento radicular aumentou acentuadamente a partir dos 14 dias pós-pastejo no verão. Os compostos de reserva (carboidratos não-estruturais e compostos nitrogenados) acumulados, principalmente, na base do colmo e nas raízes das plantas (Donaghy & Fulkerson, 1998) têm sua concentração reduzida por ocasião da desfolha, indicando que a rebrota da planta forrageira é dependente desses compostos de reserva até que a área foliar formada seja suficiente para atender as necessidades do perfilho, isto é, o perfilho em rebrota passa do estádio de dreno para fonte metabólica (Pagotto, 2001). Ao estudar o crescimento de raízes do capim-tanzânia irrigado, Pagotto (2001) afirmou que a planta fica sob condição de estresse até pelo menos duas semanas após ser colhida, independente do manejo imposto. Comportamento semelhante foi verificado neste experimento, podendo-se inferir que os compostos de reserva têm importante influência sobre o crescimento do sistema radicular pós-desfolha.
Constam na Figura 4 os valores de comprimento de raízes, em função das doses de N e períodos de rebrotação, na média dos dois capins.
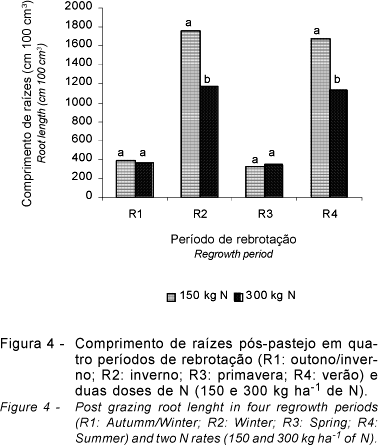
No R1 e R3, não houve diferença entre as doses de N no comprimento das raízes (P>0,10). Mas nos períodos de rebrotação R2 e R4, que foram os que apresentaram maior crescimento do sistema radicular, verificou-se diferença (P<0,10) entre as doses de N. A dose de 150 kg ha-1 de N promoveu maior crescimento em comprimento do sistema radicular que a dose de 300 kg ha-1 de N.
Os resultados obtidos de crescimento em superfície do sistema radicular (cm2 100 cm-3) nos períodos de rebrotação avaliados e nas idades de crescimento pós-pastejo encontram-se na Figura 5. Houve diferença (P<0,10) entre doses de N, períodos de rebrotação e idades de crescimento pós-pastejo, assim como interação (P<0,10) períodos de rebrotação x idades de crescimento pós-pastejo. Não foram observadas diferenças entre os capins e nem interação capins x doses de N (P>0,10).
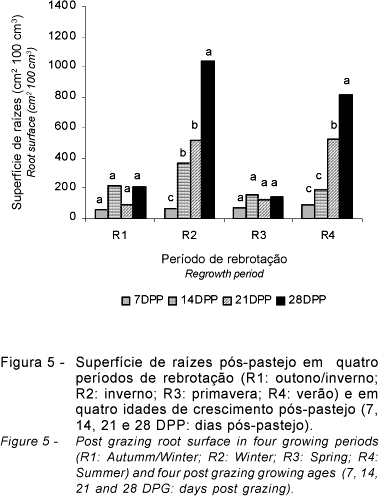
Os períodos de rebrotação que apresentaram maior aumento da superfície do sistema radicular foram o R2 e o R4, enquanto, nos períodos R1 e R3, não houve variação na superfície de raízes.
Nos períodos de rebrotação R1 e R3, a superfície de raízes não diferiu (P>0,10) entre as idades de crescimento pós-pastejo. Aos 14 dias, a superfície radicular, foi superior àquela da avaliação aos 7 dias no R2, mas não diferiu (P>0,10) no R4. A avaliação aos 21 dias indicou maior crescimento da superfície radicular (P<0,10) no R2 e R4 e crescimento também acentuado (P<0,10) aos 28 dias pós-pastejo.
Na Figura 6, consta o crescimento em superfície radicular em função das doses de N e dos períodos de rebrotação, na média dos dois capins. No R1 e R3, não houve diferença entre doses de N na superfície de raízes (P>0,10). Todavia, nos períodos de rebrotação R2 e R4, que foram os que apresentaram maior crescimento em superfície de raízes, notou-se diferença (P<0,10) entre as doses de N.
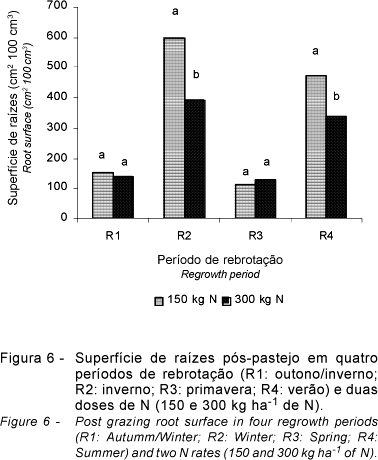
Esses resultados corroboram a afirmação de Bosemark (1954) de que relação inversa entre suprimento de nitrogênio e desenvolvimento de raízes é um fenômeno bem conhecido, em que baixas doses de N ocasionam raízes mais longas, enquanto o aumento do suprimento de N resulta em raízes menores. Uma possível explicação para esse comportamento, segundo Lemaire (1997), é que plantas crescendo em condições de baixa disponibilidade de N e, portanto, com reduzida atividade meristemática da parte aérea, alocam maior proporção de produtos da fotossíntese para o sistema radicular. Confirmando esse comportamento, Corsi et al. (2001) relatam que a estratégia da planta forrageira que rebrota em ambientes com baixa disponibilidade de N seria a de minimizar o impacto da desfolhação sobre o sistema radicular, uma vez que a baixa atividade meristemática nessas situações, resultado da falta de N no sistema, limita o rápido desenvolvimento da parte aérea e, desse modo, a retomada do balanço positivo de carbono. Portanto, o suprimento de N para a parte aérea depende de um sistema radicular mais desenvolvido e capaz de explorar melhor o meio edáfico. Baligar (1998), avaliando o crescimento do sistema radicular de trigo, observou que a massa de raízes foi menos afetada pela variação no suprimento de N que o comprimento (como neste trabalho) e que altas doses de N reduziram o crescimento em comprimento das raízes.
Em contrapartida, esses resultados diferem daqueles obtidos por Singh (1996), que conduziu experimento durante quatro anos para avaliar o efeito do uso de fertilizante nitrogenado em características do sistema radicular e concluiu que a aplicação de nitrogênio elevou o comprimento radicular até a dose de 200 kg ha-1 de N para Panicum maximum Jacq. cv. Makueni.
O sistema radicular dos dois capins (Aruana e Tanzânia) seguiu padrões de crescimento semelhantes nas avaliações de MSMO, comprimento e superfície radicular. Um fator que realmente contribuiu para maior crescimento de raízes foi a ocorrência de precipitação (Tabela 7).
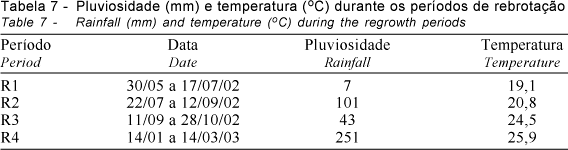
Durante o R1, a pluviosidade foi pequena, mas aumentou no R2, diminuiu novamente no R3, elevando-se novamente no R4. Comparando-se os dados da Tabela 7 com as Figuras 2, 3 e 5, observa-se que os períodos em que houve maior crescimento de raízes coincidiram com aqueles em que ocorreu maior precipitação, de modo que o maior crescimento em comprimento (Figura 3) e superfície (Figura 5) de raízes do R2 pode ser explicado pela maior precipitação. Essa hipótese é reforçada pelos resultados obtidos por Pagotto (2001), que não encontrou diferença entre épocas do ano para as variáveis massa, comprimento e superfície de raízes, provavelmente por ter trabalhado com o capim-tanzânia irrigado. Além disso, esse foi um período de pouco crescimento da parte aérea, com apenas 8% do acúmulo do período avaliado (Giacomini, 2003), em que não foram utilizadas reservas para a rebrotação, que podem ser empregadas para promover maior crescimento do sistema radicular. Sheard (1973) indicou que as plantas acumulam compostos de reserva em órgãos permanentes, remanescentes após a desfolha. Conseqüentemente, órgãos como raízes, rizomas e base do colmo são utilizados para armazená-los. Lupinacci (2002), estudando reservas de carboidratos e nitrogênio no capim-marandu, encontrou maiores teores e estoques de carboidratos não-estruturais e nitrogênio no mês de setembro. Normalmente, durante a recuperação das plantas após a desfolha, verifica-se aumento marcante na atividade de enzimas proteolíticas, com concomitante redução nos teores de proteínas solúveis presentes em órgãos de reserva, resultando na produção de aminoácidos livres, que seriam deslocados para as zonas meristemáticas e contribuiriam para formação de novos tecidos (Volenec et al., 1996), no caso, as zonas meristemáticas de raízes, pois havia pouca demanda para crescimento da parte aérea, em decorrência das condições pouco favoráveis no período. Aparentemente, a planta já investiu seus compostos de reserva no crescimento de raízes durante o período R2 e, no período R3, essas reservas podem ter se esgotado.
O crescimento expressivo do sistema radicular no verão pode ter decorrido do maior crescimento da parte aérea. Como a parte aérea depende das raízes para suprimento de água e minerais, e o sistema radicular depende da parte aérea para suprimento de fotoassimilados, há uma estreita relação entre ambos os processos (Brouwer, 1962). Com o maior crescimento da parte aérea nesse período, graças às condições favoráveis de temperatura e precipitação, aumentou a necessidade de suprimento de nutrientes do solo pelo sistema radicular que, por sua vez, aumentou seu crescimento em busca desses nutrientes, tendo sido favorecido pela maior quantidade de fotoassimilados produzidos pela parte aérea. Segundo Lupinacci (2002), os menores teores e estoques de carboidratos não-estruturais e nitrogênio foram encontrados nos meses de janeiro e fevereiro, o que significa pouco investimento em acúmulo de reservas, pois os fotoassimilados estavam sendo utilizados para crescimento da parte aérea e do sistema radicular.
O crescimento radicular é lento após o pastejo, mas crescente com o aumento das idades de avaliação. Resultados semelhantes foram encontrados por Donaghy & Fulkerson (1998), que constataram que plantas de azevém perene cessavam o crescimento radicular após desfolhação, refazendo nova área foliar (rebrotação) e retomando seu crescimento a seguir. Também Pagotto (2001), com capim-tanzânia irrigado, verificou que não houve crescimento radicular nos três primeiros dias pós-pastejo, tendo este sido mais intenso entre 12 e 30 dias pós-pastejo, nas condições de seu experimento (diferentes resíduos pós-pastejo e irrigação).
Um fator que teve grande influência no crescimento do sistema radicular foi a pluviosidade. No entanto, mais estudos devem ser realizados acerca da atividade de raízes para se conhecer o significado efetivo desse comportamento e quais as relações com a perenidade da planta forrageira no sistema de produção.
A adubação nitrogenada influenciou no crescimento de raízes nos períodos em que houve maior pluviosidade, de modo que a menor dose de N promoveu maior crescimento de raízes.
BALIGAR, V.C.; FAGERIA, N.K. ELRASHIDI, M.A. Toxitity and nutrient constraints on root growth. Hort Science, v.33, n.6, p.960-965, 1998.
BONO, J.A.; MACEDO, M.C.M.; EUCLIDES, V.B.P. Biomassa e área do sistema radicular e resistência do solo à penetração em pastagens de Panicum maximum Jacq. sob pastejo rotacionado. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 37., 2000, Viçosa, MG. Anais... Viçosa, MG: SBZ, 2000. CD-ROM. Forragicultura.
BOSEMARK, N.O. The influence of nitrogen on root development. Physiologia Plantarum, v.7, p.497-502, 1954.
BOUMA, T.J.; NIELSEN, K.L.; KOUTSTAAL, B. Sample preparation and scanning protocol for computerised analysis of root length and diameter. Plant and Soil, v.218, p.185-196, 2000.
BROUWER, R. Nutritive influences on the distribution of dry matter in the plant. Netherlands Journal of Agricultural Science, v.10, n.5, p.399-408, 1962.
CARVALHO, M.C.S. Práticas de recuperação de uma pastagem degradada e seus impactos em atributos físicos, químicos e microbiológicos do solo. Piracicaba: Escola Superior de Agricultura Luiz de Queiroz, 1999. 103p. Tese (Doutorado em Agronomia) - Escola Superior de Agricultura Luiz de Queiroz, 1999.
CARVALHO, D.D.; PAGANO, A.A.G.; FIGUEIRAS, J.F. et al. Cobertura de solo e tamanho de touceiras em pastagens de capins aruana e tanzânia. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 40., Santa Maria. Anais... Santa Maria: Sociedade Brasileira de Zootecnia, 2003. CD-ROM. Forragicultura.
CECATO, U.; HERLING, V.R.; BRAGA, L.M. et al. Carboidratos, nitrogênio total e peso de raízes em capim-tanzânia (Panicum maximum Jacq, cv. Tanzânia) adubado com diferentes doses de nitrogênio sob pastejo. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 40., Santa Maria. Anais... Santa Maria: Sociedade Brasileira de Zootecnia, 2003. CD-ROM. Forragicultura.
CORSI, M.; MARTHA JR., G.B.; PAGOTTO, D.S. Sistema radicular: dinâmica e resposta a regimes de desfolha. In: Mattos, W.R.S. (Ed.) A produção animal na visão dos brasileiros. Piracicaba: Sociedade Brasileira de Zootecnia, 2001. p.838-852.
DA COSTA, N.A.; CORSI, M.; DE FARIA, V.P. Efeito da altura e intervalo de cortes sobre a produção de massa seca aérea e peso da matéria orgânica do sistema radicular do capim-andropogon (Andropogon gayanus, Kunth). O Solo, v.75, n.2, p.5-10, 1983.
DEINUM, B. Root mass of swards in different grazing systems. Netherlands Journal of Agricultural Science, v.33, p.377-384, 1985.
DONAGHY, D.J.; FULKERSON, W.J. Priority for allocation of water soluble carbohydrate reserves during regrowth of Lollium perenne. Grass and Forage Science, v.53, p.211-218, 1998.
EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA - EMBRAPA. Sistema brasileiro de classificação de solos. Serviço Nacional de Levantamento e Conservação de Solos. Brasília: EMBRAPA, 1999, 412p.
GIACOMINI, A.A. Produção de forragem, massa e crescimento de raízes dos capins Aruana e Tanzânia submetidos a doses de nitrogênio, em lotação rotacionada com ovinos. Piracicaba: Escola Superior de Agricultura Luiz de Queiroz, 2003. 66p. Dissertação (Mestrado em Agronomia) - Escola Superior de Agricultura Luiz de Queiroz, 2003.
GREENWOOD, K.K.; HUTCHINSON, K.J. Root characteristics of temperate pasture in New South Wales after grazing at three stocking rates for 30 years. Grass and Forage Science, v.53, p.120-128, 1998.
HERLING, V.R.; RODRIGUES, L.R.A.; LUZ, P.H.C. Manejo do pastejo. In: SIMPÓSIO SOBRE MANEJO DA PASTAGEM: planejamento e sistemas de produção em pastagens. 18., Piracicaba. Anais... Piracicaba: Fundação de Estudos Agrários Luiz de Queiroz, 2001. p.157-192.
LEMAIRE, G. The physiology of grass growth under grazing: tissue turn-over. In: SIMPÓSIO INTERNACIONAL SOBRE PRODUÇÃO ANIMAL EM PASTEJO, 1997, Viçosa, MG. Anais... Viçosa, MG: Universidade Federal de Viçosa, 1997. p.117-144.
LUPINACCI, Reservas orgânicas, índice de área foliar e produção de forragem em Brachiaria brizantha cv. Marandu submetida a intensidades de pastejo por bovinos de corte. Piracicaba: Fundação de Estudos Agrários Luiz de Queiroz, 2002. 150p. Dissertação (Mestrado em Agronomia) - Escola Superior de Agricultura "Luiz de Queiroz", 2002.
MATTA, F.M. In: WORKSHOP SOBRE SISTEMA RADICULAR: metodologias e estudo de casos. Aracaju. Anais... Aracaju: EMBRAPA Tabuleiros Costeiros, 1999. 300p.
MATTHEW, C. A study of seasonal root and tiller dinamics in swards of perennial ryegrass (Lolium perenne, L). Palmerston North: Thesis (Ph.D.). Massey University, 1992.
PAGOTTO, D.S. Comportamento do sistema radicular do capim-tanzânia (Panicum maximum Jacq.) sob irrigação e submetido a diferentes intensidades de pastejo. Piracicaba: Fundação de Estudos Agrários Luiz de Queiroz, 2001. 51p. Dissertação (Mestrado em Agronomia) Escola Superior de Agricultura "Luiz de Queiroz", Universidade de São Paulo, 2001.
RICHARDS, J.H. Physiology of plant recovery from defoliation. In: BAKER, M.J. (Ed). Grassland for our world. Wellington: SIR Publishing, 1993. p.46-54.
SANTOS, L.E.; CUNHA, E.A.; BUENO, M.S. Altas lotações nas pastagens: uma técnica viável para ovinos. Nova Odessa, Instituto de Zootecnia, 2001. 45p.
SAS INSTITUTE Property software release 8. Cary, NC: SAS Institute Inc., 1999. 956p.
SCURLOCK, J.M.O.; HALL, D.O. The global carbon sink: a grassland perspective. Global Change Biology, v.4, p.229-233, 1998.
SHEARD, R.W. Organic reserves and plant regrowth. In: BUTLER, G.W.; BAILEY, R.W. (Eds.). Chemistry and biochemistry of herbage. London: Academic Press, 1973. p.353-377.
SINGH, K.A. Effect of age, cutting interval, nitrogen and farmyard manure on root growth parameters of forage grasses in na acid Inceptisol. Indian Journal of Agricultural Sciences, v.66, n.1, p.38-44, 1996.
SINGH, B.P. Soil environment and root growth: Introduction to the colloquium. Hort Science, v.33, n.6, p.946-947, 1998.
TOSI, P. Estabelecimento de parâmetros agronômicos para o manejo e eficiência de utilização de Panicum maximum Jacq. cv. Tanzânia-1 sob pastejo rotacionado. Piracicaba: Fundação de Estudos Agrários Luiz de Queiroz, 1999. 103p. Dissertação (Mestrado) - Escola Superior de Agricultura "Luiz de Queiroz", Universidade de São Paulo, 1999.
VOGT, K.A.; BLOOMFIELD, J. Tree root turnover and senescence. In: WAISEL, Y.; ESHEL, A.; KAFKAFI, U. (Eds.) Plant roots: the hidden half. New York: Marcel Dekker, 1991. p.287-308.
VOLENCEC, J.J.; OURRY, A.; JOERN, B.C. A role for nitrogen reserves in forage regrowth and stress tolerance. Physiologia Plantarum, v.97, p.5-193, 1996.
VOORHEES, W.B.; CARLSON, V.A.; HALLAUER, E.A. Root lenght measurement with a computer-controlled digital scanning microdensitometer. Agronomy Journal, v.72, p.847-850, 1980.
WERNER, J.C.; COLOZZA, M.T.; MONTEIRO, F.A. Adubação de Pastagens. In: SIMPÓSIO SOBRE MANEJO DA PASTAGEM – Planejamento de Sistemas de Produção em Pastagens, 18., 2001, Piracicaba. Anais... Piracicaba: Fundação de Estudos Agrários Luiz de Queiroz, 2001. p.129-156.
1. Parte da dissertação da primeira autora. Projeto financiado pela FAPESP.
Alessandra Aparecida GiacominiI; Waldssimiler Teixeira de MattosII; Herbert Barbosa de MattosIII; Joaquim Carlos WernerIII; Eduardo Antonio da CunhaIII; Dora Duarte de CarvalhoIII
cunha[arroba]iz.sp.gov.br
IEstudante do curso de Doutorado em Ciência Animal e Pastagens, ESALQ-USP. E.mail: alegiacomini[arroba]hotmail.com
IIPesquisador do Instituto de Zootecnia, Nova Odessa/SP e ex-bolsista de pós-doutorado da FAPESP
IIIPesquisador Aposentado do Instituto de Zootecnia, Nova Odessa/SP, CP 60, CEP: 13460-000
IVPesquisador do Instituto de Zootecnia, Nova Odessa/SP, CP 60, CEP: 13460-000
A publicação dos textos técnicos disponíveis na WEB de autoria dos pesquisadores da área de ovinocultura, Drs. Luiz Eduardo dos Santos, Eduardo Antonio da Cunha e Mauro Sartori Bueno, está liberada desde que na forma integra, sem alterações e tendo claramente citados os autores e a instituição (Instituto de Zootecnia - Nova Odessa (SP) / APTA / SAA.)
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|