 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Esta afecção, descrita por Gaucher (1882) como epitelioma primitivo do baço, consiste em uma desordem metabólica familiar, com característica autossômica dominante. Ela é uma dislipidemia dos esfingolípides provocada por atividade defeituosa da enzima ácido b-glicosidase e tem como conseqüência o acúmulo de seu substrato, o glicocerebrosídeo ceramida glicosil, nos lisossomas das células do sistema mononuclear fagocitário, transformando-as nas células de Gaucher. Em decorrência dessa infiltração gordurosa, o fígado e, principalmente, o baço, que é o principal órgão armazenador de esfingolípides, têm as suas dimensões aumentadas, podendo o baço elevar o diafragma e estender-se até a pelve direita.1
Para aliviar o desconforto abdominal, os sintomas respiratórios e a dificuldade para deambulação provocada pelo tamanho do baço, bem como os distúrbios hematológicos com quadro de hiperesplenismo, tem sido proposta a esplenectomia total. Entretanto, os resultados da asplenia podem ser piores do que os da própria doença.1 A remoção do baço acompanha-se de elevada incidência de sepse, por vezes até com evolução para morte, e agravamento da infiltração gordurosa no fígado e na medula óssea, com conseqüente insuficiência hepática e fraturas ósseas. Outros distúrbios metabólicos e cardiovasculares, como o tromboembolismo, também são mais freqüentes após a retirada total do baço.
Para prevenir os efeitos colaterais da esplenectomia total, desde 1980 tem sido realizada a esplenectomia parcial.2 Após os primeiros bons resultados com esse procedimento, verificou-se que o remanescente esplênico, suprido pelo pedículo vascular do baço, aumentava as suas dimensões até níveis próximos aos alcançados previamente pelo baço íntegro. Além do desconforto provocado pela esplenomegalia, registrava-se também a recorrência das alterações hematológicas, principalmente a pancitopenia, por aumento do armazenamento sangüíneo no baço. Os esfingolípides continuavam a acumular-se no remanescente esplênico e, em médio prazo, perdiam-se todas as vantagens obtidas com a esplenectomia parcial.1,3-5
Com o objetivo de evitar esse inconveniente, realizamos, desde 1990, a esplenectomia subtotal, em que preservamos o pólo superior suprido apenas pelos vasos esplenogástricos, em cinco pacientes com doença de Gaucher. Essa operação foi desenvolvida por nós a partir de 1979, para aplicação no tratamento cirúrgico da hipertensão porta esquistossomática, afecção que indicou tal procedimento em 109 pacientes.6-11 Nessa época, havíamos verificado experimentalmente e em estudos de anatomia que o pólo superior do baço não depende do pedículo esplênico, pois os vasos que percorrem o ligamento esplenogástrico não são ramos ou afluentes desse pedículo e são suficientes para manter essa parte do órgão.10,12-14 Assim sendo, pode ser realizada a esplenectomia subtotal, como cirurgia conservadora do baço, mesmo nos casos em que os vasos principais precisam ser ligados. Por outro lado, constatamos que os vasos esplenogástricos são insuficientes para manter uma extensão de tecido esplênico maior que a do pólo superior. Portanto, as dimensões do remanescente esplênico são mantidas, prevenindo o seu crescimento, que é um dos inconvenientes da esplenectomia parcial na doença de Gaucher, quando se preserva o pedículo esplênico.9
Posteriormente, utilizamos essa alternativa operatória para conservar parte do baço em 52 pacientes com trauma esplênico grave, sete pacientes com esplenomegalia mielóide conseqüente a mielofibrose, quatro adolescentes com hipodesenvolvimento somático e sexual decorrente de esplenomegalia, um paciente com leucemia linfocítica crônica e uma paciente com cistoadenoma de cauda pancreática, em que se indicou a retirada corpocaudal do pâncreas.14-19 O acompanhamento por até mais de 18 anos tem revelado resultados gratificantes, fato que nos estimula a prosseguir na indicação desse procedimento em outras doenças nas quais haja a necessidade de operar o baço, com a possibilidade de manter parte do tecido esplênico.11,20 Assim como tem sido relatado na literatura em relação à esplenectomia parcial, na esplenectomia subtotal também constatamos que são preservadas todas as funções do baço.21-27
Nos casos em que não foi possível realizar a esplenectomia subtotal, conservamos parte do baço sob a forma de auto-implantes esplênicos. Estudos hematológicos e imunológicos em doentes submetidos a esplenectomia total complementada por auto-implantes esplênicos, para tratar hipertensão porta em 36 pacientes, trauma esplênico em 34 doentes, esplenomegalia mielóide em um paciente e leucemia linfocítica crônica em um, foram realizados. Os resultados tardios mostraram a preservação das funções esplênicas pelos fragmentos de baço auto-implantados.28 Os valores hematológicos e imunológicos permaneceram normais e a depuração sangüínea de corpúsculos de Howell-Jolly, bem como de substâncias coloidais, foi satisfatória.18,19,27 Em estudo experimental, observamos que os auto-implantes também são capazes de remover substâncias coloidais e bactérias injetadas na circulação sangüínea.21-25,29-31
O implante autógeno heterotópico de tecido esplênico após esplenectomia total tem sido utilizado na tentativa de evitar os efeitos adversos da asplenia. Estudos recentes mostraram que os auto-implantes são eficazes em manter pelo menos parte das funções do baço.32-47
O presente trabalho apresenta nossa experiência com a conservação esplênica parcial, por meio de esplenectomia subtotal ou auto-implantes esplênicos, em pacientes com doença de Gaucher, em que foi indicada operação esplenorredutora.
Seis pacientes portadores de doença de Gaucher no Hospital das Clínicas da UFMG, na Primeira Clínica Cirúrgica da Santa Casa de Belo Horizonte e no Hospital Universitário da Faculdade de Medicina da Universidade Federal de Juiz de Fora, Minas Gerais, foram submetidos a intervenção cirúrgica. Todos vinham sendo acompanhados pelos serviços de Hematologia dos hospitais citados e a indicação cirúrgica foi determinada pelo desconforto provocado pela esplenomegalia e pela pancitopenia. Ao exame físico, também verificou-se a presença de hepatomegalia de dimensões variáveis em todos os doentes.
Os pacientes foram cinco mulheres e um homem, com as idades de 18, 23, 24, 56, 61 e 62 anos respectivamente. Quanto à coloração da pele, um era leucodérmico, duas feodérmicas e três melanodérmicas. Duas das pacientes, uma de 56 e outra de 61 anos, ambas feodérmicas, eram irmãs. Duas outras doentes melanodérmicas, uma de 18 e a outra de 23 anos, relataram que a mãe de uma e a irmã da outra haviam sido submetidas a esplenectomia por causa dessa mesma doença. Os seis doentes apresentavam pancitopenia variável e receberam múltiplas transfusões sangüíneas em diversas ocasiões. Os múltiplos exames hematológicos pré e pós-transfusionais dificultam a apresentação dos valores hematológicos próprios de cada um dos doentes. Os baços de quatro pacientes atingiam a fossa ilíaca direita e os dos outros dois doentes chegavam até a fossa ilíaca esquerda, portanto, todos classificados como grupo IV de Boyd.
As cirurgias foram realizadas através de laparotomia oblíqua esquerda, desde o nono espaço intercostal até dois dedos acima da cicatriz umbilical. Após a ligadura da artéria esplênica, no espaço retrogástrico, o baço foi completamente mobilizado para fora da cavidade abdominal, seccionando-se os ligamentos frenocólico, esplenorrenal e esplenofrênico (Figura 1a). Manteve-se intacto o ligamento esplenogástrico, tendo-se o cuidado de preservar todos os vasos esplenogástricos. Em seguida, foram ligados e seccionados os vasos do pedículo esplênico e do pólo inferior do baço.
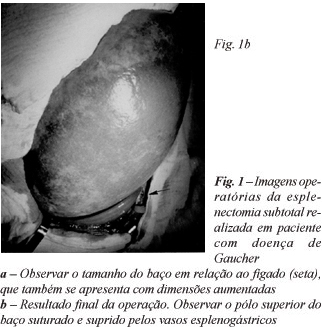
O órgão foi seccionado em cunha ao nível da transição entre o pólo superior, que permanecia com a cor rósea, e o restante do baço, que se tornara azulado após sua desvascularização. Realizou-se hemostasia cuidadosa, suturando-se os vasos do parênquima aberto, com fio de categute simples 3-0. Em seguida, as duas abas de cápsula, formadas pela secção em cunha do órgão, foram aproximadas por sutura contínua, com fio de categute cromado 2-0 (Figura 1b). O baço foi recolocado em seu leito e fixado ao peritônio diafragmático com um ponto, para prevenir a sua ptose ou torção. Em uma das pacientes melanodérmicas, com a idade de 24 anos, confirmou-se, ao inventário da cavidade abdominal, a presença de colecistolitíase já diagnosticada ao ultra-som pré-operatório. No mesmo ato cirúrgico e através da mesma incisão, realizou-se a colecistectomia. Depois de uma cuidadosa revisão da hemostasia abdominal, a cavidade foi fechada por planos, sem deixar dreno em doente algum. Em nenhuma das operações foi necessária transfusão de elementos sangüíneos e os pacientes mantiveram-se completamente estáveis durante todo o procedimento cirúrgico.
Em uma das pacientes, melanodérmica e com 23 anos de idade, percebeu-se, após a secção do baço, que o parênquima esplênico não apresentava sangramento profuso, habitual nessa fase operatória. Com receio de que os vasos esplenogástricos, nesse caso, fossem insuficientes para suprir o pólo superior esplênico, optamos pela retirada completa do baço. Nessa situação, restou como alternativa a confecção dos auto-implantes esplênicos.
Seccionou-se uma fatia esplênica, que media entre um e dois centímetros de espessura. Esse segmento foi dividido em vinte cubos, com dimensões também de um a dois centímetros. Por meio de sutura contínua, com fio de "catgut" simples 3-0, os fragmentos esplênicos foram fixados sobre o omento maior, alternando-se os pontos entre baço e omento. Como último tempo operatório, o omento maior foi dobrado sobre si, para manter os fragmentos esplênicos em seu interior e prevenir aderências anômalas a tecidos vizinhos. O total de tecido esplênico implantado foi superior a 50 gramas, peso esse estimado de acordo com estudo prévio que fizemos e por dados de literatura.28,44,48 A operação terminou com revisão da hemostasia e fechamento da cavidade abdominal, sem deixar dreno.
Não houve complicações pós-operatórias imediatas e os pacientes receberam alta hospitalar entre o terceiro e o sétimo dias depois da cirurgia. A evolução tardia dos seis doentes em acompanhamento variável entre quatro meses e 12 anos tem sido sem anormalidades relacionadas à conservação do baço. Houve melhora dos valores hematológicos em todos os pacientes, que continuam em tratamento hematológico. A grande variação de valores hematológicos e de tratamentos clínicos pós-operatórios nesses doentes durante todo o tempo de acompanhamento não permite a sua tabulação. Não foram registradas complicações hepáticas ou ósseas. Todos os pacientes retornaram às suas atividades sociais e de trabalho. A paciente submetida a esplenectomia total e auto-implantes esplênicos casou-se dois anos após a operação e atualmente é mãe de uma menina que tem 5 anos e é aparentemente saudável.
Os exames histopatológicos dos baços e das biópsias hepáticas confirmaram a doença de Gaucher. As funções dos remanescentes da esplenectomia subtotal e dos auto-implantes esplênicos foram confirmadas pela ausência de corpúsculos eritrocitários anômalos na circulação e pelos exames cintilográficos com enxofre coloidal marcado com 99m-tecnécio, que mostraram a captação esplênica do colóide. Os exames ultra-sonográfico e de tomografia computadorizada confirmaram a manutenção das dimensões esplênicas nos limites deixados durante a cirurgia. Portanto, não houve crescimento dos remanescentes tanto da esplenectomia subtotal quanto dos auto-implantes.
Sob o aspecto cirúrgico, os procedimentos conservadores do baço são simples e não requerem equipamento ou materiais cirúrgicos especiais que não estejam à disposição em todas as cirurgias de porte maior. Os remanescentes de baço não cresceram porque os vasos esplenogástricos e os formados no omento maior são insuficientes para manter uma quantidade de tecido esplênico maior que a do pólo superior ou dos implantes, assim como já havia sido descrito previamente.25,28-30
Com respeito aos auto-implantes, é preferível que eles sejam de tamanho inferior a 2 cm, para que a vasculogênese seja mais rápida e permita que esse tecido fun-cione em um tempo menor.48 Em trabalho experimental, constatamos que os auto-implantes atingem a normalidade funcional em até três meses.25 Entretanto, cabe ressaltar a necessidade de pelo menos 25% do tecido esplênico normal, portanto mais de 40 gramas, para que não haja insuficiência esplênica.28,44,48 Por esse motivo foram implantados vinte fragmentos de baço, que perfazem um peso superior a 50 gramas.
Na presente casuística, a esplenectomia total foi incidentalmente necessária em apenas uma paciente, devido ao aspecto isquêmico do parênquima do pólo superior, quando suprido apenas pelos vasos esplenogástricos. De fato, estudos prévios conduzidos por nós mostraram que o número de vasos esplenogástricos variam entre nenhum e 14 arteríolas e vênulas.10 No caso relatado, foram vistos somente dois vasos esplenogástricos, que nessa doente foram insuficientes para preservar a vitalidade do remanescente esplênico. Tal situação não pode ser prevista antes da operação, pois ainda não há método complementar sensível o suficiente para avaliar a perfusão sangüínea através dos vasos esplenogástricos.
Outro aspecto importante é o local onde os auto-implantes foram fixados. Para que o baço funcione adequadamente, a drenagem de seu sangue deve seguir para o fígado através da veia porta. Dessa forma, fragmentos de baço implantados no peritônio, em músculos, no subcutâneo ou em outros tecidos, apesar de manterem sua vitalidade, apresentam insuficiência funcional. Os melhores tecidos para o auto-implante são o omento maior, o mesocólon transverso e o mesentério, cujas drenagens venosas pertencem ao sistema porta, por meio dos vasos mesentéricos ou gastro-omentais. Por esse motivo, o tecido esplênico foi fixado ao omento maior. 28,29,32,44,48-55
O prognóstico pós-operatório de pacientes com doença de Gaucher submetidos a esplenectomia total é desfavorável. O depósito acelerado de glicocerebrosídeos no fígado e ossos resulta em hepatomegalia acompanhada de insuficiência hepática e em dores ósseas, com fraturas freqüentes.1,4,44 Sepse, eventualmente fatal, é outra complicação decorrente do estado asplênico dos pacientes.56-58 Entretanto, no período em que acompanhamos os nossos pacientes submetidos a cirurgias conservadoras do baço, nenhuma dessas complicações foi registrada.
O implante de tecido esplênico autógeno ainda não é definitivamente aceito como eficaz para manter as funções do baço após esplenectomia total. Estudos prévios mostraram que, apesar desse procedimento ser quase isento de complicações pós-operatórias, o pequeno número de implantes realizados pela maioria dos cirurgiões era insuficiente para evidenciar a sua função.32,35,37,42,51,59 Por outro lado, trabalhos experimentais foram unânimes em encontrar menor incidência e intensidade de sepse em animais submetidos ao auto-implante, quando comparados com os asplênicos.34,38,40,41,44,45
Atualmente, acredita-se que os resultados não favoráveis descritos na literatura decorrem principalmente da quantidade insuficiente de tecido esplênico implantado e que, apesar de sua função estar presente, ela não pode ser detectada.48,50,53
De qualquer modo, os auto-implantes, mesmo quando a quantidade de tecido é maior, apresentam eficácia funcional menor do que a evidenciada pelos remanescentes das esplenectomias parciais e subtotais.25,37,41,46 Aparentemente, a vascularização natural pelo pedículo ou pelos vasos esplenogástricos é melhor do que a que se forma nos locais dos implantes. Esses resultados são confirmados por pesquisas experimentais e por estudos cintilográficos pós-operatórios, que revelam a precocidade e maior eficácia funcional dos remanescentes esplênicos em relação aos auto-implantes.9,20,49 Portanto, é pertinente afirmar que os auto-implantes devem ser a opção operatória apenas nos casos em que não for possível preservar parte do baço ortotópico com sua vascularização natural.
Em conclusão, a esplenectomia subtotal, com preservação do pólo superior do baço suprido apenas pelos vasos esplenogástricos, e os auto-implantes esplênicos em omento maior parecem boas alternativas cirúrgicas para tratamento da doença de Gaucher, quando não for obtido um bom controle clínico dessa moléstia. Os benefícios desses procedimentos foram evidentes nos casos apresentados neste trabalho, contudo essa casuística ainda é muito pequena para estabelecer uma conduta. Pesquisas futuras, por um tempo mais prolongado e com um número maior de doentes, irão trazer subsídios melhores para o esclarecimento do papel das operações conservadoras do baço para tratar a doença de Gaucher.
1. Fleshner PR, Aufses AHJr, Grabowski GA. A 27-year experience with splenectomy for Gaucher's disease. Am J Surg 1991;161: 69-75.
[ Medline ]
2. Govrin-Yehudain J, Bar-Maor JA. Partial splenectomy in Gaucher's disease. Israel J Med Sci 1980;16:665-8.
3. Campos Christo MB. Partial splenectomies in hematologic diseases. Chir Gastroenterol 1993;9 (suppl 2):23-9.
4. Cohen IJ, Katz K, Freud E. Long-term follow-up of partial splenectomy in Gaucher's disease. Am J Surg 1992;164:345-7.
[ Medline ]
5. Svarch EG, Nordet I, Chesney A. La esplenectomia parcial en la hemoglobinopatia S. Rev Cuba Hematol Inmunol Hemoter 1989;5:555-63.
6. Petroianu A. Esplenectomia subtotal e anastomose esplenorrenal proximal para o tratamento da hipertensão portal. Rev Bras Cir 1983;73:101-4.
[ Lilacs ]
7. Petroianu A. Treatment of portal hypertension by subtotal splenectomy and central splenorenal shunt. Postgrad Med J 1988;64:38-41.
[ Medline ]
8. Petroianu A. Subtotal splenectomy and portal-variceal disconnection in the treatment of portal hypertension. Can J Surg 1993;36:251-4.
[ Medline ]
9. Petroianu A. Avaliação imaginológica da esplenectomia subtotal e anastomose esplenorrenal centralizada para o tratamento da hipertensão portal esquistossomática. Rev Med Minas Gerais 1993;3:106-8.
10. Petroianu A, Petroianu S. Anatomy of splenogastric vessels in patients with schistosomal portal hypertension. Clin Anat 1994;7:80-3.
11. Petroianu A, Petroianu, LPG. A twelve-year-follow-up of subtotal splenctomy and central splenorenal shunt for treatment of schistosomatic portal hypertension. Folha Med 1998;116:107-9.
12. Petroianu A, Ferreira VLM, Barbosa AJA. Morphology and viability of the spleen after subtotal splenectomy. Braz J Med Biol Res 1989;22:491-5.
[ Medline ] [ Lilacs ]
13. Petroianu A. Splenic viability after segmental devascularization. Rev Paul Med 1992;10:9-41.
14. Petroianu A. Esplenectomia subtotal preservando o pólo superior suprido pelos vasos esplenogástricos. Rev Col Bras Cir 1994;21:21-6.
[ Lilacs ]
15. Petroianu A. Treatment of cystadenoma of the pancreatic tail by distal pancreatectomy and subtotal splenectomy. Dig Surg 1995;12:259-61.
16. Petroianu A. Subtotal splenectomy for treatment of patients with myelofibrosis and myeloid metaplasia. Int Surg 1996;81: 177-9.
[ Medline ]
17. Petroianu A. Subtotal splenectomy for the treatment of retarded growth and sexual development associated with splenomegaly. Minerva Chir 2002; 57 no prelo.
18. Resende V, Petroianu A. Estudo funcional tardio do auto-implante esplênico após trauma complexo do baço humano. Rev Col Bras Cir 2001;28:165-70.
19. Resende V, Petroianu A. Funções do remanescente esplênico após esplenectomia subtotal para o tratamento de lesões complexas do baço humano. Rev Assoc Med. Bras 2002;48:26-31.
20. Petroianu A, Silva RG, Simal CJR. Late postoperative follow-up of patients submitted to subtotal splenectomy. Am Surg 1997;63:735-40.
[ Medline ]
21. Petroianu A, Barbosa AJA. Quantitative studies on the macrophage phagocytosis in whole spleen and in remnant of subtotal splenectomy. Med Sci Res 1991;19:373-5.
22. Petroianu A, Simal CJR, Barbosa AJA. Splenic macrophage phagocytic function after subtotal splenectomy in dog. Med Sci Res 1992;20:127-8.
23. Petroianu A, Simal CJR, Barbosa AJA. Impairment of phagocytosis by mammalian splenic macrophages by 99mTc sulphur colloid. Med Sci Res 1992;20:847-9.
24. Petroianu A, Simal, CJR. Shifts of the reticuloendothelial system uptake pattern induced by carbon colloid. Med Sci Res 1993; 311-2.
25. Petroianu A, Simal CJR, Barbosa AJA. Assessment of phagocytic function in remnants of subtotal splenectomy and in autologous spleen implantation. Med Sci Res 1993;21:175-7.
26. Petroianu A, Barbosa AJA. Splenic preservation based on preserved histology and phagocytic function using upper short gastric vessels. Am J Surg 1995;170:702.
27. Petroianu A, Antunes LJ. Immune profiles in hepatosplenic schistosomiasis mansoni after surgical treatments. J Int Med Res 1998;26:43-9.
[ Medline ]
28. Petroianu A, Petroianu LPG. Splenic autotransplantation combined with splenectomy and portal-variceal disconnection in the treatment of portal hypertension. World J Surg 2003; no prelo.
29. Marques RG, Petroianu A. Auto-implante esplênico. Ars Curandi 2002;35:10-18.
30. Marques RG, Petroianu A, Oliveira MBN, Filho MB, Boasquevisque EM, Portela MC. Bacterial clearance after total splenectomy and splenic autotransplantation in rat. Apllied Radiation and Isotopes 2002;57:767-71.
31. Silva RG, Petroianu A. Influência das operações sobre o baço na distribuição da Escherichia coli no sistema mononuclear fagocitário. Rev Col Bras Cir 2002; no prelo.
32. Alvarez FE, Greco RS. Regeneration of the spleen after ectopic implantation and partial splenectomy. Arch Surg 1980;115: 772-5.
[ Medline ]
33. Alvarez SR, Escalante CF, Rituerto DC. Assessment of postsplenectomy residual splenic function. Int Surg 1987;72: 149-53.
34. Clayer MTR, Drew P, Leong A. IgG-mediated phagocytosis in regenerated splenic tissue. Clin Exp Immunol 1994;97:242-7.
[ Medline ]
35. Cooney DR, Dearth JC, Swanson SE. Relative merits of partial splenectomy, splenic reimplantation and immunization in preventing postsplenectomy infection. Surgery 1979;87: 561-9.
36. Drew PA, Kiroff GK, Ferrante A. Alterations in immunoglobulin synthesis by peripheral blood mononuclear cells from splenectomizides patients with and without splenic regrowth. J Immunol 1984;132:191-6.
[ Medline ]
37. Drew PA, Clayers MTR, Jamieson GG. The value of splenic autotransplantation. Arch Surg 1990;125:1.224.
38. Haklar G, Demirel M, Peker O. The functional assessment of autotransplanted splenic tissue by its capacity to remove oxidatively modified erythrocytes. Clin Chim Acta 1997; 258: 201-8.
[ Medline ]
39. Hathaway JM, Harley RA, Self S. Immunological function in post-traumatic splenosis. Clin Immunol Immunopathol 1995; 74:143-50.
[ Medline ]
40. Leemans R, Beekhuis H, Timens W. Fc-receptor function after human splenic autotransplantation. Br J Surg 1996;83:543-6.
[ Medline ]
41. Leemans R, Harms G, Rijkers GT. Spleen autotransplantation provides restoration of functional splenic lymphoid compartments and improves the humoral immune response to pneumococcal polysaccharide vaccine. Clin Exp Immunol 1999;117:596-604.
[ Medline ]
42. Leemans R, Manson W, Snijder JAM. Immune response capacity after human splenic autotransplantation. Ann Surg 1999;229: 279-85.
[ Medline ]
43. Malangoni MA, Dawes LG, Droege EA. Splenic phagocytic function after partial splenectomy and splenic autotransplantation. Arch Surg 1985;120:275-8.
[ Medline ]
44. Miyano T, Yamataka A, Ohshiro K. Heterotopic splenic autotransplantation for splenomegaly secondary to Gaucher's disease. J Pediat Surg 1994;29:1.572-4.
45. Timens W, Leemans R. Splenic autotransplantation and the immune system. Ann Surg 1992;215:256-60.
[ Medline ]
46. Traub A, Giebink GS, Smith C. Splenic reticuloendothelial function after splenectomy, spleen repair and spleen autotransplantation. New Eng J Med 1987;317:1.559-64.
47. Yiong G, Han G, Xian-Tao K. Immunoglobulins and complement in splenectomized and autotransplanted subjects. Ann Med 1989;21:265-7
48. Iinuma H, Okinaga K, Sato S. Optimal site and amount of splenic tissue for autotransplantation. J Surg Res 1992;53:109-16.
[ Medline ]
49. Clayer MTR, Drew P, Leong A. The vascular supply of splenic autotransplants. J Surg Res 1992;53:475-84.
[ Medline ]
50. Livingston CD, Levine BA, Sirinek, KR. Preservation of splenic tissue prevents postsplenectomy pulmonary sepsis following bacterial challenge. J Surg Res 1982;33:356-61.
[ Medline ]
51. Pabst R, Westerman J. Regeneration of the spleen and splenic autotransplantation. Br J Surg 1992;79:91.
52. Patel JM, Williams JS, Naim JO. The effect of site and technique of splenic tissue reimplantation on pneumococcal clearance from the blood. J Pediatr Surg 1986;21:877-80.
[ Medline ]
53. Weber T, Hanisch E, Baum. Late results of heterotopic autotransplantation of splenic tissue into the greater omentum. World J Surg 1998;22:883-9.
[ Medline ]
54. Witte CL, Witte MH. Enlargement of splenic implants. Surgery 1995;117:357.
55. Zoli G, Corazza GR, D'Amato G. Splenic autotransplantation after splenectomy. Br J Surg 1994;81:716-8.
[ Medline ]
56. Livingston CD, Levine BA, Sirinek, KR. Site of splenic autotransplantation affects protection from sepsis. Am J Surg 1983; 146:734-7.
[ Medline ]
57. Llende M, Deplín AS, Lavergne J. Immunobiological consequences of splenectomy. J Surg Res 1986;40:85-94.
[ Medline ]
58. Pimpl W, Dapunt O, Kaindl H. Incidence of septic and thromboembolic-related deaths after splenectomy in adults. Br J Surg 1989; 76:517-21.
[ Medline ]
59. Ando K, Miyano T, Yamataka A. Torsion of autotransplanted splenic tissue in Gaucher's disease. J Pediat Surg 1997;32:747-9.
Andy Petroianu
petroian[arroba]medicina.ufmg.br
Professor titular do Depto. de Cirurgia da Faculdade de Medicina, UFMG;
Docente-livre em Técnica Operatória e Cirurgia Experimental da Escola Paulista de Medicina, Unifesp;
Docente-livre em Gastroenterologia Cirúrgica da Faculdade de Medicina de Ribeirão Preto, USP;
Doutor em Fisiologia e Farmacologia - Instituto de Ciências Biológicas, UFMG, Pesquisador IA do CNPq
Instituto Alfa de Gastroenterologia do Hospital das Clínicas da Universidade Federal de Minas.
![]() Endereço para correspondência
Endereço para correspondência
Andy Petroianu
Avenida Afonso Pena, 1.626 - apto. 1.901
30130-005 – Belo Horizonte-MG
Tel./Fax.: (31) 3274-7744 ou 3224-4275 - e-mail: petroian[arroba]medicina.ufmg.br
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|