 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Efluente
Foi utilizado efluente líquido equalizado contendo corante índigo, coletado na caixa de entrada anterior à lagoa de lodo ativado, da estação de tratamento de efluente de uma indústria têxtil da cidade de Americana-SP.
Fungos
Foram empregados os fungos basidiomicetos comestíveis Pleurotus sajor-caju (CCB 020) (F2), doado pelo Instituto de Botânica de São Paulo e Pleurotus sajor-caju (PSC 94/03) (F6), doado pela Faculdade de Ciências Agronômicas da Universidade Estadual Paulista – Campus de Botucatu, SP.
Condições de cultivo
Os fungos foram cultivados durante 8 dias em placas de Petri contendo MEA (malte, extrato de levedura, ágar). Três discos com 0,5 cm de diâmetro foram retirados das bordas das colônias e adicionados em cada frasco Erlenmeyer contendo 5 g de bagaço de cana (desidratado e esterilizado através de radiação gama) e 30 mL de efluente líquido. Os frascos (em triplicata) foram incubados no escuro, à temperatura de 28 °C ± 2 por 14 dias.
Atividade enzimática
No intervalo de 3 dias até o período final de incubação, 30 mL de água destilada foram adicionados aos frascos e o material homogeneizado, sendo posteriormente filtrado em papel de filtro (Whatman n.1); em seguida este foi centrifugado a 5000 rpm por 10 min sendo o sobrenadante utilizado para as determinações enzimáticas.
As atividades enzimáticas de lacase12, manganês peroxidase13 e peroxidase12 foram determinadas, sendo as reações realizadas em triplicata e as leituras de absorbância efetuadas com auxílio de espectrofotômetro.
Descoloração
No período final de incubação, o material que ficou retido no papel de filtro, como descrito no item anterior, foi utilizado para avaliação da descoloração por reflectância (medida de cor de objeto opaco) e o procedimento consistiu no uso de um espectrofotômetro (Minolta Chroma Meter CR-200), o qual emite um feixe de luz sobre o material e, em seguida, captura a luz refletida, fornecendo três variáveis representadas pelas letras "L" (cor variando de preto a branco), "a" (de verde a vermelho) e "b" (de azul a amarelo), em uma escala compreendida entre 0 e 100 para a variável "L" e -60 a +60, para as demais variáveis.
Análise estatística
Para análise dos resultados, foi adotado o software "R: A Programming Environment for Data Analysis and Graphics", versão 1.7.1, 2003. Os resultados de reflectância (variáveis L, a e b) dos experimentos de descoloração (dispostos em delineamento inteiramente casualizado) foram submetidos à transformação Box-Cox, quando necessário, e à análise de variância (ANOVA) e teste de comparação múltipla de médias de Tukey (pacote multcomp) a 5% de significância. Foram aplicados os testes de Bartlett para análise de homogeneidade de variância e de Shapiro-Wilk para normalidade dos resíduos. Os experimentos de avaliação de atividade enzimática seguiram um delineamento inteiramente casualizado e foram analisados em um esquema fatorial (dias x tratamentos). Os resultados, transformados por Box-Cox, quando necessário, foram submetidos à análise de variância (ANOVA) e avaliação de normalidade dos resíduos pelo teste de Shapiro-Wilk. Para comparação múltipla de médias adotou-se o teste de Tukey (função TukeyHSD, pacote base) a nível de 5% de probabilidade.
A descoloração total do efluente foi observada aproximadamente aos 14 dias de incubação, através de análise visual dos frascos contendo os fungos (Figura 1), sendo que, após a homogeneização do material com a água, observou-se que o bagaço contendo o efluente sem o tratamento pelos fungos apresentou coloração esverdeada devido ao fato do corante ser azul e misturado com o bagaço que possui coloração amarelada, enquanto que o material tratado pelos fungos apresentou coloração alaranjada, devido à biodegradação do corante presente no efluente (Figura 2). De acordo com a Tabela 1, é possível verificar diferenças nas variáveis "a" e "b" do material tratado com os fungos em relação ao controle, confirmando o fato de que a coloração dos tratamentos diferiu ao final do tempo de incubação, sendo que os tratamentos pelas duas linhagens não diferiram entre si.

Balan e Monteiro10 estudaram a descoloração do corante índigo em meio de cultura líquido por quatro espécies de fungos basidiomicetos e verificaram que Pleurotus descoloriu 94% após 4 dias de incubação. Ranzani11 selecionou duas espécies de P. sajor-caju para degradar lodo têxtil misturado com fonte de lignina e verificou que após 30 dias de incubação, os fungos descoloriram totalmente o material, reduzindo o valor de vários parâmetros, como Demanda Química de Oxigênio (DQO), fenóis e celulose (fibra detergente neutro (FDN) e fibra detergente ácido (FDA).
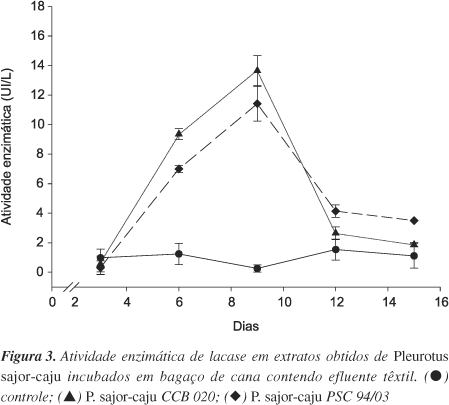
Em relação à atividade da enzima lacase, pode-se observar o pico de produção aos 9 dias de incubação pelas duas linhagens de fungos na presença do efluente têxtil (Figura 3). Segundo Kerem et al.14, a lacase tanto pode atuar na destoxificação de compostos do substrato como oxidar grupos fenólicos, agindo como enzima inicial na clivagem de cadeias laterais e anéis aromáticos das porções fenólicas da lignina. Outras enzimas de natureza oxidativa, como as álcool veratril oxidases, podem ter um papel importante na degradação da lignina, catalizando a reação do álcool veratril a peróxido de hidrogênio, necessário para atividade de peroxidases15-16. De acordo com Kumaran et al.17, lacase e manganês peroxidase devem agir em sinergismo. Estudos na descoloração de corantes industriais, inclusive o índigo, enfatizam o papel dessas enzimas produzidas por espécies de Pleurotus18,19 na descoloração.
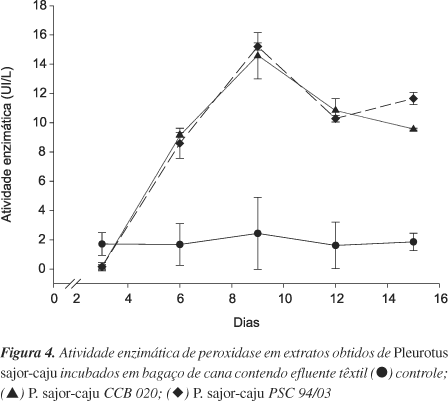
A atividade de peroxidase e a máxima produção também foram detectadas após 9 dias de incubação, comportando-se de forma similar à lacase, em ambas as linhagens testadas (Figura 4). Esta enzima também foi implicada na descoloração in vitro do corante RBBR20,21. Resultados semelhantes foram obtidos com P. ostreatus cultivado em bagaço de torta, na produção de óleo de algodão. A produção de lacase e peroxidase ocorreu durante a fase exponencial do fungo, subseqüentemente à ação das enzimas celulolíticas22.
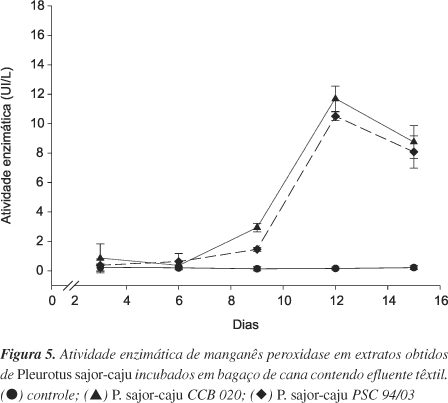
A máxima produção de MnP foi verificada no décimo segundo dia de incubação, não havendo diferença entre as duas linhagens (Figura 5). Na degradação do pireno, em substrato lignocelulósico, a produção de MnP foi maior entre 20 e 40 dias de incubação, quando a atividade da lacase já havia declinado e foi nesse período que se verificaram as maiores taxas de mineralização desse hidrocarboneto aromático policíclico (HPA)23. A correlação entre a degradação de HPAs e o corante "poly R - 478" já havia sido descrita e todos os fungos estudados secretaram as enzimas necessárias para a atividade peroxidativa implicada no processo de degradação/descoloração. A MnP apresentou uma correlação direta e houve a necessidade das oxidases produtoras de peróxido de hidrogênio e peroxidases24.
De acordo com os resultados obtidos, verifica-se que existe a produção de enzimas ligninolíticas quando os fungos foram incubados em bagaço de cana contendo efluente têxtil, fato que leva a supor que estas estão envolvidas no processo de descoloração e que têm influência neste processo, pois apresentam atividade em todo o período de incubação estudado.
Os dados apresentados neste trabalho indicam que as duas linhagens de Pleurotus sajor-caju estudadas têm potencial para serem empregadas em bioprocessos para remoção de cor de efluentes têxteis ou no tratamento de resíduos sólidos coloridos, entretanto, existe a necessidade de um melhor entendimento dos mecanismos utilizados por estes fungos para o desenvolvimento de tecnologias para a aplicação destes microrganismos.
À CAPES pela bolsa de doutorado concedida ao primeiro autor e à FAPESP pelo auxílio financeiro na execução do projeto.
1. Cegarra, J.; Quim Têxtil 2000, 58, 5.
2. Bumpus, J. A.; Aust, S. D.; Bioassay 1986, 6, 170.
3. Semple, K. T.; Femor, T. R.; Proceedings of the 14th International Congress on the Science and Cultivation of Edible Fungi 1995, 17, 917.
4. Young, L.; Yu, J.; Water Res. 1997, 31, 1187.
5. Barr, D. P.; Aust, S. D.; Environ. Sci. Technol. 1994, 28, 78.
6. Knapp, J. S.; Newby, P. S.; Reece, L. P.; Enzyme Microb. Technol. 1995, 17, 664.
7. Balan, D. S. L.; Quim. Têxtil 1999, 54, 26.
8. Banat, M. B.; Nigam, P.; Singh, D.; Marchant, R.; Bioresour. Technol. 1996, 58, 217.
9. Vyas, B. R. M.; Molitoris, H. P.; Appl. Environ. Wastewater 1995, 61, 3919.
10. Balan, D. S. L; Monteiro, R. T. R.; J. Biotechnol. 2001, 89, 141.
11. Ranzani, M. R. T. C.; Tese de Doutorado, Universidade Estadual de Campinas, Brasil, 2002.
12. Szklarz, G.; Antibus, R. K.; Sinsabaugh, R. L.; Linkins, A. E.; Mycologia 1984, 81, 234.
13. Kuwahara, M.; Glenn, J. K.; Morgan, M. A.; Gold, M. H.; FEBS Lett. 1984, 169, 247.
14. Kerem, Z.; Friesem, D.; Hadar, Y.; Appl. Environ. Microbiol. 1992, 58, 1121.
15. Waldner, R.; Leisola, M. S. A.; Fichter, A.; Appl. Microbiol. Biotechnol. 1988, 29, 400.
16. Guillén, F.; Martínez, A. T.; Martínez, M. J.; Evans, C. S.; Appl. Microbiol. Biotechnol. 1994, 41, 465.
17. Kumaran. S.; Sastry, C. A.; Vikineswary, S.; World J. Microbiol. Biotechnol. 1997, 13, 43.
18. Rodriguez, E.; Pickard, M. A.; Vasquez-Duhal, T. R.; Curr. Microbiol. 1999, 38, 27.
19. Swamy, J.; Ramsay, J. A.; Appl. Microbiol. Biotechnol. 1999, 51, 391.
20. Kim, B. S.; Ryu, S. J.; Shin, K. S.; J. Microbiol. 1996, 34, 101.
21. Shin, K.; Kim, C.; Biotechnol. Lett. 1998, 20, 569.
22. Akhmedova, Z. R.; Appl. Biochem. Microbiol. 1994, 30, 32.
23. Lang, E.; Nerud, F.; Novotná, E.; Zadrazil, F.; Martens, R.; Folia Microbiol. 1996, 41, 489.
24. Field, J. A.; Jong, E.; Feijoo-Costa, G.; Bont, J. A. M.; Trends Biotechnol. 1993, 11, 44.
Hélio Mitoshi KamidaI; Lucia Regina DurrantI; Regina Teresa Rosim Monteiro*, II; Eduardo Dutra de ArmasII
monteiro[arroba]cena.usp.br
IDepartamento de Ciência de Alimentos, Faculdade de Engenharia de Alimentos, Universidade Estadual de Campinas, CP 6121, 13081-970 Campinas - SP
IICentro de Energia Nuclear na Agricultura, Universidade de São Paulo, CP 96, 13416-000 Piracicaba - SP
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|