 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
O experimento foi realizado em canavial da Fazenda Retiro, Usina Santa Helena, município de Piracicaba-SP (22o42' S, 47o38' W e 580 m), em outubro de 1997.
Instalaram-se 100 iscas Termitrap®, de 10 em 10 metros na linha de cana, para a localização dos focos necesários para a pesquisa. Os focos foram caracterizados por um número de indivíduos na isca maior que 1000, distantes 25 metros.
Foram utilizados 20 focos de H. tenuis. Em cada foco aplicou-se na isca, 18,5 MBb (500 mCi) de radioisótopo (32P) na forma de fosfato de sódio diluído em 15 ml de água destilada. A meia-vida física do 32P é de 14,3 dias. A aplicação desse marcador radioativo foi feita por técnicos do Centro de Energia Nuclear da Agricultura (CENA), segundo os cuidados recomendados por normas internacionais.
Ao redor das iscas marcadas, foram instaladas quatro iscas Termitrap de monitoramento, sem qualquer marcador nos quatro pontos cardeais, eqüidistantes de 1, 5, 10 e 20 metros. Cada tratamento foi representado por um foco previamente determinado e marcado com 32P, e uma das distâncias estipuladas para a isca de monitoramento, sendo repetido de 4 a 6 vezes. O delineamento experimental foi inteiramente casualizado, com quatro tratamentos, representados pelos focos previamente determinados, com as seguintes repetições: Tratamento 1: 1 metro, seis repetições; Tratamento 2: 5 metros, seis repetições; Tratamento 3: 10 metros, quatro repetições e Tratamento 4: 20 metros, quatro repetições. Assim, foram utilizadas 80 iscas sem marcação e 20 iscas marcadas com a solução radioativa de 32P.
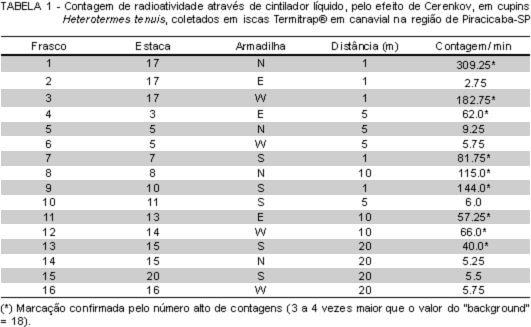
Após 15 dias, procedeu-se à avaliação, coletando-se 15 indivíduos de H. tenuis, por repetição, das iscas sem marcador, acondicionando-os em frascos de vidro com água destilada, preparados assim para serem analisados em cintilador líquido, (marca Packard, modelo Tricarb 1.600), utilizando o efeito de Cerenkov, com contagem da radiação por dois minutos por frasco, no Centro de Energia Nuclear na Agricultura, CENA-USP.
Em apenas 20% das iscas sem marcador (16 iscas) coletaram-se indivíduos de H. tenuis, e em nove frascos analisados (11,3%) existiam os insetos marcados, indicando que as demais sete iscas foram infestadas por populações diferentes daquelas dos focos inicialmente marcados (TABELA 1).
Observou-se também que, nos cupins marcados, não houve preferência pela direção da isca em nenhuma das distâncias estudadas, comportamento notado por Almeida (1994) em teste de laboratório, onde verificou-se que parte da população sai em busca de alimento e abrigo e, assim que os encontra, conduz para aquele local o restante da população forrageira.
De acordo com Su et al. (1984), C. formosanus possui hábito de forrageamento em áreas selecionadas e após a seleção do local de forrageamento, os indivíduos daquela colônia passam a visitá-lo. Notou-se que o cupim H. tenuis possui hábito semelhante, pois apesar de haver diferentes tipos de alimento no local, e mesmo, mais de uma isca, a colônia seleciona este local e passa a atacá-lo.
No trabalho, outras populações de H. tenuis invadiram as iscas não marcadas, demonstrando a presença de diversas colônias numa mesma área de forrageamento. Esse fato foi constatado pela captura de cupins nas iscas sem marcador, portanto indivíduos que não se contaminaram com 32P, evidenciando serem indivíduos de colônias diferentes daquelas que foram marcadas. Van der Linde et al. (1989) verificaram o mesmo comportamento com a espécie H. mossambicus, a qual possuía uma área de forrageamento de 0,5 a 3,1 ha.
Os maiores números de indivíduos marcados foram coletados nas iscas localizadas a 1 metro de distância da isca com 32P, seguido da distância de 10 metros. Também foram coletados cupins nas iscas localizadas nas distâncias de 5 e 20 metros. Como foram coletados cupins portadores de radioatividade na maior distância testada (20 m), pôde-se calcular que a área de forrageamento de H. tenuis foi de 1.256,63 m2. No entanto, a freqüência de forrageamento foi maior próximo do foco marcado, pois na distância de 1 metro foram coletados mais indivíduos marcados do que nas armadilhas mais distantes. Porém, nas distâncias de 5 e 20 metros esse tipo de comportamento não se repetiu, provavelmente, pela interferência de outros alimentos que interessaram mais a população que foi marcada, no entanto, a freqüência de visita foi três vezes superior para a distância de 10 metros da população marcada (Figura 1).
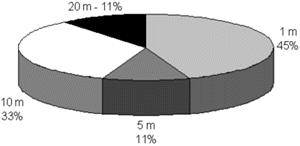
Figura 1. Porcentagem de iscas com operários e soldados de Heterotermes tenuis marcados com 32P coletados em diferentes distâncias do foco inicial, em cultura de cana-de-açúcar. Piracicaba-SP.
Esses resultados estão condizentes com os observados para outras espécies, pois para C. formosanus, as galerias da colônia atingem até 50 metros de distância no solo (Tamashiro et al. 1973) e para R.. flavipes as galerias chegam a atingir 79 metros (Grace et al. 1989).
Considerando-se que a maior distância percorrida pelos indivíduos de uma colônia de H. tenuis foi de 20 metros, pode-se inferir que com oito armadilhas por hectare poder-se-ia exercer um controle sobre a população desses insetos. No entanto, como recomendação prática, deve-se calcular o número de armadilhas por hectare baseado nas distâncias mais freqüentes de captura de cupins marcados, que foi de 10 metros. Dessa maneira, pode-se calcular que a área de forrageamento mais intensa de H. tenuis atinge cerca de 315 m2, o que permite estimar que 32 iscas/ha seriam suficientes para estudos de controle dessa espécie em cana-de-açúcar.
O cupim Heterotermes tenuis não-se orienta numa direção pré-determinada na busca por alimento em cana-de-açúcar.
Diversas colônias de H. tenuis forrageiam numa mesma área.
A área de forrageamento de H. tenuis em cana-de-açúcar pode variar de 3 a 1.250m2.
Trinta e duas iscas/ha são suficientes para estudos de controle dessa espécie em cana-de-açúcar.
Os autores agradecem à FINEP pelo suporte na realização desta pesquisa, ao Centro de Energia Nuclear na Agricultura (CENA/USP) e ao funcionário Luís Ancelmo Lopes (CENA).
José Eduardo Marcondes Almeida2*; Sérgio Batista Alves3; Júlio Marcos Melges Walder4
sebalves[arroba]esalq.usp.br
2Laboratório de Controle Biológico, Centro Experimental do Instituto Biológico, C.P.70 - CEP:13001-970 - Campinas, SP.
3Depto. de Entomologia, Fitopatologia e Zoologia Agrícola - ESALQ/USP. C.P. 09, CEP: 13418-900 - Piracicaba, SP.
4Laboratório de Radioentomologia - CENA/USP, C.P. 09, CEP: 13418-900 - Piracicaba,SP.
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|