Leyes de los gases
Introducción
Todo en el Universo está formado por materia. La
materia se puede encontrar en 3 estados de agregación o
estados físicos:
sólido, líquido y gaseoso.
Para entender los diferentes estados en los que la
materia existe, es necesario entender algo
llamado Teoría Molecular cinética de la
Materia. La Teoría Molecular cinética tiene
muchas partes, pero aquí introduciremos sólo
algunas. Uno de los conceptos básicos de la teoría
argumenta que los átomos
y moléculas poseen
una energía de movimiento, que percibimos como
temperatura. En otras palabras, los átomos y
moléculas están en movimiento constante y medimos
la energía de estos movimientos como la temperatura de una
sustancia. Mientras más energía hay en una
sustancia, mayor movimiento molecular y mayor la temperatura
percibida. Consecuentemente, un punto importante es que la
cantidad de energía que tienen los átomos y las
moléculas (y por consiguiente la cantidad de movimiento)
influye en su interacción. ¿Cómo se producen
estos diferentes estados de la materia? Los átomos que
tienen poca energía interactúan mucho y
tienden a "encerrarse" y no interactuar con otros átomos.
Por consiguiente, colectivamente, estos átomos forman una
sustancia dura, lo que llamamos un sólido. Los
átomos que poseen mucha energía se mueven
libremente, volando en un espacio y forman lo que llamamos
gas.
Los gases se forman cuando
la energía de un sistema excede todas
las fuerzas de atracción
entre moléculas. Así, las moléculas de
gas interactúan poco, ocasionalmente chocándose. En
el estado gaseoso, las moléculas se mueven
rápidamente y son libres de circular en cualquier
dirección, extendiéndose en largas distancias. A
medida que la temperatura aumenta, la cantidad de movimiento de
las moléculas individuales aumenta. Los gases se expanden
para llenar sus contenedores y tienen
una densidad baja. Debido a que las moléculas
individuales están ampliamente separadas y pueden circular
libremente en el estado gaseoso, los gases pueden ser
fácilmente comprimidos y pueden tener una forma
indefinida.
El comportamiento de todos los gases se ajusta a tres
leyes, las cuales relacionan el volumen de un gas con su
temperatura y presión. Los gases que obedecen estas leyes
son
llamados gases ideales o perfectos.
En el siguiente informe estudiaremos la ley de Boyle y
Mariotte y la ley de Charles y Gay-lussac.
Objetivos
Comprobar experimentalmente la ley de Boyle y
MariotteComprobar experimentalmente la ley de Charles y
Gay-Lussac, y determinar el cero absoluto.Observar lo que se produce al combinar un metal con
acido clorhídrico.
Marco
teórico
Propiedades de los gases
El estado gaseoso es un estado disperso de la materia,
es decir, que las moléculas del gas están separadas
unas de otras por distancias mucho mayores del tamaño del
diámetro real de las moléculas. Resuelta entonces,
que el volumen ocupado por el gas (V) depende de la
presión (P), la
temperatura (T) y de la cantidad o numero de
moles (n).
1. Se adaptan a la forma y el volumen del
recipiente que los contiene. Un gas, al cambiar de recipiente, se
expande o se comprime, de manera que ocupa todo el volumen y toma
la forma de su nuevo recipiente.
2. Se dejan comprimir fácilmente. Al
existir espacios intermoleculares, las moléculas se pueden
acercar unas a otras reduciendo su volumen, cuando aplicamos una
presión.
3. Se difunden fácilmente. Al no
existir fuerza de atracción intermolecular entre sus
partículas, los gases se esparcen en forma
espontánea.
4. Se dilatan, la energía
cinética promedio de sus moléculas es directamente
proporcional a la temperatura aplicada
Variables que afectan el comportamiento de los
gases
1. PRESIÓN
Es la fuerza ejercida por unidad de área. En los
gases esta fuerza actúa en forma uniforme sobre todas las
partes del recipiente.
La presión atmosférica es la fuerza
ejercida por la atmósfera sobre los cuerpos que
están en la superficie terrestre. Se origina del peso del
aire que la forma. Mientras más alto se halle un cuerpo
menos aire hay por encima de él, por consiguiente la
presión sobre él será menor.
2. TEMPERATURA
Es una medida de la intensidad del calor, y el calor a
su vez es una forma de energía que podemos medir en
unidades de calorías. Cuando un cuerpo caliente se coloca
en contacto con uno frío, el calor fluye del cuerpo
caliente al cuerpo frío.
La temperatura de un gas es proporcional a la
energía cinética media de las moléculas del
gas. A mayor energía cinética mayor temperatura y
viceversa.
La temperatura de los gases se expresa en grados
kelvin.
3. CANTIDAD
La cantidad de un gas se puede medir en unidades de
masa, usualmente en gramos. De acuerdo con el sistema de unidades
SI, la cantidad también se expresa mediante el
número de moles de sustancia, esta puede calcularse
dividiendo el peso del gas por su peso molecular.
4. VOLUMEN
Es el espacio ocupado por un cuerpo.
5. DENSIDAD
Es la relación que se establece entre el peso
molecular en gramos de un gas y su volumen molar en
litros.
Gas Real
Los gases reales son los que en condiciones ordinarias
de temperatura y presión se comportan como gases ideales;
pero si la temperatura es muy baja o la presión muy
alta, las propiedades de los gases reales se desvían en
forma considerable de las de gases ideales.
Concepto de Gas Ideal y diferencia entre Gas Ideal y
Real.
Los Gases que se ajusten a estas suposiciones se llaman
gases ideales y aquellas que no, se les llaman gases reales, o
sea, hidrógeno, oxígeno, nitrógeno y
otros.
1. – Un gas está formado por partículas
llamadas moléculas. Dependiendo del gas, cada
molécula está formada por un átomo o un
grupo de átomos. Si el gas es un elemento o un compuesto
en su estado estable, consideramos que todas sus moléculas
son idénticas.
2. – Las moléculas se encuentran animadas de
movimiento aleatorio y obedecen las leyes de Newton del
movimiento. Las moléculas se mueven en todas
direcciones y a velocidades diferentes. Al calcular las
propiedades del movimiento suponemos que la mecánica
newtoniana se puede aplicar en el nivel microscópico. Como
para todas nuestras suposiciones, esta mantendrá o
desechara, dependiendo de sí los hechos experimentales
indican o no que nuestras predicciones son correctas.
3. – El número total de moléculas es
grande. La dirección y la rapidez del movimiento de
cualquiera de las moléculas pueden cambiar bruscamente en
los choques con las paredes o con otras moléculas.
Cualquiera de las moléculas en particular, seguirá
una trayectoria de zigzag, debido a dichos choques. Sin embargo,
como hay muchas moléculas, suponemos que el gran
número de choques resultante mantiene una
distribución total de las velocidades moleculares con un
movimiento promedio aleatorio.
4. – El volumen de las moléculas es una
fracción despreciablemente pequeña del volumen
ocupado por el gas. Aunque hay muchas moléculas,
son extremadamente pequeñas. Sabemos que el volumen
ocupado por una gas se puede cambiar en un margen muy amplio, con
poca dificultad y que, cuando un gas se condensa, el volumen
ocupado por el gas comprimido hasta dejarlo en forma
líquida puede ser miles de veces menor. Por ejemplo, un
gas natural puede licuarse y reducir en 600 veces su
volumen.
5. – No actúan fuerzas apreciables sobre las
moléculas, excepto durante los choques. En el
grado de que esto sea cierto, una molécula se
moverá con velocidad uniformemente los choques. Como hemos
supuesto que las moléculas sean tan pequeñas, la
distancia media entre ellas es grande en comparación con
el tamaño de una de las moléculas. De aquí
que supongamos que el alcance de las fuerzas moleculares es
comparable al tamaño molecular.
6. – Los choques son elásticos y de
duración despreciable. En los choques entre las
moléculas con las paredes del recipiente se conserva el
ímpetu y (suponemos) la energía cinética.
Debido a que el tiempo de choque es despreciable comparado con el
tiempo que transcurre entre el choque de moléculas, la
energía cinética que se convierte en energía
potencial durante el choque, queda disponible de nuevo como
energía cinética, después de un tiempo tan
corto, que podemos ignorar este cambio por completo.
Leyes de los gases ideales
La Ley de Boyle-Mariotte (o Ley de
Boyle), formulada por Robert Boyle y Edme
Mariotte, es una de las leyes de los gases ideales que
relaciona el volumen y la presión de
una cierta cantidad de gas mantenida
a temperatura constante. La ley dice que el volumen es
inversamente proporcional a la presión:

Donde  es constante si la temperatura y la masa del
es constante si la temperatura y la masa del
gas permanecen constantes.
Cuando aumenta la presión, el volumen disminuye,
mientras que si la presión disminuye el volumen aumenta.
No es necesario conocer el valor exacto de la
constante  para
para
poder hacer uso de la ley: si consideramos las dos situaciones de
la figura, manteniendo constante la cantidad de gas y la
temperatura, deberá cumplirse la
relación:
![]()
Donde:




Para calcular el volumen de aire se utiliza la siguiente
fórmula:

La Ley de Charles y Gay-Lussac, o
simplemente Ley de Charles, es una de las leyes de
los gases ideales. Relaciona el volumen y
la temperatura de una cierta cantidad de gas ideal,
mantenido a una presión constante, mediante una
constante de proporcionalidad directa. En esta ley, Charles dice
que para una cierta cantidad de gas a una presión
constante, al aumentar la temperatura, el volumen del gas aumenta
y al disminuir la temperatura el volumen del gas disminuye. Esto
se debe a que la temperatura está directamente relacionada
con la energía cinética (debida al
movimiento) de las moléculas del gas. Así que, para
cierta cantidad de gas a una presión dada, a mayor
velocidad de las moléculas (temperatura), mayor volumen
del gas.
La ley fue publicada primero por Louis Joseph
Gay-Lussac en 1802, pero hacía referencia al
trabajo no publicado de Jacques Charles, de alrededor
de 1787, lo que condujo a que la ley sea usualmente
atribuida a Charles. La relación había sido
anticipada anteriormente en los trabajos de Guillaume
Amontons en 1702.
Por otro lado, Gay-Lussac relacionó la
presión y la temperatura
como magnitudes directamente proporcionales en la
llamada "La segunda ley de Gay-Lussac".
La ley de Charles es una de las leyes más
importantes acerca del comportamiento de los gases, y ha sido
usada en muchas aplicaciones diferentes, desde para globos de
aire caliente hasta en acuarios. Se expresa por la
fórmula:
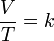
Donde:
V es el volumen
T es la temperatura absoluta (es decir, medida
en Kelvin)k es la constante de
proporcionalidad.
Además puede expresarse como:
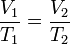
Donde:
 Volumen
Volumen
inicial
 Temperatura inicial
Temperatura inicial
 Volumen
Volumen
final
 Temperatura final
Temperatura final
La presión atmosférica: es el peso que
ejerce el aire sobre la superficie terrestre y es uno de los
principales actores de la meteorología y que tiene un gran
poder de influencia sobre la vida en la tierra.
La presión puede expresarse en diversas unidades, tales
como: Kg/cm (cuadrado), psi, cm de columna de agua, pulgadas o cm
de Hg, bar y como ha sido denominada en términos
internacionales, en Pascales (Pa).
Materiales y reactivos
1 matraz Erlenmeyer de 250 ml.
1 vaso precipitado de 2000 ml.
1 vaso de precipitado de 1000 ml.
3 cilindros graduados de 100,500 y 1000
ml.1 termómetro.
2 soportes universales.
1 pinza tipo nuez.
1 pinza de extensión
1 bureta de 50 ml.
1 regla de 30 cm o cinta métrica.
1 chicle
2 planchas de calentamiento
Pinza para bureta
2 globos
Etanol
Fósforos
Zinc
Acido clorhídrico
Procedimiento experimental
Ley de Boyle
1. Llenar una probeta de 1000 ml ³/4 de su
capacidad, invierta una bureta con la llave abierta; cierre
la llave a un ¹/4 de su volumen con agua. La bureta debe
mantenerse con la llave cerrada, asegúrese de que no
haya del aire contenido en la bureta.2. Consiga 5 lecturas de volumen y
presión para el aire encerrado dentro de la bureta. El
desnivel (H) mídalo con la regla.3. Mida el volumen de agua contenida en la
bureta igualando los niveles de agua en el bulbo y la bureta,
siendo la altura (h: desnivel igual 0, cero).Anote el volumen
de agua en la bureta.4. Levante la bureta, midiendo la altura (h:
desnivel) con una regla y anote el volumen de agua contenido
en la bureta.5. Baje la bureta, midiendo la altura (h:
desnivel) con una regla y anote el volumen de agua contenido
en la bureta.6. Obtenga la presión barométrica
del laboratorio y el volumen Vo para la bureta.7. Calcule el volumen del aire y la
presión para cada caso.8. Calcule el volumen del aire, la
presión en mmHg y determine el producto P×V para
cada caso. Compare los resultados.
Ley de Charles
1. En una plancha de calentamiento colocar un
vaso de precipitado de 1 litro lleno de agua.2. Antes de que el agua ebulla colocar dentro
del vaso precipitado un matraz apoyado en un soporte
universal.3. Una vez que el agua ebulla, mida la
temperatura.4. Utilizar un chicle como tapón para
tapar el tubito del matraz aforado.5. Luego con mucho cuidado retirar del
baño de maría el matraz aforado y colocar de
forma inversa en un vaso de precipitado de 1 litro con
suficiente agua del chorro.6. Retirar en chicle, cuando el matraz esta
boca abajo dentro del agua. Medir nuevamente la
temperatura.7. Mueva el matraz de modo que los niveles
dentro y fuera del matraz se igualen y tape el matraz con el
dedo.8. Mida el volumen de agua que se introdujo
dentro del matraz con el cilindro graduado de 100
ml.9. Mida posteriormente el volumen del matraz
llenándolo con agua completamente y luego
vertiéndola en un cilindro graduado de 500 ml. El
volumen final del gas será la diferencia de
estos.
Practica de Boyle
Datos teóricos
Densidad del mercurio (g/cm³) | Densidad del agua (g/cm³) | Presión barométrica de |
13,6 | O,99626 | 756 mmHg |
Datos experimentales
V agua (ml) | h(mmH2O) | |
Vo | 5,2 | 0 |
S | 5,5 | 68 |
S | 5,8 | 166 |
B | 4,9 | 62 |
B | 4,7 | 98 |
Tabla de medida de Vo
Vo (ml) | 6 ml |
Tabla de temperatura medida del agua
Temperatura (°C) | 28°C | ||
Practica de Charles
Datos teóricos
Presión barométrica o de | 756 mmHg | |||
Presión de vapor de agua a la temperatura | 26,74 torr | |||
Volumen del gas (Vg = V2) | 257 ml | |||
Datos experimentales
Temperatura 1 | 373 K | ||||
Temperatura 2 | 300 K | ||||
Volumen del agua dentro del matraz | 35 ml | ||||
Volumen que contiene el matraz lleno de | 320 ml | ||||
Resultados
Resultados de la práctica de
Boyle


Resultados de la práctica de
Charles

Muestra de cálculo
Practica de Boyle
1. Volumen de aire (V aire) para cada una de
las mediciones:
a.- V aire= 50-5,2+6= 50,8
b.- V aire= 50-5,5+6= 50,5
c.- V aire= 50-5,9+6= 50,2
d.- V aire= 50-4,9= 51,1
e.- V aire= 50-4,7+6= 51,3
2. Presión de la bureta
a.- P bureta= 756-0*10*(0,99681/13.6)= 756
b.- P bureta= 756+6,8*10*(0,99681/13.6)=
760,98405
c.- P bureta= 756+16,6*10*(0,99681/13.6)=
768,1669456
d.- P bureta= 756-6,2*10*(0,99681/13.6)=
751,4557191
e.- P bureta= 756-9,8*10*(0,99681/13.6)=
748,8171044
3. 1/Presión de la bureta
a.- 1/756= 0,00132275
b.- 1/760, 98405= 0,00131409
c.- 1/768,1669456= 0,0013018
d.- 1/751,4557191= 0,00133075
e.- 1/748,8171044= 0,00133544
Practica de Charles
1. Calculo del volumen del gas (Vg)
Volumen que contiene el matraz lleno completamente (V1)
menos volumen del agua dentro del matraz (V2)
Vg= V1-V2
2. Conversión de Celsius (°C) a
kelvin (K)
Kelvin = Celsius + 273
3. Volumen teórico del gas
V2=V1×T2/T1
4. Desviación promedio
V1 – V2/V1×100
5. Volumen del aire
V de aire = 50 ml – V de agua + Vo
6. Presión de la bureta
Discusión de
resultados
Con los resultados obtenidos en la práctica de
Boyle al graficar el volumen de un gas con la presión que
se ejerce sobre este a una temperatura constante pudimos observar
que a mayor presión el volumen del gas disminuía
esto se debe a que cuando ejercimos una mayor presión
sobre la bureta, dentro de esta, se introdujo un poco mas de
agua.
En caso contrario al disminuir la presión a la
mitad (¹/P) el volumen se duplicaba ya que el agua dentro de
la bureta disminuía.
Todo lo anterior mencionado ocurre debido a que al
aumentar el volumen, las partículas (átomos o
moléculas) del gas tardan más en llegar a las
paredes del recipiente y por lo tanto chocan menos veces por
unidad de tiempo contra ellas. Esto significa que la
presión será menor ya que ésta representa la
frecuencia de choques del gas contra las paredes.
Cuando disminuye el volumen la distancia que tienen que
recorrer las partículas es menor y por tanto se producen
más choques en cada unidad de tiempo: aumenta la
presión.
Lo que Boyle descubrió es que si la cantidad de
gas y la temperatura permanecen constantes, el producto de la
presión por el volumen siempre tiene el mismo
valor.
Al obtener los datos experimentales y demostrar la ley
de Charles obtuvimos un porcentaje de error de 10,89 %.Debido a
que solo realizamos el experimentos una sola vez y con un gas
real con lo que no, podemos saber si hubo o no precisión
ya que, no tenemos otras medidas para comparar nuestros
resultados y determinar si los valores estaban cercas entre
sí.
Comprobamos que el volumen es directamente proporcional
a la temperatura es decir si la temperatura aumenta el volumen
del gas también aumentara.
Cuando aumentamos la temperatura del gas las
moléculas se mueven con mayor rapidez y tardan menos
tiempo en alcanzar las paredes del recipiente. Esto quiere decir
que el número de choques por unidad de tiempo es mayor. Es
decir se produjo un aumento (por un instante) de la
presión en el interior del recipiente y un aumento del
volumen.
Como recomendación para tener más
exactitud y precisión en un experimento es necesario
realizar las mediciones más de una vez para poder comparar
los resultados y disminuir los posibles porcentajes de
errores.
El cero absoluto es 273,15 °C
teóricamente la temperatura más baja posible. En la
práctica solo se pudo medir el volumen de un gas en un
intervalo limitado de temperatura, ya que los gases se condensan
a bajas temperatura para formar líquidos.
Conclusiones
1. A una presión constante el volumen de
un gas se expande cuando se calienta y se contrae cuando se
expande.2. La temperatura y el número de moles
para demostrar la ley de Boyle deben ser
constantes.3. La presión para demostrar la ley de
charle debe ser constante.4. Si la presión de un gas se duplica el
volumen disminuye, y si la presión disminuye el
volumen aumenta.
Anexos
Unidades y equivalencias de la presión
atmosférica

Bibliografía
Paginas
http://www.juntadeandalucia.es/averroes/recursos_informaticos/andared02/leyes_gases/
http://www.educaplus.org/gases/gasesreales.html
Libros
Química General 7Th edición.pdf,
Raymond Chang. Capítulo 5.Química General 8va edición, Ralph H.
Petrucci. Capitulo 6.
Autor:
Marapacuto Josué
Medina Yoselyn
Prof: Edgardo Mundaray.
REPÚBLICA BOLIVARIANA DE
VENEZUELA
UNIVERSIDAD NACIONAL EXPERIMENTAL
POLITÉCNICA
"ANTONIO JOSÉ DE SUCRE"
VICERRECTORADO PUERTO ORDAZ

CÁTEDRA: LABORATORIO DE
QUÍMICA
Puerto Ordaz, Julio de 2011