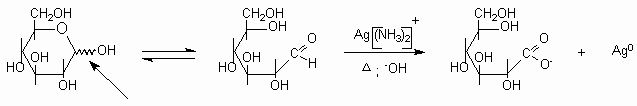Carbohidratos
Los carbohidratos, hidratos de carbono y
también simplemente azúcares. En su
composición entran los elementos carbono, hidrógeno y oxígeno, con frecuencia en la
proporción Cn(H20)n, por
ejemplo, glucosa
C6(H2O)6 de aquí los
nombres carbohidratos
o hidratos de carbono.
Estos compuestos, abarcan sustancias muy conocidas y al mismo
tiempo,
bastante disímiles, azúcar
común, papel, madera,
algodón, son carbohidratos o están
presentes en ello en una alta proporción.
A partir del dióxido de carbono y agua, las
plantas
sintetizan los carbohidratos, en un proceso
denominado fotosíntesis.

El pigmento verde de las plantas, la clorofila, pone a
disposición del vegetal, la energía que absorbe de
la luz solar. En
este proceso tienen lugar numerosas reacciones catalizadas por
enzimas, no todas
se comprenden, queda el CO2 reducido como carbohidrato
y a su vez se libera oxígeno.
La energía
solar quedó transformada en energía química a
disposición de las plantas y de animales, los
cuales metabolizan los carbohidratos realizando la
operación inversa y utilizando la energía para
diversos fines.
![]()
Ingerimos cereales, pero los cereales, digamos arroz,
maíz,
contienen almidones, estos son macromoléculas
poliméricas de glucosa, que nuestro organismo procesa y
transforma con sus enzimas para nuestro beneficio:
![]()
La glucosa, no solamente la utiliza el organismo como
fuente de energía, puede transformarla en otras
macromoléculas, el glucógeno, que se acumula en el
hígado y músculos y sirve de reserva de
energía, la transforma en colesterol y hormonas
esferoidales imprescindibles para numerosas funciones. Si se
ingieren excesos de carbohidratos estos se transforman en
grasas. De
modo que, estos compuestos resultan importantes para nosotros, no
solo por el algodón, papel y madera, los carbohidratos
constituyen uno de los tres grandes grupos de
alimentos.
Los carbohidratos se clasifican en monosacáridos,
oligosacáridos y polisacáridos. Un
monosacárido, es una unidad, ya no se subdivide
más por hidrólisis ácida o
enzimática, por ejemplo glucosa, fructosa o galactosa.
Los oligosacáridos están constituidos por
dos a diez unidades de monosacáridos. La palabra viene del
griego, oligo = pocos. Digamos el azúcar que utilizamos es
un disacárido y por tanto un oligosacárido.

Los polisacáridos son macromoléculas, por
hidrólisis producen muchos monosacáridos, entre 100
y 90 000 unidades.
![]()
Como primera aproximación, desde el punto de
vista químico, los carbohidratos son
polihidroxialdehídos o polihidroxicetonas o compuestos que
los producen por hidrólisis ácida o
enzimática. Esto es solo parcialmente cierto, pues en
solución acuosa, las estructuras de
polihidroxialdehídos o de polihidroxicetonas, permanecen
en pequeña proporción en equilibrio con
sus formas cíclicas, que son las más abundantes.
Estos aspectos interesantes los veremos más
adelante.
Como ya señalamos, en una primera
aproximación, son polihidroxialdehídos o
polihidroxicetonas. La estructura
contiene pues, varios grupos hidroxilos y un grupo
carbonilo. El sufijo que se utiliza al referirnos a ellos es
"osa". Una hexosa es por tanto, un
monosacárido de seis átomos de carbono. Si
el carbonilo se presenta como aldehído
será una aldohexosa y si se presenta de forma
similar a una cetona, diremos es una
cetohexosa.
La mayoría de los monosacáridos naturales
son pentosas o hexosas.

Pentosa Hexosa Hexosa
Aldopentosa Aldohexosa Cetohexosa
Para representar estructuras de carbohidratos, se
utiliza una representación abreviada, las fórmulas
de proyección de Fischer. Las fórmulas de
proyección de Fischer, resultan cómodas para
representar estructuras y por tanto, se continúan
utilizando, igual que el convenio de clasificar los carbohidratos
como pertenecientes a las familias D o L, en lugar de utilizar el
convenio mucho más actual de clasificar R o S
(Cahn-Igold-Prelog). Digamos D(+) gliceraldehido, D porque el
–OH está a la derecha y el signo (+) se refiere solo
a la rotación de luz polarizada, es una molécula
dextrógira. Así un carbohidrato que presenta el
–OH del estereocentro más alejado del carbonilo a la
derecha, se clasifica como D. si estuviera a la izquierda, se
clasifica como perteneciente a la familia L o
serie L.
Algunas aldopentosas naturales:
D-Ribosa 2- Dexoxi- D-Xilosa
D-Arabinosa
D-ribosa
La ribosa y la dexoxiribosa forman parte de los ácidos
nucleicos. La ribosa también se aisla de la
hidrólisis de la riboflavina (vitamina B2). El prefijo
"dexoxi" se refiere a que este monosacárido contiene menos
átomos de oxígeno que lo común, incumple con
la fórmula
Cn(H20)n.
La xilosa y la arabinosa, pueden aislarse de los
productos de
hidrólisis de las resinas vegetales, recibiendo la xilosa
también la denominación de "azúcar de
madera". La D(-) Arabinosa se encuentra también en
bacterias y
esponjas. Las hexosas naturales más comunes
son:
D(+)- Glucosa D(+)-Manosa D(+)-Galactosa L(+)-
Ramnosa D(-)- Fructosa
La glucosa también recibe el nombre de dextrosa
por ser dextrorrotatoria (D(+)-Glucosa), también
azúcar de sangre, pues
está presente en la sangre humana en concentración
de 65-110 mg/100 ml. Es posiblemente el producto
natural más abundante pues se encuentra como
polisacárido en el almidón, la celulosa y el
glucógeno. También aparece combinada como
disacárido en el azúcar común, la sacarosa
(fructosa y glucosa) y en la leche de todos
los mamíferos, lactosa, azúcar de leche
(galactosa y glucosa).
La glucosa, galactosa y ramnosa forman con frecuencia
parte de glicósidos naturales. Los glicósodos son
compuestos con una estrucura formada por uno o más
carbohidratos que se enlazan a una molécula que no es un
carbohidrato. El conjunto se llama glicósido y la
porción que no es un carbohidrato se denomina
aglicón.
La fructosa es un ejemplo de cetohexosa, es entre los
azúcares el compuesto más dulce, tiene bastante
más poder
edulcorante que la sacarosa, donde se encuentra enlazada con la
glucosa. Esta cetohexosa se encuentra libre en la miel y en
muchas frutas.
La D(+)-Manosa, se encuentra formando muchos
polisacáridos naturales.
3.1 Ciclación de los
monosacáridos
Analicemos lo dicho anteriormente respecto a que los
carbohidratos, en forma de polihidroxialdehídos o
polihidroxicetonas, en solución acuosa, permanecen
en pequeñas proporciones con sus formas cíclicas,
que son las más abundantes.
Por ataque nucleofílica de los electrones del
oxígeno hidroxílico, sobre el carbono
carbonílico, las aldosas o cetosas, de cuatro, cinco y
seis átomos de carbono formas estrucrtura cíclicas
hemiacetálicas.

Aldotetrosa forma hemiacetálica
Forma aldehídica
de cadena abierta
La estructura cíclica posee un carbono
hemiacetálico, a él están unidos, un
hidrógeno, un hidroxilo, un grupo R-O- y un grupo
R.
Debemos decir que en solución acuosa el
equilibrio es muy favorable a la forma
cíclica.
Las aldopentosas se convierten en formas
hemiacetálicas cíclicas, por reacción entre
su grupo carbonilo y los hidroxilos situados en los C4 y en C5.
De esto resultan anillos de 5 y seis miembros. Lo mismo ocurre
con las aldohexosas, aunque estas forman peferentemente ciclos o
anilos de seis miembros.
Muy importante es tener en cuenta que el grupo carbonilo
es plano, puede recibir el ataque nucleofílico del
hidroxilo por cualquiera de sus dos caras, el carbono
carbonílico se convirtió en un estereocentro
tetraédrico, la ciclación ha generado dos nuevos
diasteroisómeros que se denominan anómeros,
son los anómeros α y β y el nuevo
estereocentro se llama el carbono anomιrico.
En solución acuosa, la forma abierta de la
D-ribosa, permanece en equilibrio con cuatro formas
cíclicas:
Reacción del –OH del C4 con el C=O Dos
anillos de cinco miembros.
Reacción del –OH del C5 con el C=O Dos
anillos de seis miembros.
Un monosacárido formando anillos de cinco
miembros, se dice que es una furanosa, si es de seis miembros se
dice que es una piranosa. Las denominaciones provienen de los
heterociclos furano y pirano.

Furano Pirano
Representación de lo que ocurre en
solución acuosa de la D-ribosa, utilizando las
fórmulas de Fischer-Tollens, en los que se alargan los
enlaces del átomo de
oxígeno.
Anómero β Anómero α Trazas
Anómero α Anómero β
18% 6% 20% 56%
Anillos de cinco miembros Anillos de seis
miembros
(furanósicos) (piranósicos)
En estas estructuras, el anómero
α, se representa con el hidroxilo del carbono 1,
carbono anoméroco, a la derecha y en el anómero
β a la izquierda.
En la glucosa, las ciclaciones importantes son las que
forman anillos de seis miembros, formas piranósicas, dos
anómeros el α y el β que se forman
por ataque nucleofνlico del –OH del C5
sobre el carbonilo.
Aunque las fórmulas de Fischer son útiles
para representar estructuras abiertas y hemos visto ya las
denominadas fórmulas de Fischer-Tollens, son más
próximas a la realidad y mejores para discutir estructuras
cíclicas, las fórmulas perspectivas de
Haworth.
¿Cómo son estas fórmulas de
Haworth y cómo se representa?
Resulta muy sencillo representarlas. Vamos explicar
cómo se representa una estructura piranósica, las
que existen en solución acuosa de la D-glucosa.
Primero: Se representa un anillo de seis miembros
con el oxígeno a la derecha y arriba.
Luego: Si es un monosacárido que pertenece
a la familia D, el
grupo terminal, en la glucosa y otras aldohexosas o cetohexosas
–CH2OH, se representa arriba del anillo y si
fuera de la familia L, se representa abajo:

Ahora: Todos los hidroxilos que en
una estructura de Fischer están a la derecha, en la
fórmula perspectiva de Haworth se representan abajo y
todos los hidroxilos que en la representación de Fischer
están a la izquierda, en la de Haworth se
representarán arriba del ciclo o anillo, los átomos
de hidrógeno no se representan.
D-glucosa Anómero α Anómero
β
α –D-glucopiranosa β
–D-glucopiranosa
Por reacción entre el
hidroxilo del C5 y el carbonilo, se cicló la
molécula, se producen dos estructuras cíclicas
hemiacetálicas, dos diasteroisómeros, los
anómeros α y β.
Las fórmulas perspectivas de Haworth se acercan
más a la realidad, son superiores sin dudas a las de
Fischer-Tollens.
Las furanosas con sus anillos de 5 miembros son casi
planas, para las piranosas, aún más acorde con la
realidad, son las denominadas fórmulas o estructuras
conformacionales, las piranosas presentan estructuras de
silla.

Haworth Conformacional Haworth Conformacional α
–D-glucopiranosa β
–D-glucopiranosa
En la estructura conformacional, los sustituyentes que
quedan arriba en la fórmula de Haworth, se sitúan
arriba en esta también y los que quedan abajo en la
fórmula de Haworth, pues se colocan abajo en la
conformacional.
3.2. Propiedades químicas de los
monosacáridos
Muchas reacciones de los monosacáridos, son
debidas a la pequeña cantidad de forma abierta,
acíclica, en equilibrio con las estructuras
cíclicas. Algunas reacciones que requieren una
concentración inicial mayor fallan, el fallo se debe a que
la forma aldehídica no tiene concentración
suficiente para que se produzca la reacción, no obstante
los monosacáridos presentan una variedad de reacciones que
se producen bien, las reacciones son la típicas de las
funciones presentes, carbonilo e hidrixilo y por supuestos a
interacciones entre ambos grupos.
3.2.1. Reacciones del grupo carbonilo
- Oxidación.
Las aldosas reciben el nombre genérico de
"azúcares reductores", reducen oxidantes suaves como los
reactivos de Tollens (espejo de plata), Fehling y Benedit
(Pptado. Rojizo de Cu2O). Todo esto se debe a la
presencia de la estructura abierta en el equilibrio de la
ciclación.
Un monosacárido con el C1 oxidado a carboxilo,
recibe el nombre de ácido
Aldónico.
D-glucosa línea ondulada forma abierta
anión de un ácido
(α, β o mezcla) aldσnico o
glicσnico
Complejo tártaro-cúprico
ácido
R. de Fehling aldónico o
glicónico
Los tres reactivos, Tollens, Fehling y Bénedic,
son básicos, por lo que las cetosas, también los
reducen, pues en medio alcalino, están en equilibrio con
dos aldosas epímericas a través de un
Enodiol intermediario.

Esto se puede representar:

D- fructosa Aniones de ácidos
aldónicos
Para preparar ácidos aldónicos, no es
conveniente el medio básico, de los reactivos mencionados,
pues el medio básico induce otros cambios en los
monosacáridos. Se utiliza mejor agua de bromo (pH ~
6).
Para ver la fórmula seleccione la
opción "Descargar" del menú superior
Aldosa ác. aldónico
Con un oxidante energético, HNO3, se
oxida también el hidroxilo terminal, se obtienen los
ácidos Aldáricos o
Scáridos.
Para ver la fórmula seleccione la
opción "Descargar" del menú superior
Aldosa ác. aldárico
En los organismos vivos, ocurre la oxidación del
grupo terminal sin afectarse el C1. Éstos compuestos
reciben el nombre de ácidos
Urónicos.
Para ver la fórmula seleccione la
opción "Descargar" del menú superior
Aldosa ác. Urónico
3.2.2. Reacciones de los grupos
hidroxilos
- Acilación.
Los grupos hidroxilos de los monosacáridos, se
pueden esterificar. Por ejemplo tratando la glucosa u otra hexosa
con anhídrido acético, se pueden obtener los
derivados pentacetilados estereoisoméricos, el
α o el β. El curso estereoquνmico de
la reacciσn, depende de los catalizadores y
otras condiciones.
Para ver la fórmula seleccione la
opción "Descargar" del menú superior
α, β-glucopiranosa α,
β-pentacetilglucopiranosa
3.3. Estereoquímica de los
monosacáridos
En ocasiones has encontrado términos tales como,
dextrógira o levógira, la designación
están referida a las propiedades que presentan los
carbohidratos en disolución de originar un giro en el
plano de vibración de la luz polarizada, bien hacia la
derecha o hacia la izquierda.
En el primer caso se denominan
dextrorrotatorias y en el segundo
levorrortatorias. Estos compuestos que presentan
esta propiedad se
plantea que son óptimamente activos y el
fenómeno se conoce como actividad óptica,
(isómeros ópticos,
estereoisómeros).
- La luz polarizada.
La luz polarizada es un fenómeno
electromagnético. Un rayo de luz consiste en dos campos
oscilantes mutuamente perpendiculares: un campo
eléctrico y un campo
magnético.
Si se pudiera observar un rayo de luz ordinaria en un
extremo, pudiéramos ver que los planos en los cuales la
oscilación eléctrica se produce, están en
todas direcciones y perpendiculares a la dirección de la propagación. Cuando
la luz ordinaria pasa a trabes de un polarizador, el polarizador
interactúa con el campo eléctrico de forma tal que
en el campo eléctrico de la luz que emerge del polarizador
(y el campo magnético asociado a él) está
oscilando en un plano. Tal luz es llamada luz polarizada en un
plano.
Luz ordinaria Luz polarizada en un
plano
El polarímetro es el equipo que se utiliza para
determinar actividad óptica.
Fuente de luz Polarizador Tubo con la muestra
Analizador
Si el analizador rota en el sentido de las agujas del
reloj se dice que es (+) y si lo hace en sentido contrario es
negativa (-).

(+) (-)
dextrorrotatoria levororrotatoria
El número de estereoisómeros de una de las
estructuras de los monosacáridos, se puede calcular
utilizando la fórmula del químico alemán
Emil Fischer:
N=2n
N= número de estereoisómeros
n= números de carbonos estereogénicos
(estereocentros)
Por lo tanto para las aldohexosas tendremos
N=24=16 estereoisómeros.

Átomo de carbono con cuatro átomos o
grupos de átomos diferentes. Se señala con un
asterisco (*).
- Enantiómeros.
Existen estereoisómeros cuya relación
entre sí, es el de objeto-imagen. Estos
estereoisómeros se conocen como Enantiómeros, el
fenómeno recibe el nombre de
enantiomería.

- Diasteroisómeros.
Parejas de estereoisómeros que no son imágenes
especulares.
Es importante darse cuenta de que los conceptos de
Enantiómeros y Diasteroisómeros carecen de sentido
considerados aisladamente.
Para ver la fórmula seleccione la
opción "Descargar" del menú superior
D (+)- Glucosa D (+)-Manosa
(I) (II) (III)
I y II Enantiómeros.
II y III
Diasteroisómeros.
Generalidades sobre los disacáridos.
Como su nombre lo indica un disacárido, es un
carbohidrato formado por dos unidades de monosacáridos.
Estas unidades están unidas mediante un enlace
glicosídico.
¿Qué es un enlace
glicosídico?
Es un éter formado en el hidroxilo
hemiacetálico y se clasifica bajo la denominación
de Glicósido.
Para ver la fórmula seleccione la
opción "Descargar" del menú superior
Un carbono hemiacetálico, es aquel al que
están unidos, un hidrógeno, un hidroxilo, un grupo
R-O- y un grupo R.
Un glicósido sera:

Donde R" puede ser un carbohidrato u otro tipo de
molécula que no es un carbohidrato (la porción que
no es azúcar se le llama aglicón).
En los disacáridos existe unión
glicosídica, entre dos monosacáridos. En ellos es
importante saber: cómo se verifica esta
unión, a dónde, en qué
posición está situado el enlace.
Una unión muy común es la 1-4´,
quiere decir, están comprometidos en el enlace, el C1,
carbono anomérico de una unidad y el C4 de la otra
unidad.
β
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Enlace 1-4´ β
En este tipo de unión queda libre el hidroxilo
del carbono anomérico de la segunda unidad y por lo tanto,
el disacárido en solución acuosa estará en
equilibrio con la forma aldehídica. También ocurre
lo mismo, en el otro tipo muy común de unión, la
1-6´.

Disacárido con enlaceβ
1-4´
Un disacárido con enlace 1-4´ ó
1-6´, está capacitado para establecer equilibrio con
la forma aldehídica y por tanto, presentará las
reacciones típicas de los aldehídos que ya
estudiamos; reducirá los reactivos de Tollens, Fehling y
Benedict. Por el contrario, si el enlace compromete los dos
carbonos anoméricos, no hay posibilidades de que se
establezca el equilibrio con la forma aldehídica y por
tanto este disacárido no presentará ninguna de las
propiedades y reacciones que hemos mencionado.
El enlace entre los monosacáridos se define como
α σ β en dependencia de la
estereoquνmica del enlace de la primera unidad.
Como sabemos, todos los monosacáridos son
reductores, la mayoría de los disacáridos
también.
Cuatro disacáridos naturales más
importantes son la sacarosa, la celobiosa, la lactosa y la
maltosa.
- Celobiosa.
La celobiosa se obtiene por hidrólisis parcial de
la celulosa, es un disacárido formado por dos unidades de
glucosas unidas por enlaces β-1,4´.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
- Sacarosa.
El azúcar de mesa, sacarosa, es un
disacárido formado por fructosa y glucosa, es el
disacárido más abundante en el reino
vegetal.
La sacarosa no es reductora, pues el enlace entre los
dos monosacáridos está formado por los hidroxilos
de los carbonos anoméricos.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Sacarosa: α-glucopiranosil-β-
D- fructofuranσsido

- Lactosa.
Es un disacárido formado por una unidad de
galactosa y otra de glucosa, unidas por enlaces
β-1,4΄.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Lactosa
4-O-(β-galactopiranosil)-D-glucopiranosa
La lactosa, está presente en la leche de los
mamíferos, la leche de vaca contiene de 4-6 % y la humana
de 5-8 %.
La lactosa puede también existir en dos formas
puede ser α, o puede ser β. A la temperatura
del cuerpo la leche materna consiste aproximadamente en una
mezcla de 2 partes de α-lactosa y tres de
β-lactosa.
- Maltosa.
La maltosa, es un alimento para niños.
Es un disacárido formado por dos unidades de glucosa con
enlace α-1,4΄.
Para ver el gráfico seleccione la
opción "Descargar" del menú
superior
Maltosa
4-O-(α-glucopiranosil)-D-glucopiranosa
De este disacárido se conocen las dos formas en
dependencia de la estereoquímica del hidroxilo
hemiacetálico que puede ser α, o puede
ser β que es la forma habitual de la maltosa.
Son polímeros naturales, macromoléculas,
formadas por monosacáridos, cientos de unidades enlazadas
y a veces están constituidas por miles de unidades. Dos
ejemplos típicos de polisacáridos son el
almidón y la celulosa.
- Almidón.
Reserva energética de las plantas y para nosotros
un alimento. Se encuentra en forma en forma de pequeños
granos en muchas partes, u órganos constituyentes de las
plantas, especialmente en semillas y tejidos vegetales
embrionarios, en tubérculos de papa, semillas de arroz,
maíz o trigo. Ellos sirven de nutrientes para el proceso
germinativo y en general para el desarrollo de
las plantas.
Como primera aproximación, se puede decir que el
almidón está constituido por unidades de
D(+)-glucosa enlazadas α-1,4´. Nuestras enzimas
hidrolizan los almidones hasta sus unidades constituyentes de
glucosa, la cual, como ya hemos expresado, sirve a nuestro
organismo de nutriente y es utilizada para diferentes
transformaciones metabólicas.
Al tratar el almidón con agua caliente, este se
separa en dos fracciones: una dispersable, que se conoce como
amilasa y otra no dispersable, que es la mayoritaria, que se
conoce como amilopectina.
Para ver el
gráfico seleccione la opción "Descargar" del
menú superior
Los dos constituyentes del almidón difieren en
diversos aspectos y por tanto los consideramos por
separado.
- Amilosa
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
- Amilopectina.
Está también constituido por unidades de
D(+)-glucosa, con enlaces α-1,4΄, pero
las cadenas son de 1000 unidades o mαs y
presentan ramificaciones cada 25 unidades
α-1,6΄.
La hidrólisis de la amilopectina van produciendo
mezclas de
Oligosacáridos, de masa moleculares gradualmente menores,
que se conocen como "Dextrinas" que se utilizan en el acabado de
tejidos y en la fabricación de pegamentos, etc.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Amilopectina
Por hidrólisis parcial, se puede detectar la
presencia de isomaltosa, disacárido que tiene enlaces
α-1,6΄,
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
- Celulosa.
La celulosa es el polisacárido más
abundante en la naturaleza, es
el tejido de sostén de las plantas, formando
aproximadamente la mitad de las paredes o membranas de las
células
vegetales. Pero la celulosa, no está sola, está
asociada con las hemicelulas y la lignina. La celulosa
está formada por unidades de D(+)-glucosa, los enlaces en
el polisacáridos son β 1,4´: este tipo de
enlace los carnívoros no pueden romperlo y por tanto no
pueden utilizar la glucosa como nutriente.
Para ver el gráfico seleccione la
opción "Descargar" del menú superior
Celulosa
La celulosa forma microfibrillas de 14 000 unidades o
más, que se torcionan y se unen a otras por puente de
hidrógeno. La masa molecular varía entre 250 000 y
1 x 106 o más.
Si se trata celulosa con NaOH con concentración
de 17,5 %, una parte (cadenas menores) resulta
soluble, la β celulosa. Lo que no resulta disuelto (cadenas
mayores) la llaman α celulosa.
Para obtener pulpa de celulosa, con un 90 % de pureza a
partir de madera, existen diversos procedimientos:
en uno calientan virutas de madera con solución de
hidróxido de sodio, o bien con solución de
hidrógenosulfito de sodio y ácido sulfuroso; usan
digestores, reactores a presión a
4 atm. En este
procedimiento
de "celulosa de sulfito", las hemicelulosas resultan disueltas y
también las ligninas (en forma de sulfonatos). Este "licor
de sulfito" lo utilizan para la producción colateral de etanol. La pulpa de
celulosa, lavada, la tratan con "polvos de blanqueo" (mezclas de
clorato de calcios, cloruro e hidróxido de
calcio).
Para la producción del papel de filtro y papel de
alta calidad, se
aplican posteriores purificaciones y en el caso del papel, se
utilizan aditivos como el sulfato de bario o sulfato de calcio y
colofonia para cerrar los poros.
Derivados de la celulosa.
Durante décadas el hombre, en
su esfuerzo por vivir mejor ha desarrollado derivados de la
celulosa, por ejemplo el nitrato de celulosa, con
contenido de nitrógeno mayor a 11 %, está
constituidos por mezclas de di y trinitrato, se utiliza como
explosivo de impulsión. Esto se prepara a partir del
algodón y con mezcla nitrante
(HNO3/H2SO4), por lo que se
conoce como "algodón pólvora" y también
pólvora sin humo.
El acetato de celulosa: los tres hidroxilos de la
glucosa de la celulosa, pueden ser acetilados. Para ello se trata
la celulosa con una mezcla de ácido acético y
anhídrido acético, adicionando cantidad
catalítica de H2SO4 (conc.). Este
triacetato, se hridroliza obteniéndose diacetato, cadenas
de 200 a 300 unidades, con esto se obtienen películas de
fotografías. También a partir del diacetato, se
obtienen hilos, fibra textil, láminas para retroproyector,
películas, etc.
Los ésteres metílicos y
etílicos, de la celulosa que son plásticos
de importancia comercial.
- Fessenden Ralf j., Fessenden Joan. S, Organic Marshall W.
Logue. An International Thomson Publishing. Company, 1998. - Mc. Murry John. Organuc chemistry JTP. An International
Thomson Publisking Compary 1984. - Solomons, G. Fundamentals of Organic Chemistry, Cuarta
Edición, University of South Florida
1997
Autor:
Lic. Química Yasiel Arteaga Crespo
Dra. Ciencias
Técnicas Leila R. Carballo
Abreu
Universidad de Pinar del Río
"Hermanos Saíz Montes de Oca"
Facultad de Forestal y Agronomía
Departamento de Química
Pinar del Río, 2005