- Introducción
- Fundamento
teórico - Relación de
materiales y reactivos - Conclusiones
- Recomendaciones
- Anexos
- Bibliografía
En primera instancia es para hacer llegar mis saludos
cordiales hacia su persona a Ud. Ing. quien está a cargo
del curso de Química Orgánica, en el informe
siguiente se realizó las combinaciones de los materiales
que utilizamos por la cual hemos realizado ciertas
investigaciones y además se realizó en el
laboratorio.
Introducción
Los alcoholes son una serie de compuestos que poseen un
grupo hidroxilo, -OH, unido a una cadena carbonada; este grupo OH
está unido en forma covalente a un carbono con
hibridación. Cuando un grupo se encuentra unido
directamente a un anillo aromático, los compuestos
formados se llaman fenoles y sus propiedades
químicas son muy diferentes.
En el laboratorio los alcoholes son quizá el
grupo de compuestos más empleado como reactivos en
síntesis.
Los alcoholes tienen uno, dos o tres grupos
hidróxido (-OH) enlazados a sus moléculas, por lo
que se clasifican en monohidroxílicos,
dihidroxílicos y trihidroxílicos respectivamente.
El metanol y el etanol son alcoholes monohidroxílicos. Los
alcoholes también se pueden clasificar en primarios,
secundarios y terciarios, dependiendo de que tengan uno, dos o
tres átomos de carbono enlazados con el átomo de
carbono al que se encuentra unido el grupo hidróxido. Los
alcoholes se caracterizan por la gran variedad de reacciones en
las que intervienen; una de las más importantes es la
reacción con los ácidos, en la que se forman
sustancias llamadas ésteres, semejantes a las sales
inorgánicas. Los alcoholes son subproductos normales de la
digestión y de los procesos químicos en el interior
de las células, y se encuentran en los tejidos y fluidos
de animales y plantas.
OBJETIVOS.
Enseñar a conocer a los alumnos el uso de los
alcoholes en la metalurgia.Dar el resultado de los alcoholes en la
flotación de minerales.Obtener mejores resultados de la práctica ya
sea para el manejo de los reactivos.Determinar la capacidad crítica de los
estudiantes de ingeniería metalúrgica para
aplicar las propiedades físicas como también
las propiedades químicas de los
hidrocarburos.
Fundamento
teórico
LOS ALCOHOLES
Los alcoholes son el grupo de compuestos químicos
que resultan de la sustitución de uno o varios
átomos de hidrógeno (H) por grupos hidroxilo (-OH)
en los hidrocarburos saturados o no saturados.
Alcoholes primarios, secundarios y
terciarios.
Un alcohol es primario, si el átomo de
hidrogeno (H) sustituido por el grupo oxidrilo (-OH) pertenece a
un carbón (C) primario:

Es secundario, si el átomo de hidrogeno
(H) sustituido por el grupo oxidrilo (-OH) pertenece a un
carbón (C) secundario:

Finalmente, es terciario, si el
átomo de hidrogeno (H) sustituido por el grupo oxidrilo
(-OH) pertenece a un carbón (C) terciario:

La función alcohol puede repetirse en la misma
molécula, resultando monoles, o alcoholes monovalentes;
dioles, o alcoholes bivalentes; trioles, o alcoholes trivalentes,
etc.
Fórmula | Nombre | Clasificación |
| 1-propanol | monol |
| 1,2-propanodiol(propilen | diol |
| 1,2,3-propanotriol(glicerina) | triol |
Ensayos de solubilidad
Técnica. Se añaden 10 ml de alcohol
etílico de 95 % a 10 ml de agua contenidos en un tubo de
ensayos. Se satura la solución con carbonato de potasio y
se observa el resultado. Des pues se determina, aproximadamente,
la cantidad en peso de alcohol n-butílico,
alcohol sec-butílico y alcohol
ter-butílico que pueden disolverse en 5 ml de
agua, anotándose todas las observaciones y
resultados.
Observaciones

Interpretación
Los alcoholes de pocos átomos de carbono son
solubles en todas las proporciones. La solubilidad del alcohol
reside en el grupo -OH incorporado a la molécula
del alcano respectivo.
Las uniones puente de hidrógeno también se
manifiestan entre las moléculas de agua y el
alcohol

Asociación de metanol con
agua
Esta asociación explica la solubilidad del
alcohol metílico y etílico con el agua forman
semicombinaciones.
La solubilidad de los alcoholes disminuye con el aumento
del número de átomos de carbono, pues el grupo
hidroxilo constituye una parte cada vez más pequeña
de la molécula y el parecido con el agua disminuye a la
par que aumenta la semejanza con el hidrocarburo
respectivo.
A partir del exanol (incluido) son prácticamente
insolubles. Los miembros superiores de la serie son solamente
solubles en solventes polares.
Se puede explicar de una manera similar la causa de
insolubilidad en presencia de carbonato: la posibilidad de formar
uniones puente de hidrógeno disminuye y con ello la
solubilidad.El carbonato impide que se efectivicen estas fuerzas
de unión.
Se pueden disolver cantidades apreciables de compuestos
iónicos como el cloruro de sodio con alcoholes inferiores.
Se dice que el grupo hidroxilo es hidrofílico, lo
cual significaamigo del agua, debido a su afinidad por
esta y otras sustancias polares.
Al grupo alquilo del alcohol se le llama
hidrofóbico, lo cual significa que odia el
agua porque funciona como un alcano: rompe la red de
atracciones dipolo-dipolo y los puentes de hidrógeno de un
solvente polar como el agua. El grupo alquilo hace que el alcohol
sea menos hidrofílico, pero confiere solubilidad en
solventes orgánicos no polares. Muchos alcoholes son
miscibles con una gran variedad de solventes no
polares.
Un grupo alquilo de cuatro carbonos es lo
suficientemente grande para que algunos de sus isómeros no
sean solubles en agua, aunque, el alcohol
t-butílico, con su forma esférica
compacta, es miscible.
PROPIEDADES QUIMICAS DE LOS
ALCOHOLES.
Reacciones del -H de hidroxilo por ruptura del
enlace.
Técnica. Un trocito de sodio del
tamaño de un guisante se echa sobre 5 ml de alcohol
etílico puesto en un tubo de ensayos. Cuando la
reacción se ha completado, se añade un volumen
igual de éter anhidro y se observa el resultado. A
continuación se vierte la mezcla en un vidrio de reloj y
se deja evaporar el éter y el exceso de alcohol
etílico..
Interpretación
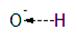
Formación de alcoholatos.
Reaccionan con los metales alcalinos como como el Li,
Na, K… y aún con los alcalino-térreos como el Ca.
El hidrógeno del hidroxilo es reemplazado por el metal
desprendiéndose en estado gaseoso.
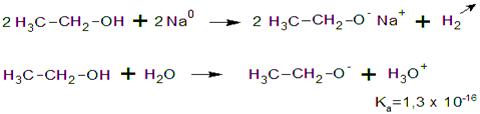
La sustancia que se forma es un alcóxido o
alcoholato que en este caso se denomina etanolato o
etóxido de sodio.
El alcohol en estas reacciones actúa como un
ácido débil.
Como los alcanos no reaccionan con los metales
alcalinos, debe admitirse que el átomo reemplazado es el
de hidrógeno unido al hidroxilo, lo que prueba la
polarización de la molécula de los
alcoholes.
La reacción de los alcoholes con los metales
alcalinos es menos enérgica que la de éstos con el
agua.
La acidez de los alcoholes varía ampliamente,
desde los alcoholes que son casi tan ácidos como el agua.
Hasta algunos que son mucho menos ácidos. La constante de
disociación ácida, Ka, de un alcohol, queda
definida por el equilibrio siguiente:
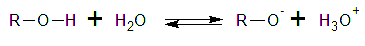
Los alcoholes más ácidos, como el etanol y
el metanol, reaccionan rápidamente con sodio para formar
metóxido y etóxido de sodio. Los alcoholes
secundarios, como el 2-butanol, reaccionan con velocidad
más moderada. Los alcoholes terciarios, como el alcohol
t-butílico, reaccionan lentamente. Con los
alcoholes terciarios con frecuencia se usa el potasio, K, porque
es más reactivo que el sodio y la reacción puede
completarse en un tiempo razonable.
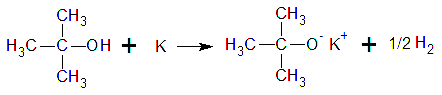
Reacciones por sustitución del grupo
hidroxilo.Formación de esteres
inorgánicos.
Cuando se efectúa la reacción entre un
alcohol y un ácido inorgánico se produce un
éster inorgánico.
En estos casos el agua se forma entre el -OH del alcohol
y el protón del ácido
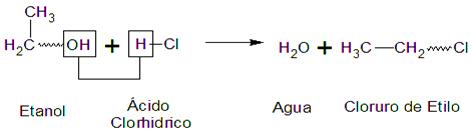
Otro ejemplo es la reacción del ácido
clorhídrico con alcoholes secundarios y terciarios. El
alcohol ter-butílico reacciona para dar un 98 % de cloruro
de ter-butilo.
Ensayo del test de Lucas.
Reactivo. El reactivo formado por HCl y ZnCl2 se
llama reactivo de Lucas. Los alcoholes secundarios y
terciarios reaccionan generalmente con el reactivo de Lucas por
un mecanismo SN1.Preparación. Disolver 68 g (0,5
ml) de cloruro de zinc anhidro en 52,5 g de ácido
clorhídrico concentrado, enfriando para evitar
pérdidas del ácido. Técnica. Colocar
1 ml del alcohol en un tubo de ensayos y agregar 6 ml de reactivo
de Lucas. Tapar y dejar reposar durante 5 minutos.
Oxidación de los
alcoholes.
Con permanganato a distintos valores de pH. Se han
desarrollado muchos métodos para la oxidación de
alcoholes. Por ejemplo, con frecuencia se emplea el permanganato
de potasio como alternativa más económica en
comparación con los oxidantes de cromo. El permanganato
oxida a los alcoholes secundarios llegando a la cetona, los
alcoholes primarios a ácidos
carboxílicos.
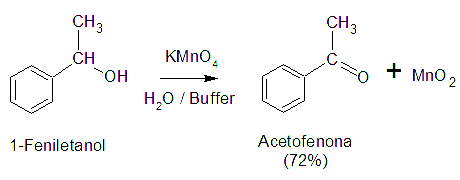

El reactivo de Jones, que es una solución
diluida de ácido crómico en acetona, es más
suave que el reactivo normal de ácido
crómico.
Para oxidar | A | reactivo que usa |
alcohol 2° | Cetona | ácido crómico o |
alcohol 1° | Aldehído | reactivo de Jones o |
alcohol 1° | Ácido | ácido |
ALCOHOL AMÍLICO
El alcohol amílico es un compuesto
orgánico incoloro con la fórmula C5H11OH, este
compuesto es conocido por tener ocho estructuras moleculares
diferentes. Posee una densidad de 0,8247 g/cm3 (a 0 °C)
y tiene un punto de ebullición de 131,6 °C, es
poco soluble en agua, pero es más soluble en solventes
orgánicos.
Isómeros
Este alcohol posee ocho isómeros:
Nombre | Fórmula | Estructura | Nomenclatura | |||
Alcohol amílico |
| Primario | 1-pentanol | |||
Carbinol isobutílicoo |
| Primario | 3-metil-1-butanol | |||
Alcohol amílico |
| Primario | 2-metil-1-butanol | |||
Carbinol butílico terciarioo |
| Primario | 2,2-dimetil-1-propanol | |||
Dietilcarbinol |
| Secundario | 3-pentanol | |||
Carbinol metil (n) |
| Secundario | 2-pentanol | |||
Carbinol metil |
| Secundario | 3-metil-2-butanol | |||
Carbinol dimetil etílicoo |
| Terciario | 2-metil-2-butanol | |||
Tres de estos alcoholes, el alcohol amílico
activo físicamente, el carbinol metil (n) propílico
y el carbinol metil isopropílico, son ópticamente
activos ya que contienen átomos de carbono
asimétricos. El más importante es el carbinol
isobutílico, siendo el principal complemento en la
fermentación del alcohol amílico, y
consecuentemente un componente del aceite de fusel.
Relación de
materiales y reactivos
Tubos de ensayos.
Vaso precipitado.
Agua.
Alcohol amílico.
Alcohol isoamilico.
Sodio metálico.
Ácido sulfúrico (H2SO4).
Otros.
CALCULO, REACCIONES Y RESULTADOS.
PROPIEDADES FISICAS
1. Agua más sodio.
El sodio en contacto con el agua se va
volatizando
2H2O + 2Na ( 2NaOH + H2
2. Alcohol amílico más
agua.
No se combinan y el agua se va en la parte baja. al
agitarlo se separa rápidamente que el alcohol
isoamilico.
No hay reacción
3. Alcohol isoamilico más
agua.
No se mezclan. El agua está en la parte alta, al
agitarlo se separan lentamente a diferencia del alcohol
amílico.
No hay reacción.
PROPIEDADES QUIMICAS
1. Alcohol amílico con
sodio.
Reacciona rápido y el sodio sale a la superficie.
Y la temperatura en el tubo de ensayo aumenta.
2C5H11OH + 2Na ( 2C5H11ONa +
H2
2. Alcohol isoamilico con
sodio.
Reacciona lentamente y el sodio tarda un tiempo en salir
a la superficie. En el tubo de ensayo demora en tener
calor.
2C5H11OH + 2Na ( 2C5H11ONa +
H2
3. Alcohol amílico con ácido
sulfúrico.
El ácido sulfúrico
está en la parte baja. Y no llegan a juntarse por lo tanto
no hay reacción. Pero al agitarlo el alcohol
amílico toma un color anaranjado claro.
C5H11OH + H2SO4 ( C5H11-SO4H +
H2O
4. Alcohol isoamilico con ácido
sulfúrico.
El ácido sulfúrico se mezcla con el
alcohol isoamilico y el tubo de ensayo tiene una determinado
temperatura.
C5H11OH + H2SO4 ( C5H11-SO4H +
H2O
5. Alcohol amílico más H2SO4
más Na.
No hay reacción, el sodio se mantiene en la
superficie.
C5H11OH + H2SO4 + Na ( C5H11-SO4HNa +
H2O
6. Alcohol isoamilico mas H2SO4 mas
Na.
No hay reacción, el sodio se mantiene en la
superficie.
C5H11OH + H2SO4 + Na ( C5H11-SO4HNa +
H2O
7. Alcohol amílico mas H2SO4 mas
agua.
Es un poco soluble en el agua. Se torna viscosa la
composición.
8. Alcohol isoamilico mas H2SO4 mas
agua.
El H2SO4 se va en la parte baja de tubo de ensayo y al
agitarlo se forman burbujas que haciende a la superficie del tubo
de ensayo. Es más soluble en agua.
9. Alcohol amílico mas H2SO4 mas agua
y Na.
El sodio se evapora lentamente, el agua se encuentra en
la parte baja y es menos soluble en el agua. En esta
reacción se libera hidrogeno.
10. Alcohol isoamilico mas H2SO4 mas agua y
Na.
El sodio se evapora, el agua se encuentra en la parte
baja del tubo de ensayo, también libera hidrogeno.
Reacciona rápidamente que el alcohol
amílico.
OBSERVACIONES A LA
PRÁCTICA
a. En la práctica realizada del alcohol
amílico y el alcohol isoamilico observamos que el
compuesto orgánico a la que pertenece estos alcoholes
no llegan a unirse o combinarse bien con el agua.b. El sodio metálico al contacto con el
agua es muy volátil, ya que puede explosionar si lo
echamos en grandes proporciones el sodio.c. El sodio con el ácido
sulfúrico (H2SO4) no es muy volátil y su
reacción es un poco lenta.d. Siempre cuando echábamos agua en el
alcohol amílico, el agua se depositaba en la parte
baja del tubo de ensayo.
Conclusiones
a. En esta práctica las reacciones que
hicimos en el laboratorio arrojaron que el alcohol
amílico no se pueden unir o juntar con el agua ya que
presentan distintas densidades y por eso no son tan
hidrofilicos.b. También no llegan a juntar
fácilmente con el ácido sulfúrico, tal
vez porque el ácido sulfúrico es un compuesto
inorgánico y los alcoholes son
orgánicos.c. El alcohol isoamilico es más soluble
en agua que el alcohol amílico.
Recomendaciones
a. Es recomendable el uso obligatorio de los
guardapolvos, ya que podemos estar expuestos a salpicaduras
de reactivos en nuestras vestimentas, por eso el ingeniero de
turno tiene que exigir al alumno si en caso contrario el
alumno no lo trae en la siguiente clase de lo dicho por el
ingeniero, tiene todo el derecho de retirarlo de su clase de
práctica.b. Dejar limpio y ordenado el laboratorio
después de la práctica realizada.
Anexos
ANEXOS DE LAS PROPIEDADES
FISICAS
a. Agua más
sodio.
2H2O + 2Na ( 2NaOH + H2
b. Alcohol amílico y
agua.

c. Alcohol isoamilico y
agua.

GRAFICOS DE LAS PROPIEDADES
QUIMICAS
a. Alcohol amílico
más sodio.
2C5H11OH + 2Na ( 2C5H11ONa +
H2
b. Alcohol isoamilico mas
sodio.

2C5H11OH + 2Na ( 2C5H11ONa +
H2
c. Alcohol amílico
más ácido sulfúrico.

C5H11OH + H2SO4 ( C5H11-SO4H +
H2O
d. Alcohol isoamilico
más ácido sulfúrico.

C5H11OH + H2SO4 ( C5H11-SO4H +
H2O
e. Alcohol amílico
más H2SO4 y sodio.

C5H11OH + H2SO4 + Na ( C5H11-SO4HNa +
H2O
f. Alcohol isoamilico mas H2SO4
y sodio.

C5H11OH + H2SO4 + Na ( C5H11-SO4HNa +
H2O
g. Alcohol amílico
más H2SO4 y agua. Alcohol isoamilico H2SO4 y
agua.
h. Alcohol isoamilico H2SO4 y
agua.
Bibliografía
Www. Buenas tareas.com
Www.jolecloud.com
Www.proyectofiona.com
Http://www.bu.edu/es/labsafety/esmsdss/msacetic.html
Http://www.cytec.com
Diccionario de química y de productos
químicos. Gessner g. Hawley.
Http://www.UNCQUIMICA.COM
Autor:
Mendoza Ventura, Anderson
INFORME Nº 02
A: Mg. BLAS ARAUCO, ANTONIO
FECHA: 08 al 15 de mayo del 2013










