- Definición de
isómero - Isómeros
estructurales - Isómeros geométricos
(cis/trans) - Diastereroisómeros
- Enantiómeros
- Moléculas con varios centros
quirales - Actividad Óptica
- Mezcla
racémica y forma meso - Estereoquímica de las
reacciones - Separación de
enantiómeros
Definición
de isómero
Se llaman isómeros a aquellas
moléculas que poseen la misma fórmula molecular
pero diferente estructura. Se clasifican en isómeros
estructurales y estereoisómeros.
Isómeros
estructurales
Los isómeros estructurales difieren
en la forma de unir los átomos y a su vez se clasifican en
isómeros de cadena de posición y de
función.
Isómeros
estructurales
Definición de
isómeros
Se llaman isómeros a
moléculas que tienen la misma formula molecular pero
distinta estructura. Se clasifican en isómeros de cadena,
posición y función.
Isómeros de cadena

Se distinguen por la diferente estructura
de las cadenas carbonadas. Un ejemplo de este tipo de
isómeros son el butano y el 2-metilpropano.
Isómeros de
posición

El grupo funcional ocupa una
posición diferente en cada isómero. El 2-pentanol y
el 3-pentanol son isómeros de posición.
Isómeros de
función

El grupo funcional es diferente. El
2-butanol y el dietil éter presentan la misma
fórmula molecular, pero pertenecen a familias diferentes
–alcohol y éter- por ello se clasifican como
isómeros de función.
Isómeros
geométricos (cis/trans)
Isomería cis/trans
Son compuestos que difieren en la
disposición espacial de sus grupos. Se llaman cis los
isómeros geométricos que tienen los grupos al mismo
lado y trans los que lo tienen a lados opuestos.
cis y trans-2-Buteno
Isómeros cis y trans del
2-Buteno

Modelos moleculares del cis y
trans-2-buteno.

cis y
trans-1,2-Dimetilciclopentano
Isómeros cis y trans del
1,2-Dimetilciclopentano

Modelos moleculares del cis y
trans-1,2-Dimetilciclopentano.

Estereoisómeros
Los estereoisómeros tienen todos los
enlaces idénticos y se diferencian por la
disposición espacial de los grupos. Se clasifican en
isómeros cis – trans o geométricos,
enantiómeros y diastereoisómeros.
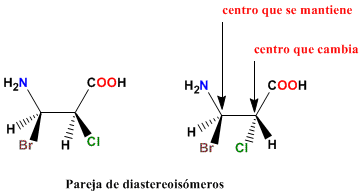
Diastereroisómeros
Definición de
Diastereoisómeros
Son moléculas que se diferencian por
la disposición espacial de los grupos, pero que no son
imágenes especulares. Un tipo de diastereoisómeros
son los isómeros geométricos (alquenos cis y
trans). Para que dos moléculas sean
diastereoisómeros es necesario que al menos tengan dos
centros quirales. En uno de los centros los sustituyentes
están dispuestos igual en ambas moléculas y en el
otro deben cambiar.
Pareja de
diastereoisómeros

Centro quiral o
asimétrico
Se llama centro quiral o asimétrico
a un átomo unido a cuatro sustituyentes diferentes. Una
molécula que posee un centro quiral tiene una imagen
especular no superponible con ella, denominada
enantiómero.
Enantiómeros
Definición de
Enantiómeros
Los enantiómeros son imágenes
especulares no superponibles. Se caracterizan por poseer un
átomo unido a cuatro grupos distintos llamado
asimétrico o quiral.
Nomenclatura de
enantiómeros
Reglas para nombrar
enantiómeros
Para dar notación R/S a un centro
quiral es necesario asignar prioridades a los sustituyentes
mediante las siguientes reglas:
Regla 1
Las prioridades de los átomos unidos
al quiral se dan por números atómicos. En el caso
de isótopos, tiene prioridad el de mayor masa
atómica.

Las prioridades se dan por orden de
número atómico de los átomos unidos
directamente al carbono asimétrico (dibujados en
rojo)
Regla 2
Cuando dos o más sustituyentes
unidos al centro quiral tengan la misma prioridad, se continua
comparando las cadenas átomo a átomo hasta
encontrar un punto de diferencia.
Regla 3

Los enlaces dobles y triples se desdoblan
considerándolos como si fueran enlaces
sencillos.

Para asignar notación R/S seguimos
el orden de prioridades a, b, c de los sustituyentes. Si esta
sucesión se realiza en el sentido de las agujas del reloj
se dice que el centro es R (rectus, latín derecha). Si se
sigue el sentido contrario a las agujas al recorrer las
prioridades a, b, c se dice que es S (sinester, latín
izquierda). Esta regla sólo es válida cuando el
grupo d está hacia el fondo del plano (enlace a trazos),
si d sale hacia nosotros (cuña) la notación es la
contraria (R giro a la izquierda, S giro a la
derecha).

Ejemplo de enantiómeros: (R) y
(S)-1-Bromo-1-cloroetano
En los modelos moleculares puede verse que
las dos moléculas son distintas, no se
superponen.


La presencia de un carbono
asimétrico (con sustituyentes distintos: metilo,
hidrógeno, cloro y bromo)
hace posible que la molécula y su
imagen especular sean distintas.
Ejemplo de enantiómeros: (R) y
(S)-Alanina
La (R) y (S)-Alanina son otro ejemplo de
enantiómeros


Moléculas
con varios centros quirales
Máximo número de
estereoisómeos
El número máximo de
estereoisómeros que presenta una molécula puede
calcularse con la fórmula (2n), donde n representa el
número de carbonos asimétricos. Así una
molécula con 2 centros quirales presenta 4
estereoisómeros.
Estereoisómeros de
2-Bromo-3-clorobutano

Estereoisómeros de
1,2-Dimetilciclohexano

Actividad óptica
Los enantiómeros poseen casi todas
las propiedades físicas idénticas, con la
excepción de la actividad óptica. Uno de los
enantiómeros produce rotación de la luz polarizada
a la derecha (dextrógiro) y el otro rota la luz polarizada
a la izquierda (levógiro).
Actividad
Óptica
Los enantiómeros y la actividad
óptica
Los enantiómeros presentan
propiedades físicas idénticas, con la
excepción de su comportamiento frente a la luz polarizada.
Un enantiómero gira el plano de la luz polarizada en el
sentido de las agujas del reloj, es dextrógiro (+). El
otro enantiómero provoca rotación en el sentido
contrario al de las agujas del reloj, es levógiro (-).
Este fenómeno asociado a sustancias quirales se conoce
como actividad óptica.
Medida de la rotación de la
luz
La rotación óptica se mide
con un polarímetro que consta de de una fuente de luz, un
polarizador del que sale luz oscilando en un único plano,
la cubeta que contiene el enantiómero y un analizador que
permite medir la rotación de la luz.

Imagen tomada de Carey, Química
Orgánica
Rotación óptica observada
y específica
La rotación medida en el
polarímetro se llama rotación óptica
observada y se representa por a. Su valor depende de numerosas
variables como temperatura, longitud de onda,
concentración, disolvente y tipo de sustancia. Para evitar
estas dependencias se define la rotación óptica
específica [a].

Exceso enantiomérico o pureza
óptica
Cuando mezclamos dos enantiómeros en
igual proporción la rotación óptica es nula
[a]=0, se compensa la rotación del dextrógiro con
la del levógiro (mezcla racémica). Si mezclamos
enantiómeros en distinta proporción se puede
calcular la rotación óptica mediante el exceso
enantiomérico o pureza óptica, que representa el
porcentaje de enantiómero que provoca la rotación
de luz.

Mezcla
racémica y forma meso
Mezcla racémica
Mezcla equimolar de enantiómeros
(50%R, 50%S). Uno de los enantiómeros de la mezcla gira el
plano de polarización de la luz el mismo ángulo
pero en sentido contrario que el otro enantiómero, de ello
se deduce que la mezcla en igual proporción de ambos
enantiómeros no muestra rotación óptica y es
por tanto ópticamente inactiva.
Forma meso
Molécula aquiral debido a la
presencia de un elemento de simetría (plano, centro de
inversión o eje impropio).

Aunque las formas meso presentan carbonos
asimétricos, el plano de simetría elimina su
quiralidad y por tanto su capacidad para rotar la luz
Estereoquímica en
reacciones
Las reacciones de halogenación
radicalaria sobre moléculas en las que puedan formarse
centros quirales producen mezclas de enantiómeros en igual
cantidad o de diastereoisómeros en distinta
proporción.
Estereoquímica de las
reacciones
Formación de
estereoisómeros
Vamos a ver como las reacciones
químicas pueden introducir quiralidad en las
moléculas, obteniéndose productos en forma de
mezclas racémicas o bien mezclas de
diastereoisómeros.
Halogenación del butano en
C2

El mecanismo de esta reacción consta
de tres etapas: iniciación, propagación y
terminación. La propagación es la etapa que
determina la estereoquímica del producto final.

El producto se obtiene como mezcla
racémica, debido a la formación de un radical plano
que es halogenado por las dos caras. Los hidrógenos
enantiotópicos son químicamente equivalentes y el
bromo los sustrae con la misma velocidad.
El radical generado es plano y los
lóbulos son atacados con igual probabilidad por el bromo
molecular, lo que produce 2-bromobutano
racémico.
Halogenación del
(S)-2-Clorobutano en C3
La reacción de halogenación
con bromo del(S)-2-Clorobutano sobre el carbono C3 tiene el
siguiente forma:

Las etapas de propagación que
determinan la estereoquímica del producto formado
son:

La halogenación de la
posición C3 conduce a diastereoisómeros. Las caras
del radical formado no son equivalentes y son atacadas a distinta
velocidad por la molécula de bromo. Se denominan caras
diastereotópicas y los hidrógenos que sustrae el
bromo: hidrógenos diastereotópicos.
Separación de
enantiómeros
Los enantiómeros tienen casi todas
las propiedades físicas iguales, difieren en la
rotación de la luz polarizada, pero poseen el mismo punto
de fusión y ebullición e idéntica
solubilidad. Por tanto, no les podemos aplicar los metodos
tradicionales de separación y hay que recurrir a
técnicas especiales. La separación vía
diastereoisómeros, consiste en transformar la mezcla de
enantiomeros en mezcla de diastereoisómeros por
adición de un reactivo quiral, los
diastereoisómeros son fácilmente separables por
métodos físicos.
Separación
de enantiómeros
Dificultades en la separación de
racematos
Los enantiómeros tienen casi todas
las propiedades físicas iguales, puntos de fusión,
ebullición, solubilidad. Tan sólo se diferencian en
la rotación de la luz polarizada, el dextrógiro
rota a la derecha y el levógiro a la izquierda. Por tanto
la separación de enantiómeros no puede realizarse
por los métodos físicos convencionales
(destilación, cristalización…..). La
solución al problema se basa en la diferencia entre las
propiedades físicas de los diastereoisómeros, los
cuales si poseen puntos de fusión, ebullición y
solubilidades diferentes que permiten separarlos.
Separación via
diastereoisómeros
Vamos a buscar una reacción que
convierta la mezcla racémica en una mezcla de
diastereoisómeros, por unión de cada
enantiómero a un reactivo quiral. Esta mezcla se separa
por cristalización fraccionada, destilación o
cromatografía de los diastereoisómeros. Para
finalizar se rompe el enlace que une cada enantiómero con
el reactivo quiral y se separan ambos, obteniéndose los
enantiómeros puros.
(R)-Propranolol
Los enantiómeros R y S del
Propranolol actúan de modo muy diferente en el organismo.
Así, el (R)- propranolol se emplea como anticonceptivo,
mientras que el (S)-propranolol es un antidepresivo.

(S)-Propranolol
Antihipertensivo, ß-bloqueador.
Indicado para tratar la hipertensión arterial, arritmias
cardiacas, arritmia e intoxicación digitálica,
prevención del infarto de miocardio.

Pareja de
enantiómeros
Los enantiómeros son imágenes
especulares no superponibles. La rotación de la primera
molécula no permite superponerla a su imagen
especular.

Autor:
Javier Santos