Es un compuesto inorgánico que fue descubierto
por Finholt, Bond y Schlesinger en 1947, se utiliza como agente
reductor en síntesis orgánica, especialmente para
la reducción de los ésteres, ácidos
carboxílicos y amidas. El sólido es peligrosamente
reactivo hacia el agua, liberando gas de hidrógeno (H2).
El hidruro de litio y aluminio, fue preparado por primera vez, de
la reacción entre el hidruro de litio (LiH) y cloruro de
aluminio: 4 LiH + AlCl3 ? LiAlH4 + 3 LiCl. El Hidruro de Litio y
Aluminio también puede ser preparado con altos
rendimientos por una reacción de metátesis: NaAlH4
+ LiCl ? 4 LiAlH4 + NaCl
Debido a que casi todos los grupos funcionales, son
afectados por el LiAlH4, el desplazamiento de los
halógenos de las estructuras alquílicas por
hidruros, es directa y fácil para el LiAlH4.


También, en las mismas condiciones de
reacción, se produce una reducción parcial de los
bis(trifluorometil) arenos, como lo demuestran K. Fuchibe, Y.
Ohshima, K. Mitomi, T. Akiyama, en el Org. Lett.,
2007, 9, 1497-1499.
Reducción de haluros de arilo
En cambio, en los haluros de arilo, |
|
Reducción con NaBH4.
El borohidruro de sodio, descubierto en la década
de 1940 por H. Schlesinger, es un compuesto inorgánico que
se presenta en forma de polvo blanco. Es un agente reductor
moderado muy utilizado a escala de laboratorio, insoluble en
éter y soluble en alcohol y dimetoxietano (glyme o glicol
de dimetoxietano). El borohidruro de sodio es preparado por dos
rutas de importancia industrial. En uno de los métodos, el
hidruro de sodio se trata con trimetil borato a 250 – 270
ºC.

El NaBH4 puede recristalizarse por disolución en
agua tibia (50 ° C) seguido de un enfriamiento de la
solución; mayormente se utiliza en el laboratorio para la
conversión de cetonas y aldehídos a alcoholes y
también reducir los cloruros de acilo y ésteres
tiol. A diferencia del LiAlH4 el borohidruro de sodio, no reduce
ésteres, amidas, ácidos carboxílicos,
haluros de alquilo, nitrilos, nitroderivados, oximas,
epóxidos, tosilatos y acetilalcoholes.
NaBH4/DMSO. Por otra parte, en solventes
apróticos, los haluros aromáticos se reducen
cuantitativamente en presencia de muchos otros grupos
funcionales, tales como hidroximetil, fenol, éster,
ciano y grupos amino.

Reducción selectiva con NaBH4-ACVA.
Roopa Rai y David Collum B., constataron que el NaBH4
conjuntamente una base de dialquilestaño soluble y el
4,4'-azobis (ácido 4-cyanovaleric) (ACVA),
producían el alejamiento de los bromuros de las
estructuras orgánicas, al mismo tiempo que se
producían ciclaciones intramoleculares.
Por otro lado, los bromuros de arilo se reducen a
velocidades menores y no existe la ciclación en
condiciones libres de estaño utilizando simplemente
NaBH4-ACVA.


Tabla Nº 11. Reducción de aril y alquil
bromuros por NaBH4 – ACVA acuoso
Reducción selectiva con BER y
Ni(AcO)2.
Aunque la reducción de los halogenuros de alquilo
es fácil de llevar a cabo por LiAlH4 y LiEt3BH. Nung Min
Yoon (1996) encontró que el NaBH4 y NaBH3CN en disolventes
polares apróticos tienen ventajas sobre los hidruros
fuertes ya que muestran una mayor selectividad hacia otros grupos
reducibles en el mismo. Min, reportó que el sistema
reductor formado por el polímero BER junto al Ni2B en
metanol es un excelente reductor selectivo, tanto para haluros
alifáticos y aromáticos. Así, los bromuros y
yoduros primarios se reducen cuantitativamente en 3 horas a
temperatura ambiente usando BER (5 eq) y Ni(AcO)2, (0,1
eq).
Esto es notable ya que en una típica SN2 |
| |
Sin embargo, el bromuro de ciclohexilo y yoduro de
ciclohexilo se reducen casi al mismo ritmo, e incluso el bromuro
terciario, 3-bromo-3-metilpentano, se reduce cuantitativamente en
3 horas utilizando una mayor cantidad de BER y Ni
(AcO)2.
Reducción radicalaria, con reactivos
orgánicos de estaño. (Laboratorie de
Synthese Organique. UCO2M. UMR, CNRS 6011, UNiversité
du Maine, 2009)
Los reactivos orgánicos iónicos de |
|
En cierto modo, una variedad amplia de halogenuros de
alquilo y arilo se podrían reducir con rendimientos
excelentes y de forma selectiva, para producir los productos
deseados con un simple procedimiento de trabajo, como puede verse
en el esquema anterior.
Cloruro de Trietilsilano-indio (III) como sistema
reductor.
El mecanismo que se indica, muestra la gama de
posibilidades de reducción de haluros de alquilo y arilo.
N. Hayashi, I. Shibata, A. Baba, Org. Lett.,
2004, 6, 4981-4983.

Reducción con Dimetilformamida (DMF)/Pd.
(Anna Maria Zawiszaa y Jacques Muzart). Los halogenuros de
arilo, pueden ser reducidos con dimetilformamida (DMF) como la
fuente de hidruro en soluciones básicas y catalizadas por
Pd metálico o sales de Pd (II). Lamentablemente, pese a
los rendimientos altos, la deshalogenación de los bromuros
de arilo, va acompañada por la reacción secundaria
de acoplamiento de la molécula.

Como era de esperar, los bromuros se reducen más
rápidamente que los cloruros y la reacción requiere
el uso de menos catalizador. Los bromuros pueden ser
selectivamente reducidos en presencia de otros grupos como el
nitro, cloro, ciano, cetonas, o ácido carboxílico
(A. Ramanathan, L.S. Jimenez. Synthesis, 2010, 217 –
220).
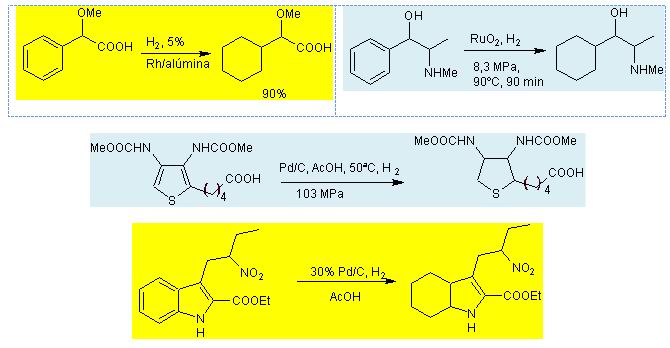
2.5. Reducción de arenos
La reducción del anillo bencénico,
requiere condiciones extremas de presión para poder
adicionar hidruros. Sin embargo se han estudiado alternativas,
que proponen la reducción del anillo bencénico por
sistemas mucho más asequibles para el trabajo en un
laboratorio.
En los siguientes ejemplos, podrá evaluarse las
alternativas diversas que se han generado, para adicionar iones
hidruro en el anillo bencénico de un areno, buscando no
afectar a otros sustituyentes presentes en la
molécula.

2.6. Reducción de Alcoholes
Existen muchos agentes reductores que permiten reducir
los alcoholes, por tal razón se hace imprescindible
conocer los alcances de estos reductores y la acción que
presentan sobre el resto de grupos funcionales, así como
la selectividad de los mismos.
Reducción indirecta de
alcoholes.
En general, una forma indirecta de remover los –OH
de los alcoholes, pasa por una primera etapa de
deshidratación del alcohol, seguido de una
hidrogenación catalítica. Ejem.

Reducción directa de
alcoholes.
Existen varios procedimientos selectivos, para reducir
directamente los alcoholes primarios, secundarios y terciarios al
alcano correspondiente.
Reducción con Silanos. Los silanos son
buenos agentes reductores y son utilizados para retirar el
grupo –OH de los alcoholes y formar alcanos en presencia
de ácidos de Lewis fuertes; los ácidos de
Bronsted generalmente originan reordenamientos del esqueleto
carbonado. Los silanos pueden ser donantes del radical H., para
lo cual se utilizan en la reacción, iniciadores de
radicales, o por el contrario pueden ser donantes de hidruros y
propiciar una sustitución nucleofílica en el
sustrato. Los alcoholes primarios requieren un exceso del
silano correspondiente.
La gama de compuestos silanos que se utilizan como
agentes reductores, se extiende desde los alquilsilanos simples
(EtSiH3), pasando sobre diferentes fenilsilanos, como PhSiH3 y
silanos halogenados (tales como triclorosilanos), hasta arribar a
los tris(trimetilsilil)silanos.
. Sustituciones
nucleofílicas:
El agente reductor es uno de los silanos generador de
hidruros
(Trietilsilanos: (Et3SiH).

Los alcoholes alílicos pueden ser desoxigenados
preferentemente en presencia de alcoholes secundarios y
terciarios, cuando se utiliza perclorato de litio como
catalizador en solución etérea.

La hidrogenólisis de alcoholes bencílicos
utilizando Et3SiH y una cantidad catalítica de paladio
(II) (Cloruro de paladio), tiene lugar en condiciones suaves,
tiempos cortos y altos rendimientos del producto.
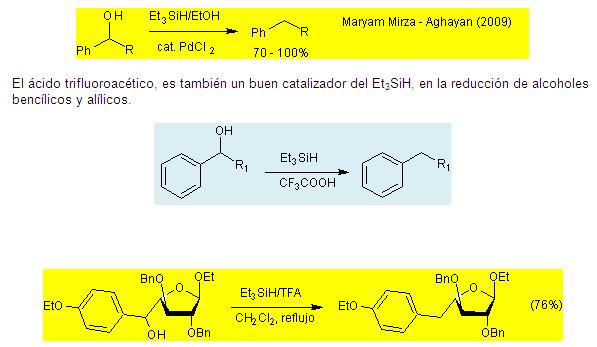
(Clorodifenilsilanos (Ph2SiHCl). Este reactivo en
presencia catalítica de InCl3, genera hidruros y muestra
una alta quimioselectividad en la reducción de alcoholes
bencílicos, alcoholes secundarios y alcoholes terciarios,
mientras que no reduce alcoholes primarios y a los grupos
funcionales que son fácilmente reducidos por los
métodos normales, tales como ésteres, bromo, cloro
y los grupos nitro. (M. Yasuda y colb. A.J. Org. Chem
2011, 7741 – 7744).

( Reducción con Trimetilsilil yoduro
(TIS). Debido a que el Me3SiI (TIS) es relativamente caro y
muy sensible a la luz, aire y humedad, usualmente es preparado
in situ a partir del trimetilsilil cloruro (TCS)
y NaI en acetonitrilo u otros solventes como el CH2Cl2, DMF,
benceno o hexano.

Las moléculas hidroxilbencílicas y el
alcohol bencílico mismo, son convertidas en yoduro de
bencilo y HMDS, si la reacción ocurre en cantidades
equimolares. Sin embargo un exceso del TIS, permite retirar el
–OH y sustituirlo por H.

Los alcoholes terciarios también pueden ser
hidrogenados y desplazar el –OH, con
ácido
trifluoroacético en |
|
La reducción de Mitsunobu. Más
conocida como la reacción de desplazamiento de
Mitsunobu de un alcohol con o-nitrobencensulfonilhidrazina,
seguido de la eliminación in situ del
ácido o-nitro bencensulfinico, genera diazenos
monoalquílicos, que se descomponen por un mecanismo de
radicales libres para formar productos desoxigenados (A. G.
Myers, M. Movassaghi, B. Zheng, J. Am. Chem. Soc.,
1997, 119, 8572-8573).

Tabla. No. 10. Reducción directa de
alcohol por Mitsunobu
La reacción es compatible con varios otros
grupos funcionales, como puede verificarse en los ejemplos
reportados:
El mecanismo de la |
| ||
2.7. Reducción de compuestos
sulfónicos
2.7.1. Reducción con ácido 3-mercapto
propiónico y NBS o I2/MeCN
Varios alquil y aril sulfóxidos han sido
exitosamente desoxigenados con ácido 3-mercapto
propiónico como agente reductor y una cantidad
catalítica del N-Bromosuccinimida (NBS) ó iodo
(I2 ) en MeCN a temperatura ambiente.

Tabla Nº 11.
Reducción de compuestos sulfónicos a
sulfuros
Reducción de alquil, vinil y sulfonatos con
el sistema CuCl2·2H2O-Li-DTBB(cat) (G. Radivoy*, F.
Alonso, Y. Moglie, C. Vitale and M. Yus Tetrahedron,
2005, 61, 3859-3864)
La reducción de una serie de alquil sulfonatos al
correspondiente hidrocarbono ha sido eficientemente trabajado
usando un sistema reductor compuesto por CuCl2.2H2O y un
exceso de sal de litio y una cantidad catalítica de
4,4" –di-tert-butilfenil (DTBB) en tetrahidrofurano a
temperatura ambinete. El proceso es también posible
aplicarlo al enol y dienol de triflates formando alquenos y
dienos respectivamente.

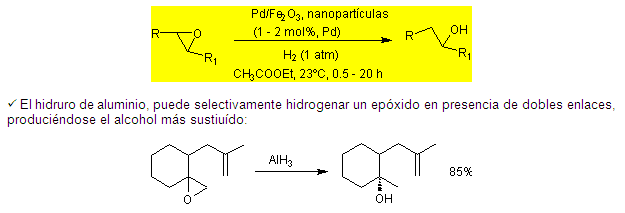
2.8. Reducción de Epóxidos
( El catalizador de paladio magnético, es muy
activo y selectivo para la hidrogenólisis de
epóxidos a temperatura ambiente. La fuente de
hidrógeno es el H2 gaseoso a 1 atm de
presión.
El catalizador puede ser reciclado sin
pérdida de actividad, se prepara a través de un
proceso sol-gel de la incorporación de
nanopartículas de paladio y nanopartículas de
óxido de hierro superparamagnético en la matriz
de hidróxido de aluminio. (M. S. Kwon, I. S. Park, J.
S. Jang, J. S. Lee, J. Park, Org. Lett.,
2007, 9, 3417-3419).
2.9. Reducción de Aldehídos y
cetonas
Reducción del C=O de aldehídos y
cetonas a alcohol
La reducción de carbonilos de
aldehídos y cetonas a alcoholes, es una de las
transformaciones simples más importantes, que
regularmente se efectúa con NaBH4 y LiAlH4 a partir de
la década de los 40.
El primero es un reductor suave y el segundo, es uno
de los más potentes reductores y consiguientemente su
accionar no es selectivo, razón por la cual se han
estudiado entre estos extremos, diversos agentes reductores
en medio acuoso y en solventes orgánicos que puedan
ser utilizados con mayor selectividad, en función de
los grupos presentes en la molécula orgánica,
donde se desea realizar una reducción.
Reducción con LiAlH4 o NaBH4. Como
se tiene dicho, dos fuentes prácticas de la
reactividad de hidruros, son los complejos
metálicos: hidruro de litio y aluminio (LiAlH4) y
borohidruro de sodio (NaBH4).
Ambos son blancos (o casi blanco) sólidos,
que son preparados a partir de hidruros de litio o de sodio
por la reacción con haluros de aluminio o boro y
ésteres.
El hidruro de litio y aluminio es de lejos el
más reactivo de los dos compuestos, reaccionando
violentamente con el agua, alcoholes y otros grupos
ácidos con la evolución de gas
hidrógeno.

Algunos ejemplos de la reducción de
aldehídos y cetonas, utilizando los reactivos
descritos anteriormente, se presentan a
continuación:
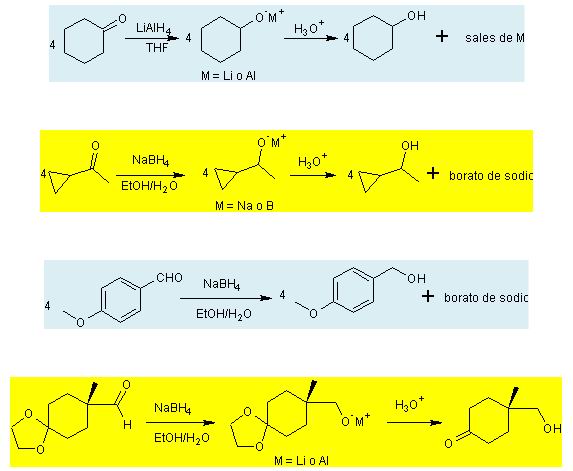
Las primeras tres reacciones muestran la
estequiometría de la reacción y el
último ejemplo, muestra la resistencia de los acetales
cíclicos al LiAlH4, aspecto que muchas veces se
utiliza como método de protección de una parte
de la molécula mientras en otra actúa el
reductor.
Reducción con cianoborohidruro de sodio
NaBH3CN. De una excelente revisión de la
selectividad del cianoborohidruro de sodio, efectuada por
Clinton F. Lane (1974), se tomará la correspondiente
a la reducción selectiva de aldehídos y
cetonas por este versátil agente reductor. El
cianoborohidruro de sodio es altamente soluble en una
variedad de solventes como el agua, alcoholes, aminas y
THF, pero es insoluble en hidrocarburos.
Uno de los métodos de preparación de
este agente reductor, se lo efectúa de acuerdo a la
siguiente reacción:

Tabla No. 13. Reducción de
aldehídos y cetonas con NaBH3CN
Por ejemplo, se ha observado la reducción
selectiva mucho más rápida que la de un grupo
carbonilo de aldehídos o cetonas, en estructuras que a
su vez pueden tener otros grupos que han demostrado ser
inertes a la acción del reactivo, como por ejemplo:
amidas, éteres, lactonas, nitrilos, nitrocompuestos y
epóxidos.
En condiciones neutras en agua o metanol hay
una reducción insignificante de aldehídos y
cetonas. Sin embargo, a un pH 3-4, el porcentaje de
reducción es suficientemente alto y rápido para
ser sintéticamente útil. Dado que la
reducción consume ácido, se requiere de un
sistema amortiguador o se requiere agregar ácido para
mantener el pH bajo.

Al cambiar el catión y el disolvente es
posible llevar a cabo una reducción aún
más selectiva. Por lo tanto, el cianoborohidruro
tetrabutilamonio en triamida acidificada con ác.
Hexametilfosfórico, reduce selectivamente
aldehídos en presencia de casi todos los demás
grupos funcionales que incluyen ciano, éster, amida,
nitro, e incluso cetonas.
Los aldehídos y cetonas alifáticas,
pueden ser también desoxigenados al correspondiente
grupo metileno, con el cianoborohidruro de sodio, para ello
aldehídos y cetonas deben previamente ser trasformados
en las tosilhidrazonas y éstas que contienen el enlace
imínico son las que verdaderamente se reducen. El
medio de reacción es una mezcla (1:1) dimetilformamida
/sulfolano. Este nuevo procedimiento selectivo, que requiere
de condiciones suaves y de alto rendimiento, se constituye en
una alternativa superior a las reducciones de Wolff-Kishner y
de Clemmensen.
La preparación previa de la tosilhidrazona es
innecesaria en muchos casos, ya que la lentitud de la
reducción de carbonilo permite la generación
in situ de tosilhidrazina y el compuesto
carbonílico.

Reducción de aldehidos y cetonas con
H2/Complejo de hierro. El complejo de hierro que contiene
acoplados electrónicamente hidrógenos
ácidos, cataliza la hidrogenación de cetonas
en condiciones suaves y muestra quimioselectividad alta de
aldehídos, cetonas, e iminas.
Los enlaces de carbono dobles y |
| |
2.9.1.4. Reducción de aldehídos con
Decaborano (B10H14) (Seung Hwan Lee, Mi Hye Nam y Min
Young Chiol) Japan november 24, 2005.

El Decaborano en medio acuoso y a temperatura
ambiente, presenta una acción quimioselectiva sobre
los aldehídos, para transformarlos en los respectivos
alcoholes. Los grupos nitro, ciano, cetonas, ésteres,
amidas y halógenos no son afectados por el
Decaborano.

Tabla No. 15. Reducción
quimioselectiva de aldehídos
en presencia de cetonas
En conclusión, la reducción de
aldehídos alifáticos y/o aromáticos
usando Decaborano en solución acuosa, con algunas
gotas de THF como solvente y a temperatura ambiente, los
transforma quimioselectivamente al alcohol respectivo con
buenos rendimientos. Tabla No. 15

Tabla No. 16. Acción del
catalizador CeCl3.7H2O/MeOH
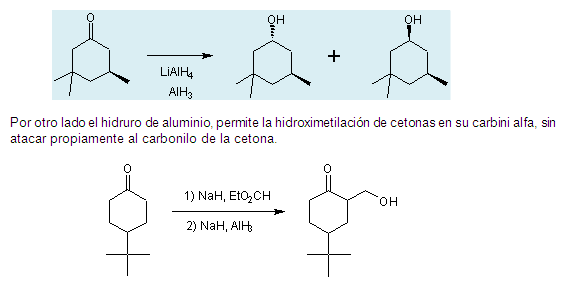
Reduccióm de aldehidos y cetonas con AlH3.
En química orgánica, el hidruro de aluminio
se utiliza principalmente para la reducción de
varios grupos funcionales. En muchos sentidos, la
reactividad del hidruro de aluminio es similar a la del
hidruro de litio y aluminio.
El hidruro de aluminio reduce aldehídos, cetonas,
ácidos carboxílicos, anhídridos,
cloruros ácidos, ésteres y lactonas a sus
correspondientes alcoholes. En cambio las amidas, nitrilos, y
oximas se reducen a sus correspondientes aminas .
En términos de selectividad del AlH3 sobre
los grupos funcionales, éste difiere de otros
reactivos de hidruro. Por ejemplo, en la reducción de
la ciclohexanona el hidruro de litio y aluminio (LiAlH4)
produce alcoholes con estereoquímica trans:cis en
una relación de 1,9:1, mientras que el hidruro de
aluminio da una trans:cis con relación
relación de 7,3: 1
2.9.1.5. Reducción de aldehídos y
cetonas con resinas de intercambio (BER). Estudios
efectuado por Nung Min Yoon, en la República de Corea,
han demostrado que la resina de intercambio BER, es mucho
más eficaz y conveniente reductor que el NaBH4, debido
a que la resina es selectiva para aldehídos aún
en presencia de cetonas, ésteres, amidas, nitrilos,
ácidos carboxílicos, enlaces múltiples
C-C y sulfóxidos.
El BER es un borohidruro de amonio cuaternario, que
se coloca en una resina de intercambio iónico,
Amberlite IRA-400, y es mucho más estable en
disolventes alcohólicos que el borohidruro de
sodio.
Asimismo se observó y comprobó que era
posible otra aplicación del BER, la aminación
reductiva de compuestos de carbonilo. De este modo se
demostró también, que el BER es un reactivo
alternativo bueno para NaBH3CN y el diborano disuelto en
piridina.


2.9.1.6. Reducción de aldehídos y cetonas
con: Dimetilsulfuro Borano y Complejo Borano –
Tetrahidrofurano). El diborano (B2H6), el más
simple de los boranos, es un reactivo útil con muchas
aplicaciones, pero es pirofórico, gaseoso y no
conveniente para su manejo. Existe una amplia gama de boranos
utilizados como agentes reductores.
Complejos de la forma Borano-Ácido de
Lewis, tales como el Borano-tetrahidrofurano (BTHF) y
sulfuro de dimetil borano (BMS, DMSB) se utilizan a menudo
como una fuente de borano para la
reducción.

Ambos reactivos están disponibles en
solución (1 M en THF), y por lo tanto son más
fáciles de manejar que el diborano. Sin embargo la
volatilidad e inflamabilidad son siempre un inconveniente. El
BMS es más estable que BTHF pero tiene un olor
desagradable.
La aplicación más interesante es como
una fuente de borano en el catalizador oxazeborolidina en la
reducción asimétrica de cetonas
(Reducción de Corey-Bakshi-Shibatan). Asimismo es muy
interesante, la reducción directa de ácidos
carboxílicos a alcoholes con (BMS) y amidas a aminas
con (BTHF). La Reducción de Corey-Bakshi-Shibata.
(CBS), es como sigue:

2.9.1.7. Reducción de aldehídos y
cetonas con: Et3SiH, (EtO)2MeSiH. Los silanos en ciertas
condiciones de reacción no actúan sobre
aldehídos, cetonas y ésteres. Pero la gran
versatilidad de los derivados de silano se hace evidente
cuando se modifican estas condiciones de reacción y
los anteriores grupos resultan ser afectados y reducidos al
alcohol correspondiente como se puede observar en los
siguientes ejemplos:

Como los silanos no son tan poderosos donantes de
iones hidruro, a menudo es necesario mejorar el
carácter catiónico del sustrato.
La formación del éter es una variante
interesante de la reducción del carbonilo como se
ilustra en el ejemplo anterior. En ambos casos una gran
variedad de aldehídos y cetonas se han reducido, y el
ácido trifluoroacético es el ácido
preferido para la formación de éter.
2.9.1.8. Reducción de aldehídos y cetonas
con polimetilhidrosiloxano (PMHS). En contraste con la
mayoría de los reactivos silano descritos con
anterioridad, el polimetilhidrosiloxano (PMHS) un subproducto
en la industria de las siliconas y por consiguiente barato,
no es tóxico y es muy amigable con el medio
ambiente.

La ecuación anterior ilustra la
reducción de aldehídos y cetonas empleando
ión fluoruro como activante de las especies (TBAF).
Estas reducciones se pueden efectuar también con
fluoruro de potasio en solventes no polares altamente
próticos como DMF y DMSO, sin embargo la
reacción es heterogénea y lenta. Por regla
general, los enlaces doble carbono-carbono, halógenos,
nitrilos y grupos nitro no se reducen en estas
condiciones.
2.9.1.9. Reducción de cetonas con
Difenilmetilsilano (Ph2Me2SH). La reducción
enantioselectiva de cetonas se puede lograr mediante el uso
de cantidades catalíticas de complejos quirales de
metales de transición.
En algunos casos, los metales de transición,
simplemente sirven como un ácido de Lewis, que
coordina al oxígeno de la cetona, sin embargo, algunos
metales (principalmente cobre) reaccionan con
fenilhidrosilanos para dar hidruro de metal como
intermediarios, y son los que actúan como agentes
reductores activos.

En presencia de un catalizador de rodio y
tricloruro de rodio, por ejemplo la 2-fenilciclohexanona, se
reduce sin diastereoselectividad, pero forma una mezcla de
enantiomeros.

2.9.1.10. Reducción de cetonas con hidruro de
cobre (CuH)
Dialquil cetonas. Los diversos procedimientos para
generar CuH in situ, han dado lugar a un método de
hidrosililación eficiente y barato para las cetonas
dialquílicas (B. H. Lipshutz, C. C. Caires, P.
Kuipers, W. Chrisman, Org. Lett., 2003,
5, 3085-3088)

Cetonas Heteroaromáticas. Un complejo formado
entre CuH y mezclas no racémicas de los ligandos de
Takasago (DTBM-SEGPHOS), es un sistema reductor especial
para hidrosililación asimétrica de cetonas
heteroaromáticas en condiciones muy suaves.
Se utiliza el PMHS como una fuente barata de hidruro para
la generación in situ de CuH. (B. H.
Lipshutz, A. Lower, K. Noson, Org. Lett.,
2002, 4, 4045-4048).

Cetonas diarílicas. El uso del ligando de
Takasago (R)-(-)-(DTBM-SEGPHOS) CuH presenta efectos
altamente enantioselectivos en la
1,2-hidrosililación de compuestos proquirales diaril
cetónicos, para producir mezcla no racémicas
de diarilmetanoles con excelentes rendimientos. C.-T. Lee,
B. H. Lipshutz, Org. Lett. 2008,
10, 4187-4190.

Cetonas a,ß–insaturadas. El uso de ligandes
asimétricos en la catálisis de la
reducción de cetonas a, ß–insaturadas
con CuH, permite la síntesis de alcoholes
alílicos con muy buenos rendimientos. (R. Moser,
Ž. V. Boškovic, C. S. Crowe, B. H. Lipshutz,
J. Am. Chem. Soc., 2010, 132,
7852-7853).

2.9.1.11. Reducción de cetonas
aromáticas con Triclorosilano (Cl3SH). Las
arilcetonas son reducidas a los correspondientes alcoholes
con excelente enantioselectividad por el Triclorosilano en
presencia de una cantidad catalítica de
N-formil-á-(2,4,6–trietilfenil)-L-prolina, que
actúa en la reacción química como
activador del sustrato.


Tabla No. 17. Reducción de
cetonas con Triclorosilano
En la misma publicación, se reporta para
algunas cetonas aromáticas estudiadas, los
rendimientos que se indican en la tabla 17.
2.9.1.12. Reducción de cetonas
alifáticas y acilsilanos, con 2,4-antipentanodiol y
ác. 2,4-dinitro bencensulfónico. Las
cetonas y los acilsilanos alifáticos, pueden ser
reducidos asimétricamente al alcohol, utilizando una
mezcla del quiral 2,4. Antipentanodiol y una cantidad
catalítica de ácido
2,4-dinitrobencensulfónico. (Jun-ichi Matsuo,
YuHattori, Mio Hashizune and Hiroyuki Ishibashi)
(2010).

2.9.1.13. Reducción quimioselectiva, de
aldehídos y cetonas aromáticas nitradas con
TUDO. Los aldehídos y cetonas aromáticas
nitradas, pueden ser reducidos al respectivo alcohol
quimioselectivamente, sin afectar al grupo –NO2, con
buenos rendimientos, utilizando para ello dióxido de
tioúrea (TUDO), en NaOH-EtOH y un calentamiento
moderado.

Sin embargo, en presencia de una fuente de protones,
el dímero se desproporciona formando un
alcóxido de samario y un compuesto de carbonilo, que
por protonación forma un carbinol (II) radical,
seguido de una segunda reducción y posterior
protonación, produciendo finalmente un
alcohol.

Eterificación reductiva de cetonas. Las
cetonas, pueden reducirse a través de un proceso de
eterificación, reaccionando con un alcohol
alifático en un ambiente de hidrógeno
molecular a la presión de un bar, catalizado por un
catalizador heterogéneo de Pt/C.
Los rendimientos son aceptables y |
| |
Acoplamientos reductivos de aldehidos.
Estos acoplamiento conocidos como el Nozaki-Hiyama o
de Nozaki-Hiyama-Kishi, se produce entre haluros y
aldehídos es una reacción redox inducida por el
cromo. Una ventaja clave es la alta
quimioselectividad hacia los aldehídos. Una
desventaja es el uso de exceso de sales de cromo
tóxico. Los nuevos métodos permiten el uso de
catalizadores de cromo (II), que se regenera por
reducción con manganeso o por reducción
electroquímica.

2.9.3. Reducción de
cetoésteres
Varios a hidroxi-ésteres
enantioméricamente puros, fueron sintetizados por una
hidrogenación asimétrica catalizada por
(Ru-Cn-Tunephos) de compuestos a-ceto ésteres. Se ha
obtenido un alta rendimiento del enantiómero tanto
para ésteres a-a-arilo y alquilo sustituidos en a con
un grupo ceto. (C.-J. Wang, X. Sun, X. Zhang,
Synlett, 2006, 1169-1172.)

Reducción del C=O de aldehídos y
cetonas a metileno (-CH2)
La reducción del grupo carbonilo de
aldehídos y cetonas de compuestos alifáticos y
en especial aromáticos, al correspondiente metileno,
puede efectuarse por alguno de los siguientes sistemas de
reducción:
Con metales alcalinos en NH3
líquido
Reducción de Clemmensen
Reducción de Wolf Kishner
LiAlH4 – AlCl3
NaBH4 – CF3COOH
Et3SiH – BF3
HI – fosforoso
Hidrogenación catalítica: Pd/C
– FeCl3
Metales alcalinos en NH3 líquido. Se
ha sabido desde principios del pasado siglo que la
reducción de la benzofenona con sodio en amoniaco
líquido permite formar difenilmetanol, como un
intermedio, Hall et. al., han demostrado recientemente que
el carbonilo de aldehídos y cetonas
aromáticas pueden ser reducidos con litio en
amoniaco líquido al correspondiente
metileno.

2.9.4.2. Reducción de Clemmensen. La
reducción de Clemmensen (Erik Clemmensen
1876–1941), excepto algunos casos especiales en la
serie alifática, permite transformar preferentemente
el grupo C=O de aldehídos y cetonas de compuestos
alifáticos y aromáticos, al respectivo metileno
(-CH2).
La reducción de aldehídos |
R o R", debe ser un grupo | |
Esto se debe a que en el mecanismo de
reacción aceptado, se postula la formación de
un intermedio complejo con carga negativa, que será
preferentemente estabilizado por el anillo aromático y
grupos donadores de electrones. Se sobreentiende que el
sustrato debe ser estable a las condiciones ácidas
fuertes del medio en el que se produce la reducción
del grupo carbonilo.
Mecanismo: Se sostiene que la reducción de
Clemmensen ocurre sobre la superficie del catalizador de zinc
amalgamado y no hay un flujo neto de electrones de zinc para
el compuesto carbonílico. Como no existe una
formación de alcohol durante la reacción, este
método no es útil para reducir el alcohol al
alcano.


Existen algunas variantes de la reducción de
Clemmensen que proporcionan alternativas, para el caso donde
en el compuesto estén presentes grupo sensibles a
ácidos y bases, como por ejemplo el grupo ciano
(-CN).
El reductor de Clemmensen, no afecta a dobles
enlaces olefínicos aislado o grupos hidroxilo
aislados, pero los reduce normalmente en primer lugar si
están alfa, conjugados con el grupo C=O.

En los derivados acíclicos, sin
interacción estereoquímica entre las dos
funciones carbonilo, los grupos cetona son independientemente
reducidos para producir metilenos en la forma habitual. En
los sistemas aromáticos y el anillo de benceno posee
grupos desactivantes del mismo para una segunda
sustitución electrofílica, funciones como el
–OH, por ejemplo se sustituyen por cloro, loque no
ocurre con el reductor de Wolff-Kishner:

Reducción de Wolff –
Kishner[3]La reducción de
Wolff-Kishner, es una reacción química
que reduce completamente una cetona (o aldehído)
alifático a un alcano .

El método originalmente involucraba el
calentamiento de la hidracina con etóxido de sodio en
un recipiente sellado a unos 180°C. En cambio, en los
últimos años se han encontrado otras bases
igual o más eficaces. Y como solvente se utiliza el
dietilenglicol (DEG), el DMSO, etc.

La modificación de Huang-Minlon, es
una transformación práctica de la
reducción de Wolff-Kishner y consiste en calentar el
compuesto carbonílico con hidróxido de potasio
e hidracina juntos.
|
|
En general las desventajas de la reducción de
Wolff- Kishner, se las halla en el exceso de Na
metálico requerido, las temperaturas altas de
reacción y los tiempos prolongados de la misma.
Limitaciones que se han ido superando con modificaciones
posteriores a las condiciones de reacción.
Así por ejemplo, la modificación de
Barton (1954), hace de la reducción de
Wolff– Kishner, la más adecuada, cuando se
tienen cetonas con alto impedimento
estérico.


En 1962, Cram et. al. Introducen el uso de
t-Butóxido en DMSO seco, para la reducción
rápida y a temperatura ambiente del C=O a metileno, en
sustratos donde la clásica reducción de Wolff
Kishner produce rendimientos bajos o modestos.

Otra de las modificaciones, que disminuye la
temperatura de trabajo en la reducción de Wolff
Kishner, fue introducida por Henbest y compañeros de
trabajo, haciendo que la hidrazona formada entre el sustrato
(aldehído o cetona) y la hidracina, se someta a
reflujo con t-Butóxido de potasio y tolueno seco a
110ºC.



2.9.5. Hidrogenación y metilación
de aldehídos.
Los aldehidos, pueden ser hidrogenados y metilados
simultáneamente, produciendo un alcano, cuando se
utiliza catalizadores de rodio se obtuenen altos
rendimientos. H. Lebel, C. Ladjel, J. Org. Chem.,
2005, 70, 10159-10161.

2.9.6. Desoxigenación de aldehídos
y cetonas con polimetilhidrosiloxano (PMHS).
Si el PMSH se utiliza acompañado de un
catalizador FeCl3.6H2O, los grupos carbonilo de
aldehído y cetonas se reducen eficientemente al
metileno correspondiente.

Tabla No.18 Reducción de
carbonilos con PMHS
2.9.7. Desoxigenación de aldehídos y
cetonas con NaBH4, LiAlH4
La reducción de aldehídos y cetonas
alifáticas, con los equivalentes adecuados de hidruros
metálicos, produce principalmente alcoholes. Sin
embargo en aldehídos y cetonas aromáticas, con
el carbonilo enlazado al anillo bencénico, en una
primera etapa de adición de hidruros metálicos,
también se forman alcoholes, que por adición de
un poco de exceso del hidruro metálico respectivo, se
abstrae el oxígeno formándose al final el
metileno.
Por esta razón, la reducción de
aldehídos y cetonas con hidruros metálicos
está limitada a aldehídos y cetonas
aromáticas.
La reducción de aldehídos |
|
Del mismo modo la reducción de orto
o para-hidroxi aril cetonas con NaBH4 en una
solución acuosa de NaOH y reflujo, da lugar a la
formación del metileno. Cuando el grupo hidroxilo se
halla en la posición meta, la cetona se transforma
íntegramente el alcohol y no en metileno,



2.10.1. Reducción con NiCl2/Li, y
polímeros.

Tabla No 19 Reducción con NiCl2/Li,
catalizada por polímeros

La reducción con catalizador de Rh, tampoco
es capaz de saturar el doble enlace conjugado con el CO, en
un compuesto endocíclico, en cambio si hidrogena un
alqueno aislado:

2.10.2. Reducción con Na/NH3
líq,
Este sistema de reducción, actúa de
manera selectiva en la saturación del doble enlace de
cetonas a, ß-insaturadas a cetonas
saturadas.

2.10.3. Reducción con
LiAlH4.
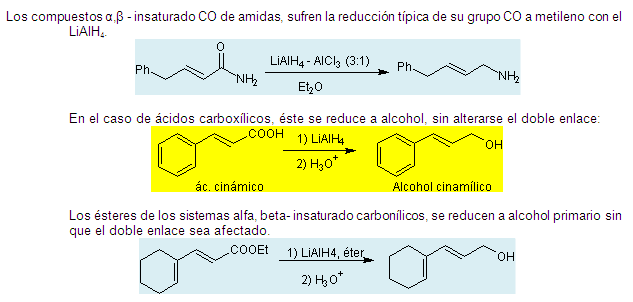
2.10.4. Reducción con NaBH4. Los
grupos carbonilo de aldehídos y cetonas de compuestos
insaturados, se reducen preferentemente a alcoholes si el
reductor se halla disuelto en alcohol, los grupos
éster y carboxílico en estas condiciones no son
afectados por el NaBH4, sin embargo si se agrega como
solvente el THF, los grupos ester serán reducidos a
alcohol primario.

2.10.5. Reducción con
Silanos


Reducción con el éster de
Hantzsch.
Catálisis del TRIP. La hidrogenación
de cetonas a,b–insaturadas conjugadas, se transforma
en un proceso eficiente y altamente enantioselectiva, sin
afectar al grupo C=O. Se utiliza como fuente de
hidrógeno el éster de Hantzsch y como
catalizador una sal a partir de terc-butilo y un
catalizador quiral de ácido fosfórico (TRIP),
introducido recientemente. N. J. A. Martin, B. List, J.
Am. Chem. Soc., 2006, 128,
13368-13369.

Tabla No 20 Productos de reducción
catalizado por TRIP
Catálisis de la imidasolidina.


Tabla Nº 21.
Reducción con éster de Hantzsch catalizada por
la imidasolina
Reducción con
Catecolborano

Por otro lado, también el boro-enolato
intermedio resultante puede reaccionar con
electrófilos para proporcionar productos con diversa
funcionalidad. Esta reacción es compatible con una
variedad de grupos funcionales

Las enonas endocíclicas no son afectadas por
el catecolborano, del mismo modo, las olefinas con
sustituyentes sobre el carbono alfa olefínico, no
serán reducidos.

Tabla Nº 22. Reducción de
sustratos conjugados carbonílicos, con
catecolborano
Reducción regioselectiva de a, ß
– insaturado cetonas y aldehídos.


El tri-sec-butilborohidruro de litio o potasio
(usualmente denominado como L o K- Selectride)
comúnmente producen 1,4 reducción en sustratos
a, ß- insaturado cetocíclicos, pero los
alcoholes alílicos son obtenidos cuando los substratos
lineales son sometidos a la misma reacción.

Otros metales como el estaño, cobre, |
|
2.10.10. Hidrogenación
catalítica:
La regioselectividad en el hidrogenación de
sistemas a,ß??-insaturados, o bien puede ser selectiva
hacia el doble enlace o al grupo carbonilo. Esto depende del
catalizador utilizado, ya que algunos catalizadores son
más selectivos circunscribiéndose a grupos
funcionales específicos.
Hidrogenación del doble enlace conjugado:
Los reactivos más utilizados en la
hidrogenación del doble enlace conjugado con un
carbonilo de cetona, son los siguientes:
Catalizador de Adams. (PtO2)
Platino en carbono (Pt/C)
Paladio en carbono (Pd/C)
Rhodio en carbono (Rh/C)
Níquel – aluminio , 10% NaOH en
carbono (Ni/C)
Cinc – Niquel reducido/H2O
Reductor H2/Pd,C


2.10.10.5. Reducción con hidruro de cobre
(CuH)
Catalizado por el PMHS y el ligando aquiral
bis–fosfina. Un ligando modificado, como lo es la
versión económica del reactivo de Stryker, se
basa en un bidentado, aquiral bis-fosfina. Generado in situ
"(BDP) CuH" sin problemas los efectos conjugados de la
reducción de una variedad de sustratos saturados,
incluyendo aquellos que normalmente no reaccionan a los
reactivos de Stryker. (B. A. Baker, Ž. V.
Boškovic, B. H. Lipshutz, Org. Lett.,
2008, 10, 289-292).

Catalizado por el PMHS y el ligando
R(-)–DTBM-SEGPHOD. Se utiliza cantidades
catalíticas de hidruro de cobre ligado por una
mezcla de ligandos no racémicos como el SEGPHOS,
sobre PMHS, forman in situ una especie extremadamente
reactiva capaz de efectuar hidroxilación
asimétrica de enonas cíclicas conjugadas con
enantioselectividad muy alta. B. H. Lipshutz, J. M.
Servesko, T. B. Petersen, P. P. Papa, A. A. Lover, Org.
Lett., 2004, 6, 1273-1275.

|
|
Reducción de Clemmensen de compuestos a,
ß -insaturado carbonilos[4]Es
necesario destacar que en este tipo de sustratos, la
reducción de Clemmensen presenta algunas
dificultades, debido a que produce dimerización e
isomerización de los mismos y si se trata de
ciclocetonas, puede producirse incluso la
contracción de las mismas.
La reacción puede controlarse variando la
cantidad de HCl y el solvente. Un exceso de HCl (gas) en
Et2O, produce la reducción completa del sustrato y
colocando 3 eq, de HCl (gas) en THF, se produce la
dimerización que no es otra cosa que el acoplamiento
de las cetonas.

Estos casos se los puede observar en el siguiente
ejemplo:

Reducción con LiAlH4/AlCl3. Brewster y
colaboradores han investigado la reducción de a,
ß-insaturado carbonilos con el sistema LiAlH4/AlCl3
(1:3), habiendo constatado que el grupo –C=O en
algunos casos, se reduce a metileno en un 70% y el 30%
restante se isomeriza.

Reducción con HCOOH catalizado por
[(PPh3)2Ru(CH3CN)3Cl][PPh4]. Este catalizador complejo
y el ácido fórmico, forman un sistema
reductor selectivo para la reducción de dobles
enlaces conjugados con el grupo carbonilo de cetonas, con
una alta conversión, donde el ácido
fórmico es el donador de
hidrógeno.

Reducción con PdCl2/Et3SiH. El
sistema cloruro de Paladio(II)/trietilsilano,
también es muy selectivo hacia la
hidrogenación de olefinas en una serie de
compuestos, como puede observarse a
continuación:

Reducción con [(Ph3P)CuH]6. Este nuevo
sistema reductor, reduce compuestos a,
ß–insaturado carbonílicos. Sin embargo
una variación de las condiciones de reacción,
permite formar proporciones distintas de los posibles
productos a formarse.

Otros reductores:


Los alquinoilésteres como
sustratos.
Los ésteres ?-hidroxi-a,
ß-acetilénicos se utilizan como precursores para
la preparación de los ésteres
?-hidroxi-a,ß-alquenoicos, por medio de una
adición trans-selectiva de dos átomos de
hidrógeno o un átomo de hidrógeno y un
átomo de yodo a través del triple
enlace.
Estos métodos permiten la preparación
de ésteres alquenoicos ß-sustituidos y
a,ß-disustituidos, de manera altamente
estereoselectiva. C. T. Meta, K. Koide, Org. Lett.,
2004, 6, 1785-1787

Por otro lado, esta reducción permite
introducir yodo en el carbono alfa al grupo éster,
llevando a cabo la reacción a temperaturas muy bajas,
como puede apreciarse en el siguiente ejemplo:

2.12. Reducción de ácidos
carboxílicos y sus derivados
Reducción de ácidos
carboxílicos
2.12.1.1. Reducción con LiAlH4. El
hidruro de litio y aluminio disuelto en un solvente
aprótico como el Tetra Hidro Furano (THF), seguido de
un tratamiento con agua acidulada, reduce a los ácidos
carboxílicos alifáticos y/o aromáticos a
alcoholes primarios, con bastante facilidad y altos
rendimientos.


2.12.1.2. Reducción con Diborano (B2H6). El
diborano, también reduce selectivamente los carbonilos
de los ácidos carboxílicos alifáticos
y/o aromáticos, antes que cualquier otro carbonilo
(cetonas, aldehidos, etc) al correspondiente alcohol
primario.

2.12.1.3. Aminación reductiva de
ácidos pirúvicos con NaBH3CN


2.12.1.4. Reducción de ácidos
carboxílicos con NaBH4/BF3. Et2O. El NaBH4 sólo
no puede reducir al grupo carboxílico, pero si se
halla en presencia de un ácido de Lewis, como por
ejemplo el BF3, es capaz de reducir cuantitativamente el
–COOH al alcohol respectivo. Este sistema reductor no
ataca a los grupos alquilo, -OH, -NO2, halógenos y
–OR.
2.12.1.5. Reducción con AlH3. El ácido
carboxílico es reducido rápida y completamente
por el AlH3 para formar un alcohol primario, en cambio grupos
funcionales poco reactivos como los haluros no son
atacados.
Por latanto, esta diferencia |
|
Reducción de ácidos a,ß-
insaturado carboxílicos.
Catálisis con rutenio. Los complejos de
Rutenio con ligandos difosforano rígidos, con
ángulos diédricos grandes, son catalizadores
altamente eficientes para la hidrogenación
asimétrica de ácidos a, ß-insaturados
carboxílicos. X. Cheng, Q. Zhang, J.-H. Xie, L.-X.
Wang, Q.-L. Zhou, Angew. Chem. Int. Ed.,
2005, 44, 1118-1121.

Reducción de ésteres
Reducción Catalítica de
ésteres.
La catálisis se efectúa con con
cromito de cobre. La hidrogenólisis (escisión
con hidrógeno) de un éster, requie de
condiciones más severas que la idrogenación
simple (adición de hidrógeno) de un doble
enlace carbono – carbono. Se necesitan presiones y
temperaturas elevadas. El catalizador de mayor uso es una
mezcla de óxidos denominada cromito de cobre, de
composición aproximada: CuO-CuCr2O4.

Reducción química de
ésteres.
La reducción química de ésteres
se efectúa con sodio metálico en alcohol, o
más comúnmente, con hidruro de aluminio o
hidruro de litio y aluminio.
Reducción con AlH3. El hidruro de aluminio
puede lograr la reducción de un éster,
transformándolo en un alcohol primario con buenos
rendimietnos, por otro lado se conoce que los grupos poco
reactivos, como los halógenos y nitros, no son
atacados por este hidruro, razón por la cual se
pueden lograr las siguientes transformaciones:

La reducción de Bouveault-Blanc. Este
método es un sustituto de bajo costo para la
reducción de los ésteres con el Hidruro de
Litio y Aluminio (LAH), hasta hace poco el más
utilizado en la industria.

Tabla No 24.Reducción de Bouveault-Blanc
de ésteres con Na-SG
Una variante de esta reacción utiliza el
sodio metálico en un gel de sílice (Na-SG) para
la reducción de ésteres alifáticos
distintos, conocida como la reducción de
Bouveault-Blanc. Los alcoholes primarios se preparan con un
rendimiento excelente en condiciones suaves de
reacción. B. S. Bodnar, P. F. Vogt, J. Org.
Chem., 2009, 74, 2598-2600.

Reducción con Borohidruro de cinc
(Zn(BH4)2). Este reactivo se prepara a partir de la
reacción entre el cloruro de cinc y el NaBH4,
según se observa en la siguiente
reacción:

Reducción de ésteres con
DIBAL-H. La reducción de estos grupos
funcionales con hidruro de litio y aluminio (LiAlH4) no
puede detenerse en la etapa de aldehído y la
reacción proporciona alcoholes (en el caso de los
ésteres) o aminas (en el caso de nitrilos y
amidas).
La reducción de ésteres, amidas y
nitrilos con hidruro de diisobutilaluminio (DIBAL-H)
proporciona aldehídos.
Lo anterior es posible, porque la reducción
con DIBAL-H proporciona un intermedio que no puede seguir
reduciéndose. Dicho intermedio se hidroliza a
aldehído durante la finalización de la
reacción.


Reducción de ésteres a
éteres.
Una eficiente síntesis de éteres
asímetricos, se consigue por una desoxigenación
reductiva directa de los ésteres utilizando el sistema
reductor catalítico: InBr3/Et2SiH. Este sencillo
sistema catalítico es muy tolerante a varios grupos
funcionales. (N.Sakai, T. Moriya, T. Konakahara, J. Org.
Chem., 2007, 72, 5920-5922.)


Tabla No 25 Reducción de
ésteres con InBr3/Et2SiH

Reducción de haluros de ácido
carboxílico (haluros de acilo y/o
benzoilo)
2.14.1. Hidrogenación con Catalizador de
Lindlar.
El catalizador de Lindlar: (H2, Pd/BaCO3), es
posible utilizar también en la reducción de un
haluro de ácido:

2.14.2. Tris (trimetilsilil)
silano.
El tris (trimetilsilil) silano reduce cloruros de
ácido a los hidrocarburos descarboxilados
correspondientes, a través de un mecanismo de
reacción en cadena de radicales libres.

2.14.3. La reducción de Rosenmund.
La hidrogenación catalítica de
cloruros de ácido permite la formación de
aldehídos. En esta reacción denominada
reducción de Rosenmund, el catalizador Pd debe ser
envenenado, con BaSO4, porque el catalizador no tratado es
muy reactivo y se pueden producir sobrrreducciones. Alguno de
los productos secundarios formados en la reacción,
pueden ser evitados si la misma se lleva a cabo en
disolventes estrictamente anhidros.

El mecanismo de la reacción puede expicarse
con el siguiente esquema:

Reducción de Amidas
Reducción de amidas primarias.
Reducción con LiAlH4. El carbonilo de la
amida (primaria, secundaria o terciaria) es transformado en
el respectivo metileno con el LiAlH4. Prácticamente
es la única reacción donde el LiAlH4, produce
esta transformación, puesto que en la
reducción de los carbonilos de otros grupos
funcionales, los transforma generalmente en
alcoholes

R: Puede ser un grupo alquilo o arilo
En el mecanismo de la reducción, se postula
que el carbonilo, primero se transforma en un intermediario
imina, que reaccionando con un segundo equivalente de LiAlH4,
se transforma en la amina correspondiente.
Reducción con NaBH4/BF3 Et2O. Bull
Korean Chem. Soc. 2004, Vol 25, Nº3,
pág. 407. La reducción más
común de las amidas, se la efectúa con
LiAlH4, pero debido al costo y el manejo especial de
éste reactivo, se ha buscado, algunas alternativas
de reducción, como la de combinar NaBH4 con BF3 en
éter como solvente.

La amida electrofílica activa, se puede
reducir al iminio correspondiente utilizando trietilsilano,
un reactivo barato, bastante inerte y disponible
comercialmente. La imina puede ser aislada o ser
fácilmente transformada en aldehído en medio
ácido. La amina se puede obtener a través de
una aminación reductora secuencial mediante la
adición de hidruro de éster de silano
(éster de Hantzsch).
Por otra parte, esta reducción tolera varios
grupos funcionales que suelen ser reactivos en condiciones
reductoras y es muy selectivo para amidas secundarias.
(J. Am. Chem Soc, 2010, 132(6), pp 1770
– 1771)

2.15.3. Reducción de amidas
terciarias
Aplicación del Borohidruro de cinc:
Zn(BH4)2. Una reducción de amidas terciarias con
(EtO)3SiH, catalizada por Zn(AcO)2 en tetrahidrofurano a
40ºC, muestra una quimioselectividad notable, la
presencia de los grupos éster, éter, nitro,
ciano, azo y los sustitutos ceto, en la estructura del
sustrato no son afectado por este reactivo.
Síntesis, 2010, 132, 1770 –
1771.

Sustrato | Reactivo | Producto | |
RCONH2 | Borano-THF, BMS | RCH2NH2 | |
RCONHR | Borano-THF, BMS | RCH2NHR | |
RCONR2 | Borano-THF, BMS | RCH2NR2 | |
RCONR2 | Sia2BH | RCHO | |
RCONH2 | Sia2BH | – | |
RCONR2 | 9-BBN | RCH2OH | |
RCONH2 | 9-BBN | Para la | |
Tabla Nº 26. Reducción de amidas con
varios reactivos de boro.
Reducción con el sistema:
Zn(AcO)2/PhMe2SiH. La reducción de amidas
terciarias, es bastante difícil, razón por la
cual existen muy pocas opciones para lograrlo. En general
se probaron con éxitos moderados, los reductores
LiAlH4, BH3 y otros hidruros, en condiciones
drásticas y quimiosectividad dudosa.

Felizmente el trabajo de Beller et al. (Rostock
Alemania), permitió superar las anteriores
limitaciones, para ello utilizaron silanos como fuente de
hidruro (PhSiH3, Ph2SiH2), siendo el de mayor rendimiento el
(ETO)3SiH. Como catalizador seleccionado fue el acetato de
cinc. Zn(AcO)2. J. Am. Chem. Soc. 2010,
132(6) pp 1770 -1771
El protocolo implica la mezcla de Zn(AcO)2 (10% mol)
y (ETO)3SiH (300% mol) en THF durante 30 min a temperatura
ambiente. A continuación, se añade la amida en
THF y se agita el sistema de 20 a 30 h. Los rendimientos son
superiores al 70%.
La selectividad de este método es excelente,
pues, las cetonas, nitrilo, ésteres, nitro, y dobles
enlaces (conjugados o nó) son resistentes al sistema
reductor.
Reducción con Ester de Hantzsch/
Tf2O
La reducción se produce en condiciones suaves
y el sistema es tolerante con varios grupos funcionales,
señalados en el anterior apartado.

2.16. Reducción de compuestos
nitrogenados[5]
Los nitrocompuestos son intermediarios
versátiles y de mucha utilidad en la industria
química. Los nitroaromáticos son usualmente
materiales de partida para diversas aplicaciones comerciales,
pero los compuestos alifáticos exhiben una diversidad
química debido a que se forman una variedad de
compuestos según las condiciones de
reacción.
Los nitros y nitroso compuestos, hidroxilaminas,
oximas, aminas, nitronas, cetonas y sililnitronatos, son
frecuentemente encontrados durante las reducciones de
nitrocompuestos.
2.16.1. Reducción de compuestos
nitroaromáticos a compuestos nitroso

2.16.2. Reducción del grupo nitro y
nitroso a azo y azoxicompuestos
El cinc en medio básico, presenta condiciones
reductoras suficientemente suaves como para reducir por
ejemplo el grupo nitro del p-nitroestireno. Esta
reacción ocurre también en los grupos
vinilo.

La siguiente reacción es un interesante
ejemplo en la formación intramolecular de azo
compuestos:

La reducción con cinc en condiciones
básicas produce azo compuestos, si se usara
anhídrido acético/ácido acético
como solvente para sistemas simétricos, se forman
azoxi compuestos. Los azoxi compuestos son de interés
porque presentan actividad fisiológica y se utilizan
en los sistemas de cristales líquidos.


2.16.3. Reducción de
nitroaromáticos y nitroso compuestos a
hidroxilaminas

La reducción selectiva del grupo nitro (NO2)
a hidroxil amina, ocurre con Zn/NH4Cl acuoso. La
sobrerreducción de aminas, puede prevenirse usando dos
fases de solvente en el sistema. Las hidroxilaminas
también se obtienen de los nitrocompuestos usando H2
molecular e Iridio como catalizador o también Pd, Rh,
C.
2.16.3.1. El NaBH4 y un metal como catalizador,
conforman otro sistema reductor de los grupos nitro en los
aromáticos, para formar hidroxilaminas.

La transferencia de electrones, seguido por la
transferencia de protones y la eliminación genera un
intermedio compuesto nitroso, que se somete a dos etapas
más de transferencia de electrones y la
protonación para producir hidroxilamina. Una mayor
reducción de la hidroxilamina conduce a la
amina.

2.16.4. Reducción de nitrocompuestos a
anilinas
2.16.4.1. Sulfuro de sodio (Na2S), es otro agente
reductor interesante de los grupos nitro. Si dos grupos nitro
se hallan sobre el benceno, reduce sólo a uno de
ellos. El grupo nitro de los nitroalifáticos, es
retirado de la estructura si se ubica en una posición
muy sensible en soluciones acuosas.

2.16.4.2. HCOONH4/PdMCM–41/EtOH. Debido a la
acción catalítica del PdMCM-41 un silicato
mesoporoso, conjuntamente el formiato de amonio como fuente
de hidruros en etanol, es otro sistema de reducción de
los grupos nitro enlazados al anillo bencénico en los
diferentes arenos, al respectivo grupo amino, con excelentes
rendimientos:

2.16.4.3.. Zn/H2NNH2, HCOOH. Los nitrogrupos
alifáticos y aromáticos que también
contienen otros sustituyentes reducibles, como: -OR, -OH,
-COOR, -COOH, -Cl, – CH=CHCOOH, -CN, -COCH3, -NHCOCH3, son
selectiva y rápidamente reducidos a temperatura
ambiente al correspondiente grupo amino con buenos
rendimientos empleando hidracina, homoformiato (àc.
Fórmico), en presencia de cinc metálico
industrial.

2.16.4.6. Indio en cloruro de amonio. Este sistema
reduce selectivamente los grupos nitro a aminas, sin afectar
a otros grupos potencialmente reducibles, como las cetonas,
ésteres, halógenos, nitrilos, etc.. Organic
Synthesis, vol 81, p. 188, 2005.


2.16.4.7. Reducción con formamida. La
reducción del grupo nitro a amino, en compuestos
aromáticos, para formar arilaminas, por la
acción reductora de la formamida, es una buena
alternativa de reducción del grupo nitro, cuando
además existen otros grupos en la molécula,
como por ejemplo los halógenos, alquenos, nitrilos,
aldehidos, y cetonas, que no son afectados, por la
formamida.


2.16.4.8. Reducción con
Zn/(NH4)2HPO3.H2O. La hidrogenación de
nitrocompuestos aromáticos, con este sistema reductor
es bastante selectiva en presencia de otros grupos sensibles
en la molécula, tales como halógeno, -OH, -NH2,
-OCH3, -CN, -COCH3, -COOH y –COOR. E. Journal of
Chemistry. Vol 5, Nº 4, pp 914 – 917 october
2008

2.16.4.9. El cloruro de estaño (II).Es
un efectivo reductor del grupo nitro (-NO2) en condiciones
ácidas. Este reactivo actúa también
selectivamente en la reducción de grupos nitro en
medios no ácidos y no acuosos, se obtienen
rendimientos cuantitativos significativos, cuando se usa
SnCl2.2H2O en alcohol o acetato de etilo.
Se utiliza condiciones no ácidas, cuando
existen en la molécula otros grupos sensibles a los
ácidos como oir ejemplo: –CHO, -COR, -COOR, -CN,
halógenos y éteres
bencílicos.

2.16.4.10. HCOOH o HCOONH4 y Zeolita REHY como
catalizador[6]La reducción
selectiva de grupos nitro a amino con HCOOH o HCOONH4 en
solución acuosa en presencia de zeolita REHY como
catalizador, seguido de irradiación con microondas, se
completa de 3 a 10 min con rendimientos de 90 a
95%.
Se afirma que esta reducción es compatible
con varios grupos funcionales sensibles, como los
halógenos, -OH, -OCH3, -CHO, -COCH3, -COPh, -COOH,
-COOEt, -CONH2, -CN, -CH=COOH, -NHCOCH3.
2.16.4.11. Hidrogenación quimioselectiva
de compuestos nitro con catalizadores de oro soportados.
La reducción selectiva de un grupo nitro cuando
están presentes otras funciones reducibles en el
sustrato, es un proceso difícil que a menudo requiere
cantidades estequiométricas mayores de agentes
reductores o, si se utiliza H2, la adición de metales
solubles.
Se ha reportado que la reducción del grupo
nitro de los nitroarenos, es quimioselectiva, cuando la misma
de efectúa con H2, bajo condiciones suaves de
reacción catalizada por nanopartículas de oro
soportadas en TiO2 o Fe2O3.
2.16.4.12. Reducción de
nitroaromáticos utilizando catalizadores solubles en
agua. Una nueva metodología de reducción
selectiva del grupo nitro de arenos al grupo amino, implica
la utilización de un sistema de dos fases:
agua-catalizadores de paladio solubles.
El rendimiento de la reacción es superior al
85% y es compatible con otros grupos funcionales en el areno,
como son la cetona, nitrilo, cloruro y alqueno que no son
afectados. Este método fue desarrollado por Ahmed
M. Tafesh, Matthias Beller and A.G.
Hoechst.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |














