Si el OAA es convertido a PEP por la PEPCK mitocondrial,
este es transportado al citosol en donde es un sustrato directo
para la gluconeogénesis y no se requiere nada más.
La transaminación del OAA a aspartato permite que el
aspartato se transporte al citosol en donde existe una
transaminación reversa dando lugar a la formación
de OAA citosólico. Esta reacción de
transaminación requiere un transporte continuo de
glutamato dentro y a-cetoglutarato fuera de la mitocondria. Por
tanto este proceso esta limitado por la disponibilidad de estos
otros sustratos. Cualquiera de estas dos últimas
reacciones predominará cuando el sustrato de la
gluconeogénesis es el lactato. Si ocurre
decarboxilación o transaminación mitocondrial
dependerá de la disponibilidad de PEPCK o de los
intermediarios de la transaminación.
El OAA mitocondrial puede también ser reducido a
malato por una reacción reversa a la que se sucede en el
ciclo de Krebs que es catalizada por la enzima malato
deshidrogenasa (MDH). La reducción del OAA a malato
requiere de NADH, que se acumulará en la mitocondria
cuando la carga energética aumenta. Este incremento en
energía permitirá a la célula llevar a cabo
el proceso de gluconeogénesis que es costoso en ATP. El
malato resultante es transportado al citosol en donde es oxidado
a OAA por la enzima citosólica MDH que requiere NAD+ y
produce NADH. El NADH producido durante la oxidación
citosólica del malato a OAA es utilizado durante la
reacción catalizada por la gliceraldehido-3-fosfato
deshidrogenasa de la glucólisis. El acoplamiento de estas
dos reacciones de oxidación-reducción es necesario
para mantener la gluconeogénesis funcionando cuando el
piruvato es la principal fuente de átomos de carbono. La
conversión de OAA a malato predomina cuando el piruvato
(derivado de la glucólisis o del metabolismo de los amino
ácidos) es la fuente de los átomos de carbono para
la gluconeogénesis. Cuando está en el citoplasma el
OAA, este es convertido a PEP por la enzima PEPCK
citoplasmática. Señales hormonales controlan el
nivel de la enzima PEPCK para regular el flujo de la
gluconeogénesis (ver mas abajo).
El resultado neto de las reacciones PC y PEPCK
es:
![]()
La conversión de fructosa-1,6-bifosfato (F1,6BP)
a fructosa-6-bifosfato (F6P) es el reverso de la reacción
limitante de la glucólisis. Esta reacción, una
simple hidrólisis, es catalizada por la enzima
fructosa-1,6-bifosfatasa (F1,6BFasa). Similar a lo que ocurre en
la regulación de la glucólisis en la enzima PFK1,
en la gluconeogénesis la reacción de la F1,6BPasa
es el principal punto de control de esta vía.
Glucosa-6-Fosfato (G6P) a glucosa (o
Glicógeno), "Bypass" 3
La glucosa-6-fosfato es convertida a glucosa por
acción de la glucosa-6-fosfatasa (G6Pasa). Esta
también es una reacción de hidrólisis simple
similar a la de la F1,6BPasa. Debido a que el cerebro, el
músculo esquelético, así como también
otros tejidos no hepáticos, carecen de G6Pasa, cualquier
gluconeogénesis que ocurra en estos tejidos no se utiliza
para dar glucosa a la sangre. En el hígado, músculo
y especialmente el hígado, la G6 P es dirigida a
glicógeno si los niveles de azúcar en la sangre son
adecuados.
La fosforólisis del glicógeno se lleva a
cabo por la glicógeno fosforilasa, mientras que, la
síntesis de glicógeno es catalizada por la
glicógeno sintasa. La G6P producida en la
gluconeogénesis puede ser convertida a glucosa-1-fosfato
(G1P) por la fosfoglucosa mutasa (PGM). Luego la G1P es
convertida a UDP-glucosa (el sustrato para la síntesis de
glicógeno) por la UDP-glucosa fosforilasa, una
reacción que requiere la hidrólisis de
UTP.
Sustratos de la
Gluconeogénesis
Lactato
El lactato es una fuente predominante de átomos
de carbonos para la síntesis de glucosa por la
gluconeogénesis. Durante la glucólisis anaerobia en
el músculo esquelético, el piruvato es reducido a
lactato por la lactato deshidrogenasa (LDH). Esta reacción
tiene dos funciones críticas durante la glucólisis
anaerobia. Primero, en la dirección de la formación
de lactato la reacción de la LDH requiere de NADH y
produce NAD+ que entonces esta disponible para ser utilizada en
la reacción de la gliceraldehido-3-fosfato deshidrogenasa
de la glucólisis. Estas dos reacciones están por
tanto íntimamente relacionadas en la glucólisis
anaerobia. Segundo, el lactato producido por la reacción
de la LDH es liberado a la sangre y transportado al hígado
en donde es convertido a glucosa. La glucosa producida entonces
regresa a la sangre para ser utilizada por el músculo como
fuente de energía y para llenar las reservas de
glicógeno. Este ciclo se llama ciclo de
Cori.

El ciclo de Cori involucra la utilización de
lactato, producido en la glucólisis en tejidos
no-hepáticos, (como el músculo y los eritrocitos)
como una fuente de carbono para la gluconeogénesis
hepática. En esta forma el hígado puede convertir
el producto de la glucólisis anaerobia, lactato, otra vez
en glucosa para su re-utilización por parte de tejidos
no-hepáticos. Note que parte de la gluconeogénesis
del ciclo (en si mismo) consume energía, lo que le cuesta
al organismo 4 moles de ATP que es más de lo que se
produce en la glucólisis. Por tanto, el ciclo no puede
mantenerse indefinidamente.
Piruvato
El piruvato que se genera en el músculo y otros
tejidos periféricos, puede ser trans-aminado a alanina que
es llevada al hígado para la gluconeogénesis. La
reacción de trans-aminación requiere de un
a-aminoácido como donador del grupo amino,
generándose un a-ceto acido en el proceso. Esta vía
se denomina el ciclo de la glucosa-alanina. Aunque la
mayoría de aminoácidos se degradan en el
hígado algunos son desaminados en el músculo. El
ciclo de la glucosa-alanina es, por tanto, un mecanismo indirecto
del músculo para eliminar nitrógeno y a la vez para
llenar su reserva de energía. Sin embargo, la
función mas importante del ciclo glucosa-alanina es
permitir a los tejidos no-hepáticos entregar la
porción amino de los amino aminoácidos
metabolizados al hígado para que sea excretada como urea.
En el hígado la alanina se vuelve a convertir en piruvato
que es utilizado como sustrato de la gluconeogénesis (si
ese es el requerimiento hepático) o es oxidado en ciclo de
Krebs. El nitrógeno amino es convertido a urea en el ciclo
de la urea que es excretada por los riñones.

El ciclo glucosa-alanina es utilizado primariamente como
mecanismo para que el músculo esquelético elimine
nitrógeno al mismo tiempo que permite su llenado de
energía. La oxidación de la glucosa produce
piruvato que puede ser transaminado a alanina. Esta
reacción es catalizada por la alanino transaminasa, ALT
(ALT se la solía llamar transaminasa glutamato-piruvato
serica, SGPT). Adicionalmente, durante periodos de ayuno, la
proteína del músculo esquelético se degrada
por el valor energético de los carbonos de los
aminoácidos y la alanina es el principal aminoácido
de esa proteína. La alanina entonces ingresa al torrente
sanguíneo y es transportado al hígado. En el
hígado la alanina es convertida a piruvato que entonces es
utilizado como fuente de carbono para la gluconeogénesis.
La glucosa nueva que ha sido formada puede entonces entrar a la
sangre para regresar al músculo. El grupo amino
transportado desde el músculo al hígado en la forma
de alanina se convierte en urea en el ciclo de la urea y es
excretado.
Aminoácidos
Todos los 20 aminoácidos, excepto leucina y
lisina, pueden ser degradados a intermediarios del ciclo de Krebs
como se discute en el metabolismo de los aminoácidos. Esto
permite que los esqueletos de carbono de los aminoácidos
se conviertan al esqueleto del oxaloacetato y luego a piruvato.
El piruvato así formado puede utilizarse en la vía
de la gluconeogénesis. Cuando las reservas de
glicógeno están bacías, en el músculo
durante el ejercicio y en el hígado durante el ayuno, el
catabolismo de las proteínas del músculo a
aminoácidos contribuye como la principal fuente de
carbonos para el mantenimiento de los niveles de
glucosa.
Glicerol
La oxidación de los ácidos grasos produce
cantidades enormes de energía en moles, sin embargo, los
carbonos de los ácidos grasos no pueden utilizarse para la
síntesis de glucosa. La unidad de dos carbonos de acetil
CoA que se deriva de la ß-oxidación de los
ácidos grasos puede incorporarse en el ciclo de Krebs, sin
embargo, durante el ciclo de Krebs se pierden 2 carbonos como
CO2. Así se explica por que los ácidos grasos no
sufren una conversión neta a carbohidratos.
El esqueleto de glicerol de los lípidos pueden
ser utilizados para la gluconeogénesis. Esto requiere la
fosforilación de glicerol-3-fosfato-cinasa de glicerol y
de deshidrogenación dihydroxyacetone fosfato (DHAP) por
glyceraldehyde-3-fosfato deshidrogenasa (G3PDH). G3PDH la
reacción es la misma que la utilizada en el transporte
citosólico de la reducción de equivalentes en la
mitocondria para su uso en la fosforilación oxidativa.
Esta vía de transporte es el glicerol-fosfato
lanzadera.

El glicerol fosfato lanzadera es un mecanismo de
secundaria para el transporte de electrones de mitocondrial NADH
citosólico a los transportistas de la fosforilación
oxidativa itinerario. El principal NADH citoplásmica de
electrones es la lanzadera malato-aspartato lanzadera. Dos son
enzimas que participan en este servicio. Una de ellas es la
versión de la citosólico enzima glicerol-3-fosfato
deshidrogenasa (glicerol-3-PDH) que tiene como un sustrato, NADH.
La segunda es la forma de la mitocondria la enzima que tiene como
uno de sus sustratos, FAD+. La red resultado es que hay una
conversión continua de la glicolíticas intermedios,
DHAP y glicerol-3-fosfato, con la consiguiente transferencia de
los electrones de la reducción de NADH citosólico a
la mitocondria oxida FAD+. Dado que los electrones mitocondrial
de las FADH2 pienso en el fosforilación oxidativa
vía en la coenzima Q (a diferencia de NADH-ubiquinona
oxidorreductasa [compleja I]) sólo 2 moles de ATP se
generarán a partir de la glicólisis. G3PDH es
glyceraldehyde-3-phoshate deshidrogenasa.
El esqueleto de glicerol del tejido adiposo almacenado
triacylgycerols se asegura de que se utilicen como un sustrato
gluconeogenic ya que las células adiposas falta de
glicerol cinasa. Adipocitos, de hecho, requieren un nivel basal
de la glicólisis, a fin de dotarlos de DHAP como producto
intermedio en la síntesis de triacyglycerols.
Propionato
La oxidación de ácidos grasos con un
número impar de átomos de carbono y la
oxidación de algunos aminoácidos genera como
producto final de la oxidación propionil-CoA. La
propionil-CoA se convierte en el intermediario del ciclo de
Krebs, succinil-CoA. Esta conversión se lleva a cabo por
la enzima dependiente de ATP, propionil-CoA carboxilasa, la
metilmalonil-CoA epimerasa y finalmente por la enzima que
requiere vitamina B12, la metilmalonil-CoA mutasa. La
utilización del propionato en la gluconeogénesis
solamente tiene una significancia cuantitativa en los
rumiantes.

Conversión de propionil-CoA a
Succinil-Co A
Papel de la Gluconeogénesis
Renal
Aunque el hígado tiene la función
fundamental de mantener la glucosa en la sangre la homeostasis y
por lo tanto, es el sitio principal de la gluconeogénesis,
el riñón desempeña un papel importante.
Durante los períodos de hipoglucemia grave que se
produzcan en condiciones de insuficiencia hepática, el
riñón puede proporcionar glucosa a la sangre a
través de gluconeogénesis renal. En la corteza
renal, la glutamina es la sustancia preferida para la
gluconeogénesis.
La glutamina es producida en grandes cantidades en el
músculo esquelético durante los periodos de ayuno
como un medio para la exportación de nitrógeno
residuos resultantes de la catabolismo de los aminoácidos.
A través de las acciones de las transaminasas, un topo de
los residuos de amoníaco se transfiere a a-cetoglutarato a
través de la glutamato deshidrogenasa reacción
catalizada por el glutamato rendimiento. El glutamato es entonces
un sustrato de glutamina sintetasa, que incorpora otro lunar de
la generación de residuos de amoniaco glutamina
(véase la página del metabolismo de
nitrógeno para más detalles). La glutamina es luego
transportado a los riñones, donde la reacción
inversa producirse la liberación del amoniaco y la
producción de a-cetoglutarato que puede entrar en la ciclo
TCA y los átomos de carbono desviado a través de la
gluconeogénesis oxalacetato. Este proceso tiene dos
funciones importantes. El amoniaco (NH3) que se libera
espontáneamente se disocia en ion amonio (NH4+) y se
excreta en la orina eficacia de amortiguación de los
ácidos en la orina. Además, la glucosa que se
producida a través de la gluconeogénesis puede
proporcionar el cerebro con la energía tan
necesario.
Regulación de la
Gluconeogénesis
Obviamente la regulación de la
gluconeogénesis estará en contraste directo a la
regulación de la glucólisis. En general, los
efectores negativos de la glucólisis son efectores
positivos de la gluconeogénesis. La regulación de
la actividad de la PFK1 y F1,6BPasa en el sitio más
significativo para controlar el flujo hacia la oxidación
de la glucosa o la síntesis de glucosa. Como se
describió en el control de la glucólisis, esta es
controlada predominantemente por la fructosa-2,6-bifosfato,
F2,6BF que es un efector alostérico negativo poderoso de
la actividad de la F1,6BPasa.
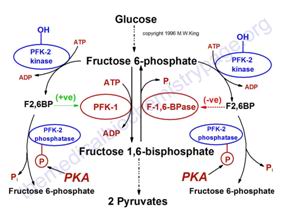
Regulación de la glucólisis y
gluconeogénesis por al fructosa-2,6-bifosfato (F2,6BF).
Los sitios más importantes de la regulación de la
glucólisis y de la gluconeogénesis son las
reacciones catalizadas por la PFK1 y la F1,6BPasa. PFK2 es la
actividad de cinasa y la F-2,6BPasa la actividad de fosfatasa de
la enzima bi-funcional regulatoria
fosfofructocinasa-2/fructosa-2,6-bisfosfatasa. La PKA es una
cinasa dependiente de cAMP que fosforila la PFK-2/F-2,6-BPasa
activando la actividad de la fosfatasa. (+ve) y (-ve) se refieren
a actividades positiva y negativa, respectivamente
El nivel de la F2,6BP disminuirá en los
hepatocitos en respuesta a la estimulación del
glucagón así como también por la
estimulación de las catecolaminas. Cada una de estas
señales se hace por medio de la activación de la
PKA dependiente del cAMP. Uno de los sustratos de la PKA es la
PFK-2/F-2,6-BPasa, la enzima bifuncional responsable de la
síntesis e hidrólisis de la F2,6BP. Cuando la PFK-2
es fosforilada por la PKA actúa como fosfatasa llevando a
la defosforilación de la F2,6BP con el concomitante
incremento de la actividad de la F-2,6-BPasa y una
disminución en la actividad de la PFK-1. De manera
secundaria, la actividad de la F-2,6-BPasa se regula por la
relación ATP/ADP. Cuando este radio es alto, la
gluconeogénesis puede proceder a su nivel
máximo.
La glugoneogénesis también se controla en
el "bypass" piruvato – PEP. Las señales
hepáticas provocadas por el glucagón o la
epinefrina llevan a la fosforilación e inactivación
de la piruvato cinasa (PK) lo que permitirá un incremento
en el flujo a través de la gluconeogénesis. La PK
es también inhibida alostéricamente por el ATP y la
alanina. La primera indica la presencia de energía y la
segunda de sustrato suficiente para la gluconeogénesis.
Contrariamente, una reducción de los niveles de
energía evidenciada por un incremento en la
concentración de ADP llevan a una inhibición tanto
de la PK como de la PEPCK. La activación alostérica
de la PK ocurre por medio de la acetil-CoA. Cada una de estas
regulaciones ocurre en un periodo corto de tiempo, mientras que
la regulación a largo plazo puede afectar a la PEPCK. La
cantidad de esta enzima se incrementa en respuesta a la
estimulación prolongada del glucagón. Esta
situación ocurriría en un individuo en ayuno
prolongado o en alguna persona con una dieta
inadecuada.
Autor:
Arrieta Leonardo, Karen Laura Vivanco,
José Luis
Profesor: Mario Carhuapoma Yance
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |