A veces se aprovecha esta reacción para la
síntesis del clorato. Con aminas se forman las cloraminas.
Estos compuestos suelen ser tóxicos y pueden ser
explosivos. No es inflamable, pero con el fuego
reacciona.
Fórmula de dilución del hipoclorito de sodio
Aplicaciones
El hipoclorito de sodio generalmente es
usado disuelto en agua en varias concentraciones.
El hipoclorito de sodio sólido no es
usado comercialmente, aunque es posible encontrarlo en esta
forma.
Las soluciones de hipoclorito de sodio son
transparentes, de color amarillo-verdoso y huelen a
cloro.
El hipoclorito de calcio es un
sólido blanco que se descompone fácilmente en el
agua liberando oxígeno y cloro.
También tiene un fuerte olor a
cloro.
Ninguno de estos compuestos ocurre
naturalmente en el ambiente.El hipoclorito de sodio y de calcio
se usan principalmente como agentes blanqueadores o
desinfectantes.
Ambos forman parte de blanqueadores
comerciales, soluciones para limpiar y desinfectantes para el
agua potable y sistemas de purificación de aguas
residuales y piscinas.

Efectos
tóxicos
Los efectos tóxicos del hipoclorito
de sodio y de calcio se deben principalmente a las propiedades
corrosivas del hipoclorito.Si usted ingiere una pequeña
cantidad de blanqueador doméstico (3-6% hipoclorito),
puede experimentar irritación gastrointestinal.Si usted
ingiere una solución comercial más concentrada (10%
de hipoclorito o más) o hipoclorito en polvo puede sufrir
lesiones corrosivas graves en la boca, la garganta, el
esófago y el estómago acompañado de
hemorragia, perforación y eventualmente la
muerte.
Los sobrevivientes de intoxicaciones
severas pueden quedar con cicatrices y estrechamiento permanentes
del esófago.Si usted inhala cloro gaseoso liberado de
soluciones concentradas de hipoclorito puede sufrir
irritación nasal, dolor de garganta y tos.
El contacto con la piel puede causar
quemaduras dolorosas, inflamación y ampollas.
El contacto de los ojos con soluciones para
blanquear de concentración moderada puede causar
irritación leve y pasajera.
El contacto de los ojos con soluciones para
blanquear de concentración moderada puede causar
irritación leve y pasajera. Soluciones más
concentradas pueden causar lesiones serias en los
ojos.
La exposición prolongada a bajos
niveles de hipoclorito puede producir irritación de la
piel.
PREVENCION
Medios para evitar salpicaduras, derrames,
vapores…etc. asociando ventilación (con
extracción) de polvos del local.Uso de equipos de protección completos que
eviten cualquier contacto respiratorio o con las manos (con
filtros de polvo…)
Calcium Hypochlorite 7778-54-3/Sodium Hypochlorite
7681-5
Los efectos de la exposición a
cualquier sustancia tóxica dependen de la dosis, la
duración, la manera como usted está expuesto, sus
hábitos y características personales y de la
presencia de otras sustancias químicas.
El público en general puede estar
expuesto a pequeñas cantidades de hipoclorito de sodio y
de calcio al usar productos domésticos que contienen estos
compuestos.Los trabajadores en ocupaciones que usan estas
sustancias químicas corren el mayor riesgo de
exposición.
El hipoclorito de sodio y de calcio puede
producir irritación de los ojos, la piel y los tractos
respiratorio y gastrointestinal.La exposición a altos
niveles puede producir grave daño corrosivo en los ojos,
la piel y los tractos respiratorio y gastrointestinal y puede ser
fatal.
Materiales y
reactivos
Materiales
|
|
Vaso de ppdo | Probeta |
|
|
Balanza | Bagueta |
|
|
espatula | Luna de reloj |
|
|
Fiola | Bureta |
|
|
Soporte | Pipeta |
Reactivos
|
|
Tiosulfato de | Acido |
|
|
Almidón | Ioduro de potasio |
|
|
Fenolftaleína | Peróxido de |
|
|
Acido | Xilecianol |
Procedimiento
experimental


Fórmulas
I. DETERMINAR DE PORCETAJE DE HIPOCLORITO DE
SODIO Y CLORO UTIL. (CLORO DISPONIBLE)


II. DETERMINACION DE SODA RESIDUAL (%
NaOH)


Deducción
de fórmulas
I. DETERMINAR DE PORCETAJE DE HIPOCLORITO DE
SODIO Y CLORO UTIL. (CLORO DISPONIBLE)


Se dice que cuando valoramos hidróxido de sodio y
carbonato; el volumen gastado de para hidróxido
será lo de este más la mitad de lo gastado para
carbonato; de esta manera:

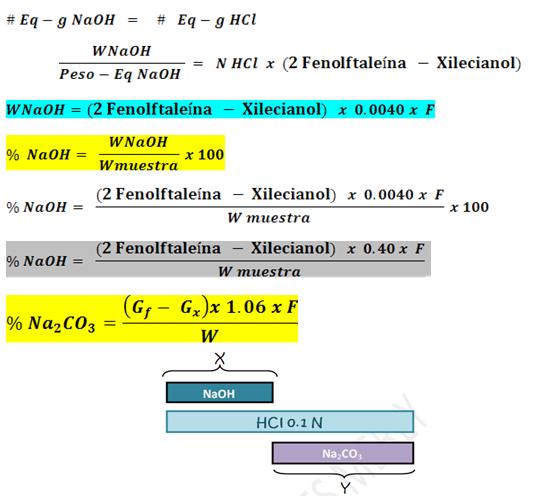
Para determinar el porcentaje de carbonato, se tiene en
cuenta el volumen gastado anteriormente por el hidróxido
es por eso que se aplica el esquema anterior.

Cuestionario
1. Define que se entiende por cloro
activo
Cloro activo.- es un término usado para expresar
el poder oxidante del cloro contenido en las lejías
descritas en las especificaciones. Se expresa en gramos de cloro
activo por litro (g cl/l)
2. Escribir las reacciones y semi-reaciones
de reducción y oxidación que tienen lugar
durante la estandarización de Tiosulfato de
sodio.
Las reacciones que se llevan a cabo son:
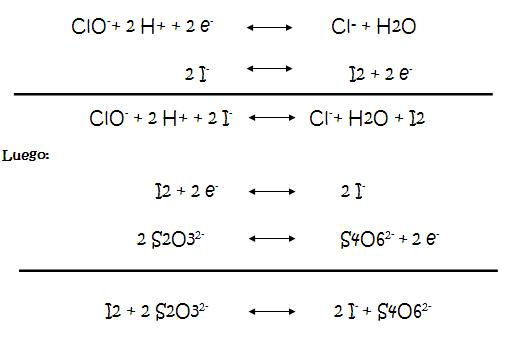
3. Escribir las reacciones y semi-reaciones
de reducción y oxidación que tienen lugar
durante la valoración del hipoclorito.
Las reacciones que se llevan a cabo en este
procedimiento son:

4. ¿Por qué se
acidula?
Para la determinar el hipoclorito de sodio es necesario
acidular la muestra ya sea con acido clorhídrico o acido
sulfúrico.
La carga de los iones puede variar, no sólo en
átomos de naturaleza distinta, sino también en un
mismo elemento; así, por ejemplo, se sabe que el
estaño de las sales estánnicas da iones con una
carga dos veces mayor que en las sales estannosas. Sin embargo,
es fácil de demostrar que la carga de cada ion es un
múltiplo muy sencillo de las cargas que poseen otros iones
tales como d hidrógeno, el cloro, etc. Hasta ahora no ha
sido posible hallar iones cuya carga sea inferior a la de estos
últimos, lo cual, unido a otras consideraciones, ha
llevado a la conclusión de que la carga negativa de un ion
cloro es la correspondiente a un solo electrón, es decir,
1,591 culombios; por consiguiente, puede admitirse que el ion
cloro y todos los iones que poseen la misma carga, consisten en
un átomo, o en un grupo de átomos, con un
electrón de más que en el estado molecular o
neutro. La carga del ion potasio neutraliza exactamente la del
cloro-ión y, por tanto, debemos admitir que su carga
positiva proviene de la pérdida de un
electrón.

El gas cloro, tal como se observa en el laboratorio, es
de color amarillo verdoso, olor desagradable y penetrante,
medianamente soluble en el agua, a la que descompone bajo la
acción de la luz y sus moléculas están
constituidas por dos átomos del elemento cloro, cada imo
de los cuales posee los electrones necesarios para neutralizar
justamente la carga positiva del núcleo material. La
constitución del cloro ionizado, como hemos visto, es
completa mente distinta, pues no está f onnado por
moléculas y los átomos van acompañados de
uñ exceso de electrones. Dada la diferencia entre la
constitución de un ion cloro y la del cloro molecular, tal
como se presenta en el estado gaseoso, no debe extrañamos
que las propiedades de uno y de otro sean completamente
distintas; así vemos que una disolución de cloruro
potásico, aun poseyendo gran cantidad de iones cloro, es
completamente incolora, inodora y estable. Tampoco los iones
potasio reaccionan con el agua, como lo haría el potasio
metálico. Por tanto, podemos afirmar que los iones poseen
propiedades distintas de las de los elementos de que derivan,
quedando así anulada la mayor de las objeciones que los
químicos opusieron a la teoría de la
disociación electrolítica.
5. ¿Por qué se adiciona el
almidón cerca del punto de equivalencia?
El almidón para esta titulación se utiliza
como indicador. Nos determinara a identificar El punto final de
la titulación la cual se pone de manifiesto por la
desaparición del color azul del complejo que el iodo forma
con el almidón.

Bibliografía
Para la realización del presente informe fue
necesario consultar la siguiente información
bibliográfica:

Anexos



I. DETERMINAR DE PORCETAJE DE HIPOCLORITO DE
SODIO Y CLORO UTIL. (CLORO DISPONIBLE)
Método a:
Peso de muestra | ||
Volumen | ||
Volumen | ||
Volumen gastado | ||
Normalidad del | ||
Método b:
Volumen de | ||
Volumen | ||
Volumen | ||
Volumen gastado | ||
Normalidad del | ||
II. DETERMINACION DE SODA RESIDUAL (%
NaOH)
Volumen de | ||
Volumen gastado con | ||
Volumen | ||
Volumen | ||
Volumen gastado | ||
Volumen gastado con | ||
Volumen | ||
Volumen | ||
Volumen gastado | ||
Normalidad del | ||
Autor:
Merly Geraldine Hidalgo
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |

















