- ¿Qué es un
equilibrio químico? - Ley de acción de
masas. Constante de equilibrio (Kc) - Constante de equilibrio
(Kp). Relación con KC - Grado de
disociación - Cociente de
reacción (Q) - Modificaciones del
equilibrio - Equilibrios
heterogéneos - Reacciones de
precipitación - Factores que afectan a
la solubilidad
¿Qué es un
equilibrio químico?
Es una reacción que nunca llega a completarse,
pues se produce simultáneamente en ambos sentidos (los
reactivos forman productos, y a
su vez, éstos forman de nuevo reactivos). Es decir, se
trata de un equilibrio dinámico.

Cuando las concentraciones de cada una de las sustancias
que intervienen (reactivos o productos) se estabiliza, es decir,
se gastan a la misma velocidad que
se forman, se llega al EQUILIBRIO
QUÍMICO.

ley de acción de
masas. Constante de equilibrio (Kc)
Para una reacción cualquiera (a A + b B + …. ?
c C + d D + …) se define la constante de equilibrio
(KC) de la siguiente manera:

siendo las concentraciones medidas en el
equilibrio (no confundir con las concentraciones iniciales de
reactivos y productos).
Se denomina constante de equilibrio, porque se observa
que dicho valor es
constante (dentro un mismo equilibrio) si se parte de cualquier
concentración inicial de reactivo o producto.
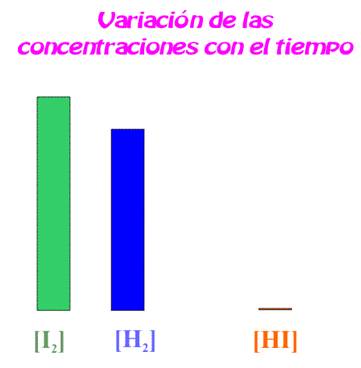
En la reacción anterior: H2 (g)+ I2
(g) ? 2 HI (g)

El valor de KC, dada su expresión,
depende de cómo se ajuste la reacción. Es decir, si
la reacción anterior la hubiéramos ajustado como:
½ H2 (g) + ½ I2(g) ? HI
(g), la constante valdría la raíz cuadrada
de la anterior.
La constante KC cambia con la temperatura.
¡ATENCIÓN!: Sólo se incluyen
las especies gaseosas y/o en disolución. Las especies en
estado
sólido o líquido tienen concentración
constante, y por tanto, se integran en la constante de
equilibrio.
Ejemplo:
Tengamos el equilibrio: 2 SO2(g) + O2(g) ? 2 SO3(g).
Se hacen cinco experimentos en
los que se introducen diferentes concentraciones iniciales de
ambos reactivos (SO2 y O2). Se produce la reacción y una
vez alcanzado el equilibrio se miden las concentraciones tanto de
reactivos como de productos observándose los siguientes
datos:

Kc se obtiene aplicando la expresión:

y como se ve es prácticamente
constante.
Ejercicio A:
Escribir las expresiones de KC para los siguientes
equilibrios químicos:
a) N2O4(g) ? 2 NO2(g); b) 2 NO(g) + Cl2(g)
? 2 NOCl(g);
c) CaCO3(s) ? CaO(s) + CO2(g); d) 2
NaHCO3(s) ? Na2CO3(s) + H2O(g) + CO2(g).
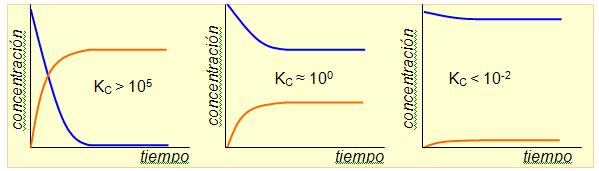
Significado del valor de Kc
Ejemplo:
En un recipiente de 10 litros se introduce una
mezcla de 4 moles de N2(g) y 12 moles de H2(g); a)
escribir la reacción de equilibrio; b) si
establecido éste se observa que hay 0,92 moles de NH3(g),
determinar las concentraciones de N2 e H2 en el equilibrio y la
constante Kc.

Ejercicio B:
En un recipiente de 250 ml se introducen 3 g de
PCl5, estableciéndose el equilibrio: PCl5(g) ( PCl3 (g) +
Cl2(g). Sabiendo que la KC a la temperatura del experimento es
0,48, determinar la composición molar del equilibrio.
(
Constante de equilibrio
(Kp). Relación con KC
En las reacciones en que intervengan gases es mas
sencillo medir presiones parciales que concentraciones.
Así en una reacción tipo: a A + b B ? c C + d D, se
observa la constancia de Kp viene definida por:

En la reacción: 2 SO2(g) +
O2(g) ( 2 SO3(g)
Página siguiente  |