b) En otro matraz erlenmeyer de 250 ml se
añadieron 25 ml de solución de ácido
acético aproximadamente 0,1 M, y luego se titulo con NaOH
aproximadamente 0,1 M. Una vez realizado este proceso se
anoto el volumen de NaOH
consumido.
c) Se agrego 10 ml de solución de vinagre blanco
en un matraz erlenmeyer más 20 ml de agua
destilada, dos gotas de fenolftaleína, y se titulo con
solución de NaOH aproximadamente 0,1 M. Hasta que se
observo un cambio de
color en la
solución del matraz. Se anoto el volumen de NaOH
consumido.
d) Se realizó el procedimiento
anterior, con 10 ml de jugo de naranja. Y luego, con 10 ml de
leche
bovina.

Figura 2. Aparato para
titulación
Resultados y
preguntas
Tabla 2. Puntos de equivalencias
obtenidos con NaOH 0,1 M & 25ml de
analito.
Titulante | Analito (25 ml) | Pto. equivalencia |
NaOH 0,1 M | HCl 0,1 M | 22,5 ml |
NaOH 0,1 M | CH3COOH 0,1 M | 21,5 ml |
NaOH 0,1 M | Jugo de naranja | 12 ml |
NaOH 0,1 M | Vinagre blanco | 45 ml |
NaOH 0,1 M | Leche bovina | 2 ml |
1. Construya la curva de valoración del
ácido clorhídrico (Ácido Fuerte), con el
Hidróxido de sodio (Base Fuerte), pH vs ml de
NaOH consumidos durante la valoración.
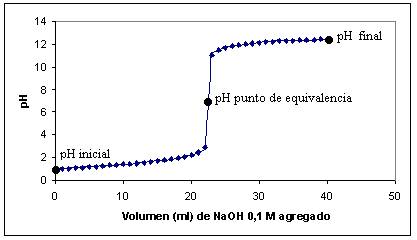
Figura 3. Curva de valoración
del HCl con NaOH
Tabla 3. Titulación de HCl
y CH3COOH con NaOH
Titulación de HCl con | Titulación de CH3COOH con | ||||
Volumen (ml) de 0,1M | pH | Volumen (ml) de 0,1M | pH | ||
0,0 | 1,00 | 0,0 | 2,88 | ||
1,0 | 1,04 | 1,0 | 3,45 | ||
2,0 | 1,07 | 2,0 | 3,77 | ||
3,0 | 1,11 | 3,0 | 3,97 | ||
4,0 | 1,15 | 4,0 | 4,12 | ||
5,0 | 1,19 | 5,0 | 4,24 | ||
6,0 | 1,23 | 6,0 | 4,34 | ||
7,0 | 1,27 | 7,0 | 4,44 | ||
8,0 | 1,31 | 8,0 | 4,53 | ||
9,0 | 1,36 | 9,0 | 4,61 | ||
10,0 | 1,40 | 10,0 | 4,70 | ||
11,0 | 1,45 | 11,0 | 4,78 | ||
12,0 | 1,50 | 12,0 | 4,86 | ||
13,0 | 1,56 | 13,0 | 4,94 | ||
14,0 | 1,62 | 14,0 | 5,03 | ||
15,0 | 1,68 | 15,0 | 5,12 | ||
16,0 | 1,75 | 16,0 | 5,22 | ||
17,0 | 1,84 | 17,0 | 5,33 | ||
18,0 | 1,93 | 18,0 | 5,47 | ||
19,0 | 2,05 | 19,0 | 5,64 | ||
20,0 | 2,21 | 20,0 | 5,88 | ||
21,0 | 2,44 | 21,0 | 6,38 | ||
22,0 | 2,93 | 21,5 | 8,61 | ||
22,5 | 7,00 | 22,0 | 11,03 | ||
23,0 | 11,02 | 23,0 | 11,49 | ||
24,0 | 11,49 | 24,0 | 11,71 | ||
25,0 | 11,70 | 25,0 | 11,85 | ||
26,0 | 11,84 | 26,0 | 11,95 | ||
27,0 | 11,94 | 27,0 | 12,02 | ||
28,0 | 12,02 | 28,0 | 12,09 | ||
29,0 | 12,08 | 29,0 | 12,14 | ||
30,0 | 12,14 | 30,0 | 12,19 | ||
31,0 | 12,18 | 31,0 | 12,23 | ||
32,0 | 12,22 | 32,0 | 12,27 | ||
33,0 | 12,26 | 33,0 | 12,30 | ||
34,0 | 12,29 | 34,0 | 12,33 | ||
35,0 | 12,32 | 35,0 | 12,35 | ||
36,0 | 12,35 | 36,0 | 12,38 | ||
37,0 | 12,37 | 37,0 | 12,40 | ||
38,0 | 12,39 | 38,0 | 12,42 | ||
39,0 | 12,41 | 39,0 | 12,44 | ||
40,0 | 12,43 | 40,0 | 12,45 | ||
2. Construya la curva de valoración del
ácido acético (ácido débil) con el
NaOH (base fuerte), pH vs ml de NaOH.

Figura 4. Curva de valoración
del HAc con NaOH
3. Señale en los gráficos, el pH inicial, o sea, antes de
adicionar NaOH; el pH del Punto de Equivalencia (punto final) y
el pH final, después de agregar 40 ml de NaOH.
4. Explique las diferencias y similitudes
que se observan en las curvas.

Figura 5. Relaciones entre las curvas
de valoración del HCl y el HAc con NaOH.
Una de las diferencias observadas entres las curvas de
valoración del HCl y el CH3COOH con el NaOH, es que en la
primera (curva I) el pH inicial es menor que en la segunda (curva
II), teniendo estas dos soluciones la
misma concentración.
El crecimiento del pH en función
del volumen de la base, en la curva I tiene un comportamiento
más exponencial en comparación con la curva II, la
cual muestra un cambio
menor de pH a la medida que se le agregaba el NaOH.
Para una reacción de neutralización de un
ácido fuerte con una base fuerte, el pH en el punto de
equivalencia siempre es igual a siete, y este valor para una
reacción de neutralización de un ácido
débil con una base fuerte es mayor que siete, ya que
dependerá del valor de pKa del ácido. En la grafica
se puede observar que el pH en el punto de equivalencia para el
CH3COOH es mayor que en el HCl (pH=7).
Una de las similitudes de las dos sustancias en la
grafica, es que después del valor de pH para el HCl en el
punto de equivalencia (pH=7), estas dos curvas tienden a
interponerse ya que los valores de
pH después de este punto tienden a ser iguales.
5. Calcule el %(p/p) o %(p/v) de ácido
acético en el vinagre, del ácido láctico en
la leche y del ácido cítrico en jugo de
naranja.
Tabla 4. Porcentaje peso volumen
de los ácidos en
las soluciones
Ácido | Masa molecular | C NaOH | Vol. NaOH | Volumen Sln. | C ácido | Mol ácido | Peso ácido | % P/V | ||||
Acético | 60,05 g/mol | 0,1M | 45 ml | 30 ml | 0,1500 | 4,5×10-3 | 0,270 g | 0,90 | ||||
Cítrico | 192,13 g/mol | 0,1M | 12 ml | 30 ml | 0,0400 | 1,2×10-3 | 0,231 g | 0,77 | ||||
Láctico | 90,08 g/mol | 0,1M | 2 ml | 30 ml | 0,0067 | 2,0×10-4 | 0,018 g | 0,06 | ||||
Conclusiones
Para terminar podemos decir que dependiendo al rango de
pKa que contenga o presente el ácido débil o la
base débil que se vaya titular este presentara un valor de
pH diferente, y el punto de equivalencia variara en
comparación a las diferentes soluciones trabajadas. Por
otro lado se pudo observar el volumen en el cual el número
de moles de H3O+ era igual al número de moles de OH- . Se
concluye que una de las formas más simples y
fáciles de comprender una reacción de
neutralización es a través del uso de las curvas de
valoración, ya que en estas se resumen las
características generales en este tipo de
reacciones.
Además aprendimos que para poder apreciar
el cambio de ácido a base o viceversa, el ojo humano no lo
detecta fácilmente y por eso es indispensable el uso de un
buen indicador, el indicador a utilizar dependerá del
rango de pH que estemos trabajando. Se deduce que en cada etapa
de la titulación, se debe satisfacer la expresión
[H3O+]?[OH-] ? 1?10-14.
Recomendaciones
Para obtener unos resultados más exactos, hay que
tener más en cuenta los siguientes
parámetros:
? Un buen espacio en el lugar de trabajo y una
buena organización de él, es decir buena
ubicación de los reactivos y materiales con
los cuales vamos a trabajar.
? Buscar las condiciones ideales a la hora de realizar
la practica (temperatura,
humedad, presión,
etc.).
? Poseer los reactivos necesarios (completos), para
mejor conocimiento y
mejor diversidad de procedimientos y
resultados.
? Una buena limpieza por parte de los materiales, y alta
pureza por parte de los reactivos, para así obtener
resultados precisos.
? Tener cuidado cuando se manipulan los ácidos
fuertes concentrados, porque son irritantes y muy
tóxicos.
Fuentes de
información
7.1.
Bibliografía
? HARRIS, Daniel. Análisis químico cuantitativo.
3ª edición.
México: Grupo
Editorial Iberoamérica S.A, 1993
? BURNS, Ralph: Fundamentos de Química, 2ª
edición.
Buenos Aires: Editorial Pentice – Hall
Hispanoamericana,
? WOOD, Jesse: Química General, editorial
HARLA.
Autor:
Juan Quevedo
Yuri Vargas

Facultad de Ciencias
Básicas
Programa de Química
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |