Sinopsis: Síntesis y reacciones de los principales compuestos orgánicos (página 2)
El primer paso de la reacción se denomina
iniciación, y los dos siguientes pasos se
denominan propagación de la cadena. Cuando
dos especies radicales chocan entre sí, el proceso se
denomina terminación.
I.-
Iniciación:
![]()
II.-
Propagación:

III.-
Terminación:

En principio, solamente una molécula de cloro a
de experimentar la ruptura homolítica para transformar
muchos moles de metano y cloro en
cloruro de metileno y HCl. En la práctica, el proceso en
cadena recorre una media de 10.000 ciclos antes de finalizar. La
terminación del proceso se produce cuando dos radicales
chocan entre sí.
Existe un tipo de compuestos para el que la
cloración tiene utilidad
práctica en las preparaciones de laboratorio.
Cuando todos los hidrógenos son equivalentes, existe
sólo un producto
monoclorado posible. En tales casos, el producto deseado puede
ser separado del hidrocarburo y las especies cloradas mediante la
destilación fraccionada de la mezcla. Dos
ejemplos son la cloración del ciclohexano y la del
2,2-dimetilpropano.


El mecanismo de cloración puede ser aplicado
también a los otros halógenos, pero las reacciones
muestran importantes diferencias.
La selectividad del bromo en comparación
con la del cloro se hace más evidente cuando el alcano
tiene hidrógenos terciarios. Por ejemplo, cuando el
2,2,3-trimetilbutano se somete a bromación, se obtiene
más de un 96 por 100 del bromuro de terciario, a pesar de
que el alcano tiene solamente un hidrógeno terciario frente a quince
hidrógenos primarios.

(96 por 00)
Así pues, la bromación es un
procedimiento
un poco más útil que la cloración para
propósitos preparativos. Sin embargo, cuando existe
solamente un hidrógeno terciario y muchos secundarios en
una molécula, se seguirán produciendo mezclas muy
complejas.
Halogenuros de
alquilo
Los halogenuros de alquilo como ya se tiene dicho,
pueden obtenerse mediante halogenación por radicales de
alcanos, pero
este método es
de poca utilidad general dado que siempre resultan mezclas
de productos.
Los halogenuros de alquilo también pueden
formarse a partir de alquenos. Estos últimos se unen a HX,
y reaccionan con NBS para formar el producto de bromación
alílica. La bromación de alquenos con NBS es un
proceso complejo por radicales que ocurre a través de un
radical alilo. Los radicales alilos son estabilizados por
resonancia y pueden representarse de dos maneras, ninguna de las
cuales es correcta por sí misma. La verdadera estructura del
radical alilo se describe mejor como una mezcla o híbrido
de resonancia de las dos formas resonantes
individuales.
Los alcoholes
reaccionan con HX para formar halogenuros de alquilo, pero este
método sólo funciona bien para alcoholes
terciarios, R3C-OH. Los halogenuros de alquilo primarios y
secundarios normalmente se obtienen a partir de alcoholes usando
SOCl2 o PBr3. Los halogenuros de alquilo reaccionan con magnesio
en solución de éter para formar halogenuros de
alquil-magnesio, o reactivos de Grignard
RMgX. Algunos reactivos de Grignard son tanto nucleófilos
como básicos, y reaccionan con ácidos de
Bronsted para formar hidrocarburos.
El resultado global de la formación del reactivo de
Grignard y su protonación es la transformación de
un halogenuro de alquilo en un alcano (R-X ? RMgX ?
R-H).
Los halogenuros de alquilo también reaccionan con
litio metálico para formar compuestos de alquil-litio,
RLi, que en presencia de CuI forman diorganocupratos o
reactivos de Gilman, R2CuLi.
Estos reaccionan con halogenuros de alquilo para formar
hidrocarburos de acoplamiento como productos. (conocida como
reacción de Corey – House).
Como los halógenos son más
electronegativos que el carbono, el
enlace resultante entre ambos resulta polarizado, el átomo de
carbono tiene una ligera carga positiva (d+), mientras que el
átomo de halógeno tiene una ligera carga negativa
(d-).

Dado que el átomo de carbono de los halogenuros
de alquilo está polarizado positivamente, estos compuestos
son buenos electrófilos. Se verá que gran parte de
la química de
los halogenuros de alquilo está determinada por su
carácter electrófilo.
OBTENCIÓN DE LOS HALOGENUROS DE
ALQUILO
1.- A
partir de alquenos por bromación
alílica.

Ejemplo:

2.- A partir
de alquenos por adición de HBr y HCl.

Ejemplo:

3.- A
partir de alcoholes.
(a) Reacción con HX, donde X = Cl, Br o I; Orden de
reactividad: 3º >2º > 1º.

Ejemplo:

(b) Reacción de alcoholes primarios y secundarios con
SOCl2 en piridina.

Ejemplo:

(c) Reacción de alcoholes primarios y secundarios
con PBr3, en éter.

Ejemplo:

1.- BROMACIÓN ALÍLICA DE
ALQUENOS.
En 1942, Karl Ziegler informó que al repetir
algunos trabajos previos de Wohl, observó que los alquenos
reaccionaban con N-bromosuccinimida (que se abrevia NBS) en
presencia de luz, para formar
productos que resultan de la sustitución de
hidrógeno por bromo en la posición adyacente al
doble enlace (la posición alílica). Por
ejemplo, el ciclohexeno se convierte en 3-bromocioclohexeno, con
un 85% de rendimiento:

Cicloheheno
3-bromociclohexeno
(85%)
Esta bromación alílica con NBS es muy
parecida a la reacción de halogenación de alcanos:
En ambos casos se rompe un enlace C-H de un carbono saturado, y
el átomo de hidrógeno es reemplazado por un
halógeno. La analogía es adecuada, pues se ha
demostrado que las bromaciones con NBS efectivamente ocurren a
través de un mecanismo por radicales. Si bien el mecanismo
exacto de la reacción es complejo, el paso crucial que
determina el producto implica la sustracción de un
átomo de hidrógeno alílico y la
formación del radical correspondiente. El radical
reacciona luego con Br2 para formar el producto y un radical
bromo, que regresa a la reacción para continuar la cadena.
El Br2 necesario para la reacción con el radical alilo es
producido por una reacción concurrente de HBr con
NBS.
Mecanismo:


¿Por qué la bromación ocurre
exclusivamente en la posición vecina al doble enlace y no
en cualquiera de las otras posiciones? Una vez más, la
respuesta se encuentra examinando las energías de
disociación de enlace para ver las estabilidades de
los diversos tipos de radicales.

Además de influir en la estabilidad, la
deslocalización de los electrones no pareados en el
radical alilo tiene consecuencias químicas. Dado que el
electrón no pareado está distribuido en ambos
extremos de la del sistema de
orbitales pi, la bromación alílica de un alqueno
asimétrico con frecuencia produce una mezcla de productos.
Por ejemplo, la bromación del 1-octeno produce una mezcla
de 3-bromo-1-octeno y 1-bromo-2-octeno. Debido a que el radical
alilo intermediario es en este caso asimétrico, la
reacción no es igualmente probable en ambos extremos, y
los dos productos no se forman en cantidades iguales.

Explicación mecanistica:

Dado que en la bromación de alquenos
asimétricos se forman mezclas de productos, la
bromación alílica transcurre mejor en alquenos
simétricos, como el ciclohexeno. Los productos de esas
reacciones son particularmente útiles para su
conversión en dienos por deshidrohalogenación con
base.

2.- OBTENCIÓN DE
HALOGENUROS DE ALQUILO A PARTIR DE ALCOHOLES.
El mejor método para producir halogenuros de
alquilo es la síntesis a
partir de alcoholes. El método más sencillo (aunque
generalmente el menos útil) para la conversión de
un alcohol en un
halogenuro de alquilo consiste en el tratamiento del alcohol con
HCl, HBr o HI:

El método funciona bien cuando es aplicado a
alcoholes terciarios, R3C-OH. Los alcoholes secundarios y
primarios también reaccionan pero a velocidades menores y
a temperaturas de reacción considerablemente altas. La
reacción de HX con un alcohol terciario es tan
rápida que a menudo se efectúa simplemente
burbujeando el HX gaseoso puro en una solución fría
de alcohol en éter. La reacción suele realizarse en
unos cuantos minutos.

La mejor forma de transformar los alcoholes
primarios y secundarios en halogenuros de alquilo es
tratándolos con reactivos como el cloruro de tionilo
(SOCl2) o tribromuro de fósforo (PBr3). Estas reacciones
normalmente ocurren en condiciones suaves, menos ácidas, y
es menos probable que ocasionen transposiciones catalizadas por
ácido que el método con HX.


Como indican los ejemplos anteriores, el rendimiento de
las reacciones con PBr3, y el SOCl2 generalmente es alto. No
suelen interferir otros grupos
funcionales como éteres, carbonilos o anillos
aromáticos.
Reacciones de los halogenuros de
alquilo
1.-
Formación de reactivos de Grignard.

donde X = Br, Cl, o I
R =
Alquilo 1º, 2º, 3º, arilo o vinilo
Ejemplo:

2.-
Formación de diorganocupratos (reactivos de
Gilman).

R = alquilo 1º, 2º , 3º, arilo o vinilo
Ejemplo:


Ejemplo:

3.-
Acoplamiento de compuestos organometalicos.

Ejemplo:

4.-
Conversión de halogenuros de alquilo en
alcanos.

Ejemplo:

Reacciones de los halogenuros de
alquilo (SUSTITUCIONES
NUCLEOFÍLICAS)
Ya tenemos claro que el enlace carbono-halógeno
de los halogenuros de alquilo es polar, y que el átomo de
carbono es deficiente de electrones. Por lo tanto, los
halogenuros de alquilo son electrófilos y gran parte de su
comportamiento
químico implica reacciones polares con nucleófilos.
Cuando un halogenuro reacciona con un nucleófilo pueden
suceder dos cosas: una sustitución del grupo X por el
nucleófilo, (Reacciones de Sustitución
nucleofílicas), o una eliminación de HX para
producir un alqueno (Reacciones de Eliminación),
que serán estudiadas en la siguiente
sección.
SUSTITUCIÓN
NUCLEOFÍLICA
Las sustituciones nucleofílicas son de dos tipos:
reacción SN2 y reacción SN1.(aunque
se suel mencionar un tercer tipo como una sustitución
nucleofílica interna SNi). En la primera, el
nucleófilo entrante ataca al halogenuro desde una
posición a 180º respecto al grupo saliente, lo que da
por resultado una inversión de la configuración cuando
en carbono en cuestión es quiral (análoga a la
inversión de un paraguas por el viento) en el átomo
de carbono. La reacción tiene cinética de segundo
orden, y es fuertemente inhibida conforme aumenta el volumen
estérico de los reactivos. Por tanto, las reacciones SN2
se ven favorecidas sólo para sustratos primarios y
secundarios.
La reacción SN1 ocurre cuando el sustrato se
disocia de manera espontánea para formar un
carbocatión en un paso limitante de la velocidad
lento, seguido por un ataque rápido del nucleófilo.
En consecuencia, las reacciones SN1 tienen cinética de
primer orden, y ocurren con racemización de la
configuración en el átomo de carbono cuando
éste es quiral. Estas reacciones se ven favorecidas para
los sustratos terciarios.
Reacciones SN2
1.- Estas reacciones ocurren con
inversión completa de la estereoquímica del carbono
estereogénico.
2.- Estas reacciones presentan una
cinética de segundo orden y obedecen a la siguiente
ley de
velocidad: Velocidad = k · [RX] ·
[Un].
3.- Su mecanismo es en un sólo
paso, formándose un estado de
transición.
Ejemplos.


El mecanismo es concertado, en un solo paso de
reacción.


¿Qué mecanismo explica la
estereoquímica observada y la cinética de segundo
orden para estas reacciones?
La característica esencial del mecanismo de
reacción SN2 formulado por Hughes e Ingold en 1937, es que
la reacción transcurre en un solo paso, sin intermedio.
Cuando el nucleófilo entrante ataca el sustrato desde una
posición a 180º del grupo saliente, se forma un
estado de transición, en el cual comienza a formarse el
enlace nucleófilo carbono y simultáneamente
comienza a romperse el enlace grupo saliente carbono,
invirtiéndose la configuración
estereoquímica de la molécula. Este proceso se
muestra para
la reacción de (S)-2-bromobutano con ion
hidróxido, lo que da por resultado
(R)-2-butanol.
|
|
CARACTERÍSTICAS DE LA REACCIÓN
SN2
El estudiante ya tendrá una buena idea de
cómo ocurren las reacciones SN2, pero también es
necesario saber cómo pueden usarse estas sustituciones y
qué variables las
afectan. Algunas reacciones SN2 son rápidas y otras son
lentas; algunas tienen altos rendimiento, y otras rendimientos
bajos, etc. La velocidad de una reacción química es
determinada por la energía de activación (?G?), la
diferencia de energía entre los reactivos y el estado de
transición. Otros factores son.
EFECTO ESTÉRICO EN LA REACCIÓN
SN2.
La primera variable por observar de una reacción
SN2 es el volumen estérico del halogenuro de alquilo. Como
la reacción implica la formación de un estado de
transición parece razonable esperar que un sustrato
voluminoso, impedido, dificultará el acercamiento del
nucleófilo, y de este modo será más
difícil alcanzar el estado de transición. En otras
palabras los sustratos estéricamente voluminosos, en los
cuales el átomo de carbono está protegido contra el
ataque del nucleófilo, reaccionan con mayor lentitud que
los sustratos menos impedidos. Como se muestra para los
siguientes casos, la dificultad para el ataque
nucleofílico se eleva a medida que aumenta el
tamaño de los tres sustituyentes unidos al átomo de
carbono.
Impedimento estérico a la
reacción SN2. Como se indican en estos modelos, el
átomo de carbono en (a), bromometano, es fácilmente
accesible, lo que da por resultado una reacción SN2
rápida. Los átomos de carbono en (b),
bromoetano (primario), en (c), 2-bromopropano (secundario) y en
(d), 2-bromo-2-metilpropano (terciario), son sucesivamente menos
accesibles, lo que da por resultado reacciones SN2 cada
vez más lentas.
Las reactividades relativas de algunos sustratos
son como sigue:
CH3-Br ( CH3-CH2-Br ( (CH3)2-CH-Br (
(CH3)3-C-Br
metilo
primario
secundario
terciario
Ejemplo: Para la reacción
R-Br + Nu- = R-Nu +
Br- (SN2)
Grupo R | Velocidad |
| 30 |
| 1 |
| 0.4 |
| 0.002 |
| 0.001 |
| 0.00001 |
Nucleófilo
atacante
La naturaleza del
nucleófilo atacante es una segunda variable con notable
efecto en las reacciones SN2. Cualquier especie que sea neutra o
cargada negativamente, puede actuar como nucleófilo,
siempre y cuando tenga un par de electrones no compartidos (es
decir, que sea una base de Lewis). Si el nucleófilo tiene
carga negativa, el producto es neutro, pero si el
nucleófilo es neutro el producto queda con carga
positiva.
Las especies nucleofílicas cargadas suelen ser
mejores nucleófilos que las especies neutras, entre
especies de igual naturaleza el mejor criterio a emplear es el
del número atómico, del tal forma que aquellos que
tengan el mayor número atómico serán mejores
especies nucleofílicas que las de menor número
atómico.
La nucleofília exacta de una especie en una
reacción dada depende de muchos factores, como la
naturaleza del sustrato, la identidad del
solvente, e incluso la concentración de los reactivos.
Aunque no hay explicaciones precisas para las nucleofílias
observadas pueden detectarse algunas tendencias en los datos:
1. La nucleofília es aproximadamente
paralela a la basicidad cuando se comparan nucleófilos que
tienen el mismo átomo atacante. El ion hidróxido
por ejemplo, es más básico y más
nucleófilo que el agua.
(Tabla 10.1).
2. La nucleofília suele aumentar al
descender por una columna en la tabla
periódica. Así, por ejemplo el HS- es
más nucleófilo que el OH-.
3. La correlación de la
nucleofília con la basicidad no es útil para
comparar átomos de una misma familia. Al
aumentar el número atómico, aumenta la nucleofilia
y disminuye la basicidad. (Tabla 10.2).
Tabla 10.1.-
Nucleofília | Nucleófilos con | Nucleófilos con | Nucleófilos con | Basicidad |
? | H2N- | C2H5O- | H2N- | ? |
? | C2H5NH2 | HO- | HO- | ? |
? | H3N | C6H5O- | H3N | ? |
? | C6H5NH2 | CH3CO2- | H2O | ? |
? | p-NO2C6H4NH2 | H2O | – | ? |
Tabla 10.2.-
Nucleofília | Nucleófilos del Grupo | Nucleófilos del Grupo | Nucleófilos del Grupo | Basicidad |
? | R3P | RS- | I- | |
? | R3N | RO- | Br- | |
? | – | – | Cl- | |
? | – | – | F- |
Grupo saliente
Otra variante que puede influir en gran medida en la
reacción SN2 es la naturaleza del grupo
saliente.
Tabla 10.3.-
Relación entre la capacidad
como grupo saliente y la acidez del ácido
conjugado
Grupo Saliente | pKa del ác. | Habilidad como G. |
p-CH3C6H4SO3- (OTs) I- Br- H2O (CH3)2S Cl- |
< 0> |
Muy Buenos Grupos |
CF3CO2- | 0.2 | " |
H2PO4- | 2 | " |
CH3CO2- | 4.8 | " |
CN- | 9.1 |
|
NH3 | 9.2 |
|
C6H5O- | 10 | Buenos Grupos Salientes |
RNH2, R3N | 10 |
|
C2H5S- | 10.6 |
|
HO- | 15.7 | Malos Grupos Salientes |
CH3O- | 15.0 | " |
NH2- | 36 | Muy Malos G. Salientes |
CH3- | 49 | " |
Dado que éste es expulsado con carga negativa en
la mayoría de las reacciones SN2, es de esperar que los
mejores grupos salientes sean aquellos que estabilicen mejor la
carga negativa. Más aún puesto que la estabilidad
de un anión se relaciona con la basicidad, puede decirse
que los mejores grupos salientes serán las bases
más débiles (a menor pKa del ácido
conjugado que genere, (ver Tabla 10.3).
Tan importante como saber cuales son buenos grupos
salientes es saber cuales no lo son, los datos anteriores indican
con claridad que F-, OH-, OR- y NH2- no son desplazados por
nucleófilos. En otras palabras fluoruros de alquilo,
alcoholes, éteres y aminas no experimentan reacciones SN2
en circunstancias normales.
Disolvente
Las velocidades de muchas reacciones SN2 se ven
afectadas por el disolvente que se use. Los disolventes
próticos, que contienen grupos -OH, suelen ser los peores
para las reacciones SN2, mientras que los disolventes
apróticos polares, que tienen dipolos fuertes pero carecen
de -OH o -NH, son los mejores.
Los disolventes próticos, como metanol y etanol,
retardan las reacciones SN2 porque afectan el nivel de
energía del reactivo nucleófilo y no el nivel de
energía del estado de transición. Las
moléculas de disolventes próticos son capaces de
formar enlaces de hidrógeno con los nucleófilos
cargados negativamente, creando una "jaula" alrededor del
nucleófilo. Esta solvatación estabiliza
fuertemente al nucleófilo, reduciendo su reactividad hacia
los electrófilos en la reacción SN2.

Un nucleófilo
solvatado
su nucleofília reducida por
el incremento en la estabilidad del estado
fundamental
En contraste con lo que sucede en el caso de los
disolventes próticos, los disolventes polares
apróticos favorecen las reacciones SN2. Son
particularmente valiosos el acetonitrilo, CH3CN, la
dimetilformamida, (CH3)2NCHO (DMF), el dimetilsulfóxido,
(CH3)2SO (DMSO); y la hexametilfosforamida [(CH3)2N]3PO
(HMPA).
Tabla 10.4.-
POLAR | Disolventes | Cte. Dieléctrica a | Disolventes |
H2O | 81 |
| |
HCO2H | 59 |
| |
| 45 | (CH3)2SO (DMSO) | |
| 39 | CH3CN | |
| 37 | HCON(CH3)2 (DMF) | |
CH3OH | 33 |
| |
| 30 | HMPA | |
CH3CH2OH | 24 |
| |
| 23 | (CH3)2CO (Acetona) | |
(CH3)2CHOH | 18 |
| |
(CH3)3COH | 11 |
| |
| 7 | THF | |
CH3CO2H | 6 |
| |
| 4 | (C2H5)2O (éter) | |
| 2 | n-C5H12; C6H6; | |
NO POLAR (APOLAR) |
|
|
|
Estos disolventes son capaces de disolver muchas sales
debido a su alta polaridad, y tienden a rodear a los cationes
metálicos en vez de hacerlo con los aniones
nucleófilos, de este modo los nucleófilos no
están solvatados y la nucleofilia es mucho más
efectiva.
La polaridad del disolvente es medida generalmente por
su constante dieléctrica, (D), que es una
indicación sobre la facilidad del medio de reacción
para acomodar especies cargadas. (ver Tabla 10.4) Las
reacciones que transcurren con un mecanismo SN2, son más
favorables en disolventes polares apróticos, y las que
transcurren con un mecanismo SN1 son más favorables en
disolventes polares en general, ya que el paso que controla la
velocidad es la formación de un
carbocatión.
Obsérvese que a mayor constante
dieléctrica, mayor es la polaridad, es decir un
mayor poder de
ionización del disolvente, según el poder
ionizante del disolvente y el tipo de reacción que se
esté tratando los efectos del medio de reacción
sobre las velocidades de las reacciones de sustitución
nucleófila son:
Mecanismo |
Reacción | Efecto de incrementar el poder ionizante del |
SN1 | R-L ? R+ + | Gran |
SN2 | Nu- + R-L ? R-Nu | Pequeña |
SN2 | Nu + R-L ? R-Nu+ | Gran |
SN2 | Nu- + R-L+ ? R-Nu | Gran |
Reacciones
SN1
Es notable el hecho de que el panorama es del todo
distinto cuando se utilizan diferentes condiciones de
reacción. Cuando se tratan en disolventes próticos
con nucleófilos no básicos en condiciones de
neutralidad o acidez, los sustratos terciarios a menudos
reaccionan varios miles de veces más rápido que los
primarios o secundarios. Por ejemplo la reacción de los
alcoholes con HX para obtener halogenuros de alquilo tiene la
rapidez máxima en el caso de alcoholes terciarios y la
mínima en el caso del metanol:
R-OH + HX ?
R-X + H2O
R3COH > R2CHOH > RCH2OH
> CH3OH
3º
2º
1º
Metanol
Más
reactivo ? Menos
reactivo
La misma tendencia se observa
en muchas reacciones de sustitución en las cuales los
sustratos se calientan con nucleófilos no básicos
en solventes próticos: Los sustratos terciarios reaccionan
mucho más rápido que los primarios o secundarios.
Por ejemplo, a continuación se presentan las velocidades
relativas de reacción con agua de
algunos halogenuros de alquilo. Se observa que el
2-bromo-2-metilpropano es más de un millón de veces
más reactivo que el bromoetano.
R-Br + H2O
R-OH + H-Br
(CH3)3CBr > (CH3)2CHBr >
CH3CH2Br> CH3Br
Reactividad relativa
1,200
0,012
0,001
0,0001
¿Qué sucede?
Es claro que se trata de reacciones de sustitución
nucleofilica, aunque el orden de reactividad parece invertido.
Estas reacciones no pueden estar ocurriendo por el mecanismo que
hemos venido considerando, y por tanto se concluye que existe un
mecanismo de sustitución alternativo. Este mecanismo
alternativo se llama reacción SN1 (que indica
sustitución nucleofilica unimolecular).
Cinética de la reacción
SN1
Se encuentra que la velocidad de la reacción
depende sólo de la concentración del halogenuro de
alquilo y es independiente de la concentración del
nucleófilo. En otras palabras, esta reacción es un
proceso de primer orden. Sólo una molécula
participa en el paso cuya cinética se determina. La
expresión para la velocidad puede escribirse como
sigue:
Velocidad de reacción = Rapidez
de desaparición del halogenuro de alquilo = k
· [RX]
La rapidez de esta reacción SN1 es
igual a un coeficiente de velocidad k por la concentración
del halogenuro de alquilo. La concentración del
nucleófilo no aparece en la expresión de velocidad.
Muchas reacciones orgánicas son muy complejas y
transcurren en pasos sucesivos. Uno de estos pasos suele ser
más lento que los otros, y se le llama paso
limitante de la velocidad. Ninguna reacción puede
transcurrir más rápido que su paso limitante de
velocidad, el cual actúa como un cuello de
botella.

Diagrama de energía para
una reacción SN1. El paso limitante de la velocidad es la
disociación del halogenuro de alquilo.
ESTEREOQUÍMICA DE LA
REACCIÓN SN1.
Si es correcto el postulado de que las reacciones SN1
ocurren a través de carbocationes intermediarios, las
consecuencias estereoquímicas deben ser distintas de las
propias de las reacciones SN2. Los carbocationes son especies
planares con hibridación sp2, y por tanto son aquirales.
De este modo, si se efectúa una reacción SN1 con un
enantiómero de un reactivo quiral y se pasa por un
intermediario simétrico aquiral, el producto debe ser
ópticamente inactivo.

El carbocatión intermediario simétrico
puede ser atacado por un nucleófilo indistintamente por el
lado derecho o por el lado izquierdo, lo que produce una mezcla
50 : 50 de enantiómeros; es decir, una mezcla
racémica.
Características de la
reacción SN1
Así como la reacción SN2 es fuertemente
influida por variables como disolvente, grupo saliente,
estructura del sustrato y naturaleza del nucleófilo
atacante, también lo es la reacción SN1. Los
factores que reducen la energía de activación, ya
sea estabilizando el estado de transición que conduce a la
formación del carbocatión intermediario o elevando
el nivel de energía de los reactivos, favorecen las
reacciones SN1 haciéndolas más rápidas. A la
inversa, los factores que incrementan la energía de
activación, ya sea desestabilizando el estado de
transición que conduce al carbocatión intermedio o
reduciendo el nivel de energía de los reactivos,
retardando la reacción SN1.
Sustrato
Según el postulado de Hammond, cualquier factor
que estabilice un intermediario de alta energía
estabilizará también el estado de transición
que conduce a dicho intermediario. Dado que el paso limitante de
la velocidad en la reacción SN1 es la disociación
unimolecular espontánea del sustrato, es de esperar que la
reacción se vea favorecida siempre que se formen
carbocationes intermediarios estabilizados. Esto es exactamente
lo que se observa: cuanto más estable es el
carbocatión intermediario, tanto más rápida
es la reacción SN1.
Como resultado de la estabilización por
resonancia en los carbocationes alílicos y
bencílicos, los carbocationes tienen el siguiente orden de
estabilidad. Nótese que un carbocatión
alílico o bencílico primario es casi tan estable
como un carbocatión alquilo secundario. De manera similar,
un carbocatión alílico o bencílico
secundario es tan estable como un carbocatión alquilo
terciario.

El orden de estabilidad de los carbocationes es
exactamente igual al orden de reactividad en las reacciones SN1
de los halogenuros de alquilo y los tosilatos. Haciendo un
paréntesis, debe mencionarse que los sustratos
alílicos y bencílicos son particularmente reactivos
en las reacciones SN2 así como en las SN1. Los enlaces C-X
alílicos y bencílicos son aproximadamente 10
kcal/mol más débiles que los correspondientes
enlaces saturados, y por tanto se rompen con mayor
facilidad.
GRUPO SALIENTE.
Durante el estudio de la reactividad SN2, se dedujo que
los mejores grupos salientes deberían ser los más
estables -es decir, las bases conjugadas de ácidos
fuertes-. Para la reacción SN1 se encuentra un orden de
reactividad idéntico, debido a que el grupo saliente
participa de manera decisiva en el paso limitante de la
velocidad. Así, se encuentra que el orden de reactividad
SN1 es:
TosO- > I- > Br- >
Cl- > H2O
Más
reactivo
>
Menos reactivo

Mecanismo de la reacción
SN1 de un alcohol terciario con HBr para formar un halogenuro de
alquilo. El grupo saliente es agua (neutra).
Nótese que en la reacción
SN1, la cual a menudo se realiza en condiciones ácidas, el
agua (neutra) puede actuar como grupo saliente. Este es el caso,
por ejemplo, cuando se elabora un halogenuro de alquilo a partir
de un alcohol terciario, por reacción con HBr o HCl. El
alcohol se protona primero y después pierde agua para
generar un carbocatión. La reacción posterior del
carbocatión con el ion halogenuro produce el halogenuro de
alquilo.
NUCLEÓFILO.
La naturaleza del nucleófilo atacante es decisiva
en la reacción SN2. En la reacción SN1 no lo
es. Por su propia naturaleza las reacciones SN1 proceden
a través de un paso determinante de la velocidad en el
cual el nucleófilo agregado no interviene en la
cinética. El nucleófilo no participa en la
reacción hasta que ha ocurrido la disociación
limitante de la velocidad. No importa su naturaleza
nucleofilica.
DISOLVENTE.
El efecto del disolvente tiene una gran importancia en
las reacciones SN1, pero de manera muy distinta a las reacciones
SN2. El postulado de Hammond establece que cualquier factor que
estabilice el carbocatión intermediario
incrementará la velocidad de reacción. La
solvatación -estabilización del
carbocatión por interacción con moléculas del
solvente– puede tener exactamente tal efecto. Si bien no
es fácil definir la naturaleza precisa de la
estabilización del carbocatión por el solvente,
podemos representar las moléculas de este último
orientadas alrededor del catión, de manera que los
extremos ricos en electrones de los dipolos del solvente queden
frente a la carga positiva.

Solvatación de un
carbocatión en agua. Los átomos de oxígeno
(ricos en electrones) del solvente rodean al catión (con
carga positiva) para estabilizarlo.
Las reacciones SN1 ocurren con mucha mayor rapidez en
solventes altamente polares que en solventes no polares. Por
ejemplo, en la reacción del 2-cloro-2-metil-propano se
observa un factor de incremento de 100.000 al pasar al del
etanol, un solvente polar, al agua, aún más polar.
(CH3)3C-Cl +
ROH ? (CH3)3C-OR
+ HCl
Agua Etanol acuoso al 80
% Etanol acuoso al 40 % Etanol
puro
100
14
0.1
0.001
Más
reactivo ?
REACTIVIDAD ?
Menos reactivo
RESUMEN
Características | SN1 | SN2 |
Mecanismo | En dos pasos, uno lento y otro
I)lento R-L ? R+ + L- II)Rápido R+ + Nu- ? RNu |
En un solo paso
R-L + Nu- ? R-Nu + L- |
Cinética | De primer orden | De segundo orden |
Nucleofilia del reactivo | No afecta a la | Controla la velocidad, |
Estructura del átomo | 1) Estabilización por 2) FAVORABLE 3º > 2º | 1) Impedimento estérico 2) CH3 > 1º > 2º > |
Efectos del | Favorecida por disolventes | Favorecidas en disolventes |
Estereoquímica | Racemización | Inversión |
Condiciones de |
Generalmente ácidas |
Generalmente |
Reacciones de |
Eliminación (E1) y |
Eliminación (E2) |
Debe insistirse en el hecho de que tanto en la
reacción SN1 como en la SN2 el solvente ejerce un gran
efecto, aunque por razones distintas. Las reacciones SN2 son
desfavorecidas por los solventes próticos debido a que el
nivel de energía del estado fundamental del
nucleófilo atacante disminuye por solvatación. Las
reacciones SN1, en contraste, son favorecidas por los solventes
próticos debido a que el nivel de energía del
estado de transición que conduce al carbocatión
intermediario disminuye por la solvatación.
HALOGENUROS DE ALQUILO. (REACCIONES DE
ELIMINACIÓN)
Las eliminaciones de halogenuros de alquilo para
producir alquenos también transcurren por dos mecanismos,
la reacción E2 y la reacción E1. En
la primera, una base sustrae un protón al mismo tiempo que se
separa el grupo saliente. La reacción E2 procede
preferentemente a través de un estado de transición
periplanar anti, en el cual los cuatro
átomos reaccionantes -el hidrógeno, los dos
carbonos y el grupo saliente- están en el mismo plano. La
reacción presenta cinética de segundo orden y un
efecto isotópico de deuterio, y ocurre cuando un
sustrato secundario o terciario se trata con una base fuerte.
Estas reacciones de eliminación suelen producir una mezcla
de alquenos en la cual predomina el alqueno más sustituido
(regla de Zaitsev).
La reacción E1 se efectúa cuando el
sustrato se disocia espontáneamente para formar un
carbocatión en un paso limitante de la velocidad (lento),
con la pérdida posterior de un protón
vecino. La reacción tiene cinética de primer orden,
no presenta efecto isotópico de deuterio y ocurre cuando
un sustrato terciario reacciona en una solución no
básica polar.
REACCIONES DE
ELIMINACIÓN

Cuando un nucleófilo o una base de Lewis atacan a
un halogenuro de alquilo, son posibles dos tipos de reacciones.
El reactivo puede atacar al átomo de carbono y sustituir
al halogenuro, o puede atacar a un hidrógeno y causar la
eliminación de HX para formar un alqueno.
Las reacciones de eliminación son más
complejas que las de sustitución, por varias razones.
Existe el problema de la regioquímica: ¿Qué
productos resultarán de la deshidrohalogenación de
halogenuros asimétricos? En efecto, las reacciones de
eliminación casi siempre producen mezclas de alqueno y
usualmente lo más que puede hacerse es predecir
cuál será el producto principal.
Conforme a una regla formulada por el químico
ruso Alexander Zaitsev, las reacciones de eliminación
inducidas por base generalmente tienen como producto el alqueno
más sustituido; es decir, el alqueno con más
sustituyentes alquilo en los carbonos del doble enlace, conocida
como regla de Zaitsev. En los siguientes dos ejemplos el
alqueno predominante es el alqueno más sustituido cuando
se usa como base etóxido de sodio en
etanol.


La eliminación de HX a partir de halogenuros de
alquilo es una reacción general que constituye un
excelente método para elaborar alquenos. Sin embargo, este
asunto es complejo, y las reacciones de eliminación pueden
proceder en una variedad de rutas mecanísticas. En este
apartado consideraremos dos de ellas en primera instancia, las
reacciones E1 y E2.
REACCIÓN E2:
La reacción E2 significa eliminación
bimolecular y se realiza cuando un halogenuro de alquilo se trata
con una base fuerte como el ion hidróxido (-OH) o ion
alcóxido (-OR). Es la vía de eliminación
más común. Al igual que la reacción SN2, la
reacción E2 es un proceso en un paso, sin intermedios pero
con un estado de transición. Cuando la base atacante
empieza a sustraer un protón del carbono vecino al grupo
saliente, el enlace C-H comienza a romperse, empieza a formarse
un nuevo doble enlace C-C, y el grupo saliente empieza a
separarse, llevándose consigo el par de electrones del
enlace C-X.
Una evidencia que apoya este mecanismo es la
cinética de reacción. Dado que tanto la base como
el halogenuro de alquilo participan en el paso limitante de la
velocidad, las reacciones E2 presentan cinética de segundo
orden:
Velocidad = k · [RX]
· [Base]
Una segunda evidencia y más sólida la
constituye la estereoquímica de las eliminaciones E2. Como
indican una gran cantidad de datos experimentales, las reacciones
E2 son estereoesfecíficas. La eliminación siempre
procede a partir de una configuración geométrica
periplanar, lo cual significa que los cuatro átomos
reaccionantes -el hidrógeno, los dos carbonos y el grupo
saliente- se encuentran en un mismo plano. Existen dos de tales
configuraciones: la periplanar sin, (eclipsada,
mayor energía), y la periplanar anti,
(alternada de menor energía). De las dos, la
configuración anti es energéticamente la preferida
de la molécula.

La base (B:) ataca un
El alqueno neutro se |
|
La configuración periplanar anti de las
eliminaciones E2 tiene consecuencias estereoquímicas bien
definidas que constituyen una sólida evidencia en favor
del mecanismo propuesto. Considérese por ejemplo el
meso-1,2-dibromo-1,2-difeniletano, que experimenta una
eliminación E2 cuando se trata con base para formar
sólo el alqueno E (con los dos grupos fenilo en
cis) puro no se forma nada del alqueno isomérico
Z, debido a que el estado de transición que
conduce al alqueno Z tendría que tener
configuración periplanar
sin.

Reacciones de
eliminación y conformación del
ciclohexano
La configuración periplanar anti de las
reacciones E2 es de particular importancia en los anillos de
ciclohexano, en los cuales la estructura rígida tipo silla
fuerza una
relación específica entre los sustituyentes de
átomos de carbono vecinos. Derek Barton[2]
señaló en 1960 en un artículo decisivo que
gran parte de la reactividad química de los cicloalcanos
sustituidos es controlada por efectos conformacionales. A
continuación se considera la deshidrohalogenación
E2 de los clorociclohexanos para ver el efecto de la
conformación sobre la reactividad.
El requisito periplanar anti para las
reacciones E2 puede satisfacerse en los ciclohexanos solamente si
el hidrógeno y el halógeno son diaxiales
trans. Si el halógeno o el hidrógeno
son ecuatoriales, la eliminación E2 no puede
ocurrir.
Cloro axial : H y Cl son periplanar
anti

Cloro ecuatorial : H y Cl no son periplanar
anti

Requisitos geométricos para
la reacción E2 en los ciclohexanos. Tanto el grupo
saliente como el hidrógeno deben ser axiales para que
ocurra la eliminación periplanar anti.
Efecto
isotópico del deuterio
Una evidencia final en apoyo del mecanismo E2 la
constituye el fenómeno conocido como efecto
isotópico de deuterio. Se sabe que un enlace
carbono-hidrógeno es más débil en una
pequeña cantidad (alrededor de 1.2 kcal/mol) que un enlace
carbono-deuterio correspondiente. Así, un enlace C-H se
rompe con mayor facilidad que un enlace equivalente C-D, y por lo
tanto la rapidez de ruptura del enlace C-H es mayor.
La eliminación de HBr inducida por base del
1-bromo-2-feniletano procede 7.11 veces más rápido
que la eliminación correspondiente de DBr a partir de
1-bromo-2,2-deuterio-2-feniletano:

Este resultado indica que el enlace C-H (o C-D) se rompe
en el paso limitante de la velocidad, y en consecuencia es del
todo consistente con el mecanismo propuesto, es decir en un
solo paso.
REACCIÓN E1:
Las eliminaciones E1 se inician con la
disociación espontánea de un halogenuro, parecida a
una reacción SN1, pero en este caso a la
disociación sigue la pérdida de un protón
del carbocatión intermedio. En efecto el mecanismo E1
normalmente ocurre en competencia con
la reacción SN1 cuando un halogenuro de alquilo se trata
con un nucleófilo no básico en un solvente
prótico. Así, los mejores sustratos son aquellos
que también se someten a la reacción SN1, y casi
siempre se obtienen mezclas de productos.
Por ejemplo, cuando el 2-cloro-2-metilpropano se
calienta a 65ºC en etanol acuoso al 80%, se obtiene una
mezcla de 2-metil-2-propanol (SN1) y 2-metilpropeno
(E1):

Se han obtenido muchas evidencias en
apoyo del mecanismo E1. Como es de esperar, las reacciones E1
presentan cinética de primer orden consistente con un
proceso de disociación espontáneo:
Velocidad = k ·
[R-X]
Una segunda evidencia es la
estereoquímica de las eliminaciones. A diferencia de la
reacción E2, en las que se requiere una
configuración periplanar, en la reacción E1 no
existe un requisito geométrico; el carbocatión
intermedio puede perder cualquier protón disponible de una
posición vecina. Por tanto, es de esperar que se obtenga
el producto más estable (regla de Zaitsev) en una
reacción E1, lo cual es justamente lo que se observa. La
cinética es de primer orden pero su mecanismo es en dos
etapas:

Deshidratación de alcoholes a
alquenos
Para que un sustrato experimente una reacción E1
es necesario que posea un buen grupo saliente, cuya marcha
origine un carbocatión estable. Los alcoholes no sufren
eliminación en condiciones neutras o alcalinas, debido a
que el -OH no es un buen grupo saliente. No obstante, en un medio
ácido los alcoholes se protonan en el oxígeno para
dar iones oxonio, capaces de perder agua (H2O), un excelente
grupo saliente.

Así, la reacción de los alcoholes 2ario y
3ario con un exceso de un ácido fuerte constituyen un
método establecido para la síntesis de alquenos.
Suelen emplearse los "ácidos sulfúricos y
fosfóricos". La temperatura
elevada acelera la reacción y favorece la
eliminación, además, permite que el alqueno destile
a medida que se forma, lo que evita las reacciones
secundarias.
Ejemplos:
1.-

2.-

3.-

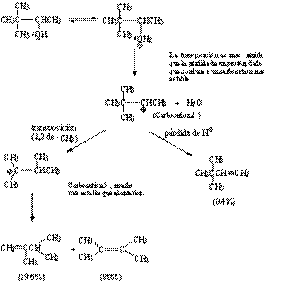
En los ejemplos 2 y 3, los resultados
están de acuerdo con lo esperado, es decir la
obtención del alqueno más sustituido. Los productos
predominantes en el ejemplo 3 se han formado a
través de una transposición, lo que
demuestra que en la reacción han intervenido carbocationes
como intermedios.
Transposiciones a través de carbocationes:
Una propiedad
común de los carbocationes es experimentar
transposiciones, siempre y cuando sean capaces de generar un
carbocatión mucho más estable que el
precursor.
| Transposición de |
|
Transposición de |
COMPARACIÓN ENTRE LAS
REACCIONES E1 y E2
Características | E1 | E2 |
Mecanismo | Dos pasos, Intermedio tipo | Un paso, eliminación |
Cinética | Primer orden | Segundo orden |
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |



