distancia o longitud del enlace: distancia a la cual se
logra la mayor estabilidad (menor energía) al formarse un
enlace.
distribución Gaussiana: es la distribución de probabilidad
que con más frecuencia aparece en estadística y teoría de
probabilidades. Se caracteriza por que cuando se realizan
medidas experimentales, algunas de ellas son mayores que la media
y otras menores, aunque unas y otras se producen en igual
cantidad y con la misma probabilidad, y
al graficarla da una grafica en forma de campana.
DOPADO: es el proceso por el
cual se introducen portadores de carga en un semiconductor.
dopaje inhomogéneo: Dopaje que se
efectúa en forma irregular es decir que no es parejo en
todo el material.
DOS: es la densidad de los
estados electrónicos, o más bien los niveles de
energía disponibles para los electrones.
efecto TuNEL: mecanismo cuántico mediante
el cual una partícula subatómica tiene la
posibilidad de alcanzar niveles energéticos poco
probables.
electrocromismo: proceso mediante el cual un compuesto
cambia de color como
consecuencia del dopaje o el dedopaje.
electrodo: conductor utilizado para hacer contacto con
una parte no metálica de un circuito por ejemplo un
semiconductor, electrolito, etc.
electroforesis: movimiento de partículas
cargadas (iones), por acción
de un campo
eléctrico.
electrolito: sustancia que al disolverse en agua, da lugar
a la formación de iones.
electroluminiscencia: es la emisión no
térmica de luz de un
material sometido a un campo eléctrico externo
electronegatividad: tendencia de un átomo a
ganar electrones.
electrones deslocalizados: electrones que no pertenecen
a un enlace atómico en especifico, sino que pueden ser
compartidos por mas de dos átomos.
ELECTRÓN VOLTIO (eV): es la energía
necesaria para mover un electrón en contra un potencial de
un voltio, o es la energía que gana una carga positiva al
aplicarle un potencial de un voltio. Es una unidad de
energía frecuentemente usada en teoría
de semiconductores y
tiene un valor de
1.6![]() 10
10![]() J.
J.
electroquímica: parte de la química que trata de
la relación entre las corrientes eléctricas y las
reacciones químicas y la conversión de la
energía química en eléctrica y
viceversa.
emeraldina: compuesto verde usado como pigmento,
producido a partir de la anilina azul cuando sobre ella
actúa un acido.
energía de disociación: es la
energía necesaria para disociar una molécula. Esta
energía es igual a la energía de enlace.
enlace π: enlace formado por la
atracción entre los orbitales pz sin hibridizar, es un
enlace mas débil que el enlace σ.
enlace σ: enlace formado por la
atracción entre los orbitales híbridos sp2.
epoxico: formado por la unión de un prepolimero
de bajo peso molecular con un compuesto que forma un
polímero entrelazado.
espín: propiedad de las partículas
fundamentales asimilable a una rotación sobre su propio
eje. Esta relacionado con el campo
magnético que estas tengan.
estado base degenerado: cuando los enlaces simples y
dobles se pueden intercambiar sin cambiar la energía de su
estado
base.
estado base no degenerado: cuando el intercambio de los
enlaces es asociado con dos estados de energía
diferentes.
estado fundamental: estado energético en el cual
un átomo o molécula presenta mayor estabilidad.
estado excitado: estado energético de mayor
energía que el fundamental al cual son promovidos los
electrones de un átomo o molécula al ser excitados
térmica, óptica
ó eléctricamente.
estados VIBRACIONALES: estados de energía
relacionados con la vibración de los núcleos de los
átomos.
etilendioxi: radical -O-CH2 -CH2 -O-
etileno: conocido también como eteno, el cual es
un compuesto químico formado por átomos de carbono
enlazados mediante un doble enlace (CH2=CH2).
Excitón: cuasi partícula creada al
excitarse una molécula, donde se forma un par
electrón-hueco acoplado electrostaticamente.
excitÓn de Frenkel: Los excitones de Frenkel
corresponden a un par electrón-hueco localizado sobre una
molécula orgánica simple y su radio es
comparable al tamaño de la molécula,
típicamente inferior a 5Å?.
excitón de Wannier-Mott: Los excitones de
Wannier-Mott son típicos en semiconductores
inorgánicos, en donde la energía de ligadura
coulúmbica es mas débil, comparada a los excitones
de Frenkel y el radio excitonico oscila entre 40-100Å?,
dependiendo del tamaño de la red cristalina.
factor de llenado: determina la forma de la
característica I-V, de las celdas solares. Un buen factor
de llenado o factor de forma es mayor a 0.7.
FET: transistor de efecto de campo.
Fluorescencia: fenómeno físico mediante
el cual ciertas substancias absorben energía y la emiten
en forma de luz u otro tipo de radiación
electromagnética. A diferencia de la fosforescencia,
dura solo mientras permanece el estimulo que la provoca.
Fonón: cuasi partícula sin carga que se
caracteriza por las vibraciones de la retícula y que
porta gran cantidad de momento.
fotoconductividad: proceso mediante el cual un material
conduce energía mediante la estimulación
óptica.
Fotofísica: fotoexcitación y transiciones
radiantes de una molécula, pero sin cambios
químicos.
fotón: una de las partículas
fundamentales de la materia,
encargada de transmitir la fuerza
electromagnética.
Fotoquímica: se encarga de estudiar las reacciones
químicas que se producen por la acción de la
luz.
fuerza de Van der Waals o London: es una fuerza
intermolecular debida a la atracción entre dipolos
temporalmente inducidos en moléculas no polares.
función de trabajo: representa la energía
mínima necesaria para poder retirar
un electrón o foton de un metal y tiene un valor
particular para cada material.
funciones de onda simétricos: esto se refiere a
que los electrones tiene funciones de onda
que son como las imágenes
reflejadas en un espejo, las cuales se refuerzan y fortalecen el
enlace.
funciones de espin anti-simétrico: esto se tiene
que dar para que se cumpla el principio de exclusión de
Pauli, y significa que los espines de los electrones deben de ser
antiparalelos.
gap: brecha energética entre la banda de
valencia y la banda de conducción, o entre el HOMO y el
LUMO en semiconductores orgánicos.
grupos aryl : radicales que contienen compuestos
aromáticos.
grupos alkoxy: se denomina así la unión
de un grupo alkyl
con oxigeno.
grupos carbonil: esta formado por la unión de un
átomo de carbono doblemente enlazado con oxigeno.
grupos hidroxyl: radical -OH
grupos imidas: conformado por un átomo de
carbono doblemente enlazado con oxigeno y enlazado con un
átomo de nitrogeno.
grupos FUNCIONALES: son estructuras
submoleculares, caracterizadas por una conectividad y
composición específica elemental, que le confiere
reactividad a la molécula que los contiene.
grupos pendientes: pequeñas cadenas de
átomos enlazadas a la cadena principal del
polímero. Estos grupos son
cadenas mucho mas cortas que la cadena principal.
hexamero: compuesto que contiene 6
monómeros.
hibridación: es el proceso de combinar
orbítales atómicos de un átomo con el fin de
producir igual numero de orbítales mezclados, pero de
características diferentes a los originales
hibridación sp2: Se da en todos los compuestos
donde el carbono posea enlaces dobles. Es el resultado de la
mezcla de dos orbitales p y uno s.
HOMO: es el orbital molecular π con
más alta energía, que se encuentra ocupado y
desde donde pueden trasladarse electrones al LUMO.
Hopping: proceso mediante el cual se trasladan
portadores de carga desde un sitio de menor energía
a uno de mayor energía mediante efecto túnel.
Iones: átomos o grupos de átomos cargados
eléctricamente.
isómero: compuestos diferentes, pero con la
misma formula molecular.
isomero cis: isomero con sustituyentes idénticos
en el mismo lado del doble enlace.
Isomero trans: isomero con sustituyentes
idénticos en diferentes lados del doble enlace.
ITO: compuesto de oxido de estaño e indio que se usa como
electrodo inyector de huecos y tiene la característica de
ser transparente.
LED: diodo emisor de luz con semiconductor de material
inorgánico como el arseniuro de galio, germanio, etc.
longitud de equilibrio: longitud de un enlace en el estado base
o fundamental.
Luminiscencia: la luminiscencia se define como la
desexcitación de un átomo o molécula,
mediante la emisión de fotones
LUMO: es el orbital molecular π* con
energía mas baja que se encuentra desocupado, al que
pueden acceder electrones excitados desde el HOMO.
Mascara: placa fotográfica de cristal, utilizada
para imprimir un patrón en el material fotorresistivo.
metallophthalocyanine: material semiconductor
orgánico, utilizado en la fabricación de
dispositivos electrónicos.
metal uni-dimensional: metal que solo conduce la
corriente en una dirección.
momento angular neto: este es el momento que tienen los
electrones debido a girar alrededor del núcleo.
momento angular de ESPíN: es el momento que se
le atribuye a un electrón por presentar fenómenos,
con los cuales se puede hacer una analogía a como si el
electrón girara en su propio eje.
MONÓMERO: unidad repetitiva en un
polímero.
naftaleno: hidrocarburo aromático, que
forma cristales semiconductores.
nanoalambres: alambres de tamaño
nanométrico.
nanomateriales: materiales que
tienen tamaños en el orden de los nanómetros. Por
ende son materiales moleculares.
nodo: parte del orbital donde la probabilidad de
encontrar un electrón es cero.
OLED: LED en donde el material semiconductor es
un material orgánico.
Oligómeros: polímeros pequeños
hasta con 20 unidades monoméricas.
olígotiofenos: polímero con pocos
monómeros tiofeno y utilizado en la fabricación de
OLED.
orbital atómico: es el lugar espacial con mayor
probabilidad de localización de un electrón
alrededor del núcleo de un átomo.
orbital molecular: es un orbital que se forma cuando
los orbitales atómicos se traslapan, formando un orbital
que pertenece a toda la molécula y no solo a un
átomo individual
Oxidación: proceso en el cual se retiran
electrones de un átomo o molécula.
PEDOT: poly(3,4-etilendioxytiofeno). Compuesto que
muestra muy
buenas propiedades electroquímicas.
Pentaceno: hidrocarburo aromático, que forma
cristales semiconductores.
Phthalocyanine: material semiconductor orgánico
utilizado en sensores, equipos
ópticos reescribibles, etc.
plano nodal: plano que divide un volumen, donde la
probabilidad de encontrar un electrón es cero.
PLED: es un LED en donde el semiconductor es un
polímero orgánico.
POLARÓN: es uno de los portadores de carga libre
en algunos semiconductores orgánicos. Es formado por la
retirada o adición de un electrón a una
molécula orgánica. En medio del catión o
anión y el radical que se forman se crea un cambio en la
estructura del
polímero, el cual es característico de esta
cuasi-partícula.
polarón negativo: polarón que fue formado
por reducción.
polarón positivo: polarón que fue formado
por oxidación.
Poliacetileno: uno de los primeros materiales
semiconductores orgánicos descubiertos
((-C![]() C-)n).
C-)n).
Polianilinas: semiconductor orgánico, de amplio
uso.
polieno: compuesto que tiene varios enlaces dobles.
polifluorenos: material polimérico utilizado en
OLEDs.
Polímeros: Los polímeros son compuestos
formados por la unión de más de 20 unidades
moleculares carbonadas idénticas, que reciben el nombre de
monómeros y pueden llegar a contener cientos o incluso
miles de monómeros, constituyendo moléculas
gigantes o macromoléculas.
polipirrole: polímero semiconductor
orgánico, utilizado en dispositivos
electrónicos.
politiofenos: material semiconductor orgánico
utilizado en OLEDs, OFETs, etc.
PPP: Poly(para-phenilene), semiconductor
orgánico utilizado en PLEDs.
PPV: poly(para-phenylene vinylene), semiconductor
orgánico utilizado en PLEDs.
principio de Aufbau: este principio dice que un
electrón siempre va al orbital de menos energía
disponible.
principio de exclusión de Pauli: dice que no mas
de 2 electrones pueden ocupar un orbital y los dos electrones
deben tener espines opuestos.
principio de Frank-Condon : dice que las transiciones
electrónicas son mucho mas rápidas que las
transiciones del núcleo, es decir que los electrones
excitados efectúan sus movimientos mucho mas rápido
de lo que le toma al núcleo reacomodarse.
principio de incertidumbre de Heisenberg: dice que la
ubicación y el momento de una partícula son dos
parámetros que no pueden ser simultáneamente
determinados.
promoción electrónica: es el resultado de la
aplicación de la regla de máxima multiplicidad de
Hund, la cual dice que en los orbitales atómicos, la mayor
estabilidad se logra cuando los espines electrónicos se
encuentran desapareados.
PSS: poly(styrene sulphonic), compuesto utilizado para
mejorar las características electrónicas del
PEDOT.
PVK: poly (vinyl Karbazole), semiconductor
orgánico utilizado en dispositivos electrónicos
orgánicos.
Radiativo: que radia o emite luz.
radical: átomo o molécula con un
electrón desapareado.
Redox: abreviación del proceso de
oxido-reducción.
Reducción: proceso mediante el cual se adicionan
electrones a un átomo o molécula.
resonancia: nombre que se da a procesos de
deslocalización electrónica.
SEMICONDUCTOR: un semiconductor es un caso intermedio
entre un metal y un aislante. En este la banda de
conducción esta vacía como en un aislante, sin
embargo, la banda de gap es menor y permite que sean promovidos
electrones mediante excitaciones ópticas o
térmicas.
semiconductor orgánico: compuesto
conjugado de átomos de carbono enlazados con oxigeno,
hidrogeno,
nitrógeno y otros pocos elementos, que gracias a la
conjugación adquiere características
semiconductoras.
semiconductores orgánicos híbridos:
semiconductores orgánicos formados por la unión
tanto de polímeros orgánicos semiconductores como
de monómeros u oligómeros semiconductores
orgánicos.
sitios: se denominan así moléculas
individuales, o segmentos de un polímero en donde ocurre
un fenómeno en específico.
solitones: son cuasi-partículas que transportan
energía en polímeros con estado base degenerado. Se
forman mediante la oxidación (reducción) de un
polímero con estado base degenerado oxidado (reducido). Se
caracteriza por cambiar la configuración de la cadena sin
cambiar de energía y sus cargas no están
enlazadas.
Singlete: se denomina así cuando un
electrón excitado adopta un espin igual al que tenia en el
estado base.
SMOLED: LED en donde el material semiconductor esta
hecho de pequeñas moléculas (monómeros u
oligómeros) orgánicas.
espin coating: técnica preferida en la
aplicación de películas delgadas uniformes para
dispositivos electrónicos. Consiste en depositar
sobre el centro del sustrato una cantidad suficiente de
polímero en solución y luego se hace girar a gran
velocidad el
sustrato para esparcir el polímero gracias a la fuerza
centrifuga.
técnicas de percolación: es una
técnica que utiliza la teoría de la
percolación, la cual representa uno de los modelos mas
simples para manejar sistemas
desordenados.
Thiazole: semiconductor orgánico utilizado en la
fabricación de dispositivos electrónicos.
thiophene: tiofeno.
tiofeno: semiconductor orgánico utilizado en la
fabricación de dispositivos electrónicos.
tipo n: material que posee exceso de electrones.
tipo p: material que posee exceso de huecos.
TRAMPAS O ESTADOS TRAMPA: son impurezas químicas
(dopantes) o defectos estructurales que generan nuevos estados
energéticos, en los cuales los portadores de carga son
atrapados por periodos de tiempo.
triplete: se denomina así cuando un
electrón excitado queda con un espin antiparalelo al que
tenia en el estado base.
Resumen
La electrónica orgánica nació en 1977 con
el descubrimiento de los polímeros conductores, por
parte de Hideko Shirakawa, Alan Heeger y Alan MacDiarmi. Este
descubrimiento los condujo a ganarse el premio Nobel de
química en el año 2000.
Los materiales orgánicos se dividen en compuestos, de
pocas moléculas (monómeros y oligómeros) y
en compuestos de grandes cantidades de moléculas o
compuestos poliméricos. Estos materiales tienen la
capacidad de conducir energía y emitir luz gracias a que
tienen una configuración específica, denominada
conjugación. Esta configuración se caracteriza por
la alternación de enlaces simples y dobles en la cadena
principal de estos materiales.
Los materiales orgánicos con propiedades
electrónicas y optoelectrónicas han sido toda una
revolución
en la industria
electrónica, la cual los ha comenzado a implementar
en pantallas para celulares, televisores, celdas
fotovoltáicas, láseres, etc., además de
implementar nuevas aplicaciones tales como, papel
electrónico, músculos artificiales, ventanas
inteligentes, nervios artificiales, entre otras.
La electrónica orgánica aun no alcanza el
desempeño de la electrónica
tradicional del silicio y el germanio, pero en el mediano plazo,
se espera que reemplace a los semiconductores inorgánicos
en el campo optoelectrónico, gracias a su facilidad de
fabricación, bajo precio y mejor
desempeño. En el largo plazo, se espera que los
semiconductores orgánicos mejoren su velocidad y puedan
competir con la electrónica tradicional en todos los
campos.
Introducción
La vertiginosa velocidad con que se dan los avances en la
industria electrónica, conlleva a la búsqueda de
nuevos materiales y campos de aplicación de los
dispositivos electrónicos. Como resultado de esta
búsqueda, nace la electrónica orgánica, la
cual se refiere a los materiales orgánicos (que son
aquellos que están constituidos por carbono principalmente
y que se enlazan generalmente con unos pocos elementos, entre los
cuales, los principales son: carbono, hidrógeno, oxígeno
y nitrógeno) que tienen un rol activo en la industria
electrónica, es decir, aquellos materiales que cumplen
funciones análogas a los semiconductores y conductores y
que los pueden reemplazar en muchas aplicaciones, con mejor
rendimiento y más bajo costo de
fabricación, además de crear nuevos campos de
aplicación, tales como el papel electrónico, las
pantallas flexibles, las ventanas inteligentes, músculos y
nervios artificiales. etc.
Esta rama de la electrónica nace en 1978, cuando el
japonés Hideko Shirakawa en colaboración con Alan
Heeger y Alan MacDiarmi de la universidad de
Pensilvania, descubren los polímeros conductores y
publican su descubrimiento en el articulo "Synthesis of
electrically contucting organic polymers: Halogen derivatives of
polyacetilene (CH)n", en el diario de la sociedad
química, Chemical Comunications. El descubrimiento
fue considerado como un gran suceso, tanto que, Shirakawa,
MacDiarmi y Heeger fueron galardonados con el premio Nobel
de química en el año 2000[1].
Estos materiales orgánicos conductores, han sido objeto
de muchas investigaciones y
desarrollos, tanto que en 1985 A. Tsumura, H. Koezuka y T. Ando
fabrican el primer dispositivo con esta tecnología, un
FET orgánico, y al año siguiente Ching W. Tang y
Steven A. Van Slyke de Eastman Kodak fabrican el primero LED
orgánico, basado en moléculas orgánicas de
bajo peso molecular. La cadena de adelantos continuó con
la fabricación del primer LED orgánico
polimérico en 1990, por parte de Jeremy Burroughs y sus
colegas Richard Friend y Donald Bradley del laboratorio
Cavendish de la Universidad de Cambridge en el Reino Unido y en
1997 con el lanzamiento al mercado del
primer producto con
esta tecnología, un display de color verde en un radio de
la Pioneer. A partir de esta fecha la industria a desarrollado
papel electrónico, baterías orgánicas, OLEDs
(LEDs orgánicos), OFETs (FETs orgánicos), monitores,
condensadores,
chips y un sin número de dispositivos y nuevas
aplicaciones basadas en materiales orgánicos. Esta nueva
tecnología no reemplazará en el corto y
mediano plazo a la tecnología del silicio, debido a que
sus velocidades de conmutación no son las apropiadas, pero
se espera que en largo plazo, estas velocidades se alcancen y
domine una gran variedad de aplicaciones que hoy en día se
basan en el silicio, debido a que esta nueva tecnología
presenta un costo de manufactura
más bajo y en algunas aplicaciones mejor rendimiento.
Por la importancia que tienen estos avances
tecnológicos en la rama de la electrónica, se
decidió hacer como trabajo de
grado este texto,
titulado "Electrónica Orgánica", que es una
recopilación en forma general del estado actual de esta
tecnología, el cual tiene como objetivo,
servir a los estudiantes e ingenieros electrónicos, como
texto introductorio, en el cual puedan encontrar los fundamentos
y aplicaciones de la electrónica orgánica, con el
fin de que adquieran un concepto mucho
más amplio de ésta, que es, una de las vertientes
tecnológicas con más perspectivas a principios de
este siglo.
Semiconductores
orgánicos
Los materiales orgánicos son compuestos que basan su
estructura en el átomo de carbono. Este al igual que el
silicio y el germanio hace parte del grupo IV de la tabla
periódica y como es característica de los
elementos de este grupo, tiene una valencia de cuatro, lo que le
permite enlazarse con cuatro átomos más. El carbono
como también los demás elementos del grupo IV
presentan una distribución electrónica que termina
en s![]() p
p![]() , que determina que
, que determina que
solo son capaces de formar dos enlaces, pero esto está muy
alejado de la realidad, en donde como ya mencionamos se enlazan
con cuatro átomos, entonces, ¿Como es posible que
se formen cuatro enlaces?. Para responder esta pregunta primero
tenemos que conocer unos conceptos básicos acerca de los
átomos, como son los de: orbital, hibridación y
enlaces atómicos.
1.1 Orbital.
Los electrones, como se descubrió a principios del
siglo XX con los trabajos de Planck[2],
Einstein[3], de Broglie[4],
Heisenberg[5] y
Schrödinger[6], presentan un comportamiento
dual entre onda y partícula, y este comportamiento conduce
a que no se les pueda atribuir una posición fija, sino tan
solo, un volumen en el espacio en donde la probabilidad de
encontrar un electrón es mucho mayor. A esta
porción en el espacio se le denomina orbital. Del
principio de exclusión postulado por Pauli, para sistemas
conformados por fermiones, se determinó que dos
partículas subatómicas no pueden existir, en un
mismo instante y lugar, con los mismos números
cuánticos, es decir, no pueden tener la misma
energía, momento angular y momento de espin. Para hacerlo,
deben diferir en por lo menos uno de estos números. De
acuerdo con esto, en un orbital, a lo sumo pueden estar dos
electrones en el mismo instante, siempre y cuando tengan espines
diferentes, es decir, antiparalelos.
Los trabajos de los científicos citados arriba,
determinan que un átomo está conformado por un
núcleo que consta de protones con carga positiva y
neutrones sin carga, que tienen la función de
mantener unidos a los protones que mutuamente se repelen.
Alrededor del núcleo giran electrones en un número
tal que las cargas negativas son iguales que las cargas positivas
en el núcleo y mantienen una neutralidad de cargas en el
átomo, además, estos electrones sólo pueden
ocupar capas o niveles de energía discretos, los cuales
solo pueden contener un número fijo de electrones. Sin
embargo, cada capa o nivel de energía se divide en
subniveles o subcapas, de diferentes energías discretas.
Dependiendo del número de protones del núcleo, los
electrones de la periferia, van llenando ordenadamente cada
subnivel de cada nivel de energía permitido, hasta que
todos los electrones estén ubicados
energéticamente. Por lo tanto, los electrones, que pueden
ser definidos como una partícula fundamental u onda
estacionaria, con carga negativa, pueden ser ubicados en un
átomo, teniendo en cuenta su nivel de energía o
capa que ocupan y el subnivel o subcapa de energía en la
que se encuentran. En el átomo, los electrones tienen unas
funciones de probabilidad de existencia llamadas orbitales, las
cuales adoptan, según Paula Yurkanis,[7]
diferentes formas de acuerdo a la subcapa que ocupen y diferentes
tamaños de acuerdo a la capa en que se encuentren. Estos
orbitales en la práctica son de cuatro tipos: s, p, d, y
f. Los orbitales s, son esféricos y sin
orientación, los orbitales p tienen forma de reloj de
arena y se orientan a lo largo de los tres ejes cartesianos, y
los orbitales d y f tienen formas y orientaciones mucho
más complejas, pero en el estudio de los semiconductores,
no tienen relevancia. Teniendo en cuenta que en la
práctica hay cuatro tipos de orbitales, se puede inferir
que también en la práctica solo hay máximo
cuatro subcapas en cada nivel de energía. También
cabe anotar que en las capas llenas, siempre los orbitales
contienen dos electrones.

Figura 1. Orbital
1S.

Figura 2.
Orbitales tipo P.
En un átomo individual a los orbitales se les denomina
orbitales atómicos, pero cuando dos átomos se unen
para formar moléculas, a los orbitales de los electrones
que mantienen unidos a los átomos, se les denomina
orbitales moleculares.
1.2 Hibridación.
La naturaleza,
como dice Fred Hoyle[8], es amante de estar
siempre energéticamente relajada y sin tensiones,
razón por lo cual en todo momento tiende a estar en el
nivel de energía más bajo que permitan las
condiciones ambientales. Esto conduce a la regla de máxima
multiplicidad de Hund, la cual dice que en los orbitales
atómicos, la mayor estabilidad (menor energía) se
logra cuando los espines electrónicos se encuentran
desapareados. Esta regla significa que, en una capa o nivel de
energía, un orbital no contendrá dos electrones,
hasta que todas las subcapas de ese nivel no estén
ocupadas por lo menos con un electrón. De esta manera,
cuando no tomamos en cuenta la regla de Hund al hacer la
distribución electrónica, estamos cometiendo una
equivocación, y para solucionarla tenemos que tener en
cuenta un proceso denominado promoción electrónica, el cual se ve
en la figura 3 y consiste en promocionar electrones que forman
pares, a orbitales vacíos de la misma capa. Este
fenómeno es posible ya que "la diferencia de
energía entre los orbitales s y p de una misma capa, es
generalmente del mismo orden de magnitud que la energía de
enlace"[9]. La regla de Hund y el proceso de la
promoción electrónica responden la pregunta
de por qué los átomos del grupo IV forman cuatro
enlaces y no dos. Sin embargo, dependiendo de las condiciones
energéticas en las que se encuentren los átomos al
momento de formar moléculas, los diferentes tipos de
orbitales de una capa están en la capacidad de mezclarse
en su totalidad o parcialmente para formar orbitales
híbridos. Este proceso de mezcla se denomina
hibridación y "consiste en combinar orbitales
atómicos con el fin de producir igual número de
orbitales atómicos mezclados, pero de
características diferentes a los
originales"[10]. Los diferentes tipos de
hibridación que se pueden dar en los átomos del
grupo IV son: sp3, sp2 y sp (ver figura 3). Estas se caracterizan
porque en la primera, los tres orbitales atómicos p y el
orbital atómico s se han mezclado para formar cuatro
orbitales híbridos, en la segunda solo el orbital
atómico s y dos de los p se han mezclado, formando tres
orbitales híbridos y quedando el tercer orbital
atómico p sin hibridizar, y en la tercera solo el orbital
s y un orbital p se han mezclado para formar dos orbitales
híbridos, quedando dos orbitales p en su estado
original.

Figura 3. Tipos de hibridación de
los átomos del grupo IV.
1.3 Enlaces atÓmicos.
Cuando dos átomos se unen para formar una
molécula, siempre la molécula resultante
tendrá menos energía que los dos átomos
individuales, de lo contrario, la unión no se daría
y esto es debido a que como ya dijimos, la naturaleza siempre
tiende a estar en su estado de menor energía. En el caso
de las moléculas formadas por los elementos del grupo IV,
estas se forman, cuando los átomos involucrados en el
enlace comparten sus electrones de valencia (electrones
desapareados de la última capa), este mecanismo se
denomina enlace covalente. Este tipo de enlace se da mediante el
traslapo de dos orbitales atómicos, y esta interacción da como resultado la
formación de dos orbitales moleculares de diferentes
características. Para entender esto, recordemos que los
electrones son ondas
estacionarias y como ya sabemos los orbitales representan a
los electrones. Por lo tanto, en este orden de ideas, cuando dos
orbitales se traslapan o se unen generan una unión que
tiene la posibilidad de darse de dos maneras. Una de esas
posibilidades es que las dos funciones de probabilidad u
orbitales estén en fase (propiedad de
las ondas) y que
ambos electrones tengan espines opuestos (antiparalelos). Esta
opción, como dice Paula Yurkanis,[11]
origina un orbital molecular que se caracteriza por tener
una densidad electrónica muy alta, debido a que al estar
en fase los dos electrones, significa que estos la mayoría
del tiempo estarán juntos, lo cual ayuda a mantener a los
dos átomos juntos, ya que cuando en el medio de dos
núcleos están presentes electrones, estos reducen
la repulsión electrostática entre los protones. El hecho
de que los electrones estén en fase y tengan espines
opuestos conduce a que este orbital molecular se caracterice por
ser muy estable (este en un nivel energético bajo).
Este orbital molecular se denomina enlace orbital molecular.
La otra opción es que los electrones estén
desfasados y puedan tener espines paralelos, lo que genera un
orbital molecular denominado antienlace orbital molecular, como
escribe Raoul Schroeder[12], debido a que al estar
desfasados, la densidad electrónica entre los
núcleos es muy baja y esto origina que la repulsión
electrostática entre los protones no se reduzca.
También, tener la posibilidad de que bajo ciertas
circunstancias que no violan el principio de exclusión de
Pauli, los electrones tengan el mismo espín, genera
inestabilidad. Por lo tanto, este antienlace orbital molecular,
es un orbital que se caracteriza por ser inestable e ir en contra
de la existencia de la molécula, y de esta forma presentar
un nivel de energía mucho mayor al anterior. Por lo tanto
cuando los electrones se encuentran en el orbital enlazante y el
orbital antienlazante esta vació la molécula
está en su nivel de mayor estabilidad (menor
energía), pero cuando los electrones se encuentran en el
orbital antienlazante, si solo uno de ellos está en
éste, la molécula pierde estabilidad, pero si los
dos electrones se encuentran en este orbital, la molécula
tiende a no ser viable debido a que se encuentra en un nivel de
energía muy alto (más alto que los dos
átomos por separado).
"Durante la formación de un enlace, cuando los dos
orbitales atómicos se aproximan el uno al otro para
traslaparse, a medida que los electrones de cada átomo
comienzan a ser atraídos por las cargas positivas del
núcleo del otro átomo, al igual que por su propio
núcleo, la energía potencial eléctrica
comienza a disminuir, hasta llegar a un punto en que la
aproximación de los átomos es tan pequeña,
que los núcleos empiezan a repelerse. A la distancia en
que se da este fenómeno significa, que la mayor
estabilidad (mínima energía) ha sido alcanzada, con
lo cual esta distancia corresponde a la longitud propia del
enlace. Por ejemplo, la longitud del enlace
hidrógeno-hidrógeno es de 0.74 Å?. La figura
4 muestra que hay una disminución de la energía
cuando se forma el enlace covalente. De la misma forma en que el
enlace covalente tiene una longitud determinada, durante su
formación también se libera energía. Por
ejemplo, cuando se forma el enlace
hidrógeno-hidrógeno se liberan 104Kcal/mol. Esta
liberación de energía durante la formación
implica que para lograr la separación de la
molécula se requiere la misma cantidad de energía,
la cual se denomina energía de disociación. De esta
manera todo enlace covalente tiene una longitud del enlace
característica y una energía de disociación
determinada"[13].

Figura 4.
Energía de enlace.
Fuente: BRUICE, Paula Yurkanis. Organic Chemistry.
2nd edition. Prentice Hall. 1998. p.18.
Continuando con la descripción de los enlaces atómicos,
cuando dos átomos de carbono se enlazan, dependiendo de
que clase de
orbitales se unen o traslapan se dividen en dos tipos: enlace
π (pí) y enlace σ (sigma). El enlace
σ, se genera en el átomo de carbono, cuando se unen
orbitales atómicos híbridos. Este enlace se da a
muy corta distancia (longitud del enlace), razón por la
cual es muy fuerte. Este tipo de enlace es el encargado de darle
la fuerza característica al enlace covalente.

Figura 5.
Enlaces moleculares σ (sigma) entre orbitales
atómicos p.
El enlace π, se forma cuando los orbitales que se
traslapan son los orbitales p que no han hibridizado, de tal
forma que este tipo de enlace sólo se da cuando los
átomos han sufrido hibridación sp2 o sp, y ya que
estos orbitales están muy separados uno del otro al
enlazarse, debido a que entre ellos siempre estará
presente un enlace σ, no alcanzan la distancia ideal
(longitud del enlace), motivo por el cual son de menor fuerza y
por ende menos estables que los enlaces σ. Es
importante anotar que los enlaces π, son los enlaces
que caracterizan a los enlaces dobles y triples.
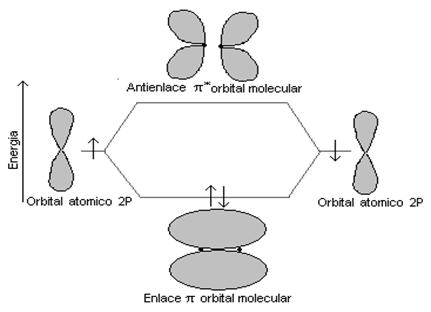
Figura 6. Enlaces
moleculares pí (π) entre orbitales
atómicos p.
Habiendo entendido porque los átomos del grupo IV
forman cuatro enlaces y no solo dos, y comprendiendo el concepto
de orbital y de enlace atómico, muy seguramente Ud. se
preguntará, ¿Por qué si el carbono
está en el mismo grupo del silicio y el germanio,
además hibridiza igual y forma el mismo tipo de enlaces,
que origina que el silicio y el germanio formen cristales
semiconductores y el carbono cristalino, como es el caso del
diamante sea tan mal semiconductor?. La respuesta, es que en los
átomos en general, tal como dice Kurt
Nassau[14], el gap (diferencia de energía
entre niveles discretos o bandas de energía) entre niveles
de energía adyacentes, varia en forma inversamente
proporcional al radio atómico, es decir a mayor radio
atómico, menor gap, por lo tanto, el carbono que es uno de
los átomos con menor radio atómico debido a su bajo
peso, de acuerdo a lo anterior, presenta un gap entre su nivel de
valencia y de conducción que se sale ligeramente del rango
de los buenos semiconductores, mientras que el silicio y el
germanio, los cuales son más pesados y de mayor radio, de
acuerdo a la premisa inicial, presentan una diferencia
energética entre su nivel de valencia y de
conducción que es menor a la del carbono y está
dentro de los niveles energéticos que caracterizan a los
semiconductores (3 eV). Después de esto, entonces Ud. se
preguntará, ¿Como es posible hablar de
semiconductores orgánicos?, para entender como un
compuesto orgánico puede ser semiconductor, primero
debemos comprender que es lo que los hace aislantes y para ese
fin, observemos primero las características
eléctricas del átomo de carbono.
1.4 CARACTERISTICAS ELECTRICAS DEL ATOMO DE
CARBONO.
El átomo de carbono es el elemento que en la naturaleza
presenta mayor versatilidad debido a su valencia de cuatro y a su
tamaño, y gracias a esto sobrepasa en decenas de veces a
los demás elementos, en cuanto a la cantidad de compuestos
que puede formar. Sin embargo hasta antes de los años
70"s, los compuestos
orgánicos fabricados por el hombre y
por la naturaleza, habían tenido características
eléctricas muy pobres para ser considerados como
conductores o semiconductores en la industria electrónica.
Por esta razón, en la industria siempre los materiales
orgánicos y los plásticos
sintéticos han solo sido implementados como materiales
aislantes, materiales de soporte o como materiales
foterresistivos en la industria electro-óptica de las
impresoras,
cámaras fotográficas, de la discografía,
etc. La razón para que ese comportamiento aislante se de
en los materiales orgánicos, recae en varios aspectos, que
son: el tipo de enlaces que forman, organización o distribución de los
enlaces y cantidad de átomos de carbono constituyentes.
Los materiales orgánicos tradicionales son aislantes
debido a que por lo general presentan enlaces simples y dobles
que no están alternados entre si, es decir no están
conjugados, y si lo están no se presentan en grandes
extensiones.
De esta manera al no presentar conjugación en una gran
cantidad de átomos y de hacerlo en forma irregular,
origina que su comportamiento sea mayoritariamente regido por las
características eléctricas de los enlaces σ,
"los cuales presentan un gap entre el enlace orbital molecular y
el antienlace orbital molecular demasiado grande, mayor a 6
eV"[15], lo que los categoriza como materiales
donde es imposible promover un electrón desde el orbital
enlazante ocupado de mayor energía (HOMO) al orbital
antienlazante desocupado de menor energía (LUMO), mediante
una radicación visible o una fuente de campo
eléctrico convencional. El enlace σ presenta un gap
tan amplio, debido a que es un enlace muy fuerte y estable, y
cuando algo es muy estable implica que se encuentra a una
energía muy baja de acuerdo a las condiciones
energéticas de su entorno. Por lo tanto, la energía
del orbital enlazante mas alto (HOMO) o nivel de valencia mas
alto de este enlace estará a una energía muy baja.
Sin embargo, el nivel de conducción mas bajo de este
enlace corresponde al orbital antienlazante mas bajo (LUMO), el
cual como ya conocemos desestabiliza la molécula y como
para desestabilizar algo muy estable hay que suministrarle mucha
energía, este se encontrará a una energía
muy alta, lo que causa que el gap en el enlace σ se tan
amplio.
Por otro lado, si los anteriores factores determinan a un
compuesto orgánico como aislante, ¿Que
características lo definen como conductor?. Como vimos
anteriormente, un compuesto orgánico no puede ser
semiconductor mediante una estructura cristalina de tipo
atómico como la del silicio o el germanio, ya que de esta
manera su gap sería muy amplio, como en el caso del
diamante. En consecuencia para que un compuesto orgánico
se comporte como un semiconductor debe optar por otra
alternativa, la cual en su caso es la conjugación, que
consiste en una estructura de enlaces simples y dobles que se
alternan (ver figura 7), pero a diferencia de los aislante
orgánicos, esta conjugación debe ser extensa,
es decir que se de a lo largo de toda una molécula, o en
su gran mayoría, con lo cual el material ya no será
regido por las características del enlace σ, sino
por las características del enlace π.

Figura
7. Estructura de un polímero conjugado.
El enlace π, a diferencia del enlace σ, es
más débil y esta debilidad se traduce en
inestabilidad, lo que conduce a que el gap del enlace π
sea menor que el del enlace σ. Ud, se preguntará
entonces, ¿Por qué el gap del enlace σ es
mayor que el del enlace π?, y la respuesta, se basa en
lo siguiente: como el enlace π es menos fuerte o menos
estable que el enlace σ, significa que su energía
será mayor y por tal razón su HOMO esta ubicado a
mayor energía que el HOMO del enlace σ. Por otro
lado, para desestabilizar algo no muy estable se necesita menor
energía que para hacerlo con algo muy estable, y al ser el
enlace π menos estable que el enlace σ, implica
que, el nivel de energía del LUMO del enlace π,
este ubicado a menor energía que el del enlace σ.
(ver figura 8).

Figura 8. Diagrama de energía de
un enlace molecular.
En la figura 8, se ve el esquema energético de una
molécula que presenta enlaces dobles, en ésta n
representa el número de electrones que participan en
enlaces π y m al número de electrones que
participan en enlaces σ. Para entender mejor el carácter aislante o no de un compuesto
orgánico, consideremos la figura 9, en donde se muestran
tres tipos de dienos (compuestos orgánicos que poseen
enlaces doble), en ésta observamos que aunque todas
presentan enlaces dobles, la figura A, presenta un comportamiento
eléctrico regido por el enlace σ, mientras que en
las figuras B y C, predomina un comportamiento regido por los
enlaces π, que se caracteriza porque sus orbitales se
traslapan a lo largo de toda la molécula, lo que origina
que los electrones de los sistemas π, se encuentre
deslocalizados en las moléculas individuales.

Figura 9. Tipos de dienos.
Por lo tanto, aunque un dieno aislante contiene enlaces
π, y estos tienen un gap reducido, al presentarse de
forma aislada, no permite que el compuesto se comporte de extremo
a extremo como un semiconductor. Por otro lado en los dienos
conjugados y alenos los enlaces π, se distribuyen por
toda la molécula, y en consecuencia el gap es reducido a
lo largo de toda su extensión, lo que bajo ciertas
condiciones les permitiría comportarse como semiconductor.
Ud, preguntará ¿Por qué se dice que bajo
ciertas condiciones?, y la respuesta es que, la
conjugación aunque es un requisito indispensable, no es
suficiente en todos los casos para que un compuesto
orgánico adquiera propiedades semiconductoras, debido a
que, el que el gap se reduzca, no significa que quede dentro del
rango de los materiales semiconductores. Cuando este rango es
alcanzado se dice que el compuesto es un semiconductor
orgánico intrínseco, de lo contrario, si el
material tiene un gap por fuera de este rango que es de 3 eV, es
indispensable que el compuesto sea dopado, con el fin de reducir
aun más la brecha energética entre el nivel de
conducción y el de valencia. Sin embargo, el que un
material orgánico sea intrínsecamente semiconductor
no significa que no nesecite ser dopado, ya que en estos ocurre
lo mismo que en los semiconductores de silicio y germanio y es
que la banda de valencia está completamente llena y la de
conducción completamente vacía, con lo que no hay
vacantes ni portadores de carga que puedan hacer parte en la
conducción, y si los hay, debido a la promoción
térmica, son en un número muy bajo, además,
el semiconductor es bipolar (que conduce al igual por medio de
electrones y de huecos), y en estas condiciones no es útil
para ser utilizado en dispositivos electrónicos.
Con el fin de suministrar los espacios vacíos en la
banda de valencia o los portadores en la banda de
conducción y de que el material conduzca mayoritariamente
por huecos o electrones, estos materiales nesecitan ser dopados
de forma análoga a los semiconductores inorgánicos.
"La diferencia entre el dopaje de los materiales orgánicos
e inorgánicos, es que en los inorgánicos, algunos
átomos del cristal son reemplazados por átomos
dopantes, mientras que en los materiales orgánicos los
átomos dopantes se insertan de forma adicional sin
reemplazar a los átomos en la cadena principal de la
molécula"[16], además "el dopaje se
da mediante un proceso de oxido-reducción en donde
interviene un electrolito que se encarga de mantener la
electroneutralidad del sistema"[17]. Como dice Oscar
Larsson[18], El dopaje en los materiales
orgánicos se da mediante dos métodos
principales, que son: el dopaje químico y el
electroquímico. El primero consiste en enlazar al material
orgánico agentes dopantes, químicos que oxidan
(remueven electrones) o reducen (adicionan electrones) el
compuesto orgánico. Cuando el material es oxidado la
electroneutralidad es mantenida mediante la adición de
aniones (cargas negativas) por parte del electrolito, en caso
contrario, es decir que se de una reducción, la
neutralidad se mantiene mediante la adición de cationes
(cargas positivas) por parte del electrolito. El dopaje
químico es utilizado cuando se necesitan dopajes de altas
concentraciones, pero para niveles intermedios, este tipo de
dopaje no es muy apropiado, la razón, es que es
difícil de variar y controlar la concentración de
los agentes dopantes y encontrar agentes dopantes de fuerza
apropiada. En este caso se utiliza el dopaje
electroquímico, en el cual la adición o
sustracción de electrones se da mediante un potencial
eléctrico y el electrolito mantiene la electroneutralidad
al igual que en el dopaje químico. Cabe anotar que la
remoción y adición de electrones se da en el
sistema π, el cual es energéticamente más
asequible.
Cabe anotar que en el dopaje de los semiconductores, no solo
cambian las propiedades eléctricas del material, sino que
también cambia el color del material, ya que al introducir
niveles de energía en la banda prohibida, estos nuevos
niveles energéticos absorben algunas longitudes de onda
adicionales, lo que ocasiona el cambio de color del material
dopado, "este fenómeno se denomina
electrocromismo"[19].
Ahora Ud. se preguntará, ¿Por qué se
habla de que los materiales semiconductores orgánicos
deben ser conjugados y no se nombran a los alenos?. La respuesta
a esta pregunta nos la da el dopaje. Al necesitar los compuestos
orgánicos ser dopados, se necesita de un material de una
reactividad tal, que reaccione fácilmente con los agentes
dopantes y los dienos conjugados son más reactivos que los
alenos, por razones que se salen del manejo de este texto,
además como la electroneutralidad es mantenida por un
electrolito, se necesitan como escribe Daniel James
Ulinski[20], espacios de carga para albergar
los iones, función para la cual son apropiados los enlaces
simples, y los alenos al no poseer enlaces simples no poseen
espacios de carga y por lo tanto no son utilizados como
semiconductores.

Figura 10. Compuesto de PEDOT:PSS.
Fuente : ULINSKI, Daniel James. Organic diode and
other circuit element creation through variations of
poly(3,4-ethylenedioxythiophene) synthesis. [en
línea]. s.l.: Pittsburg University. 2002. <http://etd.library.pitt.edu/ETD/available/etd-07072004-180027/
unrestricted/DJUlinski-MSEE-Thesis-Pitt-July-2004.pdf >. p.119
[consulta: Febrero de 2005 ].
En la figura 10, se observa un polímero conjugado
(PEDOT), el cual esta dopado (oxidado), el electrolito (PSS) y se
indican los iones y los espacios de carga.
Gracias al dopaje, un material se comporta como semiconductor,
pero tambien gracias al dopaje un compuesto orgánico
conjugado puede convertirce en conductor, y esto se logra
mediante altos niveles de dopaje, los cuales reducen el gap y
ponen a disposición grandes cantidades de portadores de
carga para la conducción.
En los párrafos anteriores hemos explicado lo que hace
a una molécula orgánica individual ser
semiconductora, pero en la práctica los materiales
utilizados y tratados en este
trabajo no son moléculas individuales (de las cuales trata
la electrónica molecular y cuyo contenido se sale de
nuestro alcance), sino muestras macroscópicas, las cuales
constan de millones de moléculas individuales, y se
encuentran unidas ya no por enlaces covalentes sino por fuerzas
muy débiles de tipo polar, como la fuerza de van der
Waals. El que las moléculas individuales estén
unidas tan débilmente origina que el gap entre
moléculas sea muy grande y la estructura de bandas de
energía sea fácilmente interrumpida, pero aun
cuando se piense en que esto echaría por tierra la
utilización de los materiales orgánicos como
semiconductores, en realidad no es así y las razones para
que no sea de esta manera las veremos en el siguiente capitulo
(física de
los semiconductores orgánicos).
Habiendo explicado en forma muy general, como un material
orgánico puede adquirir propiedades semiconductoras y
conductoras, antes de pasar al siguiente capitulo debemos
referirnos a los diferentes tipos de materiales semiconductores
que ha sintetizado la industria y que forman ya parte, en la
actualidad, de una diversidad de dispositivos
electrónicos.
1.5 CLASIFICACIÓN DE LOS SEMICONDUCTORES
ORGÁNICOS.
Los materiales orgánicos, por su naturaleza, pueden
formar una infinidad de compuestos de diferentes tamaños,
formas y estructuras, y en consecuencia pueden ser clasificados
de acuerdo a muchos parámetros, pero en cuanto a los
compuestos orgánicos con características
conductoras, se clasifican en dos grandes grupos, dependiendo de
su peso molecular, que son: moléculas de bajo peso
molecular y moléculas de alto peso molecular. Las primeras
se refieren a moléculas conjugadas, de un tamaño
menor a 20 monomeros, las cuales se conocen como oligomeros, y
las segundas abarcan a las moléculas conjugadas de
más de 20 monomeros, las cuales se conocen como
polímeros. Ambos tipos de compuestos orgánicos se
diferencian entre si por su tamaño y propiedades
físicas, pero en cuanto a las propiedades
eléctricas su comportamiento es muy similar. En este
apartado tan solo daremos las características generales de
ambos tipos de moléculas, y las más utilizados en
la industria, ya que los mecanismos utilizados para transportar
portadores de carga y comportarse como semiconductores
serán descritos más adelante.
1.5.1 Oligomeros semiconductores: En el campo de la
electrónica orgánica, estas moléculas se
caracterizan por estar constituidas por un número no muy
grande de átomos, con una estructura de sus enlaces
conjugada y por formar cristales de tipo molecular. Esto
cristales se diferencian de los cristales de tipo atómico
como los formados por el silicio, el germanio o el carbono
(diamante), en que los primeros están conformados por la
unión de moléculas individuales que
intramolecularmente están unidas por fuertes enlaces
covalentes, pero que intermolecularmente se unen mediante fuerzas
débiles como la de van der Waals, mientras que los
cristales de tipo atómico son en su totalidad una sola
molécula que está fuertemente unida por enlaces
covalentes. Esta diferencia origina que los cristales de tipo
atómico generen estructuras de bandas muy bien definidas
debido a que este tipo de cristales son muy fuertes y la
estructura de sus estados energéticos permanece
inalterada, mientras que en los cristales moleculares al estar
unidos por atracciones tan débiles, y por poseer un
número muy bajo de átomos por molécula, su
acople energético es bajo y su estructura
energética se altera con mucha facilidad, originando esto
que en este tipo de materiales, la estructura de bandas de
energía tenga muy poca importancia en la forma como
conducen corrientes eléctricas. Cabe anotar que pese a esa
facilidad con que se interrumpe el orden energético, los
cristales de moléculas pequeñas mantienen un orden
considerable. Los semiconductores fabricados con pequeñas
moléculas, se destacan por presentar mejores niveles de
conducción que los semiconductores poliméricos,
pero el ser muy difíciles de preparar en soluciones,
los inhabilita para poder ser depositados con técnicas
de fabricación de bajo costo como impresión
convencional o spin coating, y por esta razón, tampoco
pueden formar películas delgadas de gran área.
Entre los semiconductores orgánicos, las moléculas
de bajo peso molecular más utilizadas según la
pagina <http://www.shef.ac.uk /physics/ teching/
phy411c/phy411.pdf>[21], son: TPD, perileno,
pentaceno, 6-tiofeno, fullereno (C60) y
Alq3. El perileno, el pentaceno y el TPD
(N,N'-bis-(m-tolyl)-N,N'difenyl-1,1-bifenyl-4,4'-diamina) son
materiales transportadores de huecos y usados como materiales
fluorescentes en OLED. El 6-tiofeno, es un representante de
la familia del
tiofeno, el cual es conocido por su gran movilidad de huecos, y
es usualmente utilizado en OFETs. El PBD
((2-(biphenyl-4-yl)-5-(4-tertbutylphenyl)-1,3,4-oxadiazole), es
un conductor de electrones usado en OLEDs. El C60 o
Fullereno es un material con gran afinidad electrónica, y
sus derivados son utilizados como aceptores de electrones en
dispositivos fotovoltáicos. Por último el
Alq3 (tris(8-quinoleina de aluminio)) es
un complejo organometálico con una electroluminiscencia de
color verde muy eficiente y de muy buena estabilidad, usado en
OLED. (ver figura 11).

Figura 11. Principales semiconductores
de bajo peso molecular.

Figura 12.
Estructura energética de una pequeña
molécula orgánica.
Fuente: K, Leo. Organic semiconductors: the basics.
<http://www.orgworld.de/> [consulta: jun: 2004].
La figura 12, nos muestra un diagrama
energético de una pequeña molécula
orgánica, en este caso un anillo de benceno, en donde
observamos que la estructura de bandas en este tipo de
semiconductores es muy reducida, debido a la poca cantidad de
átomos constituyentes, y en donde se resaltan solo los
enlaces π, ya que son los únicos que intervienen
en la conducción, en un semiconductor orgánico.
Aquí también se ven en color rojo los niveles de
energía del HOMO y el LUMO, que en las moléculas de
bajo peso molecular, son niveles discretos debido al
número de átomos de este tipo de materiales.
1.5.2 Polímeros semiconductores: Los
polímeros se caracterizan por ser cadenas muy largas,
compuestas de monómeros, en donde cada monómero
está unido mediante enlaces covalentes. Esto conduce a que
al haber una gran cantidad de unidades monoméricas
enlazadas fuertemente, dentro de las cadenas de polímero
se formen bandas de energía, como en los semiconductores
inorgánicos. Sin embargo estas cadenas son de longitud
finita, y un compuesto polimérico está constituido
de millones de estas cadenas, las cuales están muy
débilmente acopladas, razón por la que en los
polímeros al igual que en los cristales moleculares
orgánicos conjugados, la estructura de bandas de
energía tampoco presente mucha relevancia en la corriente
total del semiconductor. Los polímeros
semiconductores a diferencia de los cristales moleculares, son
más fácilmente solubles, lo que permite que sean
depositados mediante impresión convencional o spin
coating, y de esta manera ser depositados en películas
delgadas de gran área a muy bajo costo. Adicionalmente,
los polímeros semiconductores presentan las
características propias de los materiales
poliméricos, como son flexibilidad y durabilidad. En
cuanto a la conductividad, al presentar los polímeros
estructuras amorfas, presentan una conductividad menor a los
cristales moleculares, por razones que veremos en el siguiente
capítulo.
Los polímeros semiconductores más utilizados en
la industria según la pagina de Internet
<http://www.shef.ac.uk/physics/teching/phy411c/phy411.pdf>[22],
son: los politiofenos, polipirroles, polianilinas, PPP (poly-para
fenileno), PPV (poly para-fenileno vinileno), PVK (poly vinil
carbazole), polyfluoreno, PEDOT-PSS, PPE y los dendrimeros. El
PPV es un compuesto muy utilizado en dispositivos
electroluminiscentes, este compuesto en la forma de MEH-PPV y
ciano-PPV es muy soluble y su banda de gap mejora para el
transporte de
cargas. El PPE (poly fenileno etileno) y el PPP y los
polifluorenos (PF) también son muy utilizados en
dispositivos emisores de luz. El PVK fue uno de los primeros
semiconductores orgánicos descubiertos, junto con el
poliacetileno y fue el primer polímero en el cual se
reportó electroluminiscencia. Los politiofenos son de gran
interés
por su buena solubilidad y excelentes posibilidades de
procesamiento, además presentan gran capacidad de
transporte de carga e índices altos de on/off. Uno de los
politiofenos más estudiados es el PEDOT
(poly(3,4-etilendioxytiofeno)). El PEDOT:PSS es el
resultado de la polimerización química oxidativa
del monómero EDOT en poly(acido estireno sulfonico) (PSS).
El sistema resultante que consiste de los polímeros
conjugados PEDOT de dopado tipo p y PSS como iones opuestos que
mantienen la carga neutral, es altamente conductivo (~
10Scmˉ¹), transparente, mecánicamente durable e
insoluble. En los últimos años este material
transparente está siendo utilizado en muchas aplicaciones
en los dispositivos orgánicos electroquímicos y
como capa de inyección de huecos en OLED"s (LEDs
orgánicos). Los dendrímeros son polímeros
hiper-ramificados; su estructura contiene unidades ramificadas
repetidas llamadas dendrómeros que se radían desde
su centro. Los dendrímeros tienen una concentración
extremadamente alta de grupos funcionales que le confieren su
alto peso molecular y su volumen. En el campo de los OLEDs, los
dendrímeros permiten que las pequeñas
moléculas mantengan sus propiedades semiconductoras y
adquieran algunas ventajas de los PLEDs, como la capacidad de ser
procesadas como solución.

Figura 13. Principales polímeros
semiconductores.

Figura 14.
Estructura energética de un polímero conjugado.
Fuente: K, Leo. Organic semiconductors: the
basics.<http://www.orgworld.de/ [consulta: jun: 2004].
En la figura 14, vemos la estructura energética de un
polímero semiconductor, en este caso particular la
estructura del PPV, en donde podemos observar, a diferencia de la
figura 12, que en los polímeros semiconductores si se
forman bandas de energía bien definidas, y aquí los
niveles de energía del HOMO y el LUMO se pueden considerar
como niveles no discretos, debido al gran número de
átomos que conforman los polímeros. Al igual que en
la figura de las moléculas de bajo peso molecular,
aquí solo se muestran las bandas de los enlaces
π, debido a que son los niveles de energía de
este tipo de enlaces, los únicos que contribuyen a la
conducción en un semiconductor orgánico.
Física de los
semiconductores orgánicos
En los semiconductores orgánicos al presentarse
estructuras desordenadas y mucho menos acopladas que en los
cristales atómicos que conforman a los semiconductores
inorgánicos, el modelo de
bandas de conducción, es de poca validez. En el caso de
los cristales semiconductores, la estructura de bandas no se
forma, debido a los pocos átomos que conforman cada
molécula y en los polímeros semiconductores el
modelo de bandas se utiliza intramolecularmente, pero
intermolecularmente debido al alto grado de desorden y al bajo
acople, este modelo no tiene cabida al igual que en los cristales
moleculares. Por lo tanto, si mediante el modelo de bandas no se
puede explicar el transporte de cargas en los semiconductores
orgánicos, ¿mediante que modelo se explica dicho
transporte?. Según Vissemberg[23], el
fenómeno de conducción en los semiconductores
orgánicos se explica de la siguiente manera: en los
semiconductores orgánicos los electrones se encuentran en
estados energéticos o niveles de energía
localizados, a diferencia de los conductores y semiconductores
tradicionales en donde los electrones están deslocalizados
por todo el material. En los materiales orgánicos, estos
estados localizados o sitios son: los estados de las
moléculas individuales en los cristales moleculares, los
estados de las cadenas polimericas individuales o los estados de
los segmentos de estas cadenas donde la conjugación es
interrumpida por defectos estructurales o químicos.
Habiendo definido los estados localizados o sitios y teniendo
presente que estos sitios actúan como pozos de potencial,
la transferencia de carga entre sitios se da mediante saltos
cuánticos o hopping en donde los portadores de
carga mediante efecto túnel asistido por fonones
(vibraciones de la estructura del material) pasan de un sitio a
otro, bajo ciertas condiciones especiales. Para entender un poco
más este fenómeno, vamos a explicar en forma
general este mecanismo cuántico. El efecto túnel,
como dice la editorial Time
Life[24], fue por primera vez propuesto
por George Gamow a principios del siglo XX, para explicar como
dos átomos de hidrogeno se fusionaban en las estrellas a
temperaturas sumamente bajas para que se diera dicho fenomeno, y
se basa en el principio de incertidumbre y en la ecuación
de onda de Schrödinger, la cual predice que una
partícula subatómica dentro de un pozo de potencial
o fuera de éste, siempre y cuando la barrera de potencial
sea finita, tiene una probabilidad (aunque muy pequeña) de
encontrarse por fuera o de entrar a dicho pozo, atravesando sus
paredes, como si hiciera un túnel, razón por
la cual se denominó efecto túnel.

Figura 15.Pozo de potencial o sitio.
En un semiconductor orgánico, los electrones como
dijimos en el capítulo anterior, se encuentran
deslocalizados dentro de los sistemas π de las
moléculas individuales de los cristales moleculares o de
las cadenas poliméricas. "Estos electrones al ser
estimulados por un campo eléctrico se mueven dentro de
estos sitios de extremo a extremo y al encontrarse con una
barrera energética rebotan y forman ondas
estacionarias"[25] que tienen cierto nivel de
energía. Teniendo en cuenta lo anterior los electrones u
ondas estacionarias tienen la posibilidad de atravesar la barrera
de potencial entre las moléculas o polímeros,
siempre y cuando, según Richard Turton[26],
los electrones de un sitio origen esten en un nivel de
energía igual a uno de los niveles de energía
permitido en el sitio al que va a trasladarse, de lo contrario el
hopping no se lleva a cabo. Por lo tanto, con el fin de
lograr los niveles de energía necesarios, el papel de los
fonones es indispensable, ya que la energía de los fonones
es trasmitida a los electrones que de esta forma alcanzan la
energía suficiente para trasladarse por efecto
túnel.

Figura 16. Hopping asistido por
fonones.
En la figura 16, en la parte A, observamos al lado izquierdo
un electrón en una molécula o sitio con una
energía inferior a la energía de uno de los niveles
de energía discretos de otra molécula o sitio,
inhabilitando esto su traslado por efecto túnel. En la
parte B, al aplicarle un campo eléctrico al material los
niveles de energía al igual que en los semiconductores
inorgánicos se inclinan y la diferencia de energía
entre los dos sitios disminuye pero aun no coinciden. Sin embargo
en la parte C, el electrón absorbe la energía de un
fonón e iguala la energía de la molécula
vecina, situación ésta que le permite trasladarse
por hopping.
"El mecanismo de efecto túnel asistido por fonones o
Hopping (saltos cuánticos) fue originalmente
propuesto por Conwell y Mott en los semiconductores
inorgánicos con defectos trampas y la tasa de
transición por efecto túnel asistido por fonones
fue calculada por Miller y Abrahams, en donde el Hopping
desde un estado localizado J a un estado i se lleva
a cabo a una frecuencia para el fonón de
νo, la cual es adecuada para que el fonón sea
absorbido por los portadores de carga, que así aumentan su
energía y se trasladan por efecto
túnel"[27].

Ecuación 1. Tasa de tunelage
asistido por fonones.
En la ecuación 1, γ es la longitud inversa
de localización, Rij es la distancia entre los
estados localizados, εi es la energía en el
estado i y εj es la energía del
estado J. Como los índices de salto son fuertemente
dependientes de la energía y la posición de los
estados localizados, el transporte por Hopping es
extremadamente sensible, tanto a la estructura como al desorden
energético. La anterior es la razón por la que los
cristales moleculares tienen una conductividad mayor que los
polímeros semiconductores.
Conociendo ya el modelo mediante el cual se explica la
semiconducción en los materiales orgánicos, es
importante conocer, como es la movilidad en estos materiales.
2.1 MOVILIDAD EN LOS SEMICONDUCTORES
ORGÁNICOS.
Para medir esta característica en los semiconductores
inorgánicos, los investigadores utilizan la técnica
del tiempo de vuelo, la cual consiste en "generar mediante
un flash de luz, una
capa de portadores de carga cerca de un electrodo de un capacitor
de placas paralelas y bajo un campo eléctrico aplicado E,
hacer que las cargas se mueven hacia el electrodo opuesto. El
tiempo de tránsito τt al cual las cargas
alcanzan ese electrodo (distancia L) es entonces una medida
directa de la movilidad de los
portadores"[28].
![]()
Ecuación 2. Movilidad por la
técnica de tiempo de vuelo.
Sin embargo en los semiconductores orgánicos
según Vissenberg[29], las foto-corrientes
generadas son con frecuencia dispersivas (disminuyen con el
tiempo debido a que las cargas toman diferentes caminos y se
inmovilizan temporalmente debido a que quedan atrapadas en
irregularidades) y por lo tanto la velocidad de las cargas
disminuye cuando la muestra es atravesada. En ese caso el tiempo
de arribo promedio de las cargas y consecuentemente la movilidad
de los portadores, dependen de la dimensión de la muestra
y la movilidad no refleja un parámetro genuino del
material. Esa dispersión de la corriente es debido, a que
como vimos en el capítulo anterior, los semiconductores
orgánicos presentan bajo acople y en especial los
polímeros tienen un grado muy alto de desorden al ser
amorfos. Teniendo en cuenta lo anterior y según Man Hoy
Wong[30], investigaciones con respecto a la
movilidad, han concluido que la movilidad en los materiales
orgánicos tiene una dependencia del campo eléctrico
µ = µ0 exp(β√E) que
es del tipo Poole-Frenkel y adicionalmente se observa un
transporte de carga tanto dispersivo como no dispersivo. Por lo
tanto, para estudiar la movilidad en los semiconductores
orgánicos se utiliza el modelo de Bässler, el cual
modela ambos comportamientos, teniendo en cuenta la simulación
de Monte Carlo, la cual se basa en una distribución
Gaussiana de densidad de estados (DOS) o niveles de
energía disponibles para los electrones, con el cual se
obtienen unos resultados muy acordes con los experimentos.
Dichos resultados muestran que el transporte de carga en los
sólidos orgánicos es altamente dispersivo, y que la
movilidad de los portadores depende de tres aspectos
fundamentales que son: el desorden energético (debido a la
fluctuación de la polarización de la energía
de la retícula y/o de la distribución de la
longitud de los enlaces del semiconductor), la intensidad del
campo eléctrico aplicado y el desorden estructural (debido
a la fluctuación de la distancia entre sitios, la cual
varía con una varianza Σ).
Para describir los tres aspectos anteriores, el modelo de
Bässler, primero calcula, para un paquete de portadores de
carga, la energía media de equilibrio en función
del desorden energético (<ε∞>),
teniendo en cuenta que los portadores de carga no son sometidos a
un campo electrico.

Ecuación 3. Energía media
de equilibrio.
Donde ρ(ε) es la densidad de estados de
energía y ![]() es el ancho de la
es el ancho de la
DOS normalizados a kT y representa el desorden
energético. Los sistemas que poseen grandes desordenes
energéticos implican bajas temperaturas de acuerdo a la
ecuación y se equilibran más despacio debido a que
los saltos activados térmicamente, que ayudan a los
portadores a encontrar otras trayectorias para la
relajación, están eliminados.
Según Man Hoy Wong[31], el segundo paso
del modelo de Bässler, con el fin de encontrar una
ecuación analítica de la movilidad, tiene en cuenta
la dependencia que tienen la movilidad, de la temperatura,
la cual tiene la siguiente ecuación:
![]() .
.
Ecuación 4. Dependencia
térmica de la movilidad
Luego, teniendo la relación de la movilidad con la
temperatura, el modelo de Bässler relaciona la movilidad
conjuntamente con el campo eléctrico y el desorden
energético, y aquí encuentra un comportamiento como
el de la figura 17, en donde el desorden posicional o varianza es
cero (Σ = 0) y la movilidad del material "presenta
un comportamiento que se aproxima a
(logµ~βE) que es del tipo de
Poole-Frenkel, el cual se da a campos eléctricos
moderadamente altos (>10![]() V/cm)
V/cm)
con tendencia a saturarse a grandes campos eléctricos
(>10![]()
V/cm)"[32]. En la figura se ve que a medida que el
desorden energético aumenta, la movilidad disminuye, lo
cual es consecuencia de lo que vimos anteriormente cuando
tratamos el pozo de potencial, en donde el trasporte por efecto
túnel necesita que las energías de los sitios entre
los cuales se dará el hopping sean iguales y el
desorden energético implica que dichas energías son
muy dispares. También la figura 17 nos muestra que la
movilidad aumenta con el aumento del campo eléctrico, lo
cual es consecuencia de que la DOS aumenta con el campo y el
aumentar la densidad de estados, conlleva inevitablemente a una
disminución en el desorden energético. Esto
también se puede explicar retomando la figura 16, en donde
observamos que un potencial aplicado reduce la barrera de
potencial, facilitando el hopping en la dirección
del campo aplicado. Por último y como más
importante, la figura nos muestra que a grandes campos, la
movilidad alcanza un nivel de saturación en el cual deja
de depender del desorden energético

Figura 17.
Variación de la movilidad con el desorden
energético, asumiendo desvanecimiento del desorden
posicional.
Fuente: WONG, Man Hoy. Charge transport and injection
in doped organic semiconductors. Universidad de Cornell. Mayo de
2004. <my.ece.ucsb.edu/mhwong/documents/thesis.pdf>
[consulta: feb 2005]
El modelo de Bässler habiendo ya considerado el
desorden energético, continua su análisis, considerando la movilidad
relacionada conjuntamente con el desorden posicional y el campo
eléctrico y en este aspecto encuentra que la movilidad se
comporta como la figura 18, en donde el desorden
energético es cero. En esta figura se observa que al
aumentar el desorden posicional se aumenta la movilidad, lo cual
se debe a que este desorden introduce muchas rutas alternas, es
decir, que si en la dirección del campo eléctrico
la barrera de potencial es muy grande, es factible que en otras
direcciones se encuentren barreras menos anchas por las cuales
los portadores puedan tomar atajos, incluso en direcciones en
contra del campo eléctrico. Sin embargo a medida que el
campo aplicado aumenta, los portadores de carga son obligados a
obedecer la ruta señalada por el campo y las rutas
alternas ya no se pueden tomar, con lo cual disminuye la
movilidad.

Figura 18.
Variación de la movilidad con el desorden posicional
asumiendo desvanecimiento del desorden energético.
Fuente: WONG, Man Hoy. "Charge transport and injection
in doped organic semiconductors." Universidad de Cornell. Mayo de
2004. <my.ece.ucsb.edu/mhwong/documents/thesis.pdf>
[consulta: feb 2005]
Habiendo considerado los tres factores de los que depende
la movilidad, el modelo de Bässler, con el objeto de
encontrar una fórmula general para la movilidad, toma
todos los factores en conjunto y llega una ley universal que
relaciona los tres efectos:

Ecuación 5. Movilidad relacionada
con E y el desorden energético y posicional.
En la ecuación 5, C es un parámetro del sistema
que depende del material.
Teniendo en cuenta todo lo anterior se puede concluir que:
– Según Man Hoy Wong[33],
Mediante una combinación adecuada de desorden
energético y de desorden posicional se puede lograr que la
movilidad de un semiconductor orgánico no dependa del
campo eléctrico aplicado (sea constante en la
práctica), siempre y cuando este se mantenga dentro de un
rango específico.
- El desorden energético disminuye la
movilidad y en si mismo disminuye con el campo
eléctrico.
– El desorden posicional aumenta la movilidad, pero
también disminuye con el campo eléctrico.
– El campo eléctrico hace que la movilidad de un
semiconductor orgánico no sea constante (pero este efecto
tiene solución) y satura la movilidad de los portadores de
carga a campos elevados.
La figura 19 muestra la movilidad de los huecos en
TAPC/polycarbonate ante la presencia de ambos parámetros
de desorden y del campo eléctrico.

Figura 19.
Movilidad del TAPC:PC con desorden energético y
posicional.
Fuente: WONG, Man Hoy. "Charge transport and injection
in doped organic semiconductors." Universidad de Cornell. Mayo de
2004. <my.ece.ucsb.edu/mhwong/documents/thesis.pdf>
[consulta: feb 2005]
2.2 CONDUCTIVIDAD EN LOS SEMICONDUCTORES
ORGÁNICOS.
Teniendo en cuenta el modelo de trasporte de cargas en los
semiconductores orgánicos y el comportamiento de la
movilidad con el desorden y el campo
electrico, podemos encontrar la conductividad de un
semiconductor orgánico facilmente, ya que por
definición la conductividad es:
s=nem
Ecuación 6. Ecuación de la
conductividad.
En donde n es la concentración de portadores de
carga, e es la carga del electrón y m es la
movilidad de los portadores de carga, la cual tiene la forma
encontrada en el numeral anterior. Sin embargo la conductividad
varía con la temperatura, ya que si ésta se
incrementa, tambien se incrementan el número de sitios
alcanzables, ya que se puede hacer hopping hasta estados
localizados más alejados o de mayor energía, debido
a que con la temperatura se aumentan los fonones y la
energía, y en este orden de ideas una partícula
subatómica puede trasladarse mediante efecto túnel
a mayores distancias. "La dependencia que tiene la conductividad
en los semiconductores orgánicos σ(T) con respecto a
la temperatura, está dada por la ecuación 7, en
donde σo(T) es un factor dependiente de la temperatura, To
es la temperatura de referencia (relacionada con la DOS en el
nivel de Fermi) y d la dimensión del
salto"[34].

Ecuación 7. Conductividad
dependiente de la temperatura
"Adicionalmente el número de estados localizados
disponibles, es incrementado mediante el aumento del nivel de
dopaje, lo cual mejora la conductividad. Pero para para los
polímeros conjugados altamente dopados, la conductividad
con respecto a la temperatura se asemeja al comportamiento de un
metal, en el cual la conductividad decrece con el incremento de
la temperatura"[35]. En estos casos la
ecuación anterior ya no es válida, debido a que las
moléculas individuales se comportan como metales y en este
caso el modelo cambia un poco respecto al anterior y consiste en
que el material está constituido por granos
metálicos o islas metálicas rodeadas por un medio
con una banda de gap con estados localizados. "Este modelo,
basado en el desorden heterogéneo de polímeros
conjugados altamente dopados, sugiere que el mecanismo de
transporte de cargas dentro de las islas metálicas es
similar al de los metales y entre islas sigue siendo el
hopping. La conductividad dependiente de la temperatura
σ(T) en este modelo es expresado de acuerdo a la
ecuación 8, para pequeñas islas metálicas
(~nm), donde σo y To son constantes del material, y de
acuerdo a la ecuación 9, para islas metálicas
más largas (~μm), donde T1 y T2 son constantes del
material que dependen del ancho y la altura de la barrera
de tunelaje"[36].
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |