Análisis realizados en Cuba,
inició los cultivos de Helicobacter pylori en 1986.
Desde 1991 se ha implantado en Cuba el método
rápido de la ureasa utilizando para el diagnóstico enzimático de la
bacteria, mediante el cual se le agrega al fragmento de mucosa
gástrica, una solución-sustrato amarilla pajiza y
ésta en presencia de la ureasa (enzima producida por la
bacteria, si está presente) cambia de color a rosado
rojizo ( Sara Mandado Pérez y col. 2002).
En los últimos tiempos, algunos trabajos han demostrado
la utilidad de la
citología gástrica por cepillado en el
diagnóstico morfológico de Helicobacter
pylori.
Los objetivos de
investigaciones realizadas en Cuba y otros
países sudamericanos fueron realizar el diagnóstico
morfológico de la bacteria mediante citología
gástrica por cepillado en pacientes con gastritis
crónica y/o úlcera gástrica y probar varias
técnicas de coloración para elegir
la de los mejores resultados de acuerdo con el grado de nitidez,
contraste, monotonía, costo, tiempo,
posibilidad de realizar al mismo tiempo el diagnóstico de
malignidad y la conservación de las láminas (Sara
Mandado Pérez y col. 2002).
El Helicobacter pylori induce la inflamación gástrica y es organiza
la gastritis, aumenta el riesgo para la
ulceración gástrica y duodenal, distal del
adenocarcinoma gástrico y la enfermedad de
linfo-proliferativa de la mucosa gástrica. En contraste
con la infección con otros patógenos de la mucosa,
sin embargo, sólo un porcentaje pequeño de personas
que llevan el Helicobacter pylori, en la vida desarrolla
secuelas clínicas. Recientes investigaciones enfocadas en
Helicobacter pylori y su patogénesis han dado
énfasis al riesgo de la enfermedad que involucra las
interacciones entre el patógeno y su organización, que a su vez, es dependiente
de otro factores bacterianos específicos. Estos
artículos repasarán las recientes publicaciones y
la dirección de mecanismos específicos
a través de los cuales el Helicobacter pylori
coloniza y lleva a la inflamación gástrica y
finalmente produce una lesión de impacto biológico.
Indudablemente, la vida de los individuos colonizados
continuará evolucionando como el nuevo conocimiento y
el surgimiento de los ambientes socio-económicos, y
además cambiarán las maneras para controlar y
erradicar al Helicobacter pylori, con la ayuda de los
principales centros de investigación de salud
pública ( Hoda M. Malaty y Olof Nyren 2002)
A continuación estudiaremos cada una de las
características propias del Helicobacter pylori :
1.1 TRANSMISIÓN:
Varios análisis sobre el modo de
transmisión del H. pylori están siendo
desarrolladas, y es una de las áreas mas estudiada,
discutida y controvertida desde que fue descubierto el microorganismo. Las vías de
infección del Helicobacter pylori aceptadas
actualmente incluyen la fecal-oral y la oral-oral. No hay
posibilidad de transmisión a través del acto sexual
y la infección por insectos vectores, es
prácticamente nula ( Ramírez
Ramos y R. Gilman 2001).
1.2 TRANSMISIÓN
FECAL-ORAL:
En 1992, fue publicado el primer trabajo sobre
o asilamiento de H. pylori en heces humanas. En este
estudio, se aisló H. pylori en heces de niños y
adultos infectados en Gambia. Algunos años mas tarde, esta
bacteria fue aislada en heces de individuos dispépticos
(H. pylori – positivos). Entretanto, otros estudios
evidenciaran que H. pylori está bien adaptado al
pasar al estomago y luego al duodeno. Se puede indicar, que la
bilis causa un efecto letal para la bacteria, es por eso que la
sobrevivencia de Helicobacter pylori después de la
transmisión parece ser poco común.
Algunos autores describen altas tasas (cerca de 90%) de
DNA de Helicobacter pylori en muestras de heces de seres
humanos contaminados. Por otro lado, en un estudio posterior,
apenas el 7% de DNA bacteriano fue observado en las heces
analizadas. Ahora la detección del material
genético de Helicobacter pylori en las heces
hará surgir la posibilidad de una transmisión
fecal-oral, por la presencia de DNA de la bacteria en las heces
no significa, necesariamente, que la bacteria este
presente.
Cuando Helicobacter pylori sea transmitido
vía fecal-oral, el agua
sería un probable medio de propagación de la
bacteria. En un estudio epidemiológico sobre el modo de la
transmisión del Helicobacter pylori en niños
peruanos, fue propuesto una asociación entre la
prevalencia del microorganismo en el agua potable.
Adicionalmente, fue sugerido que la
contaminación en la agricultura,
por la utilización de aguas contaminadas, a través
de consumo de
frutas y vegetales no cocidos, pueden ser un posible modo de
transmisión de Helicobacter pylori ( Ramírez
Ramos y R. Gilman 2001).
1.3 TRANSMISIÓN ORAL-ORAL:
Existen indicios de que el Helicobacter pylori
pueda permanecer al transitar por el área bucal, en la
placa dentaria o en la saliva. Además de ésta, su
presencia en el jugo gástrico indica la posibilidad de
transmisión oral-oral.
Hay evidencias de
que el vomito o el reflujo esofágico pudiera ser
considerado como un medio de propagación del
microorganismo, una vez que la bacteria fuera detectada en el
jugo gástrico de pacientes infectados. De este modo, se
propone una mayor atención y posibles transmisiones
gastro-orales, que ocurriera cuando un individuo
estuviera en contacto con el vómito
contaminado.
En estudios sobre la
investigación de la transmisión del
Helicobacter pylori, fueron aisladas bacterias de
la placa dentaria de pacientes positivos al microorganismo.
Posteriormente, en un estudio con pacientes dispépticos de
la India, se
encontraron cerca del 98% de los pacientes con presencia de
Helicobacter pylori en la placa dentaria.
Estos datos indican que
la transmisión oral-oral y gastro-oral pueden ser dos
principales medios de
propagación de la bacteria ( Ramírez Ramos y R.
Gilman 2001).
2.1 Historia del Helicobacter
pylori:
En 1893, Bizzozero y colaboradores relatan, por primera
vez, la presencia de organismos espiralados en el estómago
de perros. Tres
años mas tarde, Salomon también describió
espiroquetas en el estómago de perros y gatos.
Posteriormente, estas observaciones fueron confirmadas por otros
autores, como Balfour, que en 1906 detecto microorganismos
espiralados en úlceras gástricas y duodenales de
perros y monos. En el mismo año, la presencia de
microorganismos en el estómago y en el vómito de
pacientes con cáncer gástrico fue detectado por
Krienitz. En 1924, Luck & Seth describieron la actividad de
la enzima ureasa en la cavidad gástrica. Algunos
años mas tarde (1954), se postulo que la presencia de esta
bacteria no podía producir la contaminación de la mucosa, sucediendo un
cierto descanso con los análisis y publicaciones en esta
área ( Anita Paula de Godoy
& Marcelo L. Ribeiro, 2003).
A partir de 1972 a 1975 se comenzaron a publicar datos
relativos a la asociación de la presencia de bacterias
espirales en la mucosa del estomago y la inflamación del
estomago y la inflamación crónica de esta. En 1982
en el hospital Royal Perth de Australia, Warren y Marshall
descubren al "Campilobacter pyloridis", que después
tomaría el nombre actual de Helicobacter
pylori. Es que de esta manera en el año 1982 se
aisla por primera vez al Helicobacter pylori en Agar
Chocolate bajo atmósfera
anaeróbia en un tiempo mínimo de 3 días de
incubación.
Estos investigadores australianos, Barry Marshall y
Robin Warren descubrieron en el estómago una bacteria en
forma de espiral, que posteriormente se nombró
Helicobacter pylori (H. pylori). Después de
estudiar de cerca los efectos del H. pylori en el
estómago, ellos propusieron que la bacteria era la causa
fundamental de la gastritis y de las úlceras
pépticas.
En sus estudios, todos los pacientes que tenían
úlceras duodenales y el 80 por ciento de los pacientes que
tenían úlceras de estómago tenían la
bacteria. El 20 por ciento de los pacientes que tenían
úlceras de estómago pero no tenían el
Helicobacter pylori eran los que habían tomado
medicamentos antiinflamatorios no esteroides (como aspirina e
ibuprofeno), que son causas comunes de úlceras de
estómago.
Aunque los resultados parecían concluyentes, la
teoría
de Marshall y Warren fue discutida y disputada por algún
tiempo. Sin embargo, en los 10 años siguientes se
acumuló más evidencia que relacionaba el H.
pylori con las úlceras, ya que numerosos estudios
organizados en todo el mundo confirmaban su presencia en la
mayoría de las personas que tenían úlceras.
Los investigadores estadounidenses y europeos probaron que con el
uso de antibióticos se elimina el H. pylori, las
úlceras sanan y se previene su reaparición en
aproximadamente el 90 por ciento de los casos.
Para investigar más a fondo estos resultados, los
Institutos Nacionales de la Salud (National Institutes
of Health, su sigla en inglés
es NIH) establecieron un panel para revisar de cerca la
relación entre el H. pylori y la enfermedad por
úlcera péptica. En el Congreso para el Desarrollo del
Consenso (Consensus Development Conference) de febrero de 1994,
el panel concluyó que el H. pylori juega un papel
importante en el desarrollo de las úlceras y que los
antibióticos, junto con otros medicamentos, pueden tratar
con éxito
la enfermedad por úlcera péptica.
Pero antes de hablar acerca del Helicobacter
pylori, para el año 1983 Marshall y Skirrow acuerdan
el nombre de Campilobacter pyloridis ya que el porcentaje
de G+C era de 34% y estaba dentro del rango normal de
Campilobacter y era excluyente del genero
Spirilum. Para el año 1987 pasa a denominarse
Campilobacter pylori para adaptarse a la nomenclatura
actual.
Para el año 1989, Goodwin crea el genero
Helicobacter en base a la secuencia de bases de la
molécula 16S del ARNr, que paso a denominarse
Helicobacter pylori. Desde entonces se han aislado
distintas especies, tanto gástricas como no
gástricas.
En los primeros estudios realizados con esta bacteria,
se pensó que podría ser una nueva especie dentro
del genero Campilobacter debido a que presentaba forma
curvada, movimiento por
flagelos polares, requerimiento microaerofílico para
lograr su cultivo, aunque presentaba ciertas
características atípicas. Por este motivo se
incluyó dentro del genero Campilobacter y por su
localización en el antro gástrico se propuso el
epitelio pyloridis, así pasó a llamarse
Campylobacter pyloridis. Más adelante se
puntualizó que el nombre correcto en latín era
Campylobacter pylori. Luego, según los estudios
realizados con analisis de técnicas moleculares del
ADN y por
estudios genómicos modernos y además de varios
análisis de secuencias de ácido ribonucleico
ribosomal (ARNr) se pudo demostrar que Campylobacter y
Helicobacter son los miembros principales de un grupo distinto
de bacterias que está relacionada lejanamente con otras
eubacterias, como podemos observar en el siguiente esquema:
(Alberto Ramírez Ramos y Robert H. Gilman,
2001)

2.2 MORFOLOGÍA
El Helicobacter pylori es un bacilo Gram
negativo, en el estomago es corto espiralado o en forma de "S",
de 2.5 a 5.0 micras de ancho, en los cultivos son menos espirales
y aparecen mas como bacilos curvados. Presentan de 4 a 6 flagelos
polares envainados de 30 a 2.5 nanómetros y presenta una
característica terminación conformando un bulbo,
cada flagelo está insertado en el cuerpo bacteriano
mediante un disco amplio de 90 nanómetros. La vaina
protege al flagelo de la despolimerización del
ácido gástrico.
La morfología
del Helicobacter pylori en tinción de Gram presenta
cuando se realiza una tinción de Gram a partir de una
extensión de biopsia del antro gástrico se pueden
observar los bacilos de morfología curvada y gram
negativos.
La tinción con bromuro de etidio a partir de una
biopsia gástrica se puede observar de una manera muy
especial, ya que el bromuro de etidio es capaz de intercalarse
entre las bases nitrogenadas del ADN de la bacteria y emite
fluorescencia que permite su observación en un microscopio de
fluorescencia. En esta imagen se puede
observar la morfología espiral o de sacacorchos de
Helicobacter pylori.
En una tinción de Gram a partir de un cultivo en
placa de agar de Helicobacter pylori se observa una forma
muy distinta. Ya que cuando Helicobacter pylori crece en
medios artificiales pierde su estructura
completamente espiralar o de sacacorchos y adquiere una
estructura algo más recta aunque sigue siendo curvada.
Además se puede observar de color rosa debido a su
estructura de bacilo Gram negativo ( Alberto Ramírez Ramos
y Robert H. Gilman, 2001)
ESQUEMA

FOTOGRAFÍA
ELECTRÓNICA
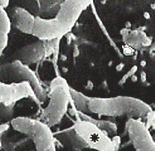

Tenemos que mencionar que se han podido observar en
cultivos in vivo formas cocoides del Helicobacter pylori y
estas podrían ser las manifestaciones morfológicas
de la muerte
celular.
Ultraestructuralmente, esta bacteria presenta una
membrana externa revestida de una estructura similar al
glicocálix; in vivo, la superficie bacteriana puede
encontrarse en íntimo contacto con las microvellosidades
del epitelio gástrico.
2.3 FORMAS COCOIDES
El Helicobacter pylori puede presentar dos
formas, una forma espiralada y una forma cocoide; ambas pueden
encontrarse en el estomago y duodeno, por lo general la
morfología bacilar espiralada es la más
común. La forma cocoide del Helicobacter pilori no
se adhiere al epitelio y no induce a la formación de
interleucinas.
La conversión de forma bacilar espiralada a la
forma cocoide se ha visto en especies que han sido cultivadas
bajo condiciones adversas, como anaerobiosis, temperaturas altas,
incubación prolongada, entre otras.
Esta forma cocoide se comportaría como una forma
de resistencia capaz
de soportar las condiciones adversas que se encontraría el
Helicobacter pylori en el medio ambiente
( Katyssulla Costa y col. 1999).
2.4 PARED CELULAR Y LIPOPOLISACARIDOS
El Helicobacter pylori al igual que otras
bacterias Gram negativas tiene una membrana externa y otra
interna, en la que se han identificado proteínas
de membrana como la de localización
citoplasmática.
A diferencia de los lipopolisacáridos (LPS) de
otras bacterias entéricas, los de Helicobacter pylori
tienen una actividad inmunogénica débil, por lo que
no hay una alta inducción de citoquininas inflamatorias
(Alberto Ramírez Ramos y Robert H. Gilman ,
2001)
2.5 RESPIRACIÓN Y METABOLISMO
El Helicobacter utiliza carbohidratos
siguiendo la vía fermentativa y oxidativa, en la que se ha
identificado a las enzimas
pertenecientes al ciclo pentosa – fosfato, por ese motivo el
Helicobacter pylori es capaz de catabolizar la D-glucosa.
Además mencionamos que el Helicobacter
pylori presenta gránulos de reserva energética
los cuales le servirán en el momento que la bacteria se
asocie a un epitelio degenerado donde el aporte de energía
está marcadamente disminuido.
2.6 CARACTERÍSTICAS
BIOQUÍMICAS:
Las principales enzimas que pueden detectarse en el
laboratorio y
que permite una identificación del Helicobacter
pylori son:
2.6.1 UREASA: es una enzima que tiene la
capacidad de hidrolizar la úrea produciendo amonio y
carbamato, el cual se descompone para producir otra
molécula de amonio y ácido carbónico y de
esta manera se produce una alcalinización del ambiente.
El Helicobacter pylori para su proceso de
colonización en la mucosa gástrica tiene que
sobrevivir al medio adverso del ácido estomacal, por ello
la clave para la adaptación al pH
ácido gástrico reside en la producción de ureasa.
Esta enzima se localiza en el citosol del bacilo y en su
superficie, por lo que, esta enzima es la más estudiada y
representa alrededor de un 5% del total de las proteínas
celulares del Helicobacter pylori.
2.6.2 CATALASA: Es una enzima que descompone el
peroxido de hidrógeno (agua
oxigenada) y la convierte en agua liberando oxígeno, el cual en una prueba de
laboratorio se visualiza como producción de burbujas. Esta
enzima juega un rol importante en la resistencia bacteriana a la
fagocitosis de los polimorfonucleares.
2.6.3 CULTIVO: El Helicobacter pylori es
una bacteria muy exigente y para su crecimiento en medios de
cultivo necesita una atmósfera adecuada,
microaerofílica, con una baja concentración de
oxigeno y
presencia de CO2 de 5 – 10%, así como una
humedad de 70 – 90%.
Se recomienda el uso de estufas de CO2 que permite
mantener una temperatura
entre 35 a 37 °C o utilizar jarras de anaerobiosis para el
crecimiento del bacilo.
Los medios de cultivo utilizados deben ser ricos en
nutrientes y deben contener sangre de
carnero, caballo o humana o productos
derivados de la sangre; por lo que el medio más adecuado
es el de Skirrow.
El periodo de incubación es prolongado (7 a 10
días) pero al cabo de 2 a 5 días ya se pueden
visualizar las colonias típicas del Helicobacter
pylori, las cuales son pequeñas, brillantes y
transparentes.
El Helicobacter pylori es una bacteria muy
adaptada a su hábitat
y es de crecimiento lento, siendo así mismo, muy
difícil de cultivarla in vitro. El crecimiento
puede ser afectado por varios factores como el número de
biopsias, el medio, la duración de la temperatura en el
transporte
(una vez sacada la muestra) hasta el
método de cultivo. Su detección puede ser
influenciada también por el uso previo de algunos
medicamentos, usados por pacientes en tratamientos de dispepsia,
como el omeprazol, algunos antimicrobianos, bismuto o
benzocaínas. Es posible que residuos de
glutaraldeído, presentes en la pinza de coleta de biopsia,
pueda afectar la viabilidad del H. pylori.
Para un desenvolvimiento del cultivo bacteriana, algunos
cuidados deben ser tomados en cuanto al ambiente de crecimiento
del H. pylori, que debe ser obligatoriamente
microaerofílico (5-6 % de O2, 8-10%
CO2, 80-85% N2). Este método permite
el aislamiento y su análisis de la susceptibilidad del
H. pylori a los antimicrobianos (Alberto Ramírez
Ramos y Robert H. Gilman, 2001)

Cultivo de Helicobacter
pylori
2.6.4 PCR:
El PCR (Polymerase Chain Reaction) es otro
método usado para la detección del H.
pylori. Esta prueba es de altísima sensibilidad y es
muy especifica, pudiendo ser realizada directamente de las
biopsias gástricas o duodenales, del jugo gástrico,
de la placa dentaria, de la saliva, del cultivo y de las heces.
Los genes rRNA 16s rRNA, ureA y el
glmM han sido utilizados para identificación de
la bacteria. Su uso es por la alta sensibilidad, el PCR es muy
utilizado en estudios epidemiológicos ligados a la
identificación de reservorios ambientales, y
también en trabajos de determinación del modo de
transmisión de esta bacteria.
2.6.5 IDENTIFICACIÓN
SEROLÓGICA:
Este examen se basa en la detección de
anticuerpos específicos [imunoglobulina G (IgG)] contra
esta bacteria, encontradas en las muestras de suero de las
personas infectadas. Generalmente son realizados a través
de la técnica de ELISA (Enzyme-Linked Immunosorbent
Assay) o de aglutinación de látex. Resultados
falsos-negativos pueden ocurrir en niños, sidosos y en
individuos inmunodeprimidos, que no se desenvuelven a la
reacción inmunológica contra la infección.
La serología tiene un papel limitado en la
confirmación de erradicación de H. pylori,
ya que la mayoría de los pacientes es necesario de 6 a 12
meses para que la reacción de IgG baje a 50%, o a valores mas
bajos, anteriores al tratamiento ( Hilpi Rautelin y col
2003).
2.6.6 TEST
RÁPIDO DE UREASA (TRU)
Esta basado en la principal característica
bioquímica
de la bacteria, la producción de la enzima ureasa que
hidroliza la urea en gas
carbónico y amoníaco, alterando el pH del medio
(Figura). Esta reacción será observada a
través de un indicador de pH, que indicará la
presencia de la bacteria. Para el diagnóstico do H.
pylori en la práctica clínica, el test de
ureasa es barato, rápido y fácil de realizarse,
pero no se tiene información sobre la intensidad de la
inflamación. Falsos-positivos pueden ocurrir debido a la
presencia de otros organismos productores de ureasa, del mismo
modo falsos-negativos pueden ocurrir cuando el paciente
está siendo tratado con inhibidores de la bomba de
protones como omeprazol, lanzoprazol o pantoprazol (Alberto
Ramírez Ramos y Robert H. Gilman, 2001).


FIGURA : Test rápido de la ureasa:
amarillo – ureasa negativo; rosa – ureasa positivo.
Reacción de la urea.
2.6.7 TEST RÁPIDO DE UREA:
El principio de este test es simple y consiste en
la
administración, por el paciente, de una
solución de urea isotópicamente marcado con
13C o 14C. El gas expirado es recolectado
para su posterior análisis. Si se encuentra H.
pylori en esta muestra, la enzima ureasa catalizará la
hidrólisis de la urea, siendo el dióxido de
carbono
absorbido por la corriente sanguínea. La molécula
con isótopo marcado será detectada en el expirado.
Además, pueden ocurrir falsos-positivos debido a la
hidrólisis de la urea por bacterias de la cavidad oral, o
falsos-negativos en el caso que el examen sea después de
una semana del uso de bismuto, o antimicrobianos o después
de una cirugía gástrica.
2.6.8 TÉCNICAS
HISTOLÓGICAS
Esta técnica histológica no esta libre de
fallas, pero la especificidad es de alta sensibilidad.
Además de la identificación de la bacteria, el
análisis histopatológico permite analizar el tipo
de la intensidad de la inflamación de la mucosa
gástrica. Las coloraciones mas utilizadas son con
hematoxilina-eosina y Giemsa.
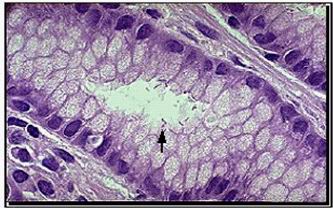
FIGURA: Análisis
histológico de la biopsia gástrica: la flecha
indica la presencia de H. pylori.
2.6.9 RESISTENCIA A LOS
ANTIMICROBIANOS
La principal razón del fracaso de las terapias
utilizadas para erradicar al H. pylori se debe a la
resistencia a algunos antibióticos utilizados. Por la
heterogenecidad de la bacteria, es recomendable analizar la
diversidad genotípica y la resistencia del H.
pylori a los antibióticos propuestos al tratamiento,
para la prevención del suceso terapéutico, ya que
una de las razónes principales es la baja eficiencia
terapéutica y la resistencia de la bacteria a algunos
antibióticos utilizados. Así mismo, es de
fundamental importancia el análisis de la
Concentración Inhibitoria Mínima
(CIM o MIC).
Cuando fueron analizadas líneas brasileras de
H. Pylori, en relación a la resistencia primaria de
estas, se verificó gran resistencia a diferentes en
comparación con datos obtenidos en otras poblaciones. La
resistencia a metronidazol fue verificada en 42% de los linajes,
para amoxicilina en 29%, para claritromicina y tetraciclina 7% y
para furazolidona 4% ( Anita Paula O. de Godoy & Marcelo L.
Ribeiro, 2003)
En otro estudio, observamos que la resistencia del H.
pylori para estos antimicrobianos podría reducir la
eficiencia del tratamiento para la erradicación hasta un
50%. Al revelar diferencias en las líneas brasileras en
comparación con otros países, estos datos refuerzan
la importancia de los estudios específicos de H.
pylori provenientes de la población brasilera ( Anita Paula O. de
Godoy & Marcelo L. Ribeiro, 2003)
La resistencia a una cierta clase de
antibióticos puede desarrollar diferentes mecanismos que
puede ocurrir con todas las líneas de una determinada
especie bacteriana. Al nivel bioquímico existen cuatro
mecanismos principales de resistencia a los agentes
antimicrobianos: impedimento de la penetración del
antimicrobiano, alteración molecular del blanco, reflujo
activo de la droga e
inactivación del compuesto antimicrobiano.
2.6.10 RESISTENCIA Y PATOGENOCIDAD
El suceso de la erradicación del Helicobacter
pylori no depende apenas de la susceptibilidad de la
línea o el antimicrobiano utilizado en la terapia, mas
este es un de los principales factores, teniendo así
mismo, mayores tasas de cura en pacientes infectados con
líneas sensibles al tratamiento. Algunos estudios sugieren
que la tasa de erradicación del H. pylori es menor
en pacientes con gastritis, comparándose con los pacientes
con úlcera. De este modo, los factores de la virulencia
podrían influenciar en la falencia
terapéutica.
Fué observado que pacientes infectados con
bacterias cagA+ responderían mejor al
tratamiento de erradicación. Esto puede ser atribuido a la
falta de estas líneas y provocarían una mayor
degradación de moco y del tejido epitelial permitiendo,
mayor penetración de los antimicrobianos contenidos en la
luz del
estomago. Las cepas cagA+ inducen a la
secreción de IL-8, aumentando la respuesta inflamatoria
local, alterando la vascularización, pudiendo favorecer
una mejor difusión de las drogas
utilizadas.
Otra posible explicación a la falta de las
bactérias cagA+ , es que presentan una
mayor tasa de erradicación y que estas cepas pueden
colonizar con mayor densidad, y
tienen un crecimiento mas rápido, comparando con las
líneas cagA- tornándose mas
susceptibles a los antimicrobianos activos durante a
división celular, como la amoxicilina. Algumas
líneas de H. pylori pueden ser
intrínsecamente mas propensas al tratamiento con
antibióticos que de otras. La conexión entre el
genotipo cagA y la resistencia a los antimicrobianos
metronidazol y claritromicina fue observada en un estudio
realizado con niñas españolas. Esta,
información no fue confirmada en otros estudios realizados
en el Reino Unido y en Estonia (Alberto Ramírez Ramos y
Robert H. Gilman, 2001).
3.
EPIDEMIOLOGÍA EN EL MUNDO
La Prevalencia a la infección por Helicobacter
pylori ocurre mundialmente, habiendo diferencias
significativas en la prevalencia de la bacteria cuando su
desarrollo es regional. En general, el número de personas
infectadas es superior en países en desarrollo,
comparándose con la prevalencia en los países
desarrollados. En los Estados Unidos y
Australia, por ejemplo, la tasa de infección oscila entre
19 e 57%, en otros países como China,
Tailandia y la India la prevalencia puede llegar al 90% (ver la
FIGURA ).

Figura – Prevalencia del
Helicobacter pylori en el
mundo.
Estudios epidemiológicos
muestran que la incidencia de la infección por H.
pylori, parece ser mayor cuanto mas elevada es la pobreza. En
los países desarrollados, la infección es
relativamente rara en niños, y es adquirida en una tasa
constante, aproximadamente de 0,5 – 2,0 % por año,
alcanzando una prevalencia de 20 – 40 % en la población
adulta. Por otro lado, en los países en desarrollo, el
H. pylori es adquirido rápidamente durante la
primera infancia, como
por ejemplo en la China, donde la tasa de infección llega
a 70% entre los adolescentes.
En Nigeria, donde la alta prevalencia muestra datos chocantes,
del 58% de niños sero-positivos con un año de edad
pueden llegar hasta 91% después de los diez años.
Adicionalmente, otros estudios epidemiológicos, indican
que en países desarrollados la tasa de infección en
niños con edades inferiores a 10 años varia de 0 a
5%, y en países en desarrollo las tasas llegan al 60%
(Vibeke Wewer y Nicolas Kalach, 2002)
En los países industrializados, la
infección por Helicobacter pylori y la enfermedad
ulcerosa péptica son menos frecuentes en los niños
que en los adultos. No obstante, una enorme cantidad de datos
científicos y de publicaciones están de acuerdo
sobre la adquisición de la infección durante la
infancia o la lactancia,
incluso en los países industrializados.
Esta infección por el Helicobacter pylori
es probablemente la infección bacteriana más
frecuente en el mundo. Su incidencia varía según
las áreas geográficas y es mucho mas elevada en
países en desarrollo. Las condiciones
socioeconómicas, los factores nutricionales, el hecho de
vivir en condiciones de hacinamiento, el agrupamiento de las
familias y la practica de compartir cama entre los hermanos han
demostrado ser factores determinantes que influyen de forma
considerable en la prevalencia de la infección en los
diferentes países.
Debido a estas dimensiones continentales y las
desigualdades socio-económicas existentes en los
países en desarrollo, especialmente en Sudamérica
es fundamental que estudios epidemiológicos sean
realizados en diferentes regiones de los países pobres de
nuestra región.
Un trabajo realizado en Brasil, en el
estado de Mato
Grosso mostró una alta tasa de infección por H.
pylori entre niños y adolescentes (77,5%), y
encontrándose 84,7% en la población adulta. En
otros estudios, realizado en Bello Horizonte, la prevalencia de
esta bacteria fue del 34,1% y en los niños fue de
81,7%.
En países desarrollados el aumento de la
relación: prevalencia de la infección con la edad,
está relacionada por un efecto corto, ya que la
mayoría de las personas fueron infectadas en la infancia
cuando las condiciones socio-económicas y de saneamiento
básico eran peores. Posteriormente, las generaciones mas
jóvenes fueron infectadas con menor frecuencia, debido a
la mejora de los servicios
básicos de saneamiento. La incidencia de la
infección por H. pylori, en los países
desarrollados, es menor comparados con los países en
desarrollo, lo que confirma que la situación
socio-económica, es un factor determinante e importante,
indicando la necesidad de realizarse mas estudios
epidemiológicos.
El papel del Helicobacter pylori como
patógeno está bien documentado que produce
gastritis crónica superficial, pero también
está implicado en la aparición de la úlcera
duodenal y gástrica y está reconocido como
carcinógeno por parte de la
Organización Mundial de la Salud ( Anita Paula O. de
Godoy & Marcelo L. Ribeiro, 2003)
En el año de 1987 se publicó una
investigación realizada en la ciudad de Lima en la que
observó 672 casos, de los cuales: 325 eran del
hospital Arzobispo Loayza (pacientes de estrato
socioeconómico bajo) y 347 de la práctica
privada (nivel socioeconómico alto),
reportándose el hallazgo de la bacteria en el 91.8 %
de pacientes con gastritis crónica activa, 72.7 % con
úlcera gástrica y 84.2 % con úlcera
duodenal.Finalmente se concluyó que en la ciudad de
Lima, la prevalencia de la infección del
estómago por el Helicobacter pylori , es mayor
(con significación estadística) en pacientes del sexo
masculino de nivel socioeconómico alto. En estos
estudios, la diferencia estadísticamente significativa
de la prevalencia de la infección en mujeres de nivel
socioeconómico bajo y alto se explicaría por la
adquisición más temprana que de la
infección de las primeras. En nuestro país a
diferencia de otros estratos socioeconómicos se
mantienen casi inalterables. En otras palabras no se observan
cambios bruscos de nivel socio económico entre la
niñez y la edad adulta.Las mujeres de nivel socioeconómico alto de
nuestro medio no se exponen a los medios de contagio
descritos como la transmisión oral-oral. Algo
diferente sucede en los hombres de nivel
socioeconómico alto que por razones de trabajo
mantienen contacto cercano con personas de nivel
socioeconómico bajo y pueden adquirir la
infección a través del uso de cubiertos,
vajilla de comer, lavados con agua potencialmente
contaminada.En los estudios demuestran que Lima, tiene una
fuente de contaminación importante que es el agua
proveniente de la Atarjea, podemos sugerir que este grupo
poblacional se infectó principalmente a través
del agua, comprobándose lo sugerido por diversos
autores que son las condiciones ambientales y no una
predisposición genética la que determinaría la
infección.Este estudio indica además que la tasa de
infección en niños de diversos niveles
socioeconómicos en Lima muestran una prevalencia a los
niños de niveles socioeconómicos bajos ya que
consumen agua de la Atarjea y de pozos subterráneos.Todas estas observaciones encuentran asidero con el
aislamiento del Helicobacter pylori en 24 de 48
muestras de agua de diferentes fuentes y
de estas, 24.20 eran provenientes de la Atarjea. Esto lleva a
plantear que la clorinización no es suficiente para
eliminar a la bacteria y si bien el porcentaje de cloro que
tiene el agua de la atarjea es ya suficientemente alto, hay
que tener en cuenta que el agua que es captada en la atarjea
es altamente contaminada, por lo que se sugiere mejorar las
condiciones del agua que se capta para el consumo humano en
Lima metropolitana.Este estudio ratifica que la presencia de
Helicobacter pylori en la mucosa del estómago
va siempre asociada con alteraciones histológicas de
la misma. A su vez, demuestran que el porcentaje
significativo produce: daño mucinoso, atrofia, displasia y
metaplasia intestinal en los pacientes que tienen a la
bacteria comparados con aquellos en que no se reporta la
presencia del microorganismo.La infección por Helicobacter pylori
causa gastritis crónica activa. Factores
geográficos de tipo nutricional probablemente modulan
la conversión de la gastritis crónica activa en
sus estadíos tempranos de Gastritis Crónica
Atrófica (GCA). Estos factores serían dietas
bajas en vitaminas
antioxidantes y otros
micronutrientes.Otro estudio realizado es que durante el proceso de
inflamación grandes cantidades de radicales libres se
encuentran en los tejidos
afectados. Los radicales libres son generados por los
leucocitos PMN y monocitos/macrófagos, como el
mecanismo por el cual estas células ejercen su acción fagocítica. Aunque los
radicales libres son primariamente beneficiosos para el
organismo, cuando no son controlados en forma adecuada pueden
tornarse muy dañinos para las estructuras histológicas. Hay dos
posibles formas de daño histológico por
radicales libres incontrolados: una directa y otra indirecta.
En la forma directa, los radicales libres reaccionan con
varias moléculas blanco, incluyendo proteínas,
lípidos y DNA. En la forma indirecta,
ellos inducen a la aparición de proteínas del
estrés.Vitaminas antioxidantes (Vitaminas A, C y E)
comparten con otros micronutrientes y enzimas la capacidad de
reducir los niveles de radicales libres en los tejidos. Lo
que llama la atención es que se haya reconocido como
un factor determinante de tipo nutricional en la Gastritis
Crónica, la baja ingesta de vegetales y frutas
frescas, alimentos
ricos en vitaminas antioxidantes.Por lo que se concluye que no solo factores de tipo
geográfico sino de tipo socioeconómico influyan
en la orientación de la patología
gastroduodenal asociada a la infección por
Helicobacter pylori en el Perú. ( Alberto
Ramírez Ramos y Dr. Robert H. Gilman, 2001
)- EPIDEMIOLOGÍA EN EL
PERÚEl genoma del Helicobacter pylori oscila entre 1.6 y
1.73 millones de bases, con un valor
medio de 1.67 millones.El cromosoma de la cepa 26695 contiene 1 667 867
pares de bases y el de la J99 1 643 831. Estos tamaños
son similares al del Haemophilus influenzae y la
tercera parte de E. coli.5.1 CARACTERIZACIÓN E
IDENTIFICACIÓN DE GENES:a. ADHESINAS:
El Helicobacter pylori generalmente sobrevive dentro
de la mucosa gástrica y no ataca a las células
del huésped. Una gran variedad de potenciales
receptores epiteliales para las adhesinas bacterianas han
sido descritas, además se han revelado varias
lipoproteínas y proteínas de la membrana
externa con rol en los mecanismos de adhesión
bacteriana.El Helicobacter pylori puede usar al menos cinco
diferentes proteínas como adhesinas para un ataque
exitoso a la
célula epitelial gástrica, estas son
proteínas de la membrana externa, además
funcionan estas proteínas, como las
porinas.b. UREASA:
Esta enzima se encuentra en la superficie y en el
citoplasma del Helicobacter pylori, representa
alrededor de un 5% del total de sus proteínas
celulares, posee un peso molecular de 600 kilodaltons y
está codificada por siete genes denominados ureA a
ureG (genes accesorios)Como se sabe la única ruta por la cual el
amonio puede ser incorporado en aminoácidos y
proteinas es mediante el glutamato, para producir glutamina
la reacción es catalizada por la glutamina
sintetasa.Las características de isla de patogenicidad
de Helicobacter pylori es debido a su contenido de
Guanina + Citosina que es del 35% comparado con el 39% del
cromosoma bacteriano.Mas de la mitad de las cepas del Helicobacter pylori
producen una proteína citotóxica de 87
kilodaltons que induce a la formación de vacuolas en
una gran variedad de celulas eucariontas y se le ha
denominado "toxina vacuolizante". Por lo que estudios
posteriores en Alemania
reportaron un estudio de 30 cepas de Helicobacter pylori que
fueron aisladas de pacientes con gastritis, ulceras
pépticas y cáncer gástrico. Otro estudio
realizado en México demostró que el 60% de
los pacientes mexicanos presentaron afecciones con
múltiples cepas del Helicobacter
pylori.c. FLAGELOS:
Los flagelos del Helicobacter pylori
consisten en estructuras complejas envainadas con un bulbo
terminal, una flagelina mayor codificada por el gen flaA y
una menor codificada por el gen flaB.Diversas investigaciones indican que existe una
correlación que existe entre la morbilidad y la
habilidad para la colonización, con todo ello se puede
considerar que el Helicobacter pylori necesita la motilidad
para la virulencia.El conocimiento de la genética y la biología molecular del Helicobacter
pylori tiene gran importancia en los procesos
patológicos que este produce, por el gran numero de
individuos que coloniza, especialmente en los países
en vías de desarrollo y por la cronicidad de la
infección que se establece a largo plazo.La frecuencia de reportes de infección
múltiple cada vez es mayor, por lo que se debe de
tomar en cuenta la coexistencia de cepas con genotipo
diferente en los pacientes, analizando cual es el resultado
de estas interacciones entre poblaciones. Es de notas que
cepas del Helicobacter pylori de genotipos diferentes
en una misma población parecen no competir entre
ellas, permitiendo la libre sobrevivencia de varias cepas con
genotipos diferentes. - BIOLOGÍA
MOLECULAR DEL HELICOBACTER PYLORI - HELICOBACTER
PYLORI Y ENFERMEDADES DEL
ESÓFAGO, ESTOMAGO Y DUODENO
El Helicobacter pylori es una bacteria que ha
infectado al ser humano y a sus ancestros desde hace muchos
millones de años y a medida que hemos ido evolucionando,
la interacción con este microorganismo ha
cambiado. Un periodo tan largo de convivencia mutua sugiere que
deben haber importantes adaptaciones del microorganismo que
incluyen beneficios para su huésped. El Helicobacter
pylori puede participar en algunos procesos
fisiológicos tales como regulación de la
secreción gástrica y la respuesta
inmunológica a patógenos transitorios. De acuerdo a
las evidencias existentes, el Helicobacter pylori al igual
que otros organismos comensales del cuerpo humano,
pueden exhibir propiedades simbióticas o
patogénicas dependiendo del contexto.
La Gastritis Crónica Atrófica con o sin
metaplasia intestinal es la enfermedad gástrica mas
común asociada al desarrollo del cáncer
gástrico. Por lo que esta enfermedad se inicia con la
destrucción de la mucina y la vacuolización basal
del epitelio gástrico creando zonas desprotegidas y
debilitadas en el epitelio y de esta forma se iniciaría
una reacción inflamatoria que es la gastritis, que
posteriormente pueda derivar en el cáncer
gástrico.
A pesar de la incidencia decreciente durante los
últimos 50 años, el cáncer gástrico
alinea todavía como uno de los cánceres más
frecuentes. Es que hoy en día, podemos estudiarlo a nivel
molecular, en el que encontramos por lo menos dos fenotipos,
asociados con la desestabilización del genoma que se han
identificado. Sin embargo, aplicando las nuevas
tecnologías como el microensayo del cDNA una nueva era
en el análisis de marcadores
moleculares ha empezado. Esta tecnología molecular
puede abrir el camino hacia las nuevas modalidades del
tratamiento, es decir la terapia de genes. Los estudios
genéticos, epidemiológicos, biológicos y
moleculares también han implicado el papel del
Helicobacter pylori en el linfomagénesis. El
conocimiento de estas patogenias y la terapia para su
tratamiento está aumentando, mientras los datos
epidemiológicos precisos son todavía
escasos.
A nivel de esófago se han realizado
múltiples publicaciones y estudios sobre el efecto del
Helicobacter pylori en la incidencia de patologías
del esófago. Una de ellas es el reflujo y el
adenocarcinoma del esófago y de la unión
gastroesofágica. Este efecto esta asociado a las cepas
cagA+ del Helicobacter pylori.
El reflujo esofágico es poco común en los
países donde la mayoría de adultos están
colonizados por el Helicobacter pylori, especialmente por
las cepas cagA+. Las secuelas a largo plazo del reflujo
esofágico están aumentando en los países
occidentales conforme la prevalencia del Helicobacter
pylori esta disminuyendo. La prevalencia del Helicobacter
pylori es menor en personas con reflujo
gastroesofágico que en los controles.
¿Por qué las cepas cagA+ que parecen ser
mas virulentas en relación a las enfermedades del
estómago y duodeno protegen contra las enfermedades del
tracto digestivo proximal? Se han planteado que las cepas cagA-
tienen poco potencial para aumentar o disminuir el riesgo de
enfermedades debido a su escasa interacción con su
huésped. En contraste, las cepas cagA+ interaccionan mas
con el huésped, por lo que tienen mayor potencial de
presentar efectos clínicos. Producen mayor
inflamación del cuerpo del estomago, pudiendo disminuir o
bloquear la secreción ácida, factor necesario para
la severidad del reflujo gastroesofágico y la
aparición posterior del esófago de
Barret.
El Helicobacter pylori es una bacteria que
persiste en el estómago durante muchos años, ya que
debe lograr un equilibrio
biológico con su huésped. El equilibrio entre
bacterias y huéspedes modelan fenómenos
biológicos tales como el ciclo de las células
epiteliales, la secreción gástrica y la
liberación linfoide, todos los cuales influyen sobre el
perfil clínico.
Luego de este tema acerca del Esófago, hay dos
preguntas importantes que en la parte clínica se hacen las
personas: 1) si el tratamiento del Helicobacter pylori
incrementa el riesgo de reflujo esofágico en pacientes sin
reflujo gastroesofágico previo; 2) si el tratamiento del
Helicobacter pylori empeora el reflujo
gastroesfágico en pacientes con reflujo
gastroesofágico. 3) Si el aumento de reflujo
gastroesofágico asociado al Helicobacter pylori va
a aumentar en la población el número de casos de
esófago de Barret y el adenocarcinoma de esófago y
la unión gastroesofágica. Con todas estas
evidencias disponibles no es posible respondeer con absoluta
certeza a estas preguntas, ya que se requiere profundizar en las
investigaciones en un número significativo de pacientes
(National Digestive Diseases Information Clearinghouse, 2002
)
Las enfermedades asociadas al estomago son la
gastritis y el cáncer gástrico, estos estudios
realizados sobre la histopatología principalmente asociada
a la gastritis provocada por Helicobacter pylori se
inician con una respuesta inflamatoria asociada a la
infección gástrica por esa bacteria. Se ha descrito
una severa infiltración de leucocitos polimorfonucleares,
así como de células redondas. También se
observó la perdida de la mucina alrededor de las
microcolonias del Helicobacter pylori que colonizan la
superficie epitelial gástrica. Todo se inicia con una
lesión destructiva de la vacuola mucinosa del epitelio de
cubierta gástrica asociada a la colonización por el
Helicobacter pylori y también una severa
vacuolización del citoplasma basal. Esta
vacuolización se produce por la llamada proteína
vacA.
La asociación de estas dos lesiones, la
destructiva mucinosa y la de vacuolización basal, produce
alteraciones estructurales severas en el epitelio gástrico
de cubierta, creando zonas desprotegidas y debilitadas de
epitelio, a través de las cuales las noxas del lumen
gástrico podrían pasar y alcanzar la túnica
propia subyacente, induciendo en ella la reacción
inflamatoria de la gastritis. Para luego, formarse la gastritis
atrófica con o sin metaplasia intestinal, ya que es la
enfermedad gástrica mas asociada al desarrollo de
cáncer gástrico.
La profundidad de la lesión ocasionada por
Helicobacter pylori, puede producir varios tipos de
lesiones ( Alberto Ramírez Ramos y Robert H. Gilman,
2001):
- Gastritis superficial, en la que las
células inflamatorias llegan hasta las regiones
foveolares y las glándulas quedan intactas. - Gastritis panmucosa, en la que el compromiso
es de todo el grosor de la mucosa, es así que las
células inflamatorias ocupan todo el espesor, pero las
glándulas aún siguen intactas. - Gastritis atrófica, con perdida de
glándulas, compromiso inflamatorio variable y pudiendo
observarse zonas de metaplasia intestinal.
El cáncer gástrico todavía alinea
como uno de los cánceres más frecuentes y produce
preocupación de parte de todas las entidades de salud
pública, debido a su proporción de altas tasas de
mortalidad y un tratamiento limitado. La incidencia de
cáncer gástrico frecuentemente varía. Lo que
viene ocurriendo es considerablemente a nivel mundial,
principalmente en países con poco desarrollo que en los
países industrializados, y tiende a mostrar una
predilección para los grupos
socioeconómicos urbanos y de bajos ingresos.
Los factores medioambientales, particularmente la dieta,
juegan un papel importante en la patogénesis del
cáncer gástrico. La dieta rica en hidratos de
carbono complejos, alimentos salados, encurtidos, el habito de
fumar, comidas a base de pescados secos salados, y además
unidos con aceites recocidos incrementan el riesgo, mientras las
dietas ricas en frutas frescas y verduras han sido asociadas con
un bajo riesgo de contraer cáncer
gástrico.
Los síntomas más comunes de las
úlceras relacionadas con Helicobacter pylori
después de infectarse pueden ocasionar: gastritis, que es
una inflamación del revestimiento del estómago. Sin
embargo, la mayoría de las personas nunca tienen
síntomas o problemas
relacionados con la infección.
Cuando los síntomas están presentes,
pueden incluir un dolor sordo o retortijón, el cual puede
ocurrir dos o tres horas después de las comidas, aparecer
y desaparecer por varios días o semanas, ocurrir por la
noche cuando el estómago está vacío,
aliviarse con las comidas, hay pérdida de peso,
pérdida del apetito, pesadez de estómago, eructos,
náuseas, vómitos.
Se ha demostrado que el Helicobacter pylori se
ubica en dos estratos de la mucosa gástrica: a)
coloniza la capa mucinosa (moco) que cubre el epitelio
gástrico y b) se adhiere a la superficie o a las
uniones intercelulares del epitelio mucosecretor gástrico.
La colonización de la capa mucinosa por si misma, no
parece conducir a alteraciones de la arquitectura del
epitelio subyacente. Pequeñas áreas del epitelio se
inician como una lesión inicial destructiva afectando a 5
o 10 células del epitelio gástrico. Luego se
asocian a la colonización bacterias en un número
significativo y estas primeras áreas muestras vacuolas
mucinosas aplanadas en desarreglo estructural, las más
afectadas se encuentran en colapso; estos cambios del epitelio se
pueden observar con la ayuda de un microscopio a un mediano
aumento (25X).
La úlcera gastroduodenal es una enfermedad
multifactorial. Individualmente la secreción
gástrica ácida, la secreción de pepsina o la
infección por el Helicobacter pylori no pueden
explicar por qué algunas personas desarrollan
úlceras y otras no. Existen otros factores implicados
dentro de la multifactoriedad de esta dolencia, sin embargo la
secreción ácida, la de pepsina y la
infección por el Helicobacter pylori actúan
sinérgicamente y aparentemente son los factores mas
importantes de la etiopatogenia.
Diversos trabajos confirman y demuestran que la
erradicación del Helicobacter pylori no solo logra
la cicatrización de la úlcera gastroduodenal
incluso aquellas refractarias a los antisecretores, sino que
disminuye drásticamente la recidiva ( Francesco Perri y
col. , 2003 )
- Estudios de correlación: factores de Riesgo
cardiovascular vs. Helicobacter pylori. Los factores como el fibrinógeno
plasmático, el factor VII de coagulación , la
hipercolesterolemia y la hipertrigliceridemia también
tienen resultados contradictorios, ya que se encontraron
diferencias significativas entre los
valores de triglicéridos y HDL de sujetos
seropositivos y seronegativos para Helicobacter
pylori. En pacientes con Helicobacter pylori se
encontró que el fibrinógeno era mayor que en
pacientes seronegativos. Otro factor de riesgo es la hipertensión arterial ya que es un
factor de riesgo cardiovascular que se ha relacionado a la
infección por Helicobacter pylori.- Estudios de correlación: Marcadores
inflamatorios vs. Helicobacter pylori.
Hay evidencias que algunos parámetros
biológicos como la proteína C reactiva, el recuento
leucocitario y el fibrinógeno, así como
proteínas de shock por el calor "hsp" ,
son marcadores asociados a la infección por el
Helicobacter pylori y que su aumento conllevaría a
un riesgo coronario (Alberto Ramírez Ramos y Robert H.
Gilman, 2001).
CONCLUSIONES
- El Helicobacter pylori es un bacilo
Gram negativo corto, helicoidal, con múltiples flagelos,
microaerófilo (con preferencia por medios escasos en
oxígeno), que coloniza las capas profundas del moco de
recubrimiento gástrico y duodenal, y se adhiere a las
células epiteliales superficiales de la mucosa del
estómago y duodeno, sin invadir la pared. La bacteria
segrega amoníaco, alcalinizando el medio; así se
protege de la acción ácida del jugo
gástrico (pH 3). El amoníaco además
irrita la mucosa, ayudado por proteasas y fosfolipasas
bacterianas que destruyen el moco protector. La mucosa y su
lámina propia son invadidas por un denso infiltrado de
células inflamatorias, especialmente
neutrófilos. - La vía más común de contagio de
Helicobacter pylori puede ser por transmisión
vía fecal-oral y el agua sería un probable medio
de propagación de la bacteria. En un estudio
epidemiológico sobre el modo de la transmisión
del Helicobacter pylori en niños peruanos, fue
propuesto una asociación entre la prevalencia del
microorganismo en el agua potable. - Se ha relacionado con el 95% de las
úlceras duodenales, el 70% de las úlceras
gástricas, el 100% de las gastritis crónicas
activas y el 100% de las gastritis crónicas tipo B (las
más frecuentes, de localización
antral). - Las pruebas que se utilizan para
diagnosticar esta infección pueden ser directas, si se
basan en la identificación del microorganismo (histología y cultivo), e indirectas,
cuando estudian alguna característica del germen (prueba
de la ureasa y pruebas en aire espirado)
o bien los anticuerpos producidos por el paciente
(serología); también puede usarse PCR
(Polymerase Chain Reaction). Las muestras utilizadas
para el diagnóstico pueden obtenerse por métodos
invasivos (biopsia durante la endoscopia) o no invasivos
(suero, saliva, aliento). - Existe evidencias de que la infección por
Helicobacter pylori este correlacionada con otras enfermedades,
como los factores de riesgo cardiovascular y los marcadores
inflamatorios. - El tratamiento se recomienda cuando se
asocian cuadros de gastritis crónica con episodios
recurrentes de úlcera o cuando los síntomas son
severos y se demuestra la presencia de Helicobacter
pylori en el estómago del paciente. La
infección se trata durante 7 a 14 días con una
combinación de dos o tres antibióticos y un
inhibidor de la secreción gástrica. Es muy
importante para el éxito del tratamiento que el paciente
lo cumpla de forma estricta.
BIBLIOGRAFÍA
- Sara Mandado Perez, Bienvenido, Oramas, Miguel
Gonzalez Carvajal, Manuel Paniagua Estevez, Felipe Piol Nery y
Carlos DomÌnguez Alvarez. Diagnostico
morfológico de helicobacter pylori mediante
citología gástrica por cepillado. Instituto de
Gastroenterología Rev. Cubana Med 2003; 42(1):27-33
2002. - Hoda M. Malaty* and Olof
NyrenဠEpidemiology of Helicobacter
pylori infection. *Department of Medicine at Baylor College
of Medicine, Houston, TX; USA; ဠDepartment
of Medical Epidemiology and Biostatistics, Karolinska
Institute, Stockholm, Sweden 2002. - Hilpi Rautelin * , Philippe Lehours
ဠand Francis Mégraud
ဠDiagnosis of Helicobacter
pylori infection. * The Haartman Institute, University of
Helsinki, and Helsinki University Central Hospital Diagnostic
Laboratory, PO Box 21, 00014. Helsinki, Finland,
ဠLaboratoire de Bactériologie,
Hôpital Pellegrin, Place Amélie Raba-Léon,
33076 Bordeaux Cedex, France. 2003 - National Digestive Diseases Information
Clearinghouse. The National Institutes of Health under the
U.S. Department of Health and Human Services. 2°
Information Way Bethesda, 2002. E-mail: . - Vibeke Wewer * and Nicolas Kalach
ဠHelicobacter pylori infection
in pediatrics. * Department of Paediatrics, H:S Hvidovre
Hospital, Kettegaard Alle 30, DK-2650 Hvidovre, Denmark;
ဠDepartment of Paediatrics, Hôpital
Saint Antoine, Université Catholique, 329 Boulevard
Victor Hugo, 59000 Lille, France. 2002. - Francesco Perri * , Asghar Qasim
ဠ, Lea Marras * and Colm O’Morain
ဠ*Treatment of Helicobacter
pylori infection. Department of Internal Medicine,
Gastroenterology Unit, ‘Casa Sollievo della
Sofferenza’ IRCCS, San Giovanni Rotondo, Italy;
ဠDepartment of Gastroenterology, Adelaide
and Meath Hospital, Trinity College, Dublin, Ireland.
2003 - Alberto Ramírez Ramos y Robert H.
Gilman. Helicobacter pylori en el Perú.
Profesores investigadores de la Universidad
Peruana Cayetano Heredia. 2001 - Anita Paula O. de Godoy & Marcelo L.
Ribeiro. Cultura
bacteriana: penetração, ajuste ao meio e
adherencia do helicobacter pylori. Universidad Federal
de Río de Janeiro. 2003 - Katyssulla Costa, Gerold Bacher, Günter
Allmaier, María Gloria Domínguez. The
Morphological Transition of Helicobacter pylori Cells
from Spiral to Coccoid Is Preceded by a Substantial
Modification of the Cell Wall. Centro de Biología
Molecular "Severo Ochoa", CSIC-UAM, Facultad de Ciencias,
Universidad Autónoma de Madrid.
1999.
Autor:
Blog. Wilmer Paredes Fernández
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |