Sindrome de Torch: Toxoplasma, Herpes, Citomegalovirus y Rubéola (página 3)
C.-EPIDEMIOLOGÍA
Es una enfermedad diseminada por todo el mundo, con
epidemias localizadas a intervalos regulares. Es de alta
contagiosidad y la infección primaria otorga inmunidad de
por vida. El hombre es
el único reservorio del virus y fuente de
infección. La rubéola postnatal se transmite por
vía aérea o por contacto directo con secreciones
nasofaríngeas. Las mujeres chilenas en edad fértil
tienen títulos de anticuerpo protectores positivos en
más de 90% de los casos. La infección
subclínica es la presentación clínica
más frecuente en un 25 – 50% de los casos.
El período de incubación dura 18 ±
3 días. El período de contagio comienza con el
período de incubación hasta 5 días
después de iniciado el período exantemático.
La infección se puede transmitir al feto durante
todo el embarazo, pero
el riesgo de
malformaciones congénitas va disminuyendo a medida que
progresa la gestación y puede ocurrir sólo hasta
las 16 semanas de edad gestacional. Si se produce la
infección en el primer trimestre del embarazo el
compromiso fetal puede ser más del 50% de los casos,
especialmente si ocurre antes de las 4 semanas de
gestación.. Entre la 5° y 8° semanas de embarazo
el riesgo de malformaciones congénitas alcanza un 40-50% y
entre la 9° y 12° semana el riesgo es de un 30-40%. Entre
la semana 13 y 16 el riesgo de malformaciones decrece al 16%. Se
produce compromiso de distintos órganos y persistencia del
virus hasta en nacimiento, encontrándose en la faringe,
recto y orina del recién nacido.
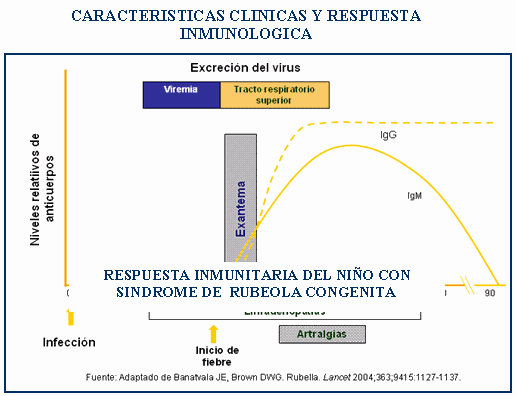
En la rubéola congénita el recién
nacido afectado puede excretar el virus por más de un
año. En la población adulta joven vacunada se presenta
un 10 – 20 % de susceptibilidad que es similar a lo encontrado en
poblaciones similares no vacunadas.
D.-CUADRO CLÍNICO
Rubéola postnatal: El
período prodrómico se caracteriza por fiebre baja,
rinitis, cefalea, odinofagia y moderado compromiso del estado
general.
En el período de estado se presentan
adenopatías grandes especialmente suboccipitales,
cervicales y retroauriculares, exantema eritamatoso maculopapular
poco confluente que se inicia en el rostro que se generaliza
(período exantemático), exantema, faringitis y
conjuntivitis leve. Este período dura 3-5
días.
Este cuadro se puede complicar con poliartritis de mano
( lo más frecuente), con encefalitis que es excepcional,
trombosis de la arteria carotídea, neuritis óptica
mielitis, síndrome de Guillain- Barré,
púrpura trombocitopénico, miocarditis y
pericarditis todas de muy baja incidencia.
Rubéola congénita: La
infección intrauterina puede dar origen a un recién
nacido vivo sano o con bajo peso de nacimiento o con
manifestaciones de infección, con malformaciones
congénitas, mortinato o aborto
espontáneo.
El recién nacido infectado presenta RCIU,
hepatoesplenomegalia, púrpura trombopénico,
anemia
hemolítica, ictericia, lesiones a nivel del
cartílago y epífisis en el hueso, alteración
del líquido cefalorraquídeo y un cuadro de sepsis
grave. En el sistema nervioso
central puede presentar microcefalia y meningoencefalitis
crónica con retardo mental. A nivel ocular presenta
coriorretinitis pigmentaria, cataratas y glaucoma, en
orden de frecuencia, también puede presentar
microoftalmia. Se observa cardiopatías congénitas como DAP,
coartación aórtica, estenosis de la arteria
pulmonar, CIA, CIV y a nivel auditivo sordera sensorioneural. El
síndrome de rubéola congénita se asocia a
manifestaciones de presentación tardía como retraso
del desarrollo
psicomotor, tiroiditis, diabetes mellitus
y panencefalitis subesclerosante subaguda.
E.-DIAGNÓSTICO
CLÌNICO
La clínica es muy inespecífica, tanto en
la rubéola postnatal como en la congénita, por lo
tanto, sólo los estudios de laboratorio
nos darán un diagnóstico de certeza.
Lo mas frecuente es realizar el diagnostico
serológico, es decir, demostrar la presencia de
anticuerpos frente al virus en los sueros. Ello se hace por
distintas de técnicas;
las mas utilizadas fueron siempre la inhibición de
hemaglutinacion (IH), y la fijación del complemento (FC),
pero hoy en día es de uso casi universal el inmunoensayo
(ELIZA), por su mejor sensibilidad, especificidad y fácil
automatización: además permite la
búsqueda tanto de las IgG como las de IgM.
Tres situaciones diagnosticas se presentan en la
clínica:
a) Demostración de estado
inmunitario: se comprueba porque existe un titulo de
anticuerpos IgG por Elisa, igual o superior a 1/10 ó 10UI,
que demuestra una infección anterior si el resultado es
negativo, y se trata de una mujer en edad
fértil, es recomendable la vacunación,
asegurándose siempre de que en los tres meses siguientes
no exista la posibilidad de un embarazo. Si el resultado es
negativo en una embarazada, se le debe avisar del peligro en un
contagio, y vacunarla después del parto.
b) Diagnóstico de rubéola en una
embarazada: que ha tenido un contacto con un caso
clínico de rubéola en el primer trimestre de la
gestación, se practicara un estudio serológico
dentro de los 7 días siguientes al contacto sospechoso; si
es positiva, indica inmunidad anterior, pero si es negativa o a
bajo titulo, se debe repetir a las 3-4 semanas. Si continua
siendo negativa, o con el mismo titulo bajo, indica que no hubo
contagio, aunque se puede repetir una tercera
determinación; si se detectan entonces anticuerpos,
cuadriplicaciones del titulo o son de tipo IgM es señal de
seroconversión.
Si la primera muestra fuera
tomada tardíamente la detección de anticuerpos IgM
demostrara que la mujer se ha
infectado, pero los títulos bajos de IgG indicaran
infección antigua.
En estos últimos años se ha podido
observar que la presencia de IgM no siempre es indicativa de
infección aguda reciente, ya que pueden persistir hasta un
año, apareciendo en el curso de reinfecciones,
después de un contagio natural, o por vacuna, e incluso se
ha comprobado que pueden tratarse de falsos positivos debido a la
presencia del factor reumatoideo o sustancias similares.
Además de que en algunos casos de primoinfeccion se ha
demostrado la ausencia de IgM.
Por todo ello se están estudiando nuevos
marcadores serológicos del diagnostico de infección
activada por este virus; entre ellos, la detección de
anticuerpos de clase IgA, y
la demostración de la presencia de anticuerpos de baja
avidez. Se ha encontrado una alta rentabilidad
al uso de la IgA sérica, detectada por anticuerpos
monoclonados, como marcador de primoinfeccion. Así mismo
la detección de anticuerpos IgG de baja avidez es de
extraordinaria utilidad en
primoinfecciones (usando dietilamina como desnaturalizante de la
uniones de Ag-Ac), y en reinfecciones (usando la urea9, lo que
mejora la sensibilidad, y lo que es mucho mas importante, la
especificidad.
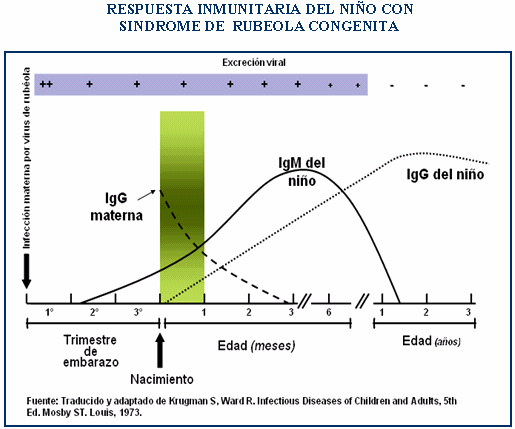
c) Diagnostico de rubéola congénita
en el recién nacido: en el niño hay
anticuerpos pasivos de la madre (IgG), que desaparecerán a
los 6 meses de vida por ello el diagnostico se basara en la
demostración de anticuerpos IgM específicos, o en
la persistencia o aumento de la IgG.
La muestra de sangre de
cordón (cordocentesis) o detección del RNA del
virus en biopsia de vellosidades coriales servirá para el
diagnostico.
Se puede lograr aislamiento del virus desde
secreción faríngea (frotis), sangre, orina y
líquido cefalorraquídeo, sin embargo, el método es
caro y engorroso. Se puede detectar la IgM específica que
al ser positivos indican infección reciente o
congénita en el recién nacido. La muestra de sangre
en el neonato puede ser obtenida de cordón y es sugerente
de infección intrauterina valores
mayores a 20 mg / dl. Las pruebas
serológicas para detectar IgG específica son
útiles con sueros pareados; con al menos 15 días de
diferencia (fase aguda y convaleciente). Un título cuatro
veces mayor del convaleciente sobre el de la fase aguda indica
infección congénita.
Se puede detectar la IgM específica que al ser
positivos indican infección congénita en el
recién nacido. La muestra de sangre en el recién
nacido puede ser obtenida de cordón y es sugerente de
infección intrauterina valores mayores a 20 mg /
dl.
MARCADORES VIRALES:
F.-TRATAMIENTO
Sólo sintomático en el caso de la
rubéola postnatal. Para la rubéola congénita
no hay tratamiento y sólo disponemos de medidas de
sostén.
G.-PRONÓSTICO
La rubéola postnatal es de buen
pronóstico, salvo en las que presentan complicación
neurológica o en pacientes inmunodeprimidos. En la
rubéola congénita, el pronóstico
dependerá de la intensidad del compromiso clínico
inicial y posteriormente de la calidad y grado
de las secuelas.
H.-PREVENCIÓN
En la población general, sólo se necesita
aislamiento del caso por siete días después de
iniciado el período exantemático. A los
recién nacidos y lactantes con rubéola
congénita se les considera contagiosos hasta un año
de edad o hasta obtener tres cultivos faríngeos y de orina
negativas después de los tres meses de edad. Frente a una
mujer embarazada que toma contacto con un paciente infectado, lo
primero que debe realizarse es la determinación de la
susceptibilidad de ella. Esto se realiza al determinar lo antes
posible la IgG que si es positiva indica infección
antigua, por el contrario, si la IgG es negativa indica
susceptibilidad frente a la enfermedad.
Si una embarazada susceptible se expone al caso debe
detectarse la seroconversión con IgG 4-8 semanas
después del contacto. Si es positiva y en ascenso, la
paciente se ha infectado y existe riesgo de infección
fetal.
Si una mujer embarazada presenta un exantema sugerente
debe medirse la IgM (se positiviza al 5° día post
exantema) específica y la seroconversión de IgG. De
ser positivas existe riesgo de infección fetal.
La vacuna que se utiliza en Chile confiere inmunidad en
98% de los casos por largo tiempo (10 –
20 años). No debe administrarse en mujeres con embarazos
menores a tres meses, aunque no se ha descrito rubéola
congénita en los casos accidentales en que se ha
colocado.
3.-CITOMEGALOVIRUS
A.-ETIOLOGÍA
El citomegalovirus (CMV) o virus de inclusión
citomegálica es un herpesvirus, con ADN. Es
parásito exclusivo del humano. Se conoce un solo serotipo,
pero varía en el ADN de cepa a cepa. La infección
celular produce un efecto
citopatológico caracterizado por inclusión
basófila rodeada por un halo claro en el interior del
núcleo celular lo que se ha denominado "ojo de lechuza o
búho" y se observa una inclusión
eosinofílica citoplasmática que generalmente se
ubica en la región paranuclear. Su material
genético es el ADN, el que incorpora al genoma de la célula
huésped, lo que determina la posibilidad de latencia del
virus. En nuestra población está ampliamente
difundido, encontrándose que en adultos la tasa de
anticuerpos contra CMV es de 97% en población de bajos
ingresos y de
85% en la de nivel socioeconómico medio.
B.-PATOGENIA
La infección es crónica y
sistémica. La puerta de entrada depende del mecanismo de
contagio. Se describen tres etapas:
1-. Aguda: Es la etapa inicial, productiva
y citolítica, en donde la replicación viral produce
muerte
celular. Afecta de preferencia al pulmón, hígado y
riñón siendo frecuentemente asintomático. En
pacientes inmunodeprimidos o con sistema inmune
inmaduro (feto o recién nacido) puede ser
sintomático. El virus se multiplica en los epitelios,
estimulando la fusión de
células
vecinas en células gigantes; aparecen inclusiones
basófilas que deforman el núcleo, ricas en ADN
viral (células en ojo de búho). Posteriormente se
produce la lisis celular, liberándose grandes cantidades
de CMV al exterior. En esta etapa, el virus se puede cultivar en
leucocitos, orina, saliva, secreción cervicouterina,
semen, lágrima, leche materna
y deposiciones. Esta excreción puede durar meses. En 2
ó 3 semanas se detecta en la sangre IgM e IgG
específicas que no tienen carácter protectivo contra reinfecciones ni
reactivación. La infección fetal, por inmadurez
inmunológica, es crónica persistente.
2-. Latente: En esta etapa el virus no se
replica y se observa el ADN en el interior de algunas
células como linfocitos T ayudadores y supresores. Los
cultivos virales en tejidos son
negativos. Es un período asintomático.
3. – Reactivación: En
períodos de inmunosupresión o por efecto hormonal
(embarazo, puerperio) se reactiva el virus que se replica con
excreción en secreciones y a veces se puede aislar en
sangre. Esta etapa puede ser sintomática o
asintomática.
C.-EPIDEMIOLOGÍA
Es un virus ampliamente difundido en todo el mundo,
entre el 30 y 100 % de los adultos son seropositivos. Es
máximo en países pobres y en grupos de bajo
nivel socioeconómico y mayor hacinamiento. Su
adquisición es precoz en estas condiciones, de manera que
en edad fértil un 70 a 80 % de las mujeres son
seropositivas. En Chile, el grupo de
mujeres en edad fértil seronegativas va desde un 5% en
nivel socioeconómico bajo a un 50% en niveles altos. Un
mismo paciente se puede infectar sucesivamente con varios
genotipos, por lo tanto, puede haber reinfección y
reactivación de ésta enfermedad.
Existen distintas vías de
transmisión:
1-. Vertical: Puede presentarse
infección intrauterina por vía transplacentaria, en
el momento del parto (connatal) por vía genital, ya que un
15 – 30 % de las mujeres embarazadas excretan CMV por orina
o por secreción cervicouterina. En el período de
recién nacido (neonatal) puede transmitirse el virus por
lactancia
materna.
Del total de mujeres seronegativas que se embarazan, un
3 – 5% adquieren la infección durante éste. En las
mujeres seropositivas a CMV, la infección se reactiva en
un 10% durante el embarazo. Si la mujer adquiere la
primoinfección durante el embarazo, el riesgo de infectar
al feto es de un 50%, lo que disminuye bastante (1-10%) si se
trata de una reinfección o reactivación viral y se
cree que la protección fetal, en estos casos,
estaría dada por la existencia previa de anticuerpos
maternos los que serían transmitidos al feto durante la
gestación. Un 10% de los recién nacidos infectados
presentan síntomas al nacer con una letalidad de 10- 20%.
De los neonatos infectados asintomáticos (90%), un 15% de
ellos presentan secuelas neurológicas tardías. En
el caso de ser infectados por reactivación del CMV durante
el embarazo, éstos nacen asintomáticos y
desarrollan secuelas en un 5-10% de los casos. Del total de
recién nacidos, un 0,5 -2 % excretan virus por orina desde
la primera semana de vida.
2-. Post natal: Dado por el contacto con
saliva, orina, transfusiones de sangre y hemoderivados, por
diálisis, circulación extracorporea, transplante de
órganos, leche humana y vía sexual dado por
la
contaminación de semen y secreción
cervicouterina.
D.-CUADRO CLÌNICO
El estado inmunitario y la edad del paciente determinan
la severidad del cuadro clínico y sus complicaciones.
Primo infección en el niño mayor o adulto: Solo un
5% de los casos son sintomáticos. Se presenta como un
síndrome de mononucleosis, pero se diferencia del
producido por el virus Ebstein- Barr por presentar un cuadro
febril más prolongado de 3 a 6 semanas, faringitis no
exudativa y un hemograma no característico. Tanto los
pacientes asintomáticos como los sintomáticos
pueden excretar el virus por secreciones corporales u orina por
meses siendo infectantes y diseminando la enfermedad ampliamente.
La presentación sintomática es más frecuente
y severa en los pacientes con inmunodepresión primaria o
secundaria, neoplasias, transplante de órganos,
desnutridos, operados con circulación extracorporea y
receptores de transfusiones masivas o frecuentes.
Infección intrauterina: Es la
infección viral fetal más frecuente (1-2% de los
recién nacidos vivos). Se produce una viremia materna que
infecta la placenta y al feto. Si la infección materna es
muy precoz durante el embarazo desencadenará un aborto o
un parto prematuro en un 20% de los casos. Si es más
tardía la infección puede llevar a un recién
nacido enfermo, lo que se presenta en el 5 – 10% de los neonatos
infectados. Mientras más precoz es la infección
durante el embarazo, el cuadro clínico será
más severo.
Este cuadro se caracteriza por RCIU con un niño
pequeño para la edad gestacional, hepatoesplenomegalia,
hepatitis,
ictericia de predominio directo, síndrome
purpúrico, anemia hemolítica, microcefalia,
calcificaciones cerebrales periventriculares, coriorretinitis. Un
10 % de los niños
infectados pueden ser asintomáticos en el período
neonatal y manifestar sólo las secuelas
neurológicas en forma tardía como retardo mental,
ceguera y sordera. Infección connatal y neonatal: La
infección del recien nacido se produce por contacto con
secreción vaginal en el momento del parto o después
de él, al alimentarse con leche materna contaminada o
tomar contacto con orina con CMV de otro neonato.
En estos casos el neonato puede infectarse y ser
asintomático (70%), presentar enfermedad caracterizada por
trombocitopenia, neumonítis intersticial o hepatitis pero
en general es más leve que el de la infección
intrauterina o presentar secuelas neurológicas
tardías. Puede existir primo infección por
hemoderivados en el prematuro lo que se presenta como un cuadro
grave séptico con compromiso respiratorio, hepatitis,
anemia y linfocitosis.
Complicaciones: Pueden presentarse en
todas las formas clínicas y en toda edad. La más
frecuente es la insuficiencia respiratoria aguda que puede llevar
a daño
pulmonar crónico, también pueden presentar
complicaciones neurológicas como mielitis,
polirradiculitis, hipoacusia progresiva o ceguera, alteraciones
del esmalte dental y complicaciones hematológicas como
púrpura trombopénico o anemia hemolítica.
Los recién nacidos que presentan hepatitis,
trombocitopenia y anemia hemolítica son los que
evolucionan con la mayor letalidad (10-20%). En los pacientes
sometidos a transplante esta infección puede llevar a
rechazo de éste.
E.-DIAGNÓSTICO
El diagnóstico se basa en la clínica, el
aislamiento del virus y en las pruebas serológicas que
orientan a su presencia. El diagnóstico virológico
se realiza por aislamiento del CMV en cultivo celular de orina,
saliva, secreción nasofaringea, leucocitos etc. Estas
pruebas son positivas en el paciente con primoinfección
tanto congénita como adquirida, en la reactivación
y no diferencia entre infección y enfermedad.
En la primoinfección adquirida, el
diagnóstico por serología se realiza por
detección de la IgM específica, la que se mantiene
positiva por 2 a 3 meses. La IgG específica vira de
negativa a positiva y ésta va aumentando sus
títulos en el tiempo, sin embargo esto no es diferente
para primoinfección o reactivación. Frente a un
caso confirmado de primoinfección durante el embarazo se
puede hacer diagnóstico antenatal de la infección
fetal tomando una muestra de líquido amniótico y
realizando aislamiento viral en cultivo celular con una
sensibilidad del 80%, sin embargo, el procedimiento no
está exento de riesgos por lo
que su utilidad está cuestionada.
Se puede realizar cordocentesis para determinar IgM
fetal específica para CMV y así hacer un
diagnóstico antenatal de la infección, pero este
procedimiento es invasivo y conlleva riesgos de pérdida
fetal y la sensibilidad del examen es muy variable (25-75%). Otro
examen que se puede realizar es la detección del ADN viral
en líquido amniótico o sangre fetal con
técnica de reacción en cadena de la polimerasa
(PCR), pero para la obtención de la muestra se necesita
métodos
invasivos con riesgo fetal.
Se puede realizar un diagnóstico precoz con
ecografías seriadas que demuestren retardo del crecimiento
intrauterino, microcefalia, ventriculomegalia, hidrocefalia,
calcificaciones cerebrales, oligoamnios, polihidroamnios, hidrops
fetal no inmune, ascitis fetal, derrame pleural o pericardico,
calcificaciones intrahepaticas o ileo pseudomeconial. En la
infección transplacentaria, el virus se replica en la
placenta y permanece en ella, de tal manera que una biopsia
placentaria después del alumbramiento, permitirá
confirmar el diagnóstico.
El CMV tiene un período de incubación de 3
– 12 semanas y por este motivo en el neonato con infección
congénita los cultivos en orina son positivos durante las
primeras dos semanas de vida y en sangre el CMV se puede aislar
por largo tiempo. Debe tomarse muestra de líquido
cefalorraquídeo para hacer aislamiento viral y
detección de ADN del virus por PCR. Se debe estudiar,
además, los cambios del líquido
cefalorraquídeo con relación al contenido de
proteínas y leucocitos. Todo esto nos
llevará al diagnóstico de severidad del compromiso
del SNC lo que estará en directa relación con el
pronóstico.
La técnica de cultivo viral tradicional demora 10
días, sin embargo, existe la técnica de shell vial
(centrifugación y tinción de cuerpos monoclonales)
con resultados en un día con sensibilidad y especificidad
cercana al 100%. La biopsia hepática o pulmonar positiva
para CMV es diagnostico de certeza de enfermedad, sin embargo, es
un método muy invasivo y en la práctica sólo
se realiza si debe hacerse alguna intervención
quirúrgica o en la autopsia. El
diagnóstico serológico se realiza por la medición de IgM específica en
sangre. En el recién nacido si es positiva en la primera
semana de vida es indicativa de infección
congénita, esta Ig se mantiene positiva por 3 a 6 meses.
La IgG se mantiene positiva durante toda la vida, pero no
confiere inmunidad. La comparación de los valores
seriados maternos y del neonato no asegura infección
congénita.
MARCADORES VIRALES:

F.-TRATAMIENTO
El medicamento que se utiliza es el ganciclovir que ha
resultado especialmente beneficioso en pacientes con
inmunosupresión e infección pulmonar. La
experiencia médica es limitada en recién nacidos y
se ha visto mejoría clínica en las manifestaciones
auditivas y oculares. Se ha observado una disminución de
la excreción del virus durante su administración. La dosis sugerida es 6 mg/k
cada 12 horas e.v. por 6 semanas. El ganciclovir tiene efectos
tóxicos en el recien nacido con neutropenia,
trombocitopenia y alteración de la función
renal y se desconoce su efecto a largo plazo, por lo que
sólo debe usarse en aquellos neonatos gravemente
enfermos.
G.-PRONÓSTICO
El pronóstico va a depender de la edad del
paciente y de su inmunocompetencia. En los pacientes infectados
intrauterinamente el pronóstico dependerá del grado
de compromiso neurológico. Constituyen la primera causa de
retardo mental de origen prenatal y puede asociarse a ceguera,
sordera, epilepsia y alteraciones neuromusculares que ensombrecen
el pronóstico. En los pacientes inmucomprometidos esta
infección puede ser fatal o producir secuelas pulmonares
invalidantes.
H.-PREVENCIÓN
En las unidades neonatales debe evitarse el uso de
transfusiones de hemoderivados de dadores
seropositivos.
En poblaciones donde la prevalencia de la
infección es alta debe preservarse la sangre en glicerol
que elimina las células infectadas y luego
desglicerolizarla o usar sangre sin leucocitos o congelarla
previamente con lo que se logra la lisis de los leucocitos
infectados e inactivación del virus. Estas son medidas de
alto costo. El
recién nacido infectado con CMV debe hospitalizarse con
técnicas de aislamiento universales, sólo
requiriendo un buen manejo de secreciones y lavado de manos para
evitar la diseminación de la infección.
4.-VIRUS HERPES
SIMPLEX
A.-ETIOLOGÍA
El virus del herpes simple fue el primer herpes Virus
humano reconocido. El nombre trepes deriva de una palabra griega
que significa serpentear. Las "calenturas" (herpes febril) fueron
descritas en la antigüedad y su etiología
vírica se demostró en 1919.
Los dos tipos de VHS, 1 y 2, comparten muchas
características, entre ellas homología del ADN,
determinantes antigénicos, tropismo celular y
síntomas de enfermedad. Sin embargo también se
pueden distinguir por diferencias en estas
propiedades.

B.-EPIDEMIOLOGÍA
Este virus tiene una amplia distribución mundial. El hombre es el
único huésped natural. La infección se
transmite por contacto directo con las secreciones contaminadas.
En el caso del virus simplex tipo 1, las secreciones orales son
las infectantes; en el caso del virus tipo 2 son las secreciones
genitales a través de contacto sexual.
En el caso del recién nacido, éste se
infecta con el virus tipo2 presente en las secreciones genitales
maternas y puede acceder al feto por vía transplacentaria
(5%) a lo que se le ha llamado infección congénita
o en el momento del parto vaginal (90-95%) por vía
ascendente con rotura de membranas o por el paso del niño
por el canal del parto a lo que se le llama infección
perinatal. Las mujeres embarazadas presentan un 20-30 % de
seropositividad para herpes 2 y un 0,5 a 4% de las embarazadas
presentan infección en el transcurso de la
gestación, y de éstas la mayoría son
reactivaciones y la mayoría son asintomáticas. Del
total de mujeres en trabajo de
parto, un 0,3 a 0,5 % excretan virus en la secreción
cervical en forma asintomática.
La incidencia de la infección neonatal es baja y
va de 1 en 3.000 a 1 en 30.000 nacidos vivos, lo que se debe a la
baja transmisibilidad global del virus a partir de una madre con
infección activa (10%) con un 35% en la
primoinfección y un 2- 3 % en la recurrencia. Se
consideran factores de riesgos para la infección
congénita el que la madre curse con primoinfección
genital durante el parto, la presencia de lesiones ulceradas o
rotura de membranas de más de 6 horas. La enfermedad puede
ser contagiada por un paciente con primoinfección
sintomática o asintomática. También los
pueden transmitir los pacientes portadores excretores
asintomáticos.
Los grupos socioeconómicos bajos tienen mayor
tasa de infección y a menor edad que los grupos de
más altos ingresos. En el caso del virus tipo 2, la edad
de mayor contagio es en la pubertad y
adulto joven y el grupo de mayor riesgo es el de prostitutas con
un 70% de anticuerpos positivos. Los factores de riesgo asociados
con el herpes 2 son la promiscuidad sexual, antecedentes de otras
infecciones venéreas, pareja con herpes genital y bajo
nivel socioeconómico.
La recurrencia de la enfermedad se presenta tanto en el
virus tipo 1 como en el 2. Existen algunos factores
desencadenantes de la recurrencia como la exposición
a luz ultravioleta,
fiebre, traumatismo local, menstruación, estrés,
etc.
C.-PATOGENIA
El virus herpes se introduce directamente en el
núcleo de la célula
huésped, multiplicándose y llevándola a la
lisis celular. Además, puede permanecer en forma latente
en el interior de la célula infectada. Al infectar los
epitelios, el organismo desarrolla una respuesta inmunitaria
local que se encarga de limitar la diseminación de la
infección. Una vez cursada la infección primaria,
el virus herpes simplex puede permanecer latente en el ganglio
sensitivo regional y frente a una baja inmunitaria del
huésped se produce reactivación viral con
propagación por continuidad de célula a
célula. Tanto en la primoinfección como en la
reactivación se produce una lesión
característica superficial que corresponde a una
vesícula con base inflamatoria. En esta vesícula se
observan células multinucleadas, edematosas con
inclusiones intranucleares características (Cowdry tipo A)
que son indistinguibles de las producidas por el virus
varicela-zoster.
D.-CUADRO CLÌNICO
La primoinfección tiene un período de
incubación de 2 – 12 días. Es
asintomática en la mayoría de los casos, sin
embargo, en el recién nacido suele ser siempre
sintomática. Puede presentarse como gingivoestomatitis
herpética fundamentalmente en los menores de 5
años, también como queratitis herpética,
panadizo herpético o comprometer cualquier zona de la
piel con las
características vesículas. La primoinfección
genital está dada mayoritariamente por el virus tipo 2
(85-90%) con un período de incubación de 2-7
días. En el hombre las lesiones vesiculares se presentan
en el glande y en la mujer se presentan lesiones vesiculares de
base eritematosa sensibles en vulva, periné,
glúteos, cuello uterino y vagina y se pueden
acompañar de leucorrea. Se puede observar fiebre, malestar
general y adenopatías inguinales. La primoinfección
genital es asintomática en el 50 % de los casos y la
recurrencia lo es en el 80 – 90 %. El virus está
presente en la secreción genital por 10 -14 días en
la primoinfección y por 5 – 7 días en la
recurrencia.
La infección del recién nacido se
caracteriza por tener variadas formas de presentación,
desde infección moderada localizada hasta formas
ampliamente diseminadas y fatales. Las formas más severas
se relacionan con primoinfección genital materna durante
el período de parto y las formas más leves con
recurrencia de la infección en la madre. La mayoría
de las madres infectadas son asintomáticas, lo que
dificulta el diagnóstico del niño y retarda su
tratamiento. Es más frecuente en prematuros que en
niños de términos. La infección
congénita (transplacentaria) se presenta en las primeras
48 h de vida. En estos niños se presenta la enfermedad
caracterizada por ictericia, hepatoesplenomegalia, trastornos de
la coagulación, bajo peso de nacimiento, microcefalia,
hidrocefalia, convulsiones, fiebre o hipotermia, coriorretinitis,
vesículas en la piel que es el signo que le da el sello a
la enfermedad y lesiones dérmicas cicatrizales. El
pronóstico es malo con alta mortalidad pese al
tratamiento. En el caso de una enfermedad localizada ésta
prácticamente no presenta mortalidad.
La infección perinatal se presenta entre los 7 y
20 días de vida con un cuadro clínico que puede ser
variable como una enfermedad diseminada similar a la
congénita ( 30 %), como encefalitis (35%) o como una
infección localizada en piel, ojos o faringe (35%), que en
general son de buen pronóstico. El compromiso ocular
localizado puede conducir a cataratas y corioretinitis. Estas
presentaciones se pueden superponer unas a otras en un mismo
paciente.
El curso de la primoinfección se puede complicar
con encefalitis, lo que es poco frecuente y de alta letalidad y
se puede presentar en cualquier etapa de la vida. En los
recién nacidos que presentan encefalitis la mortalidad
alcanza un 50 % y de los que sobreviven lo hacen con secuelas
neurológicas en el 100 % de los casos.
En pacientes inmunodeprimidos, la infección cobra
importancia, dado que puede ser diseminada, grave y con riesgo de
muerte.
E.-DIAGNÓSTICO
El diagnóstico se basa en la aparición de
las lesiones vesiculares características en piel y/o
mucosas. La certeza del diagnóstico se logra con
aislamiento viral en cultivos celulares o secreciones infectadas.
Se puede observar el efecto citopático que produce el
virus en muestras de piel o mucosa donde se encuentran las
vesículas lo que se evidencia en 1 a 3 días. La
inmunofluorescencia aplicada a los cultivos celulares es
más rápida y hace la diferenciación entre el
tipo 1 y el 2. La presencia de células multinucleadas son
indicativa de infección por virus herpes simplex o virus
varicela-zoster. Para poder
diferenciar entre primoinfección y recurrencia debe
realizarse medición seriada de títulos de
anticuerpos específicos para herpes 1 y 2, los que deben
pasar de negativos a positivos y aumentar en el tiempo para poder
hablar de primoinfección. En el recién nacido se
realiza el diagnóstico por aislamiento viral en muestras
de diversas secreciones corporales (faringe, ocular, conjuntival,
líquido vesicular), líquido cefalorraquídeo
y orina. También se puede usar la inmunofluorescencia
directa para visualizar el virus en lesiones dérmicas o de
mucosa. El diagnóstico serológico se realiza por
determinación de IgM e IgG específica, pero es de
escasa utilidad.
a) Diagnóstico directo: se basa en el
aislamiento del virus en cultivo celular, sin embargo, otros
métodos como la detección de antigeno vírico
en la propia muestra, la detección de antigeno en cultivos
(Shell vial), la observación de las partículas
víricas mediante microscopia, electrónica, y actualmente la
detección del ADN vírico mediante
amplificación por reacción en cadena de la
polimerasa (PCR), están siendo cada vez mas utilizados
debido a su rapidez, sencillez y elevada sensibilidad. Las
muestras mas adecuadas para aislar el virus a partir de lesiones
mucocutáneas son el liquido vesicular o en su defecto el
exudado de lesiones. El aislamiento del virus en cultivo celular
es sencillo y rentable, particularmente a partir de lesiones
mucocutáneas precoces y en las infecciones con
eliminación de numerosas partículas víricas.
Muchas líneas celulares son susceptibles a la
infección por VHS, apareciendo efecto citopático
típico en 24 ó 72 horas, dependiendo de la carga
vírica. La identificación y tipificación
vírica se realiza con anticuerpos monoclonados mediante
inmunofluorescencia. El aislamiento del virus en cultivo permite
realizar estudios de sensibilidad a antiviricos, así como
estudios epidemiológicos. El sell vial aporta mayor
rapidez diagnostica que el cultivo convencional, puesto que se
facilita la penetración vírica en las celulas por
centrifugación y no es necesario espesar a la
aparición del ECP para detectar su replicación. La
observación de celulas gigantes multinucleadas con
inclusiones intranucleares (celulas de Tzanck) tras
tinción Giemsa y/o papanicolau del material procedente del
raspado de las lesiones, es diagnostica, pero solo es sensible
860 por 100) en manos expertas. Sin embrago, la especificidad es
escasa, ya que no permite diferenciar entre VHS y VVZ.
Para el diagnostico de encefalitis por VHS, raramente
puede aislarse el virus a partir del LCR, debido a la escasa
cantidad en que se encuentra. Durante un tiempo se realizaba
inmunofluorescencia directa a partir de biopsias cerebrales, pero
actualmente la detección de genoma de VHS mediante
amplificación (PCR) en el LCR es el método
más sensible.
b) Diagnóstico indirecto: los
métodos serológicos pueden ser útiles para
el diagnostico de las infecciones primarias por VHS, ya sea por
demostración de seroconversion o por detección de
anticuerpos de clase IgM en individuos sin anticuerpos
preexistentes, pero sobre todo para estudios
epidemiológicos de prevalencia. Sin embrago, no es
útil para diagnosticas infecciones recurrentes, puesto que
no suelen ir asociadas a cambios en el titulo de anticuerpos ni a
la producción de IgM. Su valor es
escaso por lo tanto para controlar la aparición de
reactivaciones en mujeres gestantes y en inmunocomprometidos.
Tiene utilidad en el diagnostico de las infecciones del SNC, la
demostración de un incremento del titulo de anticuerpos
del LCR con respecto al sérico, ya que indica la
producción intratecal de los mismos. Se han desarrollado
muchos métodos para detectar anticuerpos, como la
fijación del complemento, inmunofluorescencia,
enzimoinmunoanalisis (EIA) y neutralización. Ninguno de
ellos es capaz de discriminar entre anticuerpos dirigidos frente
a VHS-1/ 2.
Recientemente se han desarrollado métodos de EIA
que detectan anticuerpos específicos para cada unos de los
tipos de virus
basados en la detección de anticuerpos tipo
específicos frente a la glucoproteinas G.
MARCADORES VIRALES:
F.-TRATAMIENTO
El tratamiento específico es con aciclovir que se
reserva para las infecciones herpéticas graves como la
infección neonatal, encefalitis y en inmunocomprometidos.
No debe ser utilizado en las infecciones localizadas que no
revisten gravedad, pues debe evitarse al máximo la
posibilidad de que el virus se haga resistente a él. La
dosis recomendada es 30 mg/k/día fraccionada cada 8 horas
por vía EV por 14 a 21 días. Con este tratamiento
se ha observado la disminución de la mortalidad de las
formas más severas y la diseminación de las formas
localizadas. En el compromiso ocular neonatal, además,
debe agregarse iododeoxiuridina al 1% o vidarabina al 3%. Esto
debe extenderse a los recién nacidos con lesiones locales
de piel o faringe y los pacientes con encefalitis aún, sin
compromiso clínico ocular. En los neonatos expuestos al
virus, asintomáticos, se recomienda hacer cultivo viral
entre las 24 a 48 horas de nacido, observación
clínica directa y profilaxis con aciclovir.
G.-PROFILAXIS
La prevención consiste en evitar el contacto
directo con las lesiones herpéticas y las secreciones
infectadas, por lo tanto, los pacientes con lesiones extensas
deben estar aislados. En el caso de detectar una paciente con
infección genital por herpes 2 con lesiones vesiculares en
el período de trabajo de parto debe realizarse
cesárea.
Así, también, en aquellas que tengan
excreción del virus por secreción vaginal,
aún siendo asintomáticas. Si han pasado más
de 4 horas de membranas rotas, no se asegura que la
cesárea evite la infección del neonato. El
recién nacido infectado debe aislarse durante toda su
enfermedad y así, también, el sospechoso de
infección. No está indicada la separación
del niño de su madre. El personal de
salud con
lesiones en mucosa bucal tiene bajo riesgo de transmisión
a los pacientes y basta con cubrirlas (mascarilla) y evitar el
contacto directo.
REFERENCIAS BIBLIOGRÁFICAS
- GARCIA y RODRIGUEZ (1996). Microbiología Médica. Edit.
Mosby/Doyma Libros.
Madrid–España. - CORTÉS, A. Estudio prospectivo
seroepidemiológico de infección por el virus
linfotrópico humano I y II (HTLV-I/II) en donantes de
sangre de áreas colombianas endémicas y no
endémicas. Colombia Med
1999; 30: 19-25. - MURRAY, P (2000). Microbiologia Médica. 2da
Edición. Edit. Harcourt
Brace. - LLAVACA, J (2001). Síndrome de TORCH. Revista de
Chile. Cap. 21 - COPPENS, J (2001). Parasite–host cell
interactions in toxoplasmosis: new avenues for intervention?
.Expert reviews in molecular medicine. . - ORDOÑEZ y Otros (2002). Construcción y expresión de una
proteína recombinarte de la envoltura del virus
linfotrópico humano tipo I (HTLV – I). Revista Colombia
Médica Vol. 33 Nº 2. - Virus Linfotrópico humano de células t
tipo 1 (HTLV-1): una infección endémica en el
Perú. Rev Perú Med Exp Salud
Publica 21(4), 2004.
ZERVOU y Otros (2005). Markers of
hepatitis viruses and human T-lymphotropic virus types I/II in
patients who have undergone open-heart surgery: evidence of
increased risk for exposure to HBV and HEV. PMID: 16198902
[PubMed]. http://www.ncbi.nlm.nih.gov/entrez/query.- Retrovirus. http://www.enciclopedia.com/es/l/le/lentivirus.php.
Acceso: Octubre 2006 - Leucemia / Linfoma T del Adulto (HTLV-I
positivo). http://www.msal.gov.ar/htm/site/pngcam/normas.Acceso:
Octubre 2006 - MALONEY, E y Otros. (2006). Historia Natural of Viral
Markers in Children Infected with Human T Lymphotropic Virus
Type I in Jamaica. The Journal of Infectious Diseases,
volume 194 pages 552–560 DOI: 10.1086/506365. - MURRAY, P (2000). Microbiologia Médica. Volm
II. 2da Edición. Edit. Harcourt Brace. - HARRISON’S. Principles of Internal Medicine.
Volm I. International Edition. Mc. Graw Hill.
ANEXOS

Colombia
Médica Vol. 33 Nº 2, 2002
CONSTRUCCIÓN Y
EXPRESIÓN DE UNA PROTEÍNA RECOMBINARTE DE LA
ENVOLTURA DEL VIRUS LINFOTRÓPICO HUMANO TIPO I
(HTLV-I)
Paula Ordóñez,
Quim.1, Flavio Cerón2, Felipe García-Vallejo,
Ph.D.3
El virus linfotrópico humano tipo I de las
células T (HTLV-I) es un oncorretrovirus asociado con la
leucemia de células T adultas (ATL) y la Paraparesia
Espástica Tropical (PET). El gen env del virus codifica la
glicoproteína precursora gp62, que mediante procesamiento
produce la gp21 (transmembranal) y la gp46 (superficie). Se ha
demostradola alta inmunorreactividad de la gp46 en sueros de
individuos infectados. Con el propósito de obtener una
proteína recombinante útil en diagnóstico y
en una potencial vacuna, se clonó en el vector de
expresión de Baculovirus "bácmido" pBlueBac4.5His
el segmento de 144bp obtenido mediante reacción en cadena
de la polimerasa (PCR) con cebadores que amplifican la
región 5622-5765 nt. El construido pBlueBacRENV fue
transfectado en células del insecto Mamestrae brassicae
(clon MB 8003) recuperándose la proteína
recombinante. La proteína RENV reaccionó
específicamente con suero de personas infectadas con
HTLV-I. Los resultados obtenidos mostraron que la
proteína RENV puede ser utilizada para el
diagnóstico serológico de la infección por
HTLV-I y en la evaluación
de nuevas vacunas.

Revista Peruana de
Medicina
Experimental y Salud Pública
Virus linfotrópico humano de
células T tipo 1 (HTLV-1): Una infección
endémica en el Perú
Eduardo Gotuzzo H 1,2; Kristien Verdonck B
1,3; Elsa González L 1; Miguel
Cabada S 1. Rev. Perú. med.
exp. Salud
publica v.21 n.4 Lima oct./dic. 2004
RESUMEN
El artículo tiene como objetivo
presentar una revisión de aspectos clínicos de la
infección por el virus linfotrópico humano de
células T tipo 1 (HTLV-1), poniendo énfasis en
información relevante para los
médicos en el Perú. Luego de presentar algunos
aspectos virológicos y epidemiológicos, tratamos
los temas de la transmisión y de las enfermedades asociadas con
el virus. Se discute específicamente las siguientes
enfermedades asociadas: leucemia linfoma de células T del
adulto, paraparesia espástica tropical, estrongiloidiasis,
sarna, tuberculosis,
dermatitis
infectiva y coinfección con VIH. En conclusión,
HTLV-1 es una infección endémica en el Perú.
El espectro de enfermedades asociadas comprende síndromes
inflamatorios, enfermedades linfoproliferativas e infecciones
oportunistas.

Historia Natural of Viral |
Elizabeth Margaret Maloney, Yoshihisa Yamano, |
The Journal of Infectious |
© 2006, the Infectious Diseases Society of |
Purpose. We Conclusiones: The provirus loads in |

Markers of hepatitis viruses and human T-lymphotropic
virus types I/II in patients who have undergone open-heart
surgery: evidence of increased risk for exposure to HBV and
HEV.
Zervou EK,
Georgiadou SP,
Liapi GK,
Karabini F,
Giogiakas V,
Zisiadis K,
Gatselis NK,
Goudevenos I,
Dalekos GN.
Blood Bank at the University Hospital of Ioannina, Ioannina,
Greece.
BACKGROUND: Open-heart procedure is characterized by a high-risk
for contracting blood-borne infections. We evaluated the
prevalence of several markers of hepatitis viruses (B-E) and
human T-cell lymphotropic virus types I/II (HTLV-I/II) in a
consecutive series of patients who had undergone open-heart
surgery. METHODS: 204 patients and 158 selected age- and
sex-matched healthy volunteers were investigated. Samples were
collected at least 6-12 months postoperatively. Commercial enzyme
immunoassays and confirmatory immunoblot assays for HCV, HEV and
HTLV-I/II were used. RESULTS: None of the subjects tested
positive for antibodies to HTLV-I/II. Prevalence of markers of
past HBV infection and antibodies to HEV (anti-HEV) were higher
in patients than in healthy controls (anti-HBc: 45.1% vs. 31%,
p=0.009; anti-HBs: 31.9% vs. 22.2%, p=0.02; anti-HBe: 32.4% vs.
10.1%, p=0.000; anti-HEV: 5.4% vs. 0%, p=0.008). HBsAg and
antibodies to HCV did not differ between the groups.
CONCLUSIONS: HTLV, HBsAg and HCV infection
markers did not differ between patients and healthy controls.
However, patients had significantly increased prevalence of
markers of previous HBV infection suggesting that an intensive
vaccination schedule against HBV preoperatively might be helpful
in minimizing the risk. The increased prevalence of anti-HEV in
cardiac patients requires further investigation. Prospective
studies are needed in order to definitely address whether the
high prevalence of exposure to HBV and HEV infections in patients
who had undergone open-heart surgery is procedure-related or not
and whether it has any impact on morbidity of these patients.
PMID: 16198902 [PubMed].
Delayed maturation of immunoglobulin G
avidity: implication for the diagnosis of toxoplasmosis in
pregnant women.
Eur J Clin Microbiol Infect Dis. 2006 Sep
26; [Epub ahead of print] Links
Lefevre-Pettazzoni M,
Le Cam S,
Wallon M,
Peyron F.
Departement de Parasitologie, Hopital de la Croix
Rousse, 69317, Lyon Cedex 04, France.
The low avidity of immunoglobulin G has been reported to
be a useful marker of recent infection with Toxoplasma. Several
investigators, however, have published discrepant result on the
maturation of avidity over time. The aim of this study was to
analyse persistent low avidity of immunoglobulin G in
immunocompetent individuals and in pregnant women and how it
could interfere in the flowchart of antenatal diagnosis of
toxoplasmosis in the latter group.
An international literature search was conducted
together with a retrospective study of a hospital database.
Eleven publications that met the inclusion criteria reported
delayed maturation of avidity at a frequency ranging from 0 to
66.6% of the patients. Examination of those publications
demonstrated an important heterogeneity in the type of assay
used, the calculation of avidity, the cutoff above which avidity
was considered to be elevated, and the delay since infection
after which indices are expected to be high. In the hospital
database, persistent low avidity was found even after a median
follow-up period of 6 years. Different factors could interfere
with maturation of avidity, such as variations between
individuals, the assay system used, and, possibly, the treatment
administered. The results of this study clearly demonstrate that,
in a pregnant woman, an acute infection cannot be reliably
diagnosed solely on the basis of low avidity of immunoglobulin G.
Further investigations and standardization of assays are urgently
needed. Estimation of the time of infection remains difficult,
especially in cases in which the samples are drawn late in
pregnancy; the final estimate must be based on several tests
repeated at intervals of weeks.
![]()
Human Immunology
Volume
64, Issue 4 , April 2003, Original
contribution
Influence of cytokine and mannose
binding protein gene polymorphisms on human t-cell leukemia virus
type I (HTLV-i) provirus load in
HTLV-I asymptomatic
carriers
Masataka Nishimura, Michiyuki Maeda, Jun-ichiro
Yasunaga , Hideshi Kawakami, Ryuji Kaji, Akio Adachi
, Takashi Uchiyama and Masao Matsuoka
Received 23 July 2002; revised 18 December 2002;
accepted 18 December 2002. ; Available online 1 February
2003.
Abstract:
Human T-cell leukemia virus type I
(HTLV-I) provirus load differs more
than 100-fold among carriers and a high provirus load in the
peripheral blood mononuclear cells (PBMCs) is regarded as a risk
factor for both preleukemic states and inflammatory diseases
including HTLV-I-associated myelopathy
(HAM). We examined polymorphisms in the genes for tumor necrosis
factor (TNF), TNF receptor type 1 and 2, lymphotoxin
(LT)-α, interleukin (IL)-1β, IL-6, IL-10,
monocyte chemoattractant protein (MCP)-1, and mannose binding
protein (ManBP) in 143 HTLV-I carriers
whether these polymorphisms affect the provirus load in the PBMCs
of carriers. No significant association was observed between
these polymorphisms and the provirus load.
Homozygotes for a ManBP-variant allele, however,
showed a tendency for the decreased number of provirus load. When
combined, the data on the alleles of LT-α and MCP-1,
HTLV-I carriers having high producer alleles
of both genes showed a trend for increased provirus load. These
data suggest that inflammation or an active immune response may
induce an increased amount of
HTLV-I–infected T cells, leading to a
high provirus load.
Association between interleukin-6 gene
polymorphism and human T-Cell leukemia virus type I associated
myelopathy
Abstract:
We studied cytokine gene polymorphisms in the promoter
region, including interleukin (IL)-6, IL-1β,
and IL-10, in Japanese patients with human T-cell leukemia virus
type I (HTLV-I) associated myelopathy (HAM)
(n = 65), asymptomatic HTLV-I
carriers (n = 143), and HTLV-I
seronegative, normal controls (n = 160). There was a
significant difference between HAM patients and
HTLV-I carriers in the distribution of IL-6
promoter polymorphism at position -634
(χ2 = 9.90,
p = 0.0071). The IL-6 genotype was also significantly
different between HAM patients and normal controls
(χ2 =
11.53, p = 0.0033), while a similar distribution was
observed in IL-1β and IL-10
polymorphisms among HAM patients, carriers, and normal controls.
The results suggest that IL-6 gene region may contribute to
susceptibility to HAM, and that aberrant cytokine productions
could be involved in the development of HAM.
Autora:
Lic. Cecilia Reyes Alfaro
TRUJILLO – PERÚ
2006
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |