CLONACIÓN
ANIMAL
En la naturaleza,
hay dos formas de reproducción celular: sexual y asexual. En
la reproducción sexual, propia de los organismos
pluricelulares, ambas células
germinativas, la femenina u oocito y la masculina o
espermatozoide, se fusionan para formar una nueva célula,
llamada cigoto. Esta nueva célula no sólo comienza
a diferenciarse, sino también se multiplica, mediante el
mecanismo de reproducción asexual llamado mitosis. Un
individuo
adulto será el resultado de las sucesivas divisiones
mitóticas experimentadas por el cigoto.
La reproducción de tipo sexual confiere una
ventaja competitiva a los organismos que la poseen, pues al
ocurrir un proceso de
recombinación génica de carácter aleatorio, aumenta la probabilidad de
la descendencia para sobrevivir en ambientes de variabilidad
imprevisible (Wilmut I. 1997)23.
Los organismos pluricelulares son pues, clones ordenados
de células con un mismo genoma, pero especializadas hacia
funciones
distintas. Esto indica que cuando se forma el cigoto, su
repertorio de actividades, aunque limitado, es suficiente para
dar origen a organismos con una elevada complejidad
estructural.
El grado de complejidad dependerá de lo que se
conoce como proceso de diferenciación. Se entiende por
diferenciación, el resultado de la expresión o de
la inhibición de determinados grupos de
proteínas, con la consecuente
formación de tejidos. Los
tejidos son grupos de células somáticas
especializadas, que debido al proceso de diferenciación
experimentado, están inhabilitadas para dar origen a
nuevos individuos (Wilmut I.1999)27.
Es claro que el asunto de fondo en la
clonación tiene sus raíces en las primeras
etapas del proceso evolutivo, cuando los microorganismos
existentes comenzaron a producir, mediante mitosis, copias
exactas de sí mismos. Así, una célula
somática (no sexual), se podía replicar a sí
misma, de modo que el material genético de las
células hijas resultaba idéntico al de la célula
progenitora. En ese orden de ideas, se podría considerar
que la mitosis es un tipo de clonación "natural" que no necesita
manipulación alguna.
CLONACIÓN ARTIFICIAL
En contraste con la llamada clonación natural,
las técnicas
seguidas para la clonación celular artificial, requieren
un proceso de elaboración o de manipulación que
permite obtener copias idénticas o casi idénticas
de las células
madre o progenitoras utilizadas. Si el producto o
embrión se transfiere a un útero, se produce la
implantación en el endometrio y se desarrolla un nuevo ser
(clonación reproductiva). Pero si se transfiere a un medio
de cultivo, el embrión dará origen a células
madre embrionarias con la potencialidad para diferenciarse hacia
cualquier tipo de célula adulta (clonación
terapéutica).
MÉTODOS DE CLONACIÓN
1. Partición. En esta
técnica se utilizan embriones octocelulares, en estado de
preimplantación. A partir del embrión seleccionado,
se toman mitades o secciones que posteriormente se introducen
dentro de zonas pelúcidas naturales o
artificiales.
A continuación, se efectúa la
implantación del producto en el endometrio. El
número máximo de células del embrión,
no puede ser superior a 8, porque a partir de este momento, se
inicia la expresión del genoma embrionario. Los individuos
obtenidos son prácticamente idénticos entre
sí, aunque diferentes a los progenitores, por lo cual se
considera que son el equivalente de los gemelos
monocigóticos (Wilmut I.1999)27. Esta
técnica se ha seguido ampliamente para la clonación
de animales de
granja11. Como ejemplos de esta técnica
están las ovejas Megan y Morag, del Roslin Institute
(Wilmut I 2000)6.
2. Clonación por transferencia nuclear de
células somáticas (SCNT: Somatic Cell Nuclear
Transfer). Los requisitos mínimos para la SCNT incluyen el
uso de dos tipos de células: somáticas o no
sexuales, y sexuales femeninas, u oocitos. Los núcleos de
células somáticas de individuos postnatales se
transfieren dentro de oocitos o de cigotos enucleados (Sims M
1994, Meng L 1997)25, 26. Esta técnica tiene la
ventaja que permite conservar el genoma durante la
diferenciación celular y la capacidad del citoplasma
celular para reprogramar la actividad génica y aumentar la
redireccionalidad de la diferenciación celular. Sin la
aplicación de estos dos principios, la
clonación no es posible (Gurdon JB,
2003)27.
Para clonar a un ser vivo mediante SCNT, se extrae el
material genético de ambos tipos de células y, a
continuación, se inyecta el núcleo de la
célula somática que se desea clonar (donante),
dentro del oocito previamente enucleado (receptor). El
transplante de núcleos somáticos dentro de oocitos
enucleados tiene como fin reproducir los procesos
bioquímicos y fisiológicos que, de manera natural,
se desencadenan durante la fertilización.
Vale entonces, en este orden de ideas, establecer una
comparación entre la fertilización y la
clonación.
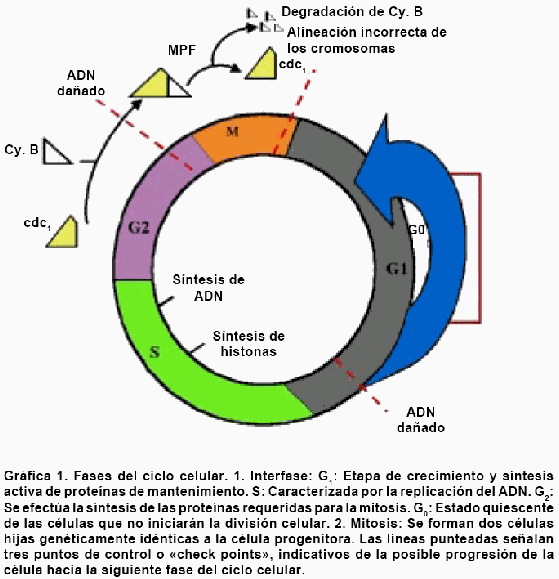
Durante la fertilización, el primer evento que
ocurre es la sincronización de los pronúcleos
masculino y femenino. Cuando el espermatozoide atraviesa la
membrana plasmática del oocito, su núcleo se
encuentra en la etapa G0 del ciclo celular, mientras
que el núcleo del oocito está detenido en la
metafase de la segunda meiosis. Los
oocitos recientemente ovulados presentan una elevada
concentración de Factor Promotor de la Maduración
(siglas en inglés
MPF), una proteincinasa que induce la ruptura de la membrana
nuclear y la condensación de los cromosomas,
motivo por el cual pueden hacer su ingreso al núcleo
ciertos factores citoplasmáticos que son necesarios para
la replicación del ADN (Wilmut I.
2003)28. Los dos pronúcleos se llevan entonces
a la etapa S del ciclo, caracterizada por una síntesis
activa de ADN. La reanudación de la segunda meiosis ocurre
como consecuencia del aumento cíclico de [Ca2+]
intracelular, que provoca a su vez la inhibición de las
dos subunidades constitutivas del MPF -ciclina B y
cdc1- con el descenso consecuente en la actividad del
MPF(Wakayama T , 1998, Vallejo J, 2003) 29,
30.
Cuando, en la clonación, se introduce el
núcleo de la célula somática donante en la
célula receptora u oocito, se efectúa un proceso
similar de sincronización o reprogramación del
ciclo celular, con la finalidad de que ocurra un acoplamiento
fisiológico entre el núcleo y el citoplasma. La
reprogramación del ciclo celular, o lo que es lo mismo, la
reprogramación nuclear, son términos que describen
los cambios en la actividad génica inducida
experimentalmente por el transplante de un núcleo dentro
de un medio citoplasmático diferente.
La reprogramación es un requisito indispensable
para el éxito
del procedimiento,
pues permite que la expresión génica de la
célula somática sea la apropiada para un desarrollo
embrionario normal (Campbell KHS 1996, Hwang WS, 2004)31,
32. Esta reprogramación se efectúa en el
tiempo
transcurrido entre la fusión
núcleo-citoplasma y la activación del producto
resultante (Hwang WS, 2004)32.
Si se transplantan núcleos de células
somáticas, parcial o totalmente diferenciadas, dentro de
oocitos enucleados de anfibios o de mamíferos en metafase de la segunda
meiosis, se podrán obtener blastocistos, a partir de los
cuales se formará un amplio rango de tejidos y de tipos
celulares(Gurdon JB, 2002 ) 33.
El proceso de sincronización o
reprogramación se efectúa mediante el
estímulo de la entrada de Ca2+ al oocito, ya
sea con un impulso eléctrico suave o con la
utilización de ionomicina (Campbell KHS, 1996., Gurdon JB,
2002) 31,33 o puromicina (Hwang WS,
2004)32.
El núcleo de la célula somática
donante no debe haber iniciado o completado la replicación
del ADN, para que el cigoto pueda tener una ploidía o
complemento cromosómico normal. Si se activa el oocito, y
se le permite entrar a su primer ciclo celular, la actividad del
MPF caerá y no ocurrirá la ruptura de la membrana
nuclear después de la transferencia del núcleo de
la célula donante. Así las cosas, el núcleo
determina si habrá o no replicación del ADN, de
modo que pueda esperarse una ploidía normal -necesaria
para un normal desarrollo- en todos los estados del ciclo celular
de la célula donante (Wilmut I. 2003) 28. Se
considera entonces que el oocito es un receptor universal, pues
no sólo provee un medio apropiado para el núcleo de
la célula donante en cualquier estado del ciclo sino que,
independientemente de éste, tiene la capacidad para actuar
sobre la estructura y
la función
de la cromatina del núcleo somático, de modo que lo
lleva de nuevo a un estado de totipotencialidad (Wilmut I. 2003,
Betts DH, 2001)28, 34.
Al aplicar la técnica de la transferencia
nuclear, no sólo se debe procurar mantener una
ploidía normal en el producto formado, sino también
evitar la destrucción de la cromatina. Por este motivo se
han hecho investigaciones
sobre la evaluación
de la técnica, cuando se utilizan células donantes
en diversas etapas del ciclo celular (G1, S,
G2, M), y como células receptoras, oocitos en
metafase de la segunda meiosis. (Campbell KHS. 1996, Wakayama T,
1999, . Kasinathan P, 2001)29, 31, 35 Como
células somáticas donantes, al principio se
utilizaron las células quiescentes en fase G0,
que habían abandonado el ciclo celular en fase
G1 y, que, por tanto, tenían un complemento
cromosómico diploide. Como ejemplo de células en
fase G0 se encuentran células del
cúmulus, células de Sertoli y neuronas, aunque
también se pueden obtener artificialmente en un medio de
cultivo, mediante la deprivación de factores de
crecimiento (Kühholzer B,2000)36. Aunque estas
células son menos activas en la transcripción y,
además contienen poblaciones distintas de ARN mensajero
(ARNm) que las que se hallan en fase G1, se
prefirieron, pues sus mismas características, de alguna
manera facilitan la acción
de los factores citoplasmáticos del oocito necesarios para
modificar la expresión génica del embrión,
y, por tanto, la reprogramación nuclear(Wilmut I. 2003,
Campbell KHS 1996) 28,31. También se han
utilizado células somáticas donantes en fases
G1 (Kasinathan 2001, Piotrowska, 2000)
35,37, G238 (Ono Y, 2001)Lai y
M39 (L, Macháty Z, 2001) ().
Se ha obtenido una notable eficiencia en el
desarrollo de los embriones así clonados hasta el estado de
blastocisto, cuando el núcleo inyectado se encuentra en
fase M (Wakayama T 1998, Li X, Li Z, 2003) 29,40. En
cualquier caso, una clonación exitosa requiere reprogramar
el núcleo de la célula somática donante,
debido a que la cromatina ha sufrido previamente transformaciones
epigenéticas incompatibles con el desarrollo
embrionario, que incluyen la desacetilación de las
histonas y la metilación del ADN41,
42.
Recientemente, Hwang et al. 2004 32
obtuvieron células madre embrionarias a partir de
blastocistos humanos. El éxito de su procedimiento
radicó en que el tiempo destinado a la
reprogramación celular fue de unas pocas horas, en
contraste con la metodología utilizada en experimentos con
otras especies de mamíferos (Kühholzer B
2001)43. Sin embargo, no siempre la
reprogramación nuclear ocurre de modo
satisfactorio.
Así hay informes de
hallazgos de embriones clonados a partir de células
somáticas donantes, que fracasan en la reactivación
de genes claves para el desarrollo embrionario normal ( Bortvin A
2003 )44. En estos embriones se pueden expresar
precozmente genes específicos de las células
donantes (Gao S 2003) 45, y, adicionalmente, presentar
patrones aberrantes de metilación del ADN en el
trofoectodermo (Rhind S 2003, Dean W 2001) 46, 47,
así como mosaicismo (Rhind S
2003)46.
Por otra parte, las células somáticas, a
lo largo de las sucesivas divisiones mitóticas sufridas in
vivo, han perdido parte de los extremos de los cromosomas,
denominados telómeros. Los telómeros son
repeticiones cortas en conjunto (tándem) de ADN, que se
replican mediante la acción de la enzima telomerasa. Se ha
encontrado que variables como
la longitud de los telómeros y la actividad de la
telomerasa están significativamente disminuidas en las
células somáticas donantes, cuando se comparan con
las células madre embrionarias como fuente donante de
núcleos. Debido a que los telómeros
desempeñan un papel estabilizador del ADN, su acortamiento
progresivo puede incidir, tanto en los procesos de envejecimiento
celular, como en la aparición de anormalidades
cromosómicas, espermatogénesis defectuosa,
apoptosis aumentada y proliferación celular disminuida en
médula ósea, bazo y testículo,
en animales clonados a partir de células somáticas
donantes(Betts DH , 2001) 48.
Es claro entonces que el estado de diferenciación
de la célula donante afecta directamente la eficiencia de
la clonación, y en tal sentido se considera que las
células madre embrionarias ofrecen ventajas cualitativas
sobre las células somáticas como posibles donantes
en la técnica de transferencia nuclear.
A pesar de los éxitos sucesivos obtenidos en la
clonación de células adultas, la SCNT dista mucho
aún de ser considerada una técnica eficaz. En
primer lugar, muchos embriones clonados mueren inmediatamente
después de la implantación, o bien, a lo largo del
desarrollo prenatal49-50. También se ha
observado, que si bien algunos individuos sobreviven hasta el
término de la gestación, mueren prontamente debido
a un amplio rango de diversas entidades51. Si logran
sobrevivir, presentan una talla corporal y un tamaño de la
placenta mayores que lo normal49,52-53,
obesidad46, así como defectos en
riñones, corazón,
hígado, pulmones y cerebro55.
Hasta hace poco tiempo se desconocía cuál
era la razón biológica y cuáles los problemas
técnicos causantes de tales fracasos. En el caso de
primates no humanos, como los monos Rhesus macacus, los intentos
de clonación han fallado, debido a que, durante la
enucleación de los oocitos no fertilizados -previa a la
transferencia nuclear- se removían ciertas
proteínas necesarias para la
organización normal del huso mitótico, como las
proteínas motoras de los microtúbulos y del
centrosoma51,56.
La dificultad fue en apariencia resuelta por Hwang y su
equipo de colaboradores32, quienes recientemente
obtuvieron blastocistos humanos. Ellos extrajeron el complejo
ADN-huso mitótico inmediatamente después de la
aparición del primer cuerpo polar, a través de un
orificio en la zona pelúcida, en lugar de aspirarlo con
una pipeta de vidrio, tal como
es descrito por otros autores 8.
En especies de mamíferos como perros, conejos,
cerdos, caballos, gatos y seres humanos, el éxito de la
clonación ha sido altamente dependiente de la
disponibilidad de tecnologías especie-específicas,
que incluyen el cultivo, la activación, la
micromanipulación y la transferencia de huevos y embriones
a receptores32,57-58. Es así como en la
aplicación de la SCNT en cerdos, si se efectúan
simultáneamente los procesos de fusión
núcleo-citoplasma y activación del producto, se
obtienen resultados satisfactorios.
En contraste, cuando se utiliza el mismo proceso en
bovinos y en seres humanos, los porcentajes de fusión y de
clivaje o segmentación son muy bajos y no se forman
blastocistos. Por tanto en estas especies, parece ser necesario
un mayor tiempo de reprogramación entre fusión y
activación con el fin de obtener un número
significativo de blastocistos. Por otro lado, el tipo de sustrato
energético añadido al medio de cultivo (fructosa en
lugar de glucosa)
también parece ser un factor determinante para la
formación de blastocistos en bovinos y en seres
humanos32,58.
3. Paraclonación. Consiste en
inyectar núcleos de células madre embrionarias en
cultivo, dentro de oocitos enucleados y, a veces, de cigotos
nucleados. Los blastómeros se obtienen a partir de varias
fuentes como
la masa celular interna o el trofoectodermo de embriones
preimplantados y sus núcleos son transferidos dentro de
oocitos enucleados6. Los individuos obtenidos son casi
idénticos entre sí, aunque diferentes a los padres
del embrión que aportó el núcleo
transferido59. Se ha demostrado que la supervivencia
de los clones formados a partir de células madre
embrionarias en el instante del nacimiento o hasta la edad
adulta, es 10 a 20 veces mayor que en los derivados de
células somáticas40,60,61,62.
Por otra parte, los clones derivados de células
madre embrionarias tienen mejores posibilidades de reactivar
completamente genes claves para el desarrollo embrionario -tales
como oct4 y 10oct4- y así constituir una población de células verdaderamente
totipotenciales32,40,44. Sin embargo, las
células madre embrionarias, aunque requieren un menor
grado de reprogramación que las células
somáticas, presentan una elevada inestabilidad
epigenética en cultivos in vitro. La inestabilidad se
refleja en una expresión aberrante de la huella genética,
de modo que, cuando estas células se utili-zan como
donantes para la clonación reproductiva, el fenotipo fetal
y placentario de los clones, exhibe graves patrones de
anormalidad. Sin embargo, cuando se emplean como fuente de
núcleos para la clonación terapéutica, en
apariencia no ocurre este error, pues, durante la
reprogramación, se seleccionan tan sólo las
células competentes41,61,52.
APLICACIONES DE LA CLONACIÓN MEDIANTE LA
TÉCNICA DE TRANSFERENCIA NUCLEAR
El estado del arte en la
clonación ha permitido su empleo en dos
direcciones claramente definidas: La clonación con fines
reproductivos y la clonación con fines
terapéuticos. La primera apunta a duplicar seres vivos
completos, mientras que la segunda promete convertirse en una
alternativa para prevenir y tratar ciertas enfermedades, así
como para el reemplazo de tejidos y órganos lesionados
(Gráfica
2).

Clonación terapéutica. Las
células madre o troncales son pues células
pluripotenciales de gran tamaño que, después de
experimentar un proceso de diferenciación, se especializan
en una dirección funcional determinada, hacia una
gran variedad de tipos celulares63.
Las células madre se pueden obtener en dos formas
diferentes:
1. A partir de células de la masa celular interna
o del trofoectodermo de blastocistos clonados mediante la
técnica de transferencia nuclear y cultivadas in
vitro32.
A las células somáticas donantes se las
manipula para inducirlas a un proceso de diferenciación en
tipos celulares determinados, que posteriormente se
utilizarán en el tratamiento de ciertas enfermedades
incurables. La ventaja de esta técnica radica en que las
células madre embrionarias, una vez transplantadas, no
provocan rechazo inmunológico, pues se comportan como
injertos autólogos, gracias a que son genéticamente
idénticas a las células del receptor o del
paciente.
El problema de los transplantes heterólogos, es
el largo tiempo que toma el enfermo en aceptarlos, a pesar de que
los órganos utilizados comparten su misma información genética, pues casi
siempre provienen de miembros de la misma familia. Por otra
parte, cuando se produce rechazo al tejido transplantado, la
salud del
individuo queda seriamente comprometida y hay la eventualidad que
se debe pensar en un nuevo transplante.
Algunos hallazgos recientes han revolucionado la
biología
de las células madre y han demostrado su potencial
clínico para tratar diversas enfermedades, como trastornos
neurodegenerativos, desórdenes sanguíneos y
diabetes.
Además, una estrategia
válida para el manejo de desórdenes de origen
genético conocido, como la anemia
falciforme y la ß-talasemia, consiste en utilizar la
técnica de transferencia nuclear, combinada con terapia
génica y celular.
Los defensores de la clonación terapéutica
de células humanas aducen que permite disponer de tejidos
y de órganos viables, a partir de una fuente de ADN, sin
que sea necesario traer un nuevo ser al mundo con el único
fin de obtener un tejido. Con la finalidad de asegurar la
normalidad del clon y, por tanto de las células madre
embrionarias, se propone una "prueba o test de seguridad" que
seleccione y discrimine los embriones a los que se les
permitirá progresar en su desarrollo. En teoría,
este filtro se podría efectuar mediante la
evaluación de los errores en la expresión y en la
huella genética de los blastómeros en estado de
preimplantación, pero no tiene en cuenta que se desconocen
los efectos epigenéticos adversos que
desencadenaría tal manipulación.
El asunto controversial es la conveniencia de crear
embriones de seres humanos con la única finalidad de
obtener líneas celulares, como también tejidos y
nuevos órganos que se puedan utilizar en el reemplazo de
los que se encuentran lesionados. Así se han levantado
innumerables voces que de plano rechazan cualquier tipo de
investigación que comprometa embriones de
seres humanos. Argumentan que, para el cultivo de las
células madre que forman parte del embrión, es
necesario separarlas, y, por tanto destruir el paquete de
células que se origina como producto de la fecundación.
El meollo del asunto ético es "el sacrificio de
embriones que sirven solamente como bancos de
tejidos"59,60. Se ha cuestionado el uso de
células madre embrionarias humanas con finalidades
terapéuticas, no obstante sus encomiables objetivos, no
sólo por reconocidos bioéticos sino también
por organizaciones
defensoras de los derechos humanos,
con el argumento que se trata de un daño
enorme a la vida del ser humano62,63.
A partir de ciertos órganos o tejidos de
individuos postnatales, donde se ha demostrado que pueden
persistir en forma indiferenciada. A la luz de
conocimientos actuales de la ingeniería
genética, estas células podrían ser
transformadas en células madre pluripotenciales y
cultivadas separadamente, de acuerdo a la necesidad del
paciente48.
Así, dentro de tejidos clásicamente
considerados con un potencial regenerativo nulo, como el
nervioso64,65 y el muscular66, se han
identificado grupos de células madre, capaces de
proliferar y de madurar hacia diferentes tipos celulares, tanto
in vivo como in vitro. De la misma manera, en la zona
subventricular del cerebro adulto,
se han hallado células madre que eventualmente se
podrían utilizar en terapias de reemplazo neuronal. Por
otro lado, se observa una buena regeneración de tejidos
como músculo esquelético lesionado, cuando se
injertan mioblastos cultivados in vitro.
Otra fuente prometedora de células
pluripotenciales es la sangre del
cordón umbilical. La muestra de sangre
se obtiene en el momento del nacimiento, sin que el neonato ni su
madre se vean afectados. La eficiencia del procedimiento es tal,
que, a partir de un volumen de 20 ml
de sangre del cordón, se obtienen hasta 4 millones de
células madre67, que pueden crioconservarse por
largo tiempo sin deterioro alguno, para ser utilizadas en
transplantes68 y en procesos de terapia génica.
La sangre del cordón umbilical también provee
hematíes normales y leucocitos muy útiles en el
tratamiento de la anemia falciforme y en la restauración
del sistema
inmunitario de los niños
nacidos con inmunodeficiencia grave69,70.
Si las células madre que provienen de
determinados órganos de individuos adultos, se cultivan en
condiciones apropiadas, son susceptibles de sufrir
transdiferenciación. En 1999, un grupo de
científicos italianos y canadienses demostraron la
presencia, en personas adultas, de células madre nerviosas
capaces de diferenciarse en células
hematopoyéticas. Según sus hallazgos, la
diferenciación de las células madre estaría
condicionada por las señales
que reciben del entorno donde se sitúan71.
Igualmente se ha determinado que células madre nerviosas
de ratones se pueden diferenciar hacia células
hemáticas, como también las células
hemáticas en células musculares
esqueléticas72, o bien, en células de
microglia o de astroglia73. Estos hechos sugirieron la
posibilidad que células madre de la médula
ósea fueran transplantadas con el fin de tratar
enfermedades como distrofia muscular, mal de Parkinson,
infarto de
miocardio o falla hepática. Sin embargo no es claro si la
aparente plasticidad de las células madre adultas
examinadas se debe a las condiciones particulares en las que se
cultivaron, a posible contaminación o a fusión celular.
Además de esta incógnita que retrasa su empleo como
donantes en la clonación, se ha observado que las
células madre adultas presentan otra serie de desventajas
con respecto de las células madre embrionarias. Tales
desventajas incluyen no sólo dificultades en su
aislamiento y cultivo, sino también una alta probabilidad
de sufrir mutagénesis insercional y cáncer, como
resultado de la introducción de transgenes retrovirales,
necesarios para su manipulación
genética74. En contraste, las células
madre embrionarias se obtienen fácilmente a partir del
embrión seleccionado, proliferan de modo indefinido en
cultivo, y sus defectos genéticos se pueden reparar
mediante procesos de recombinación
homóloga75.
Recientemente se obtuvieron células madre adultas
derivadas de
tejido mesenquimatoso de médula ósea en ratas,
ratones, otros animales y seres humanos76, que
sufrieron una rediferenciación exitosa hacia
células de las tres capas germinativas (ecto, meso y
endodermo), cuando se transfirieron sus núcleos dentro de
blastocistos.
Hay otras fuentes, también cuestionadas, que
ofrecen disponibilidad de células madre pluripotenciales
humanas, que se pueden diferenciar y cultivar separadamente: Son
los embriones desechados durante el procedimiento de
fertilización in vitro (IVF)4,77.
Clonación reproductiva. Inicialmente, el
proceso es igual al que se efectúa durante la
clonación terapéutica. La diferencia aparece con
posterioridad a la fusión del núcleo de la
célula donante con el oocito enucleado, pues el cigoto se
debe implantar en un útero, donde se desarrollará
hasta formar un individuo réplica del donante. Dicen sus
defensores, que esta técnica podría ser una
alternativa para las parejas infértiles o, para las que
tienen hijos con enfermedades genéticas o, que
potencialmente podrían engendrarlos.
Sin embargo, los detractores consideran que es un
procedimiento "biológicamente incierto"78
debido al poco éxito alcanzado en la clonación de
primates no humanos35, amén de poco
práctico, pues tendrían que fertilizarse muchas
madres sustitutas con el fin de obtener un solo nacimiento
exitoso79. Además, la necesidad médica
para efectuar una clonación reproductiva es mínima,
si se tiene en cuenta el porcentaje relativamente bajo (1%) de
parejas infértiles78. En favor de la
clonación con fines reproductivos, se ha esgrimido que
representa una opción para las "parejas de homosexuales"
que desean tener hijos propios. Tal es el caso de las parejas
femeninas que no desean tener un bebé a partir del esperma
de alguien desconocido, como ocurre con los procedimientos de
reproducción asistida (IVF). También podría
ser una luz de esperanza para los padres que han perdido a un
hijo. Sin embargo, ninguno de estos argumentos ha sido acogido
por las organizaciones internacionales de bioética o
por los científicos geneticistas. Así, se ha
afirmado que la clonación no puede hacer de nadie un ser
inmortal, porque el clon es una persona
diferente80, y, aún se debate si el
clon tendría los mismos derechos que cualquier otro
ser humano. La verdad es que si la clonación con fines
reproductivos estuviera permitida, de seguro la
practicarían preferentemente las parejas
infértiles, de manera semejante a lo que ocurre con los
procedimientos de IVF, y no por individuos que motu proprio
decidan reproducirse mediante este procedimiento.
Por otro lado, si alguien desea clonar a una persona ya
fallecida, debería haber tenido la precaución de
obtener células suyas en vida, si se considera que la
supervivencia celular postmortem es sólo de unas dos
horas. Además, debería tener un consentimiento
certificado del individuo donante.
Otras razones éticas, como la identidad del
clon, suscitan cuestionamientos, hipotéticamente aun por
parte del mismo clon. En 1970 Hans Jonas, filósofo
inglés -según Annas60- explicó
que "la clonación es un crimen contra el mismo
‘clon’ pues lo priva de sus derechos de conocer la
verdad acerca de su existencia." En otras palabras, el clon
estaría sujeto a la versión que el donante quiera
suministrarle sobre el origen de su existencia y su legitimación como ser humano.
En contraste, en el campo de la clonación animal
con fines reproductivos, no se han generado tales controversias,
pues existe consenso sobre las bondades de efectuar el
procedimiento en animales de granja, con la finalidad de
preservar el genoma de los mejores ejemplares.
Las características genéticas más
valoradas son, entre otras, un crecimiento rápido,
resistencia a
enfermedades, una elevada producción de leche o de
lana de alta calidad. Si se
toma la decisión de clonar animales, no sólo es
factible predecir con facilidad sus características, sino
también aumentar el bienestar de la población,
mediante el aumento de la resistencia a ciertas entidades. Aunque
la clonación utilizada en este contexto reduciría
la diversidad, por otro lado ayudaría a esparcir mejores
genes. La clonación reproductiva también permite
preservar especies exóticas o que se encuentren en peligro
de extinción7.
CONCLUSIONES Y PERSPECTIVAS.
La aplicación de la clonación mediante la
técnica de transferencia nuclear, no obstante las pocas
modificaciones experimentadas en los últimos 10
años, ha permitido un mejor entendimiento de los
mecanismos que regulan el desarrollo. Una consecuencia
trascendental de lo anterior es la revelación de nuevos
prospectos que se refieren a temas de estudio nunca antes
imaginados, así como de aplicarlos tanto a la medicina como
a las ciencias
agropecuarias.
Aunque la eficiencia de las técnicas empleadas
hasta la fecha ha sido baja, su potencialidad es enorme, de modo
que se espera que dentro de muy poco tiempo se pueda utilizar
comercialmente, con el fin de incrementar, tanto la productividad
como el bienestar de las poblaciones de animales de granja.
Asimismo serán una realidad los animales clonados y
manipulados genéticamente mediante la introducción
de genes humanos, que se utilizarán para producir
proteínas humanas, cuya deficiencia causa serias
enfermedades como la fibrosis quística y la
hemofilia.
El futuro de la clonación con fines
terapéuticos es prometedor, pues se podrán efectuar
trasplantes de tejidos sanos en personas aquejadas por diversos
tipos de enfermedades. Así los científicos esperan
producir órganos completos en el laboratorio,
para reemplazar los que se encuentran lesionados en pacientes con
enfermedades devastadoras como cáncer, dolencias
cardíacas, diabetes y mal de Parkinson. A este respecto,
el debate ético no está centrado en sus loables
propósitos, sino en la conveniencia de utilizar
células madre de embriones de seres humanos versus
células madre obtenidas a partir de individuos
adultos.
Sobre la clonación con fines reproductivos se
ciernen serias incógnitas, debido a que casi todas las
causas de las complicaciones vistas, permanecen en el
misterio.
En la práctica, su aplicación en el ser
humano ha sido vetada no solo por eminentes científicos,
sino por la gran mayoría de las organizaciones defensoras
de los derechos humanos, que han expresado con claridad su
rechazo al procedimiento, debido a convicciones que van desde lo
social y ético, hasta lo religioso.
En su Declaración Universal sobre el Genoma
Humano y los Derechos Humanos81 del año 1997,
en el artículo 11, la Conferencia
General de la Organización de las Naciones Unidas
para la
Educación, la Ciencia y
la Cultura
(UNESCO), declara: "No deben permitirse las prácticas
que sean contrarias a la dignidad
humana, como la clonación con fines de reproducción
de seres humanos. Se invita a los Estados y a las organizaciones
internacionales competentes a que cooperen para identificar estas
prácticas y a que adopten en el plano nacional o
internacional las medidas que corresponda, para asegurar que se
respetan los principios enunciados en la presente
Declaración".
Por su parte, Wilmut et al.8,
científicos del Roslin Institute que lideraron el equipo
responsable de la clonación de la oveja Dolly, afirman:
"Aunque parece técnicamente posible la clonación
humana, no se debería intentar siguiera, pues es una
aberración carente de utilidad
clínica".
En concordancia con las declaraciones anteriores, un
número significativo de países miembros de la
Organización de las Naciones Unidas (ONU) ha venido
propiciando el debate tendiente a la adopción
de una convención internacional que regule las
investigaciones sobre clonación humana. Es así como
dentro del marco del VI comité de la 58° Asamblea
General, el día 6 de noviembre de 2003, se presentaron dos
propuestas: la primera, que abogaba por una prohibición
total de las investigaciones sobre clonación humana, tanto
reproductiva como terapéutica, avalada por un numeroso
grupo de países liderado por los Estados Unidos de
América, Costa Rica y
España.
La segunda, aunque también vetaba la
clonación humana con fines reproductivos, hacía
énfasis sobre la necesidad de investigar con
células humanas clonadas, con miras a su posible
utilización terapéutica. Esta última
propuesta fue presentada por un grupo de países entre los
que estaban Gran Bretaña, Bélgica y Singapur. No
obstante la aparente claridad de las diferentes posturas, en el
transcurso del debate se hizo evidente una gran
polarización, que llevó a que los países
pertenecientes a la Organización de la Conferencia
Islámica (OIC), representados por Irán, promovieran
una propuesta alterna que postergaba el debate hasta el
año 2005. El objetivo de
esta moción, que finalmente fue aprobada, era el de
permitir que en el lapso previsto hubiese una mayor posibilidad
de demostrar hasta qué punto son necesarias las
células humanas clonadas en el tratamiento de enfermedades
degenerativas82.
Consciente de la importancia de adoptar con prontitud
una posición definida al respecto, la Asamblea General de
las Naciones Unidas, en encuentro efectuado el día 9 de
diciembre de 2003, anuló la votación de su
comité legal que postergaba por 2 años el debate,
y, en consecuencia, decidió incluir el tema de la
clonación humana con fines reproductivos en su agenda para
la sesión 59 del año 2004. Igualmente instó
a los países miembros a que una vez sea aprobada la
convención, desarrollen una legislación coherente
que prohiba cualquier tipo de investigación,
experimentación, desarrollo o aplicación de
técnicas orientadas a la clonación humana con fines
reproductivos dentro de sus territorios.
Por tanto, una legislación nacional tendrá
que seguir a la resolución de la ONU, si se tiene en
cuenta la no obligatoriedad de acatar sus
resoluciones83.
Aunque muy seguramente la prohibición de clonar
seres humanos será adoptada internacionalmente por
convención de la ONU durante el transcurso del año
2004, la radicalización de las diferentes posiciones en
torno a la
clonación humana con fines terapéuticos, no
permitirá que exista consenso a su alrededor, al menos en
el corto plazo. Así por ejemplo, se habla de la
posibilidad de que los embriones utilizados como fuente de
células madre provengan en su mayoría de los
países en vía de desarrollo82 donde, en
este orden de ideas, no sería inusual que un comercio
ilegal de embriones y de tejidos embrionarios hiciera su
aparición.
BIBLIOGRAFÍA
- Uribe V. El prodigio de la evolución: del simio ancestral al
hombre
moderno. Bogotá: Cristina Uribe Editores Ltda; 2001. p.
252. - Edey MA, Johanson DC. Blueprints: Solving the mystery
of evolution. Boston: Little Brown Co. Ltd; 1989. p. 284,
304. - Gould SJ. Wonderful life. New York: WW Norton &
Co; 1989. p. 57. - Facchini F. L’homme, ses origins. Milán:
Editoriale Jaca Book; 1990. p. 10. - Domínguez F, Díaz Y, Gómez MA,
Guzmán C. Clonación ¿el futuro de la
humanidad? México: Grupo Editorial Tomo, S.A. de
C.V.; 1999. p. 53-54. - Wilmut I, Campbell K, Tudge C. La segunda
creación. Barcelona: Sine Qua Non; 2000. p. 24-28;
162-171. - Bren L. Cloning: revolution or evolution in animal
production? Food and Drug Administration Consumer Magazine
2003; mayo-junio. p. 1-7. - Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell
KHS. Viable offspring derived from fetal and adult mammalian
cells. Nature 1997; 385: 810-813. - Wilmut I. Clonación con fines médicos.
Investig Cienc 1999; 269: 24-29. - Gindoff PR. Clonación por separación
embrionaria. En Las fronteras de la vida: ciencia y
ética
de la clonación. Madrid:
Ediciones Doce Calles; 1998. p. 52-61. - Piulats Octavi. La manipulación
genética en el mundo vegetal. Integral. Número
102. Junio de 1988. - Borrelli, E. et al (1989) Trasgenic mice with
inducible dwarfism. Nature. 339: 538-41. - Palmiter, R D. and Brinster, R. L. (1986) Germ- line
transformation of mice. Annu. Rev. Genet. 20:
465-99. - Jaenisch, R. (1976) Germ line integration and
mendelian transmission of the exogenous moloney leukemia
virus. Proc.
Nat. Acad. Sci. 73:1260-64. - Brackets, B. G. (1971) Uptake of heterologous genome
by mammalian spermatozoa end its transfer ova through
fertilization. Proc. Nat. Acad. Sci. 68:
353-57. - Gradolfi, F. (1998) spermatozoa, DNA binding and
transgenic animals . Transgenic Res. 7:147- 55. - Harrison, s. J. et .al (2002) efficient generation of
α-(1,3) galactosyl trasferase Knockout
porcine fetal fibroblast for nuclear transfer. Trasgenic Res.
11:143- 50. - Galli, C. et. al (1994) Embryonic stem cells in farm
animals . Zigote.2: 385 – 89. - Wright, G. et. al. (1991) High level expression of
active human alpha- 1- antitrypsin in the milk of the
transgenic sheep. Biofuture. 184: 90-91. - Rudolph, U. and MŐhler, H. (1999) genetically
Modified animals in pharmacological research: future trends.
Eur. J. Pharmacology 375: 327- 37. - M. Cajero, J, A. Ochoa, Z et. al (2002)
Manipulación del Genoma de los animales,
CMEB-FMVZ-UMSNH. - Bren L. Cloning: revolution or evolution in animal
production? Food and Drug Administration Consumer Magazine
2003; mayo-junio. p. 1-7. - Wilmut I, Schnieke AE, McWhir J, Kind AJ, Campbell
KHS. Viable offspring derived from fetal and adult mammalian
cells. Nature 1997; 385: 810-813. - Wilmut I. Clonación con fines médicos.
Investig Cienc 1999; 269: 24-29. - Sims M, First NL. Production of calves by transfer of
nuclei from cultured inner mass cells. Proc Natl Acad Sci 1994;
91: 6143-6147. - Meng L, Ely JJ, Stouffer RL, Wolf DP. Rhesus monkeys
produced by nuclear transfer. Biol Reprod 1997; 57:
454-459. - Gurdon JB, Byrne JA. The first half-century of
nuclear transplantation. Proc Natl Acad Sci 2003; 100:
8048-8052. - Wilmut I. 2003. Whole animal cloning. En Encyclopedia
of Life Sciences. Londres: Nature Publishing Group.
http://www.els.net - Wakayama T, Perry ACF, Zuccotti M, Johnson KR,
Yanagimachi R. Full-term development of mice from enucleated
oocytes injected with cumulus cell nuclei. Nature 1998; 394:
369-374. - Vallejo J, Gómez-Piquer V, Tarín JJ.
Inducción de la partenogénesis en
ovocitos de mamíferos. Rev Iberoam Fertil Reprod Hum
2003; 20: 177-187. - Campbell KHS, McWhir J, Ritchie WA, Wilmut I. Sheep
cloned by nuclear transfer from a cultured cell. Nature 1996;
380: 64-66. - Hwang WS, Ryu YJ, Park JH, et al. Evidence of a
pluripotent human embryonic stem cell line derived from a
cloned blastocyst. Science, 12 February 2004 (10.1126/science.
1094 515). - Gurdon JB, Byrne JA, Simonson S. Nuclear
reprogramming and stem cell creation. PNAS Early Edition.
Colloquium of the National Academy of Sciences "Regenerative
Medicine". Irvine: Arnold and Mabel Beckman Center of the
National Academies of Science and Engineering; 2002. October
18-22. - Betts DH, Bordignon B, Hill JR, et al. Reprogramming
of telomerase activity and rebuilding of telomere length in
cloned cattle. Proc Natl Acad Sci 2001; 98:
1077-1082. - Kasinathan P, Knott JG, Moreira PN, Burnside AS,
Jerry DJ, Robl JM. Effect of fibroblast donor cell age and cell
cycle on development of bovine nuclear transfer embryos in
vitro. Biol Reprod 2001; 64: 1487-1493. - Kühholzer B, Prather RS. Advances in livestock
nuclear transfer. Proc Soc Exp Biol Med 2000; 224:
240-245. - Piotrowska K, Modlinsky JA, Korwin-Kossakowski M,
Karasiewicz J. Effects of preactivation of ooplasts or
synchronization of blastomere nuclei in G1 on preimplantation
development of rabbit serial nuclear transfer embryos. Biol
Reprod 2000; 63: 677-682. - Lai L, Macháty Z, Kühholzer B, et al.
Feasibility of producing porcine nuclear transfer embryos by
using G2 /M-stage fetal fibroblasts as donors. Biol Reprod
2001; 65: 1558-1564. - Ono Y, Shimozawa N, Ito M, Kono T. Cloned mice from
fetal fibroblast cells arrested at methaphase by a serial
nuclear transfer. Biol Reprod 2001; 64: 44-50. - Li X, Li Z, Jouneau A, Zhou Q, Renard JP. Nuclear
transfer: progress and quandaries. Reprod Biol Endocrinol 2003;
1: 84-89. - Hochedlinger K, Jaenisch R. Nuclear transplantation,
embryonic stem cells, and the potential for cell therapy. N
Engl J Med 2003; 349: 275-286. - Jiménez LF, Merchant H. Biología
celular y molecular. México: Prentice Hall; 2003; p.
82-83. - Kühholzer B, Hawley RJ, Lai L, Kolber-Simonds D,
Prather RS. Clonal lines of transgenic fibroblast cells derived
from the same fetus result in different development when used
for nuclear transfer in pigs. Biol Reprod 2001; 64:
1695-1698. - Bortvin A, Eggan K, Skaletsky H, et al. Incomplete
reactivation of Oct4-related genes in mouse
embryos cloned from somatic nuclei. Development 2003; 130:
1673-1680. - Gao S, Chung YG, Williams JW, Riley J, Moley K,
Latham KE. Somatic cell-like features of cloned mouse embryos
prepared with cultured myoblast nuclei. Biol Reprod 2003; 69:
48-56. - Rhind S, Taylor JE, De
Sousa PA, King TJ, McGarry M, Wilmut I. Human cloning: can it
be made safe? Nat Rev Genet 2003; 4: 855-864. - Dean W, Santos F, Stojkovic M, et al. Conservation of
methylation reprogramming in mammalian development: Aberrant
reprogramming in cloned embryos. Proc Natl Acad Sci 2001; 98:
13734-13738. - Betts DH, Bordignon B, Hill JR, et al. Reprogramming
of telomerase activity and rebuilding of telomere length in
cloned cattle. Proc Natl Acad Sci 2001; 98:
1077-1082. - Rideout WM III, Eggan K, Jaenisch R. Nuclear cloning
and epigenetic reprogramming of the genome. Science 2001; 293:
1093-1098. - Hochedlinger K, Jaenisch R. Nuclear transplantation:
lessons from frogs and mice. Curr Opin Cell Biol 2002; 14:
741-748. - Rhind S, Taylor JE, De Sousa PA, King TJ, McGarry M,
Wilmut I. Human cloning: can it be made safe? Nat Rev Genet
2003; 4: 855-864. - Humpherys D, Eggan K, Akutsu H, et al. Epigenetic
instability in ES cells and cloned mice. Science 2001; 293:
95-97. - Hill JR, Burghardt RC, Jones K, et al. Evidence for
placental abnormality as the major cause of mortality in first
trimester somatic cell cloned bovine fetuses. Biol Reprod 2000;
63: 1787-1794. - Tamashiro K, Wakayama T, Yamazaki Y, et al. Phenotype
of cloned mice: Development, behavior and physiology. Exp Biol
Med 2003; 228: 1193-1200. - Cibelli JB, Campbell KH, Seidel GE, West MD, Lanza
RP. The health profile of cloned animals. Nat Biotechnol 2002;
20: 13-14. - Simerly C, Dominko T, Navara C, et al. Molecular
correlates of primate nuclear transfer failures. Science 2003;
300: 297 - De Sousa PA, Dobrinsky JR, Zhu J, et al. Somatic cell
nuclear transfer in the pig: control of
pronuclear formation and integration with improved methods for
activation and maintenance of pregnancy. Biol Reprod 2002; 66:
642-650. - Shin T, Kraemer D, Pryor J, et al. A cat cloned by
nuclear transplantation. Nature 2002; 415: 859. - Chan AW, Dominko T, Luetjens CM, et al. Clonal
propagation of primate offspring by embryo splitting. Science
2000; 287: 317-319. - Hochedlinger K, Jaenisch R. Nuclear transplantation,
embryonic stem cells, and the potential for cell therapy. N
Engl J Med 2003; 349: 275-286. - Humpherys D, Eggan K, Akutsu H, et al. Abnormal gene
expression in cloned mice derived from embryonic stem cells and
cumulus cell nuclei. Proc Natl Acad Sci 2002; 99:
12889-12984. - Eggan K, Akutsu H, Loring J, et al. Hybrid vigor,
fetal overgrowth, and viability of mice derived by nuclear
cloning and tetraploid embryo complementation. Proc Natl Acad
Sci 2001; 98: 6209-6214. - Storms RW, Trujillo AP, Springer JB, et al. Isolation
of primitive human hematopoietic progenitors on the basis of
aldehyde dehydrogenase activity. Proc Natl Acad Sci 1999; 96:
9118-9123. - Johansson CB, Momma S, Clarke DL, Risling M, Lendahl
U, Frisén J. Identification of a neural stem cell in the
adult mammalian central nervous system. Cell 1999; 96:
25-34. - Conover JC, Allen RL. The subventricular zone: new
molecular and cellular developments. Cell Mol Life Sci 2002;
59: 2128-2135. - Gussoni E, Soneoka Y, Strickland CD, et al.
Dystrophin expression in the mdx mouse restored by stem cell
transplantation. Nature 1999; 401: 390-394. - Orlic D, Kajstura J, Chimenti S, et al. Bone marrow
cells repair infarcted myocardium. Nature 2001; 410:
701-705. - Harris DT, Schumacher MJ, Rychlik S, et al.
Collection, separation and cryopreservation of umbilical cord
blood for use in transplantation. Bone Marrow Transplant 1994;
13: 135-143. - Broxmeyer HE, Douglas GW, Hangoc G, et al. Human
umbilical cord blood as a potential source of transplantable
hematopoietic stem/progenitor cells. Proc Natl Acad Sci 1989;
86: 3828-3832. - Keller G, Snodgrass HR. Human embryonic stem cells:
the future is now. Nat Med 1999; 5: 151-152. - Björnson CR, Rietze RL, Reynolds BA, Magli MC,
Vescovi AL. Turning brains into blood: a hematopoietic fate
adopted by adult neural stem cells in vivo. Science 1999; 283:
534-537. - Kopen GC, Prockop DJ, Phinney DG. Marrow stromal
cells migrate throughout forebrain and cerebellum, and they
differentiate into astrocytes after injection into neonatal
mouse brains. Proc Natl Acad Sci 1999; 96:
10711-10716. - Elitism MA, Mosey E. Hematopoietic cells
differentiate into both microglia and macroglia in the brains
of adult mice. Proc Natl Acad Sci 1997; 94:
4080-4085. - Check E. Second cancer case
halts gene-therapy trials. Nature 2003; 421-305. - Rideout WM, Hochedlinger K, Kyba M, Daley GQ,
Jaenisch R. Correction of a genetic defect by nuclear
transplantation and combined cell and gene therapy. Cell 2002;
109: 17-27. - Jiang Y, Jahagirdar BN, Reinhardt RL, et al.
Pluripotency of mesenchymal stem cells derived from adult
marrow. Nature 2002; 418: 41-49. - Harris J. Assisted reproductive technological
blunders (ARTBs). J Med Ethics 2003; 29: 205-206. - Biological uncertainties about reproductive cloning
(editorial). Lancet 2001; 358: 519. - Nash JM. The age of cloning. Time 1997-03-10; Special
report: 34-37. - Gibbs N. Cloning: where do you draw the line? Time
2001-08-13; Nation: 18-21. - Conferencia General de la Organización de las
Naciones Unidas para la Educación, la Ciencia y la Cultura.
Declaración universal sobre el genoma humano y los
derechos humanos. 1997; artículo 11. - Fifty-eight General Assembly. Sixth Comittee. 23rd
Meeting (AM). Legal Committee, ending session, recommends
that general assembly defer for two years consideration of
human cloning. Press release GA/L/3246. En:
http://www.un.org/News/Press/docs/2003/gal3246.doc.htmLibros de texto:
- Fifty-eight General Assembly. Plenary. 72nd Meeting
(AM). General Assembly decides to include item on reproductive
cloning in its agenda for 59th session in 2004. Press release
GA/10218. En: http://www.un.org/News/Press/docs/2003/ga10218.doc.htm - L.C. Junqueira., José Carneiro (1997)
Biología Celular y Molecular. 6a
edición. Ed. McGraw-Hill.
Chile. - Albert L. Lehninger., David l. Nelson., et al. (1993)
Principios de Bioquímica. 2a
edición. Ed. Omega. Barcelona. - Christopher K. Mathews., K.E van Holde., et al.
(2002) Bioquímica. 3a edición.
Ed. Addison Wesley. España. - David L. Nelson., Michael M. Cox. (2001) Lehninger
Principios de Bioquimica. 3a edición. Ed.
Omega. Barcelona. - Helena curtis., N. Sue Barnes., et al (2001)
Biología. 6a edición. En
español, Ed. Medica panamericana.
España. - Lodish., Berk., Zipursky., Matsudaira et al (2002)
Biología Celular y molecular. 4a
edición. Ed. Médica panamericana.
España. - Alberts., Bray., Lewis., Raff., et al. (2002)
Biología Molecular de la Célula.
3a edición, Ed. Omega. Barcelona. - Gerald Karp (1998) Biología Celular y
molecular. 2a edición. Ed. McGraw-Hill.
México. - Robert K. Murria., Daril K. Granner., et al. (2001)
Bioquímica de Harper. 15a
edición. Ed. Manual
Moderno. - J.J. Hicks (2002) Bioquímica
2a edición. Ed. McGraw-Hill.
México. - Robert Roskoski, JR. (2001) Bioquímica.
2a edición. Ed. McGraw-Hill.
México. - Christopher K.Mathews., K.E. van Holde. (2001)
Bioquímica. 2a edición. Ed.
McGraw-Hill. España. - J.A. Lozano Teruel., J. D. Galindo Cascales., J.C.
García – Borrón Martínez., et al.
(2000) Bioquímica y Biología Molecular para
las Ciencias de la Salud. 2a edición. Ed
McGraw-Hill. España. - José Laguna., Enrique Piña. (2002)
Bioquímica de Laguna. 5a
edición. Ed. Manual Moderno. México.EN INGLÉS:
- Lubert stryer., (1995) Bioquímica.
4a edición. Ed. Reverté.
España. - Molecular Cell Biology by Harvey
Lodish, David Baltimore, Arnold Berk,
Lawrence Zipurksy (contributor), James Darnell
(contributor). 4th edition (1999) W.H. Freeman
& Co.; ISBN: 0-7167-3136-3. - Genes VII by Benjamin
Lewin.7th edition (2002). Oxfort Univ
Press; ISBN: 0-19- 8792 77-8. - Molecular Cell Biology by H. lodish,
J.E.darnell. 5th (2004) W.H. Freman &
Company; ISBN:0-7167- 4366-3.
Mvz. Yoshio Iván Macswiney
Román
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |