Importancia de la química para el ser humano y el ambiente (página 5)
RELACIONES EN LAS REACCIONES
QUÍMICAS
Las formulas de los compuestos
tienen un significado cualitativo y cuantitativo; lo mismo sucede
cuando se presentan mediante ecuaciones
químicas las transformaciones que se producen entre unos
compuestos para obtener otros distintos.
Las ecuaciones químicas tienen dos miembros,
separados por una flecha que nos indica el sentido en que se
produce la reacción o, si son reversibles, una doble
flecha. Además, es importante destacar que las ecuaciones
se presentan siempre balanceadas, por lo que supone una información precisa acerca de las
cantidades, tanto en moles como en gramos, que intervienen en las
reacciones; siendo estas iguales en ambos miembros de la
ecuación, aunque los compuestos son distintos. Asimismo,
nos informa de la relación de volúmenes que
intervienen en las reacciones. También se sobreentiende
que las ecuaciones químicas representan la relación
que se establece tanto entre átomos como entre
moles.
Una vez establecida la ecuación química de un
proceso se
puede seguir un modelo simple
para la solución de todos los problemas
estequiométricos, que consta de tres pasos:
- convertir la cantidad de sustancias dadas a
moles - convertir los moles de las sustancias dadas a moles
de las sustancias que se desean - convertir los moles de las sustancias deseadas a las
unidades de cantidad requeridas
relación masa –
masa
1. El alcohol
etílico se quema de acuerdo con la siguiente
ecuación:
C2H5OH +
3O2—–2CO2+ 3H2O
¿cuántos grs de CO2 se producen cuando
se queman 3.10 grs de C2H5OH de esta
manera.
2. Si 3.00 grs de SO2 gaseoso reaccionan con
oxígeno
para producir trióxido de azufre, ¿cuántos
grs de oxígeno se necesitan?
3. Las bolsas de aire para
automóvil se inflan cuando se descompone
rápidamente azida de sodio, NaN3, en los
elementos que la componen según la reacción
2NaN3 —-2Na + 3N2
¿Cuántos gramos de azida de sodio se necesitan para
formar 5.00 g de nitrógeno gaseoso?
4. ¿Qué masa de magnesio se necesita para
que reaccione con 9.27 g de nitrógeno? (No olvide
balancear la reacción.)
Mg + N2 —-Mg3N2
5. ¿Cuántos gramos de H2O se
forman a partir de la conversión total de 32.00 g
O2 en presencia de H2, según la
ecuación
2H2 + O2—-
2H2O?
6. El octano se quema de acuerdo con la siguiente
ecuación:
2C8H18 + 25O2
—-16CO2 + 18H2O
¿Cuántos gramos de CO2 se producen
cuando se queman 5.00 g de C8H18
7. La fermentación de glucosa,
C6H12O6, produce alcohol
etílico, C2H5OH, y dióxido de
carbono:
C6H12O6(ac)—-2C2H5OH(ac)
+ 2CO2(g)
¿Cuántos gramos de etanol se pueden producir a
partir de 10.0 g de glucosa?
8. El CO2 que los astronautas exhalan se
extraer de la atmósfera de la nave
espacial por reacción con KOH:
CO2 + 2KOH —-K2CO3 +
H2O
¿Cuántos gr de CO2 se pueden extraer con
1000 g de KOH?
9. ¿Cuántos gramos de óxido de
hierro
Fe2O3, se pueden producir a partir de 2.50
g de oxígeno que reaccionan con hierro
sólido?
10. Un producto
secundario de la reacción que infla las bolsas de aire
para automóvil es sodio, que es muy reactivo y puede
encenderse en el aire. El sodio que se produce durante el proceso
de inflado reacciona con otro compuesto que se agrega al
contenido de la bolsa, KNO3, según la
reacción 10Na + 2KNO3 ![]() K2O + 5Na2O + N2
K2O + 5Na2O + N2
¿Cuántos gramos de KNO3 se necesitan
para eliminar 5.00 g de Na?
que cantidad de carbono se necesita para producir 600 g
de oxido de plomo
PbO + C——- Pb + CO2
cuantos gramos de sodio es necesario poner a reaccionar
con agua para
obtener 10 g. De Hidrógeno
Na + H20—– NaOH +
H2
cuantos gramos de dicromato de potasio debemos poner a
reaccionar con suficiente cantidad de acido clorhídrico
para obtener 10 grs. De cloro
K2Cr2O7 + HCl
—–KCl + CrCl3 + H2O +
Cl2
cuantos gramos de ácido sulfhídrico se
obtienen al hacer reaccionar 50 g. De sulfuro de fierro III con
suficiente cantidad de ácido clorhídrico
FeS + HCl—– FeCl2 +
H2S
cuantos gramos de nitrato de sodio es necesario poner a
reaccionar con suficiente cantidad de ácido
sulfúrico para obtener 100 g. De ácido
nítrico
NaNO3 + H2SO4
—–NaHSO4 + HNO3
Al poner a reaccionar 200 g. De carbonato calcio con
suficiente cantidad de ácido clorhídrico, cuantos
gramos de dióxido de carbono se obtienen
CaCO3 + HCl —–CaCl2 +
H2O + CO2
Que cantidad de peroxido de sodio es necesario poner a
reaccionar con agua para obtener 300 g. De oxigeno.
Na2O2 + H2O
—–NaOH + O2
el oxigeno se prepara calentando el clorato de
potasio, ¿ cual es el peso de oxigeno obtenido a partir
de 6g. De clorato de potasio ?
KClO3—– KCl + O2
Cuantos gramos de HCl reaccionan con 28.2 gramos de
hidróxido de bario de acuerdo con la siguiente
reacción
Ba(OH)2 + HCl —–BaCl2 +
H2O
si se hacen reaccionar 20 g. De cobre con
ácido nítrico concentrado ¿ que cantidad
de nitrato cuprico se obtiene ?
Cu + HNO3
—–Cu(NO3)2 + NO2 +
H2O
Relaciones masa – volumen o
viceversa
NH4 NO2 —–N2 +
H2O- Al poner a calentar 100 g. De nitrito de amonio en
condiciones NPT ¿ que volumen de nitrógeno se
obtiene ?KClO3—- KCl + O2
- Que cantidad de clorato de potasio en condiciones NPT
es necesario poner a calentar para obtener 10 lts de
oxigenoCaH2 + H2O—–
Ca(OH)2 + H2 - cuantos litros de hidrógeno en condiciones NPT
se obtienen al poner a reaccionar 20 grs. De hidruro de
calcio con agua.NH4Cl + Ca(OH)2—–
CaCl2 + H2O + NH3 - Cuantos litros de amoniaco se obtienen al poner a
reaccionar 100 g de cloruro de amonio con hidróxido de
calcioNH4 NO3—– H2O +
N2O - Cuantos gramos de nitrato de amonio en condiciones NTP
es necesario poner a calentar para obtener 500 lts. De
monóxido de dinitrogenoCa CO3—– CaO +
CO2 - Cuantos litros de dióxido de carbono se obtienen
al calentar 15 g de carbonato de calcio en condiciones
NTPH2SO4 + NaHSO3
—–NaHSO4 + H2O +
SO2 - cuantos litros de dióxido de azufre se
obtienen al poner a reaccionar 50 g. De sulfito ácido de
sodio con ácido sulfúrico concentrado - determinar la masa molecular de un gas si 600 ml
tiene una masa de 1.5 g. En condiciones NTP. - encontrar el volumen ocupado por 50 g. De oxigeno en
condiciones NTP. - determinar el volumen de hidrógeno liberado
cuando 300 g. De zinc reaccionan con ácido
sulfúrico. - cuantos litros de dióxido de carbono se obtienen
calentando 400 gramos de carbonato de calcio.H2O2—– H2O +
O2Relaciones volumen – volumen
- cual es el volumen de oxigeno en litros, formado por la
descomposición de 20 grs. De agua oxigenada en
condiciones NTPHCl + CaCO3 ——-CaCl2 +
H2O + CO2- Que volumen de dióxido de carbono a
° C de temperatura y 1atmosfera de presión puede producirse a partir a
partir de 75 g. De carbonato calcico. - Que volumen de ácido clorhídrico
gaseoso a ° C de temperatura
y 1atmosfera de presión se necesita para preparar la
solución de ácido.
- Que volumen de dióxido de carbono a
- se puede obtener dióxido de carbono por la
acción del ácido
clorhídrico sobre el carbonato calcico. El producto
principal que se obtienen es la caliza. - cuantos litros de amoniaco se pueden obtener
partiendo de 750 litros de nitrógeno y midiendo todos
los gases en
condiciones normales.
N2 + H2—–
NH3
GASES IDEALES
La materia puede
presentarse en tres estados: sólido, líquido y
gaseoso. En este último estado se
encuentran las sustancias que denominamos comúnmente
"gases".
Ley de los gases
Ideales
Según la las moléculas pueden tener
o no cierta libertad de
movimientos en el espacio; estos grados de libertad
microscópicos están asociados con el concepto de orden
macroscópico. Las libertad de movimiento de
las moléculas de un sólido está restringida
a pequeñas vibraciones; en cambio, las
moléculas de un gas se mueven aleatoriamente, y
sólo están limitadas por las paredes del recipiente
que las contiene.
Se han desarrollado leyes
empíricas que relacionan las variables
macroscópicas en base a las experiencias en laboratorio
realizadas. En los gases ideales, estas variables incluyen la
presión (p), el volumen (V) y la temperatura
(T).
se le llama gas ideal al que cumple los tres postulados
de la teoría
cinética
La presión es la fuerza que se
ejerce por unidad de area de un recipiente, para medirla se
utiliza el barómetro. Las unidades mas usadas para medir
la presión son: atmósferas, milímetros de
mercurio, torr, kg/cm2, Dinas/cm2 y libras/
in2
La presión normal es de 1 atm = 760
mm de Hg= 760 torr que son las unidades que
utilizaremos
Temperatura, es la medida de energía
cinética promedio de las moléculas de un cuerpo, se
mide mediante un termómetro y la unidad es el grado. Las
escalas utilizadas para la temperatura son las siguientes
° C, ° R, ° F y la
absoluta K ( K = ° C + 273 ) que
es la utilizada para la medición de gases.
Volumen es el espacio ocupado por una sustancia
determinada. Se mide en litros, mililitros, metros
cúbicos, etc
La ley de Boyle –
Mariotte relaciona inversamente las proporciones de volumen y
presión de un gas, manteniendo la temperatura constante:
P1. V1 = P2
. V2
Cuando la temperatura es constante se dice
que las condiciones son isotérmicas
La ley de Gay-Lussac afirma que el volumen de un gas, a
presión constante, es directamente
proporcional a la temperatura absoluta:  *
*
Cuando la presión es constante, se dice que las
condiciones son isobáricas
La ley de Charles sostiene que, a volumen constante, la
presión de un gas es directamente proporcional a la
temperatura absoluta del sistema:
![]()
Cuando el volumen es constante se dice que las
condiciones son isocóricas
* En ambos casos la temperatura se mide en kelvin (273 K
= 0ºC) ya que no podemos dividir por cero, no existe
resultado.
De las tres se deduce la ley universal de los
gases:

Resuelve los siguientes Ejercicios aplicando la ley que
corresponda:
1) Un volumen
gaseoso de un litro es calentado a presión constante desde
18 °C hasta 58 °C, ¿qué volumen final
ocupará el gas?.
Rta.: 1,23 l
2) Una masa gaseosa a 32 °C ejerce una
presión de 18 atm, si se mantiene constante el volumen,
qué aumento sufrió el gas al ser calentado a 52
°C?.
Rta.: 1,1 atm
3) En un laboratorio se obtienen 30 cm3 de
nitrógeno a 18 °C y 750 mm de Hg de presión, se
desea saber cuál es el volumen normal.
Rta.: 27,7 cm3
4) Una masa de hidrógeno en condiciones normales
ocupa un volumen de 50 litros, ¿cuál es el volumen
a 35 °C y 720 mm de Hg?.
Rta.: 59,5 l
5) Un gas a 18 °C y 750 mm de Hg ocupa un volumen de
150 cm3, ¿cuál será su volumen a
65 °C si se mantiene constante la presión?.
Rta.: 17,42 cm3
6) Una masa gaseosa a 15 °C y 756 mm de Hg ocupa un
volumen de 300 cm3, cuál será su volumen
a 48 °C y 720 mm de Hg?.
Rta.: 310,3 cm3
7) ¿Cuál será la presión que
adquiere una masa gaseosa de 200 cm3 si pasa de 30
°C a 70 °C y su presión inicial es de 740 mm de
Hg?.
Rta.: 837,68 mm de Hg
8) ¿Cuál será la presión de
un gas al ser calentado de 20 °C a 140 °C si su
presión inicial es de 4 atm?.
Rta.: 5,6 atm
9) Un recipiente está lleno de aire a
presión normal y a 0 °C. Posee una válvula de
seguridad que
pesa 100 N y su sección es de 8 cm2. Si la
presión se mantiene normal, se desea saber qué
temperatura deberá alcanzar el recipiente para que la
válvula se abra, despreciando la dilatación del
recipiente.
Rta.: 57,34 °C
10) En una fábrica de oxígeno se almacena
1 m3 de ese gas en un cilindro de hierro a 5 atm,
¿qué volumen habrá adquirido si inicialmente
la presión era de 1 atm?
Rta.: 1,0323 bar
11) La densidad del
oxígeno a presión normal es de 14,29
kg/m3, ¿qué presión
soportaría para que su densidad sea de ,589
kg/m3?.
Rta.: 313,2 mm de Hg
12) A presión de 758 mm de Hg, el aire en la rama
de un manómetro de aire comprimido marca 32 cm,
¿qué presión se ejerce cuando ese nivel se
reduce a 8 cm? (considere uniforme la sección del
tubo).
Rta.: 2,9 atm
13) Se almacena 1 m3 de oxígeno en un
cilindro de hierro a 6,5 atm. ¿Cuál será el
nuevo volumen si estaba inicialmente a 1 atm?.
Rta.: 0,1538 m3
14) En un tanque se coloca querosen hasta el 75 % de su
volumen, se introduce luego aire hasta que alcanza una
presión de 2,8 atm, determinar el volumen de aire dentro
del tanque, si su longitud es de 35 cm y 8 cm de radio.
Rta.: 4,92 dm3
15) En un rifle de aire comprimido se encierran 200
cm3 de aire a presión normal que pasan a ocupar
22 cm3. ¿Cuál es la nueva presión
del aire?, si el proyectil sale con una fuerza de 120 kgf,
¿cuál será la sección del
proyectil?.
Rta.: 9390 gf/cm2 y 1,27
cm2
16) Un tubo cilíndrico de 1,5 m de largo se
sumerge verticalmente en mercurio hasta que el extremo cerrado
queda a 25 cm de la superficie libre del mercurio. Determinar la
longitud que ocupará, dentro del tubo, el aire, si la
presión exterior es de 75 cm de Hg (d = 13,56
g/cm3).
Rta.: 56,25 cm
17) En un tubo vertical lleno de aire y de 4 cm de
diámetro se coloca un émbolo que ajusta
perfectamente (sin rozamiento). Si el peso del émbolo es
de 2,5 kgf y la presión exterior es de 735 mm de Hg
¿cuál es la presión del aire encerrado
cuando el sistema aire-émbolo se encuentra en equilibrio?.
Rta.: 1198 gf/cm2
18) En el caso del problema anterior,
¿cuál será el volumen ocupado por el aire si
la longitud del tubo es de 3 m?.
Rta.: 3142 cm3
19) Un volumen de 150 dm3 está a
presión normal, ¿qué presión
soportará si su volumen se reduce a 12
cm3?.
Rta.: 9500 mm Hg
20) El aire en la rama cerrada de un manómetro de
aire comprimido es de 35 cm cuando la presión es de 755 mm
de Hg, ¿cuál será la presión cuando
es nivel sea de 6 cm?.
Rta.: 4404 mm de Hg
21) El aire en la rama cerrada de un barómetro a
presión normal, alcanza a un volumen que equivale a 65 cm.
¿Cuál será el nuevo nivel si la
presión ejercida fuera de 40 kgf/cm2 y cuanto
se elevará el Hg?.
Rta.: 1,678 cm y 63,322
cm
- en el suelo un globo
aerostático tiene un volumen de 100 K litros a –
27° C y presión normal.
Cual seria el volumen del globo si se elevara a una altura
donde la temperatura es de -12°
C y la presión de 300 mm de Hg - el volumen medido de un gas fuew de 15 litros a
37° C y una presión de 2
atm. Que volumen ocupara el gas en condiciones
normales - un gas tiene un volumen de 300 ml a 20° C y 4 atm. Cual será su volumen si
la temperatura se incrementa en 10° C y la presión se reduce a la
mitad - manteniendo constante la temperatura se
comprimió una nuestra de 200 ml de un gas hasta 55 ml.
La presión que se ejerció fue de 2 atm. Cual era
la presión inicial del gas - a presión normal el volumen ocupado por un gas
es de 15 litros a una temperatura de 25° C. Si la temperatura se reduce hasta
-15° C. Cual será el
volumen del gas - un tanque se encuentra a 2 atm de presión y
tiene una temperatura de 20° C.
Calcular que temperatura adquiere cuando se le aplica una
presión de 5 atm - el volumen medido de un gas es de 1000 ml a
temperatura de 60° C y una
presión de 720 torr. Que volumen ocupara el gas en
condiciones normales - un gas ocupa un volumen de 50 litros a una
temperatura constante y soportando una presión de 2 atm.
Que volumen ocupara ese mismo gas a una presión de 10
atm. - una muestra de gas
a una presión de 900 mm de Hg, y a una temperatura de
20° C mantiene un volumen
constante. Que presión tendrá ese gas a una
temperatura de 50° C - un gas ocupa un volumen de 8 litros a una temperatura
de 27° C y una presión
constante que volumen ocupara a 80° C - un gas tiene un volumen de 50 ml a una temperatura de
20° C y una presión de
dos atmósferas. Que presión en mm de Hg
tendrá ese gas a una temperatura de 77° C y un volumen de 200 ml - a que presión debe estar sometido un gas, que
se encuentra a temperatura constante, para que pase de un
volumen de 10 litros a otro de 8 litros, si inicialmente se
encontraba a una presión de 1 atm. - que volumen inicial ocupo un gas sometido a una
presión constante y una temperatura de 30° C, si 40°
C ocupo un volumen de 10 litros - en condiciones iniciales, un gas ocupo un volumen de
8 litros a una temperatura de 25° C y una presión de 1 atm. Que
volumen ocupara a una presión de 8 atm. Y una
temperatura de 30°
C. - una masa de nitrógeno ocupa 200 ml a
100° C encontrar su volumen en
condiciones isobaricas - se tienen 2 litros de oxigeno en condiciones
normales. Si el volumen disminuye 200 ml y la presión se
duplica. Cual será su temperatura en ° C - 50 ml de un gas se encuentran a 20° C y presión normal. Cual
será su volumen a 30° C y
700 torr. - en condiciones isotérmicas se tienen 500 ml de
un gas a una atm de presión, si el volumen aumenta a 1.5
lts. Cual será la presión de ese gas. - un volumen de 20 litros de un gas se encuentra a una
temperatura de 20° C y 730 mm de
Hg de presión. Cual será su volumen en
condiciones normales - un tanque de 3 litros contiene gas a una temperatura
ambiente
(20° C), tiene una
presión de 20 atm. Cual seria el volumen del gas a 1 atm
y a la misma temperatura - el gas contenido en un spray para el pelo puede tener
una presión de 1200 torr a 25° C. Que presión ejerceria el gas si
se calentara a 300°
C
Teoría Cinética de los
Gases
El comportamiento
de los gases, enunciadas mediante las leyes anteriormente
descriptas, pudo explicarse satisfactoriamente admitiendo la
existencia del átomo.
El volumen de un gas: refleja simplemente la distribución de posiciones de las
moléculas que lo componen. Más exactamente, la
variable macroscópica V representa el espacio
disponible para el movimiento de una
molécula.
La presión de un gas, que puede medirse con
manómetros situados en las paredes del recipiente,
registra el cambio medio de momento lineal que experimentan las
moléculas al chocar contra las paredes y rebotar en
ellas.
La temperatura del gas es proporcional a la
energía cinética media de las moléculas, por
lo que depende del cuadrado de su velocidad.
La reducción de las variables
macroscópicas a variables mecánicas como la
posición, velocidad, momento lineal o energía
cinética de las moléculas, que pueden relacionarse
a través de las leyes de la
mecánica de Newton, debería de
proporcionar todas las leyes empíricas de los gases. En
general, esto resulta ser cierto.
La teoría física que relaciona
las propiedades de los gases con la mecánica clásica se denomina
teoría cinética de los gases. Además de
proporcionar una base para la ecuación de estado del gas
ideal. La teoría cinética también puede
emplearse para predecir muchas otras propiedades de los gases,
entre ellas la distribución estadística de las velocidades moleculares
y las propiedades de transporte
como la conductividad térmica, el coeficiente de
difusión o la viscosidad.
Densidad de un gas
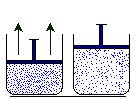
En un determinado volumen las moléculas de gas
ocupan cierto espacio. Si aumenta el volumen (imaginemos un globo
lleno de aire al que lo exponemos al calor
aumentando su temperatura), la cantidad de moléculas (al
tener mayor espacio) se distribuirán de manera que
encontremos menor cantidad en el mismo volumen anterior. Podemos
medir la cantidad de materia, ese número de
moléculas, mediante una magnitud denominada masa. La
cantidad de moléculas, la masa, no varía al
aumentar o disminuir (como en este caso) el
volumen, lo que cambia es la relación masa –
volumen. Esa relación se denomina densidad (d). La
densidad es inversamente proporcional al volumen (al aumentar al
doble el volumen , manteniendo constante la masa, la densidad
disminuye a la mitad) pero directamente proporcional a la masa
(si aumentamos al doble la masa, en un mismo volumen, aumenta al
doble la densidad).
![]()
Hipótesis de
Avogadro
Esta hipótesis establece que dos gases que
posean el mismo volumen (a igual presión y temperatura)
deben contener la misma cantidad de
moléculas.
Cada molécula, dependiendo de los átomos
que la compongan, deberán tener la misma masa. Es
así que puede hallarse la masa relativa de un gas de
acuerdo al volumen que ocupe. La hipótesis de Avogadro
permitió determinar la masa
molecular relativa de esos
gases.
Analicemos el orden lógico que
siguió:
- La masa de 1 litro de cualquier gas es la masa de
todas las moléculas de ese gas. - Un litro de cualquier gas contiene el mismo
número de moléculas de cualquier otro
gas - Por lo tanto, un litro de un gas posee el doble de
masa de un litro otro gas si cada molécula del primer
gas pesa el doble de la molécula del segundo
gas. - En general las masas relativas de las
moléculas de todos los gases pueden determinarse pesando
volúmenes equivalentes de los gases.
En condiciones normales de presión y temperatura
(CNPT) [ P = 1 atm y T = 273 ºK ] un lito de
hidrógeno pesa 0,09 g y un litro de oxígeno
pesa 1,43 g. Según la hipótesis de Avogadro ambos
gases poseen la misma cantidad de moléculas. La
proporción de los pesos entre ambos gases es: 1,43 : 0,09
= 15,9 (aproximadamente) 16. Es la relación que existe
entre una molécula de oxígeno e hidrógeno es
16 a 1. Las masas atómicas relativas que aparecen en la
tabla
periódica están consideradas a partir de un
volumen de 22,4 litros en CNPT.
Ley de los Gases
Generalizada
Como consecuencia de la hipótesis de Avogadro
puede considerarse una generalización de la ley de los
gases. Si el volumen molar (volumen que ocupa un mol
de molécula de gas) es el mismo para todos los gases
en CNPT, entonces podemos considerar que el mismo para todos los
gases ideales a cualquier temperatura y presión que se
someta al sistema. Esto es cierto por que las leyes que gobiernan
los cambios de volumen de los gases con variaciones de
temperatura y presión son las mismas para todos los gases
ideales. Estamos relacionando proporcionalmente el número
de moles (n), el volumen, la presión y la
temperatura: P.V ~ n T. Para establecer una
igualdad
debemos añadir una constante (R)
quedando:
P.V = n . R . T
El valor de
R podemos calcularlo a partir del volumen molar en
CNPT:
![]()
por lo tanto R= 0.08205lt-atm/Kmol = 82.05 ml-atm/Kmol =
1.99 cal/ K mol = 8.31 x 107 ergios / K mol
Por definición n (número de moles)
se calcula dividiendo la masa de un gas por el Mr (la masa
molecular relativa del mismo).

Que es otra forma de expresar la ley general de gases
ideales.
EJERCICIOS:
- que volumen ocuparan 5 moles de bióxido de
carbono a una temperatura de 27°
C y 800 mm de Hg. - a que presión estarán sometidos 5º
gramos de bióxido de carbono que ocupan un volumen de 10
ml a una temperatura de 30°
C. - encontrar la densidad de un gas que tiene una masa
molecular de 350 gr/mol y se encuentra a 2.5 atm y
35° C - determínese el volumen ocupado por 4 grs de
oxigeno en condiciones normales - un tanque de 590 litros de volumen contiene oxigeno a
20° C y 5 atm de presión.
Calcúlese la masa del gas almacenado en el
deposito. - a 18° C y 765 mm de
Hg, 1.29 litros de un gas ideal " pesan " 2.71 grs.
Encuéntrese la masa molecular del gas. - determínese el volumen de 8 grs. De Helio a
15° C y 480 mm de
Hg. - encuéntrese la densidad del metano
CH4 a 20° C y 5
atm. - determínese el peso molecular aproximado de un
gas si 560 cm3 pesan 1.55 g a TPE - a 18° C y 765 torr,
1.29 litros de un gas pesan 2.71 g. Calcular el peso molecular
aproximado del gas. - si la densidad del monóxido de carbono es 3.17
gr/lt a -27° C y 2.35 atm, cual
es su peso molecular aproximado. - si 200 ml de un gas pesan 0.268 g a TPE cual es su
peso molecular - calcúlese el volumen de 11 grs. De
N2O a TPE - que volumen ocuparan 1.216 grs de SO2
gaseoso a 18° C y 755
torr - calcúlese el peso de un litro de amoniaco
gaseoso NH3 a TPE - calcúlese la densidad del H2 S
gaseoso a 27° Cy 2
atm - encuéntrese el peso molecular de un gas cuya
densidad a 40° C y 758 torr es
1.286 kg/m3 - 5.75 grs. De un gas ocupan un volumen de 3.4 lt a una
temperatura de 50° C y una
presión de 0.94 atm. Cual es su peso
molecular - se ha encontrado que 820 cc de un gas desconocido, a
35° C y a 800 mm de Hg pesan
2.46 g. Cual es su peso molecular - que volumen ocuparan 1.5 grs. De NO gaseoso a
75° C y a 300 mm de Hg de
presión
LEY DE LAS PRESIONES PARCIALES ( DALTON )
A temperatura constante, la presión ejercida por
una mezcla de gases, es igual a la suma de las presiones
parciales de cada gas. Se define como presión parcial de
un gas en una mezcla gaseosa, a aquella que ejercería este
gas, si solamente él ocupara todo el volumen de la
mezcla.
Ejercicios:
Una mezcla de gases a 760 torr contiene 65 % de
Nitrógeno, 15 % de oxigeno y 20 % de dióxido de
carbono, en volumen. ¿ cual es la presión parcial
de cada gas en torr ?
En una mezcla gaseosa a 20 ° C, las presiones parciales de los
componentes son: hidrógeno 200 torr, dióxido de
carbono 150 torr, metano 320 torr, etileno 105 torr. ¿
cual es la presión total de la mezcla y el porcentaje en
volumen de hidrógeno ?
La presión parcial del oxigeno en una muestra
diferente de aire es de 152 mm de Hg. La presión total
es de 750 mm de Hg ¿ cual es la fracción molar de
oxigeno ?
Un matraz de 200 ml contiene oxigeno a 200 torr y un
matraz de 300 ml contiene nitrógeno a 100 torr.
Entonces, los dos matraces se conectan de forma que cada gas
llene sus volúmenes combinados. Suponiendo que no hay
cambio en la temperatura, ¿ cual es la presión
parcial de cada gas en la mezcla final y cual es la
presión total?
El aire del norte en invierno contiene esencialmente
nitrógeno, oxigeno y argón. Las fracciones
molares de estos tres gases son 0.78, 0.21 y 0.01
respectivamente. Si la presión del aire es de 742 mm de
Hg, ¿ cuales son las presiones parciales de estos
gases?
En una practica de laboratorio se hace reaccionar
ácido clorhídrico con aluminio, el
hidrógeno gaseoso desprendido se recogió sobre
agua a 25 ° C, ocupando un
volumen de de 355 ml a una presión total de 750 mm de
Hg. La presión de vapor del agua a 25 ° C vale 24 mm de Hg. Calcular : ¿
cual es la presión parcial del hidrógeno en la
mezcla? ¿ cuantos moles de hidrógeno se han
recogido ?
Se recogen exactamente 100 ml de oxigeno en agua a 23
° C y 800 torr. Calcúlese
el volumen estándar del oxigeno seco. La presión
de vapor del agua es de 21.1. torr
se recolecto una muestra de oxigeno por desplazamiento
del agua contenida en tubo invertido. La temperatura es 25
° C, la presión es de 750
mm de Hg y el volumen ocupado es de 280 ml. Cual es el
verdadero volumen del oxigeno en TPS. Considere que el vapor de
agua a dicha temperatura es de 23.5 mm de Hg.
en un recipiente a vacío se introducen 7 grs de
nitrógeno, 16 de oxigeno y 3.03 de hidrógeno. La
capacidad del recipiente es de 80 lts y la temperatura de 50
° C. ¿ cual es la
presión parcial de cada uno de los gases en la mezcla ?
¿ cual es la presión total ?
se recogen 500 ml de oxigeno sobre agua, a una
presión de 760 mm de Hg. La temperatura del sistema es
de 25 ° C; a esta temperatura,
el agua
tiene una presión de vapor de 23.8 mm de Hg ¿
cual es la presión parcial del oxigeno?¿ cuantos
moles de oxigeno hay en el tubo colector?¿ cual seria el
volumen del oxigeno libre de vapor de agua, a PTN ?
LEY DE AMAGAT
El volumen de una mezcla gaseosa es igual a la suma de
los volúmenes de cada gas, medidos a la misma
presión y temperatura de dicha mezcla.
LEY DE GRAHAM
Las velocidades de difusión ( efusión) de
los gases son inversamente proporcionales a las raíces
cuadradas de sus respectivas densidades.
v1 (d2) —– = ——— v2 (d1) | v1 (m2) —– = ——— v2 (m1) | t1 (m2) —– = ——— t2 (m1) |
Ejercicios:
- cual de los siguientes gases tiene una velocidad de
difusión mayor, el metano (CH4) o el
hidrógeno ( H2) - en un experimento de efusión se necesitan 45 s
para que un cierto numero de moles de un gas desconocido pasen
a través de un pequeño orificio al vacío.
En las mismas condiciones el mismo numero de moles de
CO2 tardo 18 s en efundir. Calcule la mas molecular
del gas desconocido
TEORÍA CINÉTICA DE LOS GASES
IDEALES
1 ) Los gases están constituidos por diminutas
partículas discretas ( moléculas o átomos )
de igual masa y tamaño para un mismo gas. Para gases
diferentes son distintas.
2 ) Las partículas se encuentran en un incesante
movimiento caótico, chocando entre sí y con las
paredes del recipiente que las contiene.
3 ) Los choques contra las paredes del recipiente
originan la presión del gas.
4 ) Los choques son elásticos.
5 ) La temperatura absoluta es proporcional a la
energía cinética promedio de las moléculas
(o átomos ) del gas.
6 ) Para presiones bajas, el diámetro de las
moléculas ( o átomos ) es mucho menor que la
distancia promedio entre ellas. Por lo tanto, se consideran
despreciables su volumen efectivo y las fuerzas de
atracción entre ellas.
ECUACION DE ESTADO DE VAN DER WAALS
Van der Waals estableció esta ecuación
para gases reales.
Introdujo ciertas correcciones a la ECUACION DE
ESTADO DE LOS GASES IDEALES :
( P + n2a / V2 ) ( V nb )
= nRT
a y b son constantes particulares de cada gas,
independientes de la presión y temperatura. Por ejemplo
para el H2 :
a = 0,244 [ atm2 /
mol2 ]; b = 0,0266 [ / mol ]
LÍQUIDOS
LAS DISOLUCIONES
Las disoluciones son mezclas
homogéneas de sustancias en iguales o distintos estados de
agregación. La concentración de una
disolución constituye una de sus principales
características. Bastantes propiedades de las disoluciones
dependen exclusivamente de la concentración. Su estudio
resulta de interés
tanto para la física como para la
química.
El estudio de los diferentes estados de
agregación de la materia se suele referir, para
simplificar, a una situación de laboratorio,
admitiéndose que las sustancias consideradas son puras, es
decir, están formadas por un mismo tipo de componentes
elementales, ya sean átomos, moléculas, o pares de
iones. Los cambios de estado, cuando se producen, sólo
afectan a su ordenación o agregación.
Sin embargo, en la naturaleza, la
materia se presenta, con mayor frecuencia, en forma de mezcla de
sustancias puras. Las disoluciones constituyen un tipo particular
de mezclas. El aire de la atmósfera o el agua del mar son
ejemplos de disoluciones. El hecho de que la mayor parte de los
procesos
químicos tengan lugar en disolución hace del
estudio de las disoluciones un apartado importante de la
química-física.
COMBINACIÓN MEZCLA Y DISOLUCIÓN
Conceptos fundamentales
La separación de un sistema material en los
componentes que lo forman puede llevarse a cabo por métodos
físicos o por métodos químicos. Los primeros
incluyen una serie de operaciones tales
como filtración, destilación o centrifugación, en las
cuales no se produce ninguna alteración en la naturaleza
de las sustancias, de modo que un simple reagrupamiento de los
componentes obtenidos tras la separación dará
lugar, nuevamente, al sistema primitivo. Los segundos, sin
embargo, llevan consigo cambios químicos; la materia base
sufre transformaciones que afectan a su naturaleza, por lo que
una vez que se establece la separación, la simple
reunión de los componentes no reproduce la sustancia
original.
Las nociones científicas de combinación,
mezcla y disolución tienen en común el hecho de
que, en todos los casos, intervienen dos o más
componentes, a pesar de lo cual presentan diferencias notables.
Una combinación química es una sustancia
compuesta formada por dos o más elementos cuyos
átomos se unen entre sí mediante fuerzas de enlace.
Sus entidades elementales, ya sean moléculas, ya sean
pares iónicos, son iguales entre sí, y sólo
mediante procedimientos
químicos que rompan tales uniones es posible separar los
elementos componentes de una combinación.
Las mezclas son sistemas materiales que
pueden fraccionarse o separarse en sus distintos componentes por
métodos físicos. Cuando los buscadores de
oro lavan
sobre el cedazo las arenas auríferas, procuran, mediante
un procedimiento
físico, separar el barro y los granos de arena de las
pepitas del precioso metal. En las salinas, por efecto de la
intensa evaporación, el agua del mar se separa en dos
componentes: agua propiamente dicha, que en forma de vapor se
incorpora al aire, y un conjunto de sales minerales que se
acumulan en el fondo hasta que se completa la
desecación.
En cierto tipo de mezclas la materia se distribuye
uniformemente por todo el volumen constituyendo un sistema
homogéneo. Cuando una sustancia sólida se mezcla
con un líquido de tal forma que no puede distinguirse de
él, se dice que la sustancia ha sido disuelta por el
líquido. A la mezcla homogénea así formada
se la denomina disolución. En este caso la
sustancia sólida recibe el nombre de soluto y el
líquido se denomina disolvente. La noción de
disolución puede generalizarse e incluir la de gases en
gases, gases en líquidos, líquidos en
líquidos o sólidos en sólidos. En general,
el soluto es la sustancia que se encuentra en menor
proporción en la disolución y el disolvente la que
se encuentra en mayor proporción. Cuando dos sustancias
líquidas pueden dar lugar a mezclas homogéneas o
disoluciones, se dice que son miscibles.
Una parte homogénea de un sistema se denomina
fase. La colonia constituye una disolución en agua
y alcohol de ciertas esencias, sin embargo, no es posible
determinar dónde está la parte de alcohol,
dónde la de agua y dónde la de esencia. Por tal
motivo las disoluciones, al igual que las sustancias puras en un
estado de agregación determinado, se consideran formadas
por una única fase.
En la naturaleza existen sustancias en diferentes
estados físicos, que pueden intercambiar de uno al otro al
variar la temperatura, dichos fenómenos se conocen como
cambios de estado o transformaciones de fase estos
son:
Por calentamiento, un sólido pasa al estado
liquido, el proceso se llama fusión.
Como es endotérmico, a la cantidad de calor requerido para
fundir un gramo de sustancia se le llama calor latente de
fusión. La temperatura a la cual un sólido funde se
conoce como punto de fusión y tiene un valor particular
para cada sustancia. El proceso inverso de la fusión se
denomina solidificación. El cambio es exotérmico,
lo que significa que pierde calor. La temperatura a la cual un
liquido se solidifica se le llama punto de solidificación
o de congelación, y permanece constante durante el cambio,
tiene un valor especifico para cada sustancia.
Cuando se calienta lo suficiente un liquido, este hierve
y se convierte en vapor. El proceso se llama evaporación,
y la temperatura a la cual hierve, se le llama punto de
ebullición, el proceso inverso de la evaporación se
llama condensación, lo que significa que por enfriamiento,
el vapor se convierte en liquido. La temperatura durante el
cambio permanece constante y recibe el nombre de punto de
condensación.
La cantidad requerida para que un sólido pase al
estado gaseoso es significativamente mayor que la necesaria para
vaporizarlo además que se requiere el concurso de otro
factor, la presión, que coadyuve a acortar la distancia y
reducir la energía cinética de las
partículas gaseosas. A este proceso se le llama
gasificación. El proceso inverso de la gasificación
es la licuefacción. La temperatura a la cual tiene lugar
el cambio se llama punto de licuefacción.
Algunos sólidos tienen la propiedad de
cambiar de forma directa al estado gaseoso, sin pasar por
el estado
liquido, el proceso se llama sublimación y es
endotérmico. Cabe destacar que este cambio de estado es
poco frecuente, y suele ocurrir sin la intervención de
gran cantidad de energía. La temperatura de
sublimación constituye una constante física de gran
valor, el fenómeno inverso de la sublimación es la
deposición. El cambio es en extremo muy difícil de
lograr y requiere del manejo de técnicas,
en las cuales se conjuguen el enfriamiento brusco a presiones
elevadas, para conseguir que el gas se convierta en sólido
sin pasar por el estado liquido.
Mezclas homogéneas y
heterogéneas
En la naturaleza existe gran cantidad de materia en
forma de mezclas. Una mezcla es la combinación
física o unión aparente de dos o mas sustancias o
componentes, que conservan sus propiedades físicas y
químicas y cuya proporción no es fija; los
componentes de las mezclas no pierden sus propiedades.
Mezcla homogénea: son las que a simple vista
tienen un aspecto uniforme en todas sus partes, aunque sus
componentes sean sustancias diferentes. Se les llama
también disoluciones.
Mezcla heterogénea: son las que tienen un aspecto
que no es uniforme y como en todas las mezclas las proporciones
de sus componentes son variables, un ejemplo son las aleaciones.
Estado físico de los | Ejemplo de mezcla homogénea | Ejemplo de mezcla heterogénea |
Sólido – sólido | Bronce | Tierra |
Sólido – liquido | Amalgama dental | Madera |
Sólido – gas | Hidrógeno adsorbido en metal | Piedra porosa |
Liquido – sólido | Agua de mar | Agua con arena |
Liquido – liquido | Vinagre | Aceite y vinagre |
Liquido – gas | Agua con aire | Refresco con gas |
Gas – sólido | Humo | Aire con tierra |
Gas – liquido | Brisa de mar | Nubes |
Gas – gas | Aire | No existe |
DISOLUCIONES, COLOIDES Y SUSPENSIONES
DISOLUCIONES: Las mezclas también se denominan
dispersiones; sus componentes, generalmente son dos, reciben el
nombre de fase dispersante y fase dispersa. la fase dispersante
se encuentra en mayor cantidad que la dispersa. Todas las
disoluciones son mezclas homogéneas.
Las características de las disoluciones
son:
- Las partículas del soluto tienen menor
tamaño que en las otras clases de mezclas. - Presentan una sola fase, es decir son
homogéneas - Si se dejan en reposo durante algún tiempo,
las fases no se separan ni se observa sedimentación;
es decir las partículas no se depositan en el fondo
del recipiente. - Son totalmente transparentes, es decir, permiten el
paso de luz - Los componentes o fases no se pueden separar por
filtración.
TIPOS DE DISOLUCIONES | |||
soluto | disolvente | mezcla | ejemplos |
Gas | Gas | Gas | Aire, gas natural |
Gas | Liquido | Liquido | Bebidas efervescentes, agua de una |
Gas | Sólido | Sólido | Hidrógeno adsorbido en metales |
Liquido | Gas | Gaseosa | Brisa de mar |
Liquido | Liquido | Liquida | Vinagre, alcohol |
Liquido | Sólido | Sólida | Amalgamas dentales, vaselina |
Sólido | Gas | Liquida | Agua de mar |
Sólido | Liquido | Sólida | Aleaciones ceras y parafinas |
Sólido | Sólido | gaseosa | Algunos humos finos |
COLOIDES: Cuando las partículas de la fase
dispersa de una mezcla miden entre 10 y 10000 veces mas que las
partículas de una disolución ( 1nm), se tiene un
sistema coloidal o coloide.
Todos los estados físicos de la materia pueden
formar mezclas coloidales, con excepción de los gases
mezclados con otros gases, los cuales forman disoluciones por que
se mezclan perfectamente.
Las características de los coloides
son:
- Las partículas de la fase dispersa son
mayores que las de una disolución y menores que las de
una suspensión. - En muchos sistemas coloidales resulta
difícil distinguir a simple vista la fase dispersa del
medio o fase dispersora. - Las partículas de la fase dispersa no se
sedimentan, a un cuando las mezclas se dejen en
reposo. - Las fases no se pueden separar por
filtración y son mezclas translucidas, es decir dejan
pasar la luz
parcialmente.
COLOIDES | |||
Fase dispersora | Fase dispersa | nombre | ejemplos |
Gas | Liquido | Aerosol liquido | Nube, aerosol para el |
Gas | Sólido | Aerosol sólido | Humo |
Liquido | Gas | Espuma | Merengue, espuma de |
Liquido | Liquido | Emulsión | Leche, mayonesa |
Liquido | Sólido | Sol liquido | Gelatina, gomita de |
Sólido | Gas | Espuma sólida | Malvavisco, piedra |
Sólido | Liquido | Emulsión | Quesos y mantequilla |
Sólido | Sólido | Sol liquido | Rubíes, perlas |
SUSPENSIONES: Las suspensiones son mezclas
heterogéneas en las que se aprecia fácilmente la
separación de fases. Casi todas las suspensiones
están formadas por una fase dispersa sólida,
insoluble en la fase dispersora liquida. Sus
características son:
- Las partículas son relativamente grandes y
por lo general, visibles - Las partículas de la fase dispersa
sedimentan cuando la suspensión se deja en reposo, por
lo que no están muy unidas al disolvente y la fuerza
de gravedad hace que se asienten. - Las partículas de una suspensión
pueden ser separadas del liquido mediante filtración,
lo que no ocurre en una disolución y un
coloide. - Las mezclas son traslucidas y opacas.
DISOLUCIONES SÓLIDAS
- Disoluciones sólidas donde el soluto es un
sólido - Disoluciones sólidas donde el soluto es un
liquido - Disoluciones sólidas donde el soluto es un
gas
DISOLUCIONES LIQUIDAS
- Disoluciones liquidas donde el soluto es un
sólido - Disoluciones liquidas donde el soluto es un
liquido - Disoluciones liquidas donde el soluto es un
gas
DISOLUCIONES GASEOSAS
- Disoluciones gaseosas donde el soluto es un
liquido - Disoluciones gaseosas donde el soluto es un
gas - Disoluciones gaseosas donde el soluto es un
sólido
DISOLUCIÓN Y
SOLUBILIDAD
El fenómeno de
la disolución
Cuando un terrón de azúcar
se introduce en un vaso lleno de agua, al cabo de un tiempo
parece, a primera vista, que se ha desvanecido sin dejar rastro
de su presencia en el líquido. Esta aparente
desaparición parece indicar que el fenómeno de la
disolución se produce a nivel molecular.
La disolución de un sólido supone la
ruptura de los enlaces de la red cristalina y la
consiguiente disgregación de sus componentes en el seno
del líquido. Para que esto sea posible es necesario que se
produzca una interacción de las moléculas del
disolvente con las del soluto, que recibe el nombre
genérico de solvatación. Cuando una
sustancia sólida se sumerge en un disolvente apropiado,
las moléculas (o iones) situadas en la superficie del
sólido son rodeadas por las del disolvente; este proceso
lleva consigo la liberación de una cierta cantidad de
energía que se cede en parte a la red cristalina y permite
a algunas de sus partículas componentes desprenderse de
ella e incorporarse a la disolución. La repetición
de este proceso produce, al cabo de un cierto tiempo, la
disolución completa del sólido. En algunos casos,
la energía liberada en el proceso de solvatación no
es suficiente como para romper los enlaces en el cristal y,
además, intercalar sus moléculas (o iones) entre
las del disolvente, en contra de las fuerzas moleculares de
éste.
Para que la energía de solvatación tome un
valor considerable es necesario que las interacciones entre las
moléculas del soluto y entre las del disolvente sean de la
misma naturaleza. Sólo así el fenómeno de la
solvatación es lo suficientemente importante como para dar
lugar por sí solo a la disolución del cristal. Ello
explica el viejo aforismo de que «lo semejante disuelve a
lo semejante». Los disolventes apolares como el agua son
apropiados para solutos polares como los sólidos
iónicos o los sólidos formados por moléculas
con una cierta polaridad eléctrica. Por su parte, los
disolventes apolares, como el benceno
(C6H6), disuelven las sustancias apolares
como las grasas.
Junto con los factores de tipo energético,
como los considerados hasta ahora, que llevan a un sistema
sólido/líquido a alcanzar un estado de menor
energía potencial, otros factores determinan el que la
disolución se produzca o no de forma espontánea.
Esta afirmación está respaldada por dos tipos de
fenómenos: en primer lugar la existencia de procesos de
disolución que implican una absorción moderada de
energía del medio, lo cual indica que el sistema
evoluciona hacia estados de mayor energía interna; en
segundo lugar sustancias apolares como el tetracloruro de carbono
(CCl4), aunque poco, se llegan a disolver en
disolventes polares como el agua.
Los procesos físico-químicos están
influidos, además, por el factor desorden, de modo
que tienden a evolucionar en el sentido en el que éste
aumenta. La disolución, sea de sólido en
líquido, sea de líquido en líquido, aumenta
el desorden molecular y por ello está favorecida.
Contrariamente, la de gases en líquidos, está
dificultada por el aumento del orden que conllevan. Del balance
final entre los efectos de ambos factores, el de energía y
el de desorden, depende el que la disolución sea o no
posible.
La solubilidad : Las sustancias no se disuelven
en igual medida en un mismo disolvente. Con el fin de poder comparar
la capacidad que tiene un disolvente para disolver un producto
dado, se utiliza una magnitud que recibe el nombre de
solubilidad. La capacidad de una determinada cantidad de
líquido para disolver una sustancia sólida no es
ilimitada. Añadiendo soluto a un volumen dado de
disolvente se llega a un punto a partir del cual la
disolución no admite más soluto (un exceso de
soluto se depositaría en el fondo del recipiente). Se dice
entonces que está saturada. Pues bien, la solubilidad de
una sustancia respecto de un disolvente determinado es la
concentración que corresponde al estado de
saturación a una temperatura dada.
Las solubilidades de sólidos en líquidos
varían mucho de unos sistemas a otros. Así a 20
ºC la solubilidad del cloruro de sodio (NaCl) en agua es 6 M
y en alcohol etílico (C2H6O), a esa
misma temperatura, es 0,009 M. Cuando la solubilidad es superior
a 0,1 M se suele considerar la sustancia como soluble en el
disolvente considerado; por debajo de 0,1 M se considera como
poco soluble o incluso como insoluble si se aleja bastante de
este valor de referencia.
La solubilidad depende de la temperatura; de ahí
que su valor vaya siempre acompañado del de la temperatura
de trabajo. En la
mayor parte de los casos, la solubilidad aumenta al aumentar la
temperatura. Se trata de procesos en los que el sistema absorbe
calor para apoyar con una cantidad de energía extra el
fenómeno la solvatación. En otros, sin embargo, la
disolución va acompañada de una liberación
de calor y la solubilidad disminuye al aumentar la
temperatura.
PROPIEDADES DE LAS
DISOLUCIONES
La presencia de moléculas de soluto en el seno de
un disolvente altera las propiedades de éste. Así,
el punto de fusión y el de ebullición del
disolvente cambian; su densidad aumenta, su comportamiento
químico se modifica y, en ocasiones, también su
color. Algunas de
estas propiedades de las disoluciones no dependen de la
naturaleza del soluto, sino únicamente de la
concentración de la disolución, y reciben el nombre
de propiedades coligativas.
Las disoluciones y los cambios de
estado
Entre las propiedades coligativas de las disoluciones se
encuentra el aumento del punto de ebullición y la
disminución del punto de congelación con respecto a
los valores
propios del disolvente puro. Este aumento del rango de
temperaturas correspondiente al estado líquido, fue
descrito por el físico-químico francés
François Marie Raoult (1830-1901), quien
estableció que las variaciones observadas en los puntos de
ebullición y de congelación de una
disolución eran directamente proporcionales al cociente
entre el número de moléculas del soluto y el
número de moléculas del disolvente, o lo que es lo
mismo, a la concentración molal.
La interpretación de esta ley en
términos moleculares es la siguiente: la presencia de
moléculas de soluto no volátiles en el seno del
disolvente dificulta el desplazamiento de las moléculas de
éste en su intento de alcanzar, primero, la superficie
libre y, luego, el medio gaseoso, lo que se traduce en un aumento
del punto de ebullición. Análogamente, las
moléculas de soluto, por su diferente tamaño y
naturaleza, constituyen un obstáculo para que las fuerzas
intermoleculares, a temperaturas suficientemente bajas, den lugar
a la ordenación del conjunto en una red cristalina, lo que
lleva consigo una disminución del punto de
congelación.
Osmosis y presión osmótica: Cuando
dos líquidos miscibles se ponen en contacto, el movimiento
asociado a la agitación térmica de sus
moléculas termina mezclando ambos y dando lugar a un
sistema homogéneo. Este fenómeno físico se
conoce con el nombre de difusión.
Las membranas semipermeables se caracterizan porque,
debido al tamaño de sus poros, cuando se sitúan
como límite de separación entre una
disolución y su disolvente correspondiente, permiten el
paso de las moléculas de disolvente, pero no las de soluto
solvatadas, cuyo tamaño es mayor. Se produce entonces
entre ambos sistemas una difusión restringida que se
denomina ósmosis.
La ósmosis se caracteriza porque el intercambio
de moléculas en uno y otro sentido no se produce a igual
velocidad. Ello es debido a que el número de
moléculas de disolvente que choca con la membrana por
unidad de superficie, es mayor del lado del disolvente puro que
del lado de la disolución, en donde la presencia de
moléculas de soluto entorpece el proceso.
Hay, por tanto, una presión de fluido que se
ejerce del disolvente hacia la disolución y que recibe el
nombre de presión osmótica. La
presión osmótica, p, de una disolución
depende de su concentración y se atiene a una ley
semejante a la de los gases perfectos. Dicha ley fue establecida
por Van't Hoff en 1897 y se expresa en la forma:
p V = n R T
o lo que es lo mismo:
![]()
siendo M la concentración molar, R
la constante de los gases y T la temperatura absoluta de
la disolución.
A partir de la medida de la presión
osmótica se puede determinar la masa molecular del soluto;
la ley de Van't Hoff permite calcular el número de moles
n, empleando como datos los
resultados de las medidas de , de T y del volumen V
de la disolución. La masa del soluto se determina
inicialmente con la balanza, y un cálculo
del tipo:
![]()
proporciona una estimación de la masa de las
moléculas de soluto.
LA COMPOSICIÓN DE LA DISOLUCIONES
La concentración de una disolución
Las propiedades de una disolución dependen de la
naturaleza de sus componentes y también de la
proporción en la que éstos participan en la
formación de la disolución. La curva de
calentamiento de una disolución de sal común en
agua, cambiará aunque sólo se modifique en el
experimento la cantidad de soluto añadido por litro de
disolución. La velocidad de una reacción
química que tenga lugar entre sustancias en
disolución, depende de las cantidades relativas de sus
componentes, es decir, de sus concentraciones. La
concentración de una disolución es la cantidad de
soluto disuelta en una cantidad unidad de disolvente o de
disolución.
Formas de expresar la concentración: Existen
diferentes formas dé expresar la concentración de
una disolución. Las que se emplean con mayor frecuencia
suponen el comparar la cantidad de soluto con la cantidad total
de disolución, ya sea en términos de masas, ya sea
en términos de masa a volumen o incluso de volumen a
volumen, si todos los componentes son líquidos. En este
grupo se
incluyen las siguientes:
Molaridad. Es la forma más frecuente de expresar
la concentración de las disoluciones en química.
Indica el número de moles de soluto disueltos por cada
litro de disolución; se representa por la letra M. El
cálculo de la molaridad se efectúa determinando
primero el número de moles y dividiendo por el volumen
total en litros:
![]()
Na3PO4
Ca(OH)*5 H2O
Cu(NO3)2
HCO3
Al2(SO4)3
K2Cr2O7
KMnO4
NH4
AuCl3
Cu(NO3)2
SnF2
NO2
- calcula el numero de moles de 100 grs de los
siguientes compuestos - cuantos gramos de soluto se necesitan para preparar 1
lt de solución 1M de AlCl2 * 6
H2O - Como prepararías una solución 1 molar
de H2SO4 - si tenemos una solución de CaI2 y
sabemos que hay 58.8 grs. Del compuesto por litro, ¿
cual es la molaridad? - cuantos gramos de soluto por litro tiene una
solución 2M de NaNO3 - Para preparar un litro de disolución de
ácido sulfúrico ¿ cuanta agua y cuanto
ácido deben combinar? - cuantos gramos AgNO3 , se deberán
llevar a un litro de solvente para tener una solución 10
molar - que concentración molar tiene una
solución que se preparo disolviendo 200 grs. De
K2Cr2O7 y se aforo aun
litro.0.432 g de NaOH en 0.75 litros de
solución12 g. De AlCl3 * 6 H2O
por litro de disolución18 g de AgNO3 por litro de
disolución432 x 10-3g. De 98 ml de
solución51482 g. De KCN en 1.875 litros de
disolución - calcular la molaridad:
- ¿ cuantos moles de HCl hay en 1.5 lt de una
disolución 2 M ?¿ Cuantos gramos de ácido
clorhidrico? - como se prepararian 300 cm3 de una
disolución 2.2. M de AlCl3 - cuantos gramos de soluto se requieren para preparar 1
litro de solución 1M de
Pb(NO3)2 - cual es la concentración molar de una
solución que contiene 16 g de CH3 OH en 200
ml de solución - cuanto (NH4)2SO4 se
necesita para preparar 400 ml de una solución 0.25
M
Normalidad: la normalidad de una solución ( N) es
el numero de equivalentes gramo de soluto contenidos en un litro
de solución. El peso equivalente es la fracción del
peso molecular que corresponde a una unidad definida de
reacción química, y un equivalente gramo es esa
misma fracción de un mol. Los pesos equivalentes se
determinan de la siguiente manera:
Para obtener el equivalente químico de un
ácido, se divide la masa molecular de ese ácido
entre el numero de hidrógenos ionizables que tenga la
formula del ácido.
Para obtener el equivalente químico de una base
se divide la masa molecular del hidróxido entre el numero
de iones oxidrilo que contiene la formula.
Para encontrar el equivalente químico de una sal
se divide la masa molecular entre el numero de oxidación
que tenga el catión.
Para obtener el equivalente químico de sustancias
reductoras, donde se presenta una reacción de oxido
– reducción, se divide la masa molecular entre el
numero de electrones que se han ganado o perdido en la
reacción
N=Eqg/V
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |