Modelo atómico de
Bohr
El modelo de Bohr
es muy simple y recuerda al modelo planetario de
Copérnico, los planetas
describiendo órbitas circulares alrededor del
Sol.
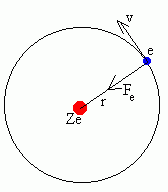
El electrón de un átomo o
ión hidrogenoide describe también órbitas
circulares, pero los radios de estas órbitas no pueden
tener cualquier valor.
Consideremos un átomo o ión con un solo
electrón. El núcleo de carga Ze es
suficientemente pesado para considerarlo
inmóvil,
| Si el electrón describe una órbita
|
En el modelo de Bohr, solamente están permitidas
aquellas órbitas cuyo momento angular está
cuantizado.

n es un número entero que se denomina
número cuántico, y h es la constante de
Planck 6.6256·10-34 Js
Los radios de las órbitas permitidas
son

donde a0 se denomina radio de Bohr.
a0 es el radio de la órbita del
electrón del átomo de Hidrógeno Z=1 en su estado
fundamental n=1.
La energía total es:

En una órbita circular, la energía total
E es la mitad de la energía potencial
![]()
La energía del electrón aumenta con el
número cuántico n.
La primera energía de excitación es la que
lleva a un átomo de su estado fundamental a su primer (o
más bajo) estado excitado. La energía del estado
fundamental se obtiene con n=1, E1=
-13.6 eV y la del primer estado excitado con n=2,
E2=-3.4 eV. Las energías se suelen
expresar en electrón-voltios (1eV=1.6 10-19
J)
La frecuencia f de la radiación
emitida cuando el electrón pasa del estado excitado
E2 al fundamental E1
es
![]()
El Átomo de Hidrógeno contiene un
electrón y un núcleo que consiste de un sólo
protón. · El electrón del átomo de
Hidrógeno puede existir solamente en ciertas
órbitas esféricas las cuales se llaman niveles o
capas de energía.
Estos niveles de energía se hallan dispuestos
concentricamente alrededor del núcleo. Cada nivel se
designa con una letra (K, L, M, N,…) o un valor de n (1, 2, 3,
4,…).
- El electrón posee una energía definida
y característica de la órbita en la cual se
mueve. Un electrón de la capa K (más cercana al
núcleo) posee la energía más baja posible.
Con el aumento de la distancia del núcleo, el radio del
nivel y la energía del electrón en el nivel
aumentan. El electrón no puede tener una energía
que lo coloque entre los niveles permitidos. - Un electrón en la capa más cercana al
núcleo (Capa K) tiene la energía más baja
o se encuentra en estado basal. Cuando los átomos se
calientan, absorben energía y pasan a niveles
exteriores, los cuales son estados energéticos
superiores. Se dice entonces que los átomos están
excitados. - Cuando un electrón regresa a un Nivel inferior
emite una cantidad definida de energía a la forma de un
cuanto de luz. El cuanto
de luz tiene una longitud de onda y una frecuencia
características y produce una línea espectral
característica. - La longitud de onda y la frecuencia de un
fotón producido por el paso de un electrón de un
nivel de energía mayor a uno menor en el átomo de
Hidrógeno esta dada por: - Para Bohr el átomo sólo puede existir
en un cierto número de estados estacionarios, cada uno
con una energía determinada. - La energía sólo puede variar por saltos
sucesivos, correspondiendo cada salto a una transición
de un estado a otro. En cada salto el átomo emite luz de
frecuencia bien definida dada por:
hv = | Ei – Ei |
De esta manera se explican los espectros
atómicos, que en el caso del Hidrógeno los niveles
de energía posibles están dados por la
fórmula:

El modelo de Niels Bohr,
coincide con el propuesto por Rutherford, admite la presencia de
un núcleo positivo que contiene, prácticamente,
toda la masa del átomo, donde se encuentran presentes los
protones y los neutrones.
Los electrones con carga negativa, se mueven alrededor
del núcleo en determinados niveles de energía, a
los que determinó estados estacionarios, y les
asignó un número entero positivo. El nivel
más cercano tiene el número 1, le sigue el 2, como
se citó en párrafo
de éste mismo enunciado (Modelo atómico de
Bohr).
Siempre que el electrón se mantenga en la
órbita que le corresponde, ni gana ni pierde
energía.
La evolución de los modelos
físicos del átomo se vio impulsada por los datos
experimentales. El modelo de Rutherford, en el que los electrones
se mueven alrededor de un núcleo positivo muy denso,
explicaba los resultados de experimentos de
dispersión, pero no el motivo de que los átomos
sólo emitan luz de determinadas longitudes de onda
(emisión discreta).
Bohr partió del modelo de Rutherford pero
postuló además que los electrones sólo
pueden moverse en determinadas órbitas; su modelo
explicaba ciertas características de la emisión
discreta del átomo de hidrógeno, pero fallaba en
otros elementos.
Freddy G, Suárez F, Química
Editorial Romor, 1º Ciclo diversificado,
1997.
Mayor serrano de Benítez y José
Fabián Zonella, Química editorial
Larenze, 1º ciclo diversificado 1987.
Wilian I. Mantecton, Emil Slowinski.
Química Superior, Tercera edición, Editorial
Interamericana.
http://www.monografias.com/trabajos14/modelo-atomico/modelo-atomico.shtml#BOHR
Enviado por:
Douglas Alfredo Dominguez Ruiz
Instituto Universitario Pedagógico
"Monseñor Arias Blanco"
Caricuao – Caracas
República Bolivariana de Venezuela
Ministerio de Educación y
Deporte
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |