Las troponinas cardiacas (cTn) son proteínas que
forman parte de los mecanismos de regulación de la
contracción del músculo cardiaco, están
presentes en las fibras miocárdicas. Las isoformas
cardiacas específicas son: Troponina T cardiaca (cTnT) y
Troponina I cardiaca (cTnI), que pueden ser medidas en el
Laboratorio utilizando sistemas inmunoenzimáticos. La cTnT
fue descrita en 1989 y la cTnI en 1992, y en la actualidad son
consideradas el estándar de oro dentro de los marcadores
bioquímicos para el diagnóstico del daño
miocárdico, arrebatándole el título a la
CK-MB la cuál no tiene un papel
pronóstico para los pacientes con síndrome agudo
coronario. La cTnT aparece en el plasma en casos de isquemia o
muerte tisular, con una especificidad del 98% para el infarto
agudo al miocardio; es un marcador temprano, que refleja datos sobre la
extensión y evolución del mismo, también se
utiliza en el diagnóstico de microinfartos en pacientes
con angina inestable y en la monitorización de la
fibrinolisis. (1, 2)
DESARROLLO
BIOQUÍMICA DEL
MÚSCULO ESTRIADO
El tejido muscular es el responsable de los
movimientos del organismo. Se caracteriza por presentar agregados
de células especializadas alargadas y dispuestas en forma
paralela, cuya principal función es
la contracción. Con la contracción celular se
asocian dos tipos de filamentos: finos (6-8 nm de
diámetro), compuestos principalmente por actina y gruesos
(aproximadamente 15 nm de diámetro), compuestos
principalmente por miosina.
El músculo se clasifica según el aspecto
de las células contráctiles en: Músculo
estriado y Músculo liso. A su vez el tejido muscular
estriado, se subdivide según su localización en
músculo esquelético (unido al hueso),
músculo estriado visceral (tejidos blandos)
y músculo cardiaco (corazón).
En el músculo estriado cada célula
muscular (fibra muscular), forma un sincicio multinucleado; por
fusión
de pequeñas células musculares individuales, los
mioblastos, durante el desarrollo.
Los núcleos de la fibra muscular se localizan
inmediátamente por debajo de la membrana plasmática
o sarcolema.
El tejido conectivo que rodea cada una de las fibras
musculares y a los haces de fibras, es esencial para la
transducción de fuerzas. El endomisio es una delicada capa
de fibras reticulares que rodea a cada fibra muscular, el
perimisio es una capa gruesa de tejido conectivo que rodea a un
grupo de
fibras formando un haz o fascículo y el epimisio que es la
vaina de tejido conectivo que rodea el conjunto de
fascículos que forman el músculo. (3)
Las fibras de músculo se clasifican en rojas,
blancas e intermedias de acuerdo a su diámetro, contenido
de mioglobina, citocromos y mitocondrias.
Las fibras rojas son de diámetro pequeño y
contienen gran cantidad de mioglobina y de citocromos y numerosas
mitocondrias, que se disponen en filas entre las miofibrillas y
en acúmulos por debajo del sarcolema; estas se contraen
más lentamente. Las fibras blancas son de diámetro
mayor, poseen menor cantidad de mioglobina, citocromos y
mitocondrias que se disponen de preferencia, entre las
miofibrillas, a nivel de la banda I, estas se contraen
rápidamente. Las fibras intermedias tienen tamaño
mediano y contienen pigmentos y mitocondrias en cantidad
intermedia entre fibras rojas y blancas. (3, 4)
La subunidad estructural y funcional de la fibra
muscular es la miofibrilla. Las fibras musculares están
formadas por estas subunidades, dispuestas en forma longitudinal.
Las miofibrillas se componen de haces de miofilamentos que son
polímeros filamentosos individuales de miosina (filamentos
gruesos) y de actina y sus proteínas asociadas:
tropomiosina y troponina (filamentos finos). Son los elementos
contráctiles del músculo estriado. Los haces de
miofilamentos que componen la miofibrilla están rodeados
por retículo endoplásmico liso, denominado
retículo sarcoplasmático, alineado en forma precisa
con respecto al patrón de bandeo de las
miofibrillas.
Las estriaciones transversales son la principal característica histológica del
músculo estriado, que se evidencian como bandas claras y
obscuras alternas que se denominan banda A, banda I y
línea Z (zona densa que divide en dos a la banda I).
Existen además una zona H (que divide en dos a la banda A)
y la línea M que se puede ver a la mitad de la banda H. En
la zona de unión de la banda A con la banda I el
retículo sarcoplásmico se expande para formar las
cisternas terminales. Las dos cisternas terminales paralelas se
asocian estrechamente a un tubo transverso (T), formando un
complejo denominado triada. La contracción de una fibra
muscular requiere de la contracción simultánea de
todas sus miofibrillas. La forma y distribución del sistema T permite
que la onda de despolarización, responsable de la
contracción muscular, se distribuya rápidamente
desde la superficie celular hacia el interior del citoplasma
alcanzando a cada miofibrilla.
El sarcómero es la unidad estructural y funcional
de las células musculares estriadas. El análisis de la estructura y
composición del sarcómero, permite entender el
mecanismo de contracción de las fibras musculares
estriadas, basado en el deslizamiento de los miofilamentos
gruesos sobre los miofilamentos finos. Los filamentos gruesos
formados principalmente por miosina se localizan a lo largo de la
banda A y los filamentos finos corresponden a microfilamentos de
F-actina; estos se anclan en la línea Z, luego cursan a lo
largo de la banda I y penetran en la banda A, donde corren
paralelos a los filamentos gruesos, terminando a nivel de la
banda H que contiene solo filamentos gruesos. En la banda A se
observan puentes que se extienden desde los filamentos gruesos
hacia los finos y que corresponden a las cabezas de las
moléculas de miosina. A nivel de la línea M cada
filamento grueso se asocia a 6 filamentos finos adyacentes, a
través de puentes proteicos dispuestos
radialmente.
Durante el proceso de
contracción los filamentos finos de los sarcómeros
adyacentes son empujados hacia el centro de la banda A, lo que
produce el acortamiento del sarcómero. Como consecuencia
de este proceso, se oblitera la banda H y disminuye la longitud
de la banda I, sin que se modifique la longitud de la banda A. El
grado de traslapamiento entre los filamentos gruesos y finos
explica este fenómeno. (3,4)
ESTRUCTURA
MOLECULAR DE LOS MIOFILAMENTOS Y SUS INTERACCIONES
Estructura molecular de los miofilamentos
gruesos
La miosina constituye la principal proteína del
filamento grueso. La molécula de miosina está
formada por 2 cadenas polipeptídicas de 220 KD cada una
(cadenas pesadas) y por 4 polipéptidos de 20 KD cada uno
(cadenas livianas). Está organizada en tres dominios
estructuralmente y funcionalmente distintos: cabeza, cuello y
cola. En el extremo amino terminal las dos cadenas pesadas
presentan una estructura globular, llamada cabeza, la que se
continua en una zona con forma de bastón, de unos 150 nm
de largo, cuya porción inicial corresponde al cuello de la
molécula y el resto a la cola.
En el músculo estriado, cada filamento grueso es
una estructura bipolar formada por la asociación
antiparalela de alrededor de 300 a 400 moléculas de
miosina. La región central del filamento está
compuesta de un conjunto de colas dispuestas en forma traslapada
y antiparalela. Los filamentos gruesos son simétricos a
nivel de la región central y su polaridad se revierte a
ambos lados de esta zona. Las cabezas protuyen del filamento en
un ordenamiento helicoidal a intervalos de 14 nm.
En la molécula de miosina existen dos sitios que
pueden experimentar cambios conformacionales: uno a nivel de la
unión de la cabeza con la cola y otro a nivel del sitio en
que el inicio de la cola se une al cuello de otras
moléculas de miosina. Estas modificaciones se relacionan
con las interacciones que establece la miosina con ATP y
G-actina.
Los filamentos gruesos contienen otras proteínas,
estas son proteína C (peso molecular de 140 KD) que se
fija fuertemente a la cola de la miosina y está enrollada
alrededor del filamento grueso a intervalos regulares. Puede
servir para sujetar juntos a los filamentos del haz y la
proteína de la línea M, que fija las
moléculas de miosina de un filamento grueso a nivel de la
línea M. (4,5)
Estructura molecular de los miofilamentos
delgados
Estos están formados por actina, tropomiosina y
troponinas, proteínas que se relacionan directamente con
el proceso de acortamiento del sarcómero. (Fig.1) La
actina es una proteína; en ausencia de sales adopta una
forma globular (actina G), con un peso molecular de 47 KD, si se
añade ATP forma dímeros y en presencia de KCl 0.1 M
y ATP se polimeriza para dar fibras de actina F.
Fig. 1 Miofilamento delgado

http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu31749.html
Los microfilamentos de actina están constituidos
por dos hebras proteicas, que se enrollan para formar una
estructura helicoidal doble. Cada hebra corresponde a un
polímero de moléculas asimétricas de G
actina, lo que otorga a los microfilamentos de actina una
polaridad definida.
La tropomiosina ( peso molecular de 64 KD) está
constituída por dos subunidades, con forma de
bastón, de alrededor de 40 nm de longitud, son dos cadenas
hélice idénticas, que se enrollan una con respecto
a la otra para formar filamentos que corren a lo largo de ambos
bordes del microfilamento de la F-actina.
La troponina es una gran proteína globular
consiste de un complejo formado por tres subunidades, que se
disponen en forma discontinua a lo largo del microfilamento. El
complejo está formado por TnT, que se une fuertemente a la
tropomiosina, TnC (18 KD) que une iones calcio y TnI (23 KD) que
se une a la actina. En los filamentos finos cada molécula
de tropomiosina recorre siete moléculas de G-actina y
tiene un complejo de troponina unido a su superficie.
(4,5)
Las 2 cadenas de actina F, compuesta cada una por
monómeros de actina G, están enrolladas entre
sí formando los filamentos delgados. (4,5)
El músculo cardiaco (Fig. 2) está
formado por células musculares ramificadas, que poseen uno
o dos núcleos y que se unen entre sí a
través de discos intercalares. (Fig. 3)
Los discos intercalares son los sistemas de unión
que asocian a las células musculares cardiacas para formar
las fibras del miocardio, estas estructuras se
encuentran en regiones de la membrana donde los extremos de dos
células se enfrentan y se ubican en lugar de un disco Z.
Los discos intercalares presentan una porción transversa,
en la cual se ubican dos tipos de uniones intercelulares: la
fascia adherens es un tipo de unión propia del
corazón, su estructura es semejante a la de las zonas de
adhesión de los epitelios. Estas estructuras anclan
filamentos de actina a la membrana plasmática y
también unen las membranas de células adyacentes;
de esta manera se asocian el aparato contráctil de cada
célula con el de la célula
vecina y la mácula adherens corresponde a desmosomas
típicos que se ubican en las porciones transversas y
paralelas del disco, anclan filamentos intermedios de la fibra
cardiaca y participan junto con la fascia adherens, en la
adhesión de las membranas plasmáticas de
células vecinas.
Las uniones de comunicación (nexos o gap junctions),
corresponden a sitios que permiten el paso de iones y
moléculas pequeñas desde el citoplasma de una
célula a la célula vecina.
Fig. 2 Músculo cardiaco Fig.
3 Discos Intercalares


http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu33325.html
A diferencia del músculo esquelético, las
fibras musculares cardiacas corresponden a un conjunto de
células cardiacas unidas entre sí en
disposición lineal. Las células musculares
cardiacas, tienen el núcleo ubicado al centro del
citoplasma y presentan estriaciones transversales, similares a
las del músculo esquelético. El retículo
sarcoplásmico no es muy desarrollado y se distribuye
irregularmente entre las miofibrillas, que no aparecen claramente
separadas. Sin embargo, las mitocondrias que son muy numerosas,
están distribuidas regularmente dividiendo a las
células cardiacas en miofibrillas aparentes. Las
células están rodeadas por una lámina
externa, comparable a la lámina basal de los
epitelios.
Estructuralmente, las miofibrillas del músculo
cardiaco, son iguales a las del músculo
esquelético. Los túbulos T del músculo
cardiaco son de mayor diámetro que los del músculo
esquelético y se ubican a nivel del disco Z. Los
túbulos se asocian generalmente con una sola
expansión de las cisternas del retículo
sarcoplásmico. La característica del músculo
cardiaco son las diadas, compuestas de un túbulo T y de
una cisterna del retículo sarcoplásmico.
(4)
El músculo cardiaco se contrae de forma
involuntaria como el músculo liso. En el corazón
existen unas fibras especializadas que producen potenciales de
acción espontáneamente, a una frecuencia de 60 por
minuto aproximadamente. Estos potenciales de acción se
propagan a las demás fibras a través de conexiones
eléctricas que comunican a todas las fibras del
corazón. En el corazón existe inervación
simpática que acelera la contracción y
parasimpática que la vuelve lenta.
Los músculos transforman la energía
química
del ATP en fuerza o
movimiento. En
el músculo existen filamentos finos (formados por actina,
troponina y tropomiosina) y filamentos gruesos (formados por
miosina) que forman haces que se entrelazan entre sí.
(Fig. 4)
Fig. 4 Filamentos finos y gruesos

http://www.uam.es/personal_pdi/medicina/algvilla/cyta/cont.html
Cuando llega un potencial de acción por los
axones de los nervios motores se libera
el neurotransmisor acetilcolina en las sinapsis de estos axones
con las fibras musculares. La acetilcolina se une a receptores,
que producen un potencial de acción en la fibra muscular
estimulando la liberación de calcio desde las cisternas
del retículo sarcoplásmico. El calcio liberado se
une a la troponina de los filamentos finos lo que modifica la
posición de la tropomiosina que descubre la región
de la actina en la que esta proteína se puede unir con la
miosina. La miosina se une con la actina, y establece puentes
entre los filamentos finos y gruesos haciendo que estos se
deslicen entre sí, lo que produce acortamiento de la fibra
muscular.(Fig.5) El calcio es rápidamente recaptado por
las cisternas del retículo sarcoplásmico y la fibra
muscular se relaja. (6)
Fig. 5 Mecanismo de la contracción en el
músculo esquelético

http://www.uam.es/personal_pdi/medicina/algvilla/cyta/cont.html
BASES MOLECULARES DE
LA CONTRACCIÓN MUSCULAR
La cabeza de miosina que carece de un nucleótido
unido, se encuentra estrechamente unida al filamento de actina.
La unión de ATP a la cabeza de la miosina, reduce la
afinidad de esta por la actina. La hidrólisis parcial del
ATP (durante la cuál ADP + Pi permanecen unidos a la
miosina), activa la cabeza de la miosina que experimenta un
cambio conformacional y se desplaza respecto del filamento fino.
La miosina activada hace contacto con una molécula de
actina y se une a ella produciéndose liberación de
Pi. Una vez unida a la actina, la miosina experimenta un nuevo
cambio conformacional que se traduce en desplazamiento del
filamento fino y en la liberación de ADP. De esta manera
cada cabeza de miosina se desplaza hacia el extremo positivo del
filamento fino adyacente. Mientras la concentración de
calcio sea alta y exista ATP disponible, los ciclos de
formación de puentes actina-miosina continúan y el
sarcómero se contrae. En ausencia de ATP el complejo
actina-miosina se estabiliza. (4)
La contracción muscular está
regulada por variaciones en los niveles citosólicos de
Ca++ , lo que afectan las interacciones entre las
cabezas de miosina y los filamentos de actina a través de
las dos proteínas accesorias asociadas a la actina en el
filamente fino: tropomiosina y troponina.
En el músculo en reposo la concentración
citosólica de Ca++ es de 10-7 M, la
miosina no puede asociarse a la actina debido a que los sitios de
unión para las cabezas de miosina en la G-actina,
están bloqueados por la tropomiosina. Al aumentar las
concentraciones citosólicas de Ca++ a
10-5 M, la subunidad TnC de la troponina une
Ca++, produciéndose un cambio conformacional en
la molécula de troponina y el desplazamiento de la
molécula de tropomiosina hacia la parte más
profunda de la hendidura de la hélice de la actina. Como
resultado, los sitios en la G-actina, capaces de interactuar con
las cabezas de la miosina quedan libres.
Las variaciones en las concentraciones de
Ca++, se producen en respuesta a los estímulos
nerviosos que inducen la contracción muscular y que
actúan desencadenando la liberación de
Ca++ desde el retículo sarcoplásmico
hacia el citosol. (4)
PRUEBAS QUE SE
UTILIZAN PARA DIAGNOSTICAR UN INFARTO AGUDO AL MIOCARDIO
(IAM)
Electrocardiograma (ECG)
Es el primer auxiliar del que disponemos y aunque con
limitaciones, es de indudable valor. Tomado
aisladamente puede tener baja sensibilidad para IAM en las
primeras horas, en el que puede no ser diagnóstico en el
50% de los casos. Es bueno recordar que este es el tiempo en el que
por lo general se tienen que tomar decisiones, a pesar de no
tener una seguridad mayor,
que solo se basen en la clínica y en el trazado.
También tomado aisladamente es el primero en diagnosticar
IAM en las primeras tres horas, luego de las cuales es mayor la
sensibilidad de las enzimas, y aún mayor si se combinan.
(7)
El electrocardiograma (ECG) mide y registra la actividad
eléctrica del corazón. Es el primer paso
diagnóstico a realizar y ante la sospecha de un infarto,
el paciente se monitoriza de forma continua con un ECG. Es
útil tanto para determinar la gravedad del problema como
para el tratamiento óptimo inmediato. También es
muy importante el papel que desempeña en otras situaciones
graves. La activación eléctrica secuencial del
músculo cardiaco da lugar a las ondas P, QRS y T
en el ECG. La onda P representa la despolarización
auricular, el complejo QRS representa la despolarización
ventricular, y la onda T, representa la repolarización
ventricular. El patrón electrocardiográfico
más importante y que determina el tratamiento en un
infarto es el denominado "elevación del ST y onda
Q".
La elevación del segmento ST indica que la
arteria de una zona del miocardio está obstruida y el
músculo cardíaco está sufriendo. En muchos
pacientes, esto evoluciona a un infarto completo, lo que se
denomina médicamente "infarto de miocardio con onda Q". La
elevación del segmento ST (la fase entre la
despolarización y repolarización ventricular) es un
buen indicador para la realización de tratamientos
agresivos (fármacos trombolíticos o angioplastia)
para reabrir los vasos sanguíneos. En algunos casos, sin
embargo, los pacientes con un ST elevado presentarán solo
un "infarto de miocardio sin onda Q o infarto no Q", lo cual,
generalmente, reviste menores consecuencias.
El segmento ST no elevado indica una obstrucción
parcial de la arteria y ocurre en alrededor de la mitad de los
pacientes con otros signos de enfermedad cardiaca. En estos
casos, las pruebas de laboratorio son necesarias para determinar
la extensión, si existe, de lesión cardiaca. En
general, se pueden dar una de las tres situaciones
siguientes:
Angina (los resultados de los análisis de
sangre u otras
pruebas no muestran graves alteraciones y el dolor en el pecho
ser resuelve). La mayoría de los pacientes con angina
pueden volver a casa.
Angina inestable (los análisis de sangre no
muestran marcadores positivos de infarto pero el dolor en el
pecho persiste). La angina inestable es potencialmente
grave.
Infarto no Q (los análisis de sangre sugieren que
se ha producido un infarto pero, en muchos casos, la
lesión en las arterias es menos grave que en un infarto
completo).
La angina inestable y el infarto no Q son dos formas de
lo que se denomina conjuntamente Síndrome coronario
agudo, porque se tratan de manera diferente que un infarto
establecido. La depresión
del segmento ST representa un problema potencial muy grave.
(8)
Marcadores en sangre
Se trata de otro gran auxiliar para el
diagnóstico de IAM en las primeras horas. Casi todas
tienen gran sensibilidad y especificidad, pero también
tienen limitaciones.
Cuando las células cardíacas se
dañan, liberan diferentes enzimas y otras moléculas
en el torrente sanguíneo. Los niveles elevados de estos
marcadores de lesión cardiaca en sangre pueden ayudar a
predecir el infarto en pacientes con dolor torácico
importante. Algunos de estos factores incluyen a los
siguientes:
Troponinas. Las llamadas Troponina I y troponina T se
liberan cuando se lesiona el músculo cardíaco.
Ambas son la mejor prueba diagnóstica que indica un
infarto de miocardio. Troponina T: es un marcador
específico del músculo cardíaco; es de
fácil acceso a la información por el método
rápido, pero para el diagnóstico de IAM tiene los
mismos inconvenientes en cuanto a que no es un marcador
más temprano. Contrariamente a otras enzimas ofrece
información adicional que es útil a la hora de
evaluar la repercusión del dolor torácico.
Ajustando el umbral de dosificación (0,1 mg/ml) se puede
detectar daño celular en pacientes con angina inestable,
aún en aquellos que no sufrieron IAM, este dato es de
singular importancia ya que permite descubrir el posible origen
isquémico en pacientes con dolor torácico
atípico. El otro gran aporte que hace este marcador es que
es un excelente indicador pronóstico per se desde
la primera dosificación, estratificando riesgos de
eventos
fatales a los 30 días.
Creatin quinasa (CK-MB). La CK-MB ha sido el marcador
estandar, pero no el más preciso ya que sus niveles
elevados pueden aparecer en personas sin daño
cardíaco. Ciertas formas de CK-MB puede mejorar la
especificidad de esta prueba en la lesión
cardiaca.
Mioglobina. La mioglobina es una proteína que se
encuentra en el músculo cardíaco. Se libera
precozmente en el corazón dañado y puede ser
útil en combinación con las CK-MB y las
troponinas.
Fibrinógeno. El fibrinógeno es una
proteína involucrada en la coagulación
sanguínea.
Proteína C reactiva. La proteína C
reactiva es un producto del
proceso inflamatorio. Los marcadores que muestran una respuesta
inflamatoria intensa en pacientes con angina inestable pueden ser
importantes indicadores
para realizar un tratamiento agresivo. (7,8)
Angiografía
La angiografía es una prueba invasiva que puede
realizarse en los pacientes que tienen una angina muy
incapacitante y que no responde a tratamiento
médico.
Se inserta un tubo muy estrecho en una arteria,
normalmente en la pierna o el brazo, y el tubo se desliza hasta
las arterias coronarias.
Se inyecta una sustancia de contraste en un tubo y una
radiografía registra su recorrido por las
arterias.
Este proceso ofrece un mapa de la circulación
coronaria, lo que revela cualquier área
obstruida.
De gran importancia es un estudio que indicó que
las mujeres con dolor torácico pueden tener angiogramas
normales pero continuar teniendo evidencia de enfermedad
coronaria si se realizaban otras pruebas.
Técnicas de imagen
Ecocardiograma. Los ecocardiogramas son
útiles en los pacientes con sospecha de infarto de
miocardio; es particularmente importante en el diagnóstico
de la lesión del músculo cardíaco y la
insuficiencia cardiaca congestiva.
Resonancia magnética. Las mejoras de
software
informático de técnicas
de resonancia magnética, que no es radiactiva, hacen que
esta prueba actualmente nos facilite información muy
fiable sobre el flujo de sangre arterial, incluyendo aquellos
vasos sanguíneos tan pequeños que no se pueden
detectar mediante la angiografía. (8)
MARCADORES
BIOQUÍMICOS DE DAÑO
MIOCÁRDICO
Historia de los marcadores
de daño miocárdico: GOT/AST primera vez
descrito en 1954; CK en los 60’s; mioglobina y LDH en los
70’s; a principios de los
80’s CK-MB. Características de un marcador ideal: 1.
tener suficiente especificidad como para permitir un
diagnóstico de daño miocárdico aún
con la coexistencia de daño muscular; 2. ser altamente
sensible como para detectar un daño miocárdico
intermedio; 3. ser liberado rápidamente del miocardio
dañado; 4. aparecer en cantidades proporcionales a la
extensión del daño; 5. permanecer en el plasma
durante horas, para dejar una ventana diagnóstica; 6. ser
fácil de medir técnicamente. (13)
Cuando se necrozan las células del tejido
miocárdico pierden la integridad de la membrana celular y
las macromoléculas intracelulares difunden hacia la micro-
circulación y a los linfáticos. Eventualmente estas
macro moléculas se detectan en la circulación
periférica y constituyen los marcadores bioquímicos
que nos permiten establecer el diagnóstico y
cuantificación del IAM. Nuevos marcadores de daño
miocárdico como las sub-formas de la CK-MB, las Troponinas
I y T, la mioglobina han adquirido gran popularidad.
Tradicionalmente se emplea en el diagnóstico de IAM la
determinación de CPK, LDH y AST.
Elevaciones seriadas de la Creatin-fosfokinasa y de la
fracción MB han sido utilizadas para el diagnóstico
del Infarto durante muchos años.
Creatinin Kinasa (CPK): la actividad
plasmática de ésta enzima aumenta entre las 4 y 8
hs del comienzo del infarto, pero hay que recordar que dicho
aumento se observa también en el 15 % de pacientes con
enfermedades
musculares, intoxicación alcohólica, diabetes
sacarina, traumatismos de músculos esqueléticos,
ejercicio violento, convulsiones, inyecciones intramusculares,
síndrome braquial, embolia pulmonar, de manera que pueden
obtenerse falsos positivos. (9,10)
En busca de aumentar la especificidad surge la
determinación de una isoenzima de la CPK llamada CPK
MB.
Cratinin Kinasa MB (CPK MB): Isoenzima de la CPK
que se encuentra en el músculo cardíaco y en menor
medida en intestino delgado, lengua,
diafragma, útero y próstata. Su
determinación aumenta la especificidad diagnóstica
para IAM comparada con la CPK total. Sin embargo una única
determinación al ingreso no es suficiente para un correcto
diagnóstico. Las mediciones seriadas de CPK-MB presentan
una sensibilidad y una especificidad de alrededor de 92 y 98 %
respectivamente, pero la sensibilidad y especificidad de una
muestra
inicial aislada no se asocia con el mismo valor predictivo.
Bakker y col. Evaluaron a 290 pacientes consecutivos y
confirmaron el diagnóstico de IAM en 153. La primera
muestra tomada de CPK-MB al momento del ingreso de los pacientes
resultó positiva solo en el 35 % de los casos. Aunque la
sensibilidad y la especificidad relativas cambian según el
momento de presentación después del comienzo de los
síntomas, ninguna determinación inicial de un
marcador aislado posee el valor predictivo negativo suficiente
como para excluir definitivamente el diagnóstico de IAM.
(10)
La CK-MB existe en una sola forma en el tejido
miocárdico pero en diferentes sub-formas en el plasma. Una
es CK-MB1 (Plasma) y CK-MB2(tisular). En las primeras 6 horas de
la evolución de un infarto, un nivel absoluto de CK-MB2
> 1.0 U/lt y una relación de CK-MB2 a CK-MB1 > 1.5
es más sensible y específica para el
diagnóstico de IAM que la CK-MB.
Deshidrogenasa Lactica (LDH): su aumento es
tardío ya que excede los valores
normales entre las 24 y 48 hs después de iniciado el
infarto y además es muy inespecífica ya que se
observan resultados falsos positivos en pacientes con
hemólisis, anemia megalobástica, leucemia,
hepatopatías, congestión hepática,
nefropatías, varias neoplasias, embolia pulmonar,
miocarditis, enfermedades del músculo esquelético y
shock.
Aspartato Aminotransferasa (AST): ya no es
utilizada dado su alto índice de falsos positivos y a que
el tiempo que transcurre entre la elevación y la
caída es intermedio entre el de la CPK y la
LDH.
Troponinas: constituyen un complejo de
proteínas estructurales y regulatorias del músculo
cardíaco y esquelético. Los niveles séricos
de troponinas son habitualmente muy bajos y en circunstancias
normales resultan indetectables. Por lo tanto son altamente
sensibles y específicas. Su elevación se produce a
partir de las 3 o 4 hs de iniciado el IAM. Katus y col.
determinaron una sensibilidad del 100 % para diagnóstico
de IAM y una especifidad del 78%, significativamente menor que el
92% comunicada para CPK-MB.
El complejo de las Troponinas consiste de tres
sub-unidades: Troponina T, Troponina I y Troponina C. Ambas
troponinas TnT y TnI están presentes en el músculo
esquelético y cardíaco, sin embargo por ser
codificadas por diferentes genes y tener diferente secuencia de
aminoácidos producen anticuerpos diferentes que permiten
ser detectados independientemente. Varios estudios han demostrado
su utilidad en el
diagnóstico y pronóstico de los Síndromes
Coronarios Agudos. Dado que la troponina I es muy sensible para
la detección temprana de lesión miocárdica
se utiliza para evaluar pacientes con el Síndrome de Dolor
Torácico Agudo. Los pacientes que no presentan
elevación del segmento ST durante el período de
dolor y teniendo dos muestras de TnI negativas (por lo menos 6
hrs después del inicio del dolor) tienen un riesgo muy leve
de IM o muerte (0.3%) y pueden ser externados del servicio de
observación. La elevación de las
Troponinas cardíacas en los Síndromes Coronarios
Agudos ha llevado al Dr Braunwald ha modificar la
clasificación de angina propuesta por él en 1989.
Publicada recientemente en Circulation en Julio de este
año propone dividir a la angina en reposo con menos de 48
hrs de evolución Clase 3B en un grupoTnT positiva y otro
TnT negativo. El riesgo de infarto o muerte en el primer grupo es
entre 15-20% comparado con el segundo que es de menos del 2%.
(9,10)
Mioglobina: una proteína de peso molecular
relativamente bajo presente en el músculo cardíaco
y esquelético, es liberada con rapidez desde los miocitos
necróticos y por lo general puede ser detectada en el
suero dentro de las dos horas posteriores al comienzo del IAM,
con un valor pico entre 3 y 5 horas. Las muestras seriadas
mejoran la capacidad diagnóstica. Gibler y col. Estudiaton
a 59 pacientes con dolor de pecho y en 21 diagnosticaron
posteriormente un IAM. Entre las muestras iniciales 13 fueron
positivas para mioglobina, mientras que solo 3 lo fueron para
CPK-MB; las muestras obtenidas a las tres horas fueron positivas
para mioglobina en los 21 pacientes, mientras que solo 19 fueron
positivas para CPK-MB. (10)
Las mioglobinas se elevan muy tempranamente en el IAM
pero no son específicas para músculo
cardíaco y se pueden encontrar elevadas cuando hay
daño en el músculo esquelético.
Puede concluirse entonces que si bien estas enzimas son
sensibles para el diagnóstico de IAM son muy poco
específicas.
Multimarcadores
De acuerdo con lo anterior se hace evidente que cada
marcador posee sus ventajas y desventajas. Esto motivó el
estudio de la determinación seriada de 2 o mas marcadores
para el diagnóstico de síndrome coronario agudo y
su beneficio queda demostrado en el reciente estudio de Kristin y
col. que concluye que el empleo de
multimarcadores (CPK-MB, mioglobina y troponina I) identifica
mejor y mas tempranamente, y provee una mejor
estratificación de riesgo de muerte para pacientes con
síndromes coronarios agudos que el empleo de un solo
marcador. (9,10)
TROPONINA MARCADOR
BIOQUÍMICO ESPECÍFICO
Los filamentos delgados del músculo estriado,
además de estar formados por actina, contienen dos
proteínas principales accesorias, que ejercen una
función reguladora, controlando la construcción y la ruptura de los puentes
transversales entre los filamentos gruesos y delgados, así
como la producción de energía mecánica. Una de ellas es la
tropomiosina , molécula fibrosa que consta de dos
cadenas, alfa y beta que se adhieren a la actina F en el surco
entre los dos polímeros, representa del 10 al 11% de la
proteína contráctil total del músculo; fue
aislada por primera vez en forma cristalina por K. Bailey en la
década de los 40. Las moléculas de tropomiosina se
asocian por los extremos y cuando cristalizan forman un
retículo cuadricular. Tiene un peso molecular de 64,000
daltons
Las largas y delgadas moléculas de tropomiosina
están dispuestas de extremo a extremo en las poco
profundas ranuras de los filamentos arrollados de actina F, de
forma tal, que cada molécula de tropomiosina está
en contacto con solo uno de los dos filamentos de la actina F.
Cada una de las moléculas de tropomiosina se extiende a lo
largo de siete monómeros de actina G. Las moléculas
de tropomiosina no están en posición fija, sino que
pueden moverse a lo largo de ranuras que existen entre las hebras
de actina F.
La segunda proteína reguladora importante es la
troponina, proteína globular de gran tamaño
descubierta por el bioquímico japonés S. Ebashi y
sus colaboradores en 1965; tiene un peso molecular de 78,000
daltons. La troponina contiene tres subunidades
polipeptídicas, cada una de las cuales tiene una
función específica.
La subunidad fijadora de Ca++ de la troponina
es la TnC, tiene un peso molecular de 18,000 daltos. Cada
molécula de TnC enlaza fuertemente a dos iones
Ca++, y simultáneamente experimenta un cambio
de conformación.
La subunidad inhibidora de la troponina es la TnI, tiene
un peso molecular de 23,000 daltons y posee un centro de
unión específico para la actina; su función
consiste en inhibir la interacción de la actina con los
puentes cruzados de la cabeza de la miosina. La subunidad TnI es
fosforilada por la fosforilasa-quinasa, que normalmente activa a
la fosforilasa b transformándola en la fosforilasa a,
activa.
El tercer componente de la troponina, TnT, es la
subunidad fijadora de tropomiosina, tiene un peso molecular de
37,000 daltons.
La molécula completa de la troponina tiene forma
globular y contiene una de cada una de las subunidades TnC, TnI y
TnT. (Fig. 6)
Fig. 6 Representación esquemática del
filamento delgado de las miofibrillas del músculo
estriado

http://cariari.ucr.ac.cr/~gacetapc/TROPONIN.HTM
Cada Molécula de troponina está fijada al
filamento delgado por dos centros de unión, uno de ellos
específico de una hebra de actina, y el otro
específico para una hebra de tropomiosina. La unión
a la tropomiosina, parece que tiene lugar en un punto fijo, pero
la unión al filamento de actina experimenta su
formación y ruptura dependiendo de la unión de
Ca++. A lo largo de un filamento delgado, se encuentra
una molécula de troponina cada 40 nm, así que por
cada siete monómeros de actina G, existe una
molécula de tropomiosina y otra de troponina.
(11)
Cuando se da algún daño en el tejido
muscular es cuando se podrían encontrar en el torrente
sanguíneo algunos de los componentes proteicos que tienen
que ver con el proceso de contracción- relajación.
Las troponinas son marcadores bioquímicos que pueden ser
utilizadas para la detección de daño celular. Las
subunidades T, C e I de la troponina son proteínas del
aparato contráctil que se presentan en diversas isoformas,
dependiendo del músculo específico de que
provengan. La determinación de estas sustancias junto con
otros marcadores bioquímicos abre nuevas posibilidades
diagnósticas en diversas patologías, en especial en
el infarto agudo del miocardio.
El valor diagnóstico de la troponina ha sido
ampliamente discutido en tiempos recientes. La
determinación que se mantuvo en boga por cierto tiempo fue
la medición de la troponina T (TnT). Sin
embargo, recientemente se ha insistido en que es la troponina I
(TnI) es la que posee mayor sensibilidad y eficiencia en el
diagnóstico del infarto agudo del miocardio. Las
referencias que existen al respecto son numerosas y se han
descrito comparaciones con otros parámetros: las
isoenzimas de deshidrogenasa láctica (LDH), creatina
kinasa (CK) y sus isoenzimas como la CK-MB, mioglobina e incluso
con la misma TnT. Con estas comparaciones se ha llegado a la
conclusión de que es la TnI la mejor opción para el
diagnóstico del infarto.
La conclusión a la que se ha arribado es que la
TnI es el marcador de elección para el diagnóstico
del infarto agudo del miocardio, porque aparece
rápidamente después del accidente coronario y se
mantiene por mucho tiempo en la circulación. Se prefiere
la TnI y no la TnT porque esta última se expresa en otros
músculos aparte del corazón. Sin embargo, se ha
indicado que en las dos primeras horas después de ocurrido
el infarto aparece primero la mioglobina, aunque esta no es
específica del músculo cardíaco.
La TnT se ha identificado como un dato de mucho valor en
los pacientes con la elevación del segmento
electrocardiográfico ST, mientras que la TnI se ha visto
como un medio para evaluar el riesgo de los pacientes con
problemas
coronarios del segmento Q y angina inestable. También se
ha sugerido el uso de anticuerpos que reconozcan en conjunto a la
TnI junto con las otras dos subunidades, ya que se ha descrito
que la TnI se libera al torrente sanguíneo, en algunas
ocasiones libre y en otras formando complejos con las otras
subunidades tropónicas. Existen únicamente tres
isoformas de TnI: la del músculo esquelético
rápido, la del músculo esquelético lento, y
la del músculo cardiaco (cTnI). Las tres isoformas
están codificadas por genes diferentes y tienen una
variación del 40% en sus secuencias de aminoácidos.
La cTnI tiene un residuo adicional de aminoácido en su
extremo N-terminal, lo que hace que éste sea un excelente
analito, muy específico para el músculo cardiaco.
(12)
Finalmente, aunque se recomienda el uso de la TnI como
prueba diagnóstica, la evaluación
de la CK-MB y la mioglobina son otros parámetros
útiles, en especial para la determinación de la
fase de daño y la toma de decisión
terapéutica. El primer analito que se altera es la
mioglobina, la cual se eleva en aproximadamente una hora; la TnI
aparece en unas cuatro horas, ligeramente después de la
CK-MB. La TnT aparece primero que la TnI, pero aquella presenta
la limitación de no ser tan específica como la
última. (12) (Fig. 7)
Figura 7: Marcadores séricos en el
infarto agudo de miocardio.
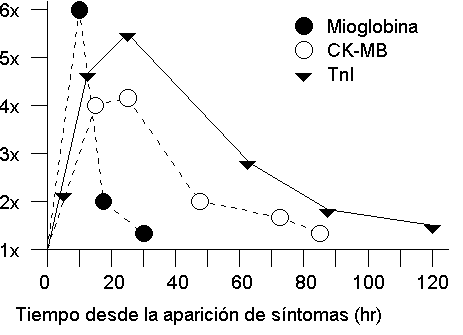
http://cariari.ucr.ac.cr/~gacetapc/TROPONIN.HTM
La liberación de Troponina T (TnT)
es típicamente bifásica: el primer pico aparece en
el 50% de los pacientes a las 4 horas ( CK sólo el 25%),
máxima a las 12-24 horas; ésta primera oleada se
corresponde con la liberación del complejo terciario por
daño de las miofibrillas, que posteriormente se degrada a
complejo proteína C-cTnI + cTnT libre junto con la cTnT
liberada del pool citosólico; y un segundo pico el el
día cuartro, sobre todo en los pacientes que han sido
reperfundidos.
La presencia de cTnT en plasma no es específica
de la cardiopatía isquémica, sino que se libera en
casos de IC (por lesión de los miocitos); por el
contrario, hay estudios hechos en cerdos bajo remodelación
VI importante tras un IAM, en los que los valores de
cTnI y cTnT están disminuidos entre un 40-80% de lo
normal, debido a una pérdida crónica de troponinas
en un miocardio dañado en el que no hay suficiente
capacidad de re-expresar los genes que aumentarían la
síntesis proteica. (13)
Su vida media es de 120 minutos, pero puede detectarse
proteína circulante hasta 21 días después de
un IAM debido a la degradación de las miofibrillas (hasta
una semana más que la CK). Presenta una especificidad de
órgano muy alta, por lo que una elevación de su
concentración en sangre indica claramente necrosis
células miocárdicas. Es un marcador de daño
miocárdico.
La Troponina I cardíaca (cTnI) es
una proteína contráctil presente exclusivamente en
el músculo cardíaco. Su papel fisiológico
consiste en inhibir la actividad ATPasa del complejo
actina-miosina en ausencia de calcio y por consiguiente, en
impedir la contracción muscular.
Se han identificado tres isoformas específicas de
tejido:
La troponina I rápida y la troponina I lenta con
pesos moleculares de 19,800 D cada una, expresadas
respectivamente en fibras contráctiles de músculo
esquelético rápidas y lentas.
La cTnI de 24,000 D de peso molecular, tiene un residuo
adicional de 31 aminoácidos en el extremo
N-terminal.
La secuenciación de la cTnI de mamíferos ha desvelado diferencias
importantes entre las formas cardiaca y esquelética . Cada
una de las isoformas de troponina I está codificada por
genes distintos. La cTnI humana presenta una homología de
secuencia aminoacídica del 52 y el 54% respectivamente con
las troponinas I esqueléticas humanas rápida y
lenta. Asimismo, se ha demostrado que el músculo
esquelético no expresa cTnI ni durante su fase de
desarrollo ni como respuesta a estímulos. Por
consiguiente, la cardioespecificidad absoluta de la cTnI permite
distinguir entre lesiones cardíacas y lesiones
esqueléticas, y permite el diagnóstico de infarto
de miocardio diferente de lesiones musculares
(rabdiomiólisis, politraumatismo) y la cirugía no
cardíaca. También se han demostrado niveles
elevados de troponina I en casos de angina inestable e
hidropesía cardíaca. Los niveles de cTnI en infarto
agudo de miocardio (IAM) muestran pautas de elevación y
disminución similares a las encontradas en la
creatincinasa CK tipo MB. Se recomienda la recogida de al menos
tres muestras de sangre durante el período inicial. La
cTnI es 13 veces más abundante en el miocardio que la
CK-MB y normalmente no circula en la sangre, por lo que la
señal de tasa de ruido es
más favorable para la detección de necrosis
miocárdica. Los datos acumulados a partir de diversos
estudios indican que los niveles de troponina I son detectables
(por encima de los datos indicados para muestras no-IAM)
transcurridas 3–6 horas desde la aparición del dolor
de pecho. Los niveles de troponina I alcanzan su nivel más
alto aproximadamente a las 12–16 horas y pueden mantenerse
elevados durante 4–9 días después del IAM.
Estos mismos estudios indicaron que el tiempo para alcanzar el
nivel más alto de concentración de cTnI fue
más prolongado en los pacientes que no habían
recibido terapia trombolítica. Se ha demostrado en
estudios recientes que la forma de cTnI predominante presente en
la sangre de pacientes tras sufrir IAM es el complejo binario de
troponina IC con cantidades más pequeñas del
complejo ternario ITC, del complejo binario IT y de la troponina
libre cTnI. El reconocimiento diferencial de las formas de cTnI,
en su forma libre o acomplejada, es común en la
mayoría de los métodos
comerciales. En algunos ensayos las respuestas relativas a las
diversas formas de cTnI son prácticamente equivalentes,
mientras que en otros ensayos muestran una diferencia sustancial.
Esto último puede llevar a cálculos por encima y
por debajo de la concentración real de troponina I en un
entorno biológico complejo. La unión equimolar
definida como la capacidad de reconocer igualmente ambas, la
forma libre y la forma compleja de cTnI, permite la
determinación objetiva de la cTnI total presente en
muestras del mismo sujeto en el curso de un IAM. (14)
Existen diversos métodos disponibles para la
determinación de TnT y TnI, entre los cuales se destacan
la inmunocromatografía, ELISA, la quimioluminiscenia,
Inmunoensayos enzimáticos de micropartículas (MEIA)
y otros. Todos los procedimientos
involucran el uso de anticuerpos monoclonales. Existe abundante
literatura en la
que se describen, comparan, evalúan y validan estos
métodos. Se han estudiado también las
características de estas sustancias no solamente en el
infarto agudo, sino también en otras situaciones
clínicas, como en la angioplastía coronaria, en
pacientes con fallo renal agudo sometidos a hemodiálisis,
en personas con trauma de músculo esquelético y en
otras patologías. (12)
Para la determinación de la TnT y la TnI; hay
técnicas inmunocromatográficas rápidas que
son semicuantitativas y también inmunoensayos
cuantitativos (ELISA). Recientemente se ha manufacturado una
técnica inmunocromatográfica para la
determinación de CK-MB y mioglobina, ambas en una misma
unidad de prueba, facilitando la medición de estos
parámetros que antes sólo podían ser
determinados por técnicas más sofisticadas. Existe
además una prueba inmunocromatográfica para la
determinación de anticuerpos anti-estreptoquinasa, la cual
permite la selección
temprana de un adecuado tratamiento trombolítico. La
utilización de estos métodos y determinaciones
será una excelente opción para apoyar la
evaluación de los pacientes que presentan problemas
cardíacos agudos o crónicos. (12)
Métodos de medición: Existen
técnicas automáticas y test
rápidos con sangre; métodos de primera
generación, medidos por ELISA cTnT, basándose
en utilizar anticuerpos monoclonales; métodos de
segunda generación: enzimoinmunoensayos sin
reactividad cruzada con TnT del músculo esquelético
(ENZYMUN-Test Cardiac T con system analyzer Boehringer Mannheim).
Incluyen nuevos anticuerpos monoclonales (M7 y M11.7) que
reconocen exclusivamente los aminoácidos terminales de la
isoforma de la TnT cardiaca; los epítopos de unión
de estos Ac sólo están separados por 6
aminoácidos residuales, lo que reduce la probabilidad de
dividir la TnT cardiaca en dos sitios de unión no
específico para proteasa plasmáticas. El
límite superior de referencia es de 0,1 ng/ml para
IAM-angina inestable (inapropiado para cardiopatía
isquémica (IC), que suele corresponderse con valores de
corte de 0,2 ng/ml). No deberían dar falsos positivos,
pero hasta en un 10-20% de los pacientes con insuficiencia renal
(IR) y sin cardiopatía de base, tienen esta prueba
positiva de manera inexplicable.
La sensibilidad para estos métodos
diagnóstico varía en función del tiempo de
medición: 50% a las 4 horas (umbral entre 0,1 y 0,2); 89%
a las 6 horas; 100% a las 10-12 horas. La especificidad a
las 6 horas es del 84%. De una manera global y según las
series, presenta una especificidad que varía entre 46-98%
y una sensibilidad algo menor del 100%. (13)
El ensayo
Access AccuTnI
permite reconocer los complejos de troponina binaria IC o IT o
troponina terciaria ITC y la troponina cTnI libre de igual
manera. Asimismo, este ensayo es sensible en igual medida a ambas
formas del complejo de cTnI, la fosforilada y la desfosforilada.
La cTnI es muy propensa a experimentar lisis o
modificación enzimática. Se produce
degradación considerable tanto in vivo como in vitro. El
extremo C terminal de la molécula tiende a perderse antes,
seguido después de la pérdida del extremo
N-terminal. En el ensayo
Access AccuTnI se
utilizan anticuerpos monoclonales que se dirigen contra la zona
más estable de la molécula y se ve por ello menos
afectada por la degradación de la cTnI. (14)
Pruebas rápidas para la determinación de
cTnT en sangre como la que ofrece la Roche (TropT sensitive Test
rápido), que puede ser empleado ante la sospecha de una
lesión miocárdica (por ejemplo, infarto agudo de
miocardio, angina de pecho inestable, contusión cardiaca).
La troponina T se libera en la sangre a partir de 2 a 8 horas
tras la lesión del miocardio y empiezan a declinar sus
valores a los 14 días.
Un resultado positivo significa que la
concentración de cTnT supera el valor umbral del test de
0.1 ng/ml, lo que implica una lesión miocárdica.
Debido a la cinética de liberación de la troponina,
no es posible excluir con seguridad un infarto de miocardio ante
un resultado negativo en las primeras 8 horas después de
la aparición de los primeros síntomas. Si existe
sospecha se recomienda repetir el test.
Esta prueba utiliza dos anticuerpos monoclonales
específicos de la troponina T cardiaca, uno de ellos
está marcado con oro y el otro con biotina. Si la sangre
contiene cTnT , los anticuerpos forman un complejo emparedado con
ella. Después de la separación de los eritrocitos,
el plasma pasa por la zona de reacción, en la que gracias
a la fijación de los complejos sándwich marcados
con oro aparece la señal positiva en forma de una
línea rojiza. La aparición de una línea de
control indica el
funcionamiento correcto del test. (15)
La Troponina I es un marcador bioquímico
considerado altamente específico de isquemia
miocárdica. Apoyado por varios estudios comparativos con
otros marcadores como la CK-MB, se concluye que la Troponina I
presenta una especificidad superior a la CK-MB (97.37% vs 89.5%)
cuando se determina en pacientes sin sospecha de enfermedad
cardiaca. El 13.5% de los pacientes ingresados por insuficiencia
cardiaca sin patología coronaria previamente documentada
han mostrado, elevación de Troponina I. Los pacientes
ingresados por angina sin necrosis, han mostrado una gran
variabilidad en las cifras de Troponina I y CK-MB. La Troponina
es un marcador de necrosis miocárdica más
persistente que la CK-MB, encontrándose elevada al sexto
día en más de la mitad de los pacientes con infarto
agudo al miocardio.(18)
Winter, en 309 pacientes con sospecha de infarto de
miocardio, efectuó controles de Mioglobina, CK-MB y
Troponina T, observando que en las primeras cuatro horas del
comienzo de los síntomas la sensibilidad de estos
marcadores es menor, comenzando a mejorar luego de las 6 horas,
siendo lo Mioglobina el marcador más sensible durante las
primeras horas. (19)
Troponina I cardiaca en los pacientes con angina
inestable: Galván y cols. De Forli, Italia y St.
Louis, Missouri, estudiaron a 106 pacientes con angina inestable
para determinar el valor pronóstico de las mediciones de
cTnI. La evidencia electrocardiográfica de la isquemia
miocárdica y los valores normales de CK sérica
durante las 16 horas iniciales de observación y las
molestias torácicas en reposo a las 48 horas del ingreso
caracterizaban a estos pacientes. El punto final primario del
estudio fue la muerte o el
IAM no fatal a los 30 días, y el punto final secundario
fue la incidencia de episodios cardiacos al año. Se tomo
sangre cada 8 horas durante 3 días. Al año solo el
68% de los pacientes con TnI elevada carecieron de episodios
cardiacos, comparados con el 90% de los carentes de estas
elevaciones. Estos datos indican que la troponina I es una
variable pronóstica útil en los pacientes con
angina inestable y predice el pronóstico tanto a corto
como a largo plazo. (21)
La Troponina T identifica a los pacientes con
arteriopatía coronaria inestable; en un estudio realizado
por Lindahl y cols, en Suecia propusieron que en los pacientes
con aumento de troponina T, la oclusión temporal por un
trombo rojo pudiera ser el principal mecanismo que responde a la
heparina de bajo peso molecular. Por el contrario los pacientes
sin aumento de troponina T responderían menos a este tipo
de tratamiento. Así pues, un aumento de troponina T
podría ser útil en la selección de una
estrategia
terapéutica a largo plazo para los pacientes con
arteriopatía coronaria inestable. (21)
En pacientes con síndromes coronarios inestables
la existencia de niveles elevados de TnT y PCR son un potente
predictor del desarrollo de eventos cardiovasculares alejados
(muerte cardiovascular). Estos marcadores de riesgo constituyen
predictores independientes de las variables
clínicas de empleo tradicional para la
estratificación de riesgo y otorgan un valor incrementado
y aditivo (entre sí y respecto a los marcadores
clínicos y ECG) para la identificación de sujetos
en alto riesgo de desarrollar eventos cardiovasculares mayores en
un periodo de seguimiento alejado. (20)
La medida de CK-MB junto con la realización de
una prueba de esfuerzo es la estrategia inicial más
coste-efectiva para los pacientes jóvenes y para
aquéllos con una baja o moderada probabilidad de infarto
de miocardio. La medición de Troponina I puede ser un
segundo test coste-efectivo en pacientes de mayor riesgo en los
que el nivel de CK-MB es normal y a los que no se les puede
realizar un test temprano de ejercicio. (16)
Se realizó un estudio para evaluar la utilidad de
la troponina T cardiaca (TnT) en la decisión de ingreso o
alta del hospital y el impacto de su empleo en los costos de
internación en 90 pacientes que consultaron por angor en
el Departamento de Emergencia, con al menos un factor de riesgo
coronario y que no tenían sobreelevación del ST en
el ECG. De acuerdo a la clínica, el ECG y la
fracción CK-MB del ingreso, se planteó la
internación o el alta, pero el paciente permaneció
en observación. A las seis horas del ingreso se
dosificó la TnT y si el valor era <0,01 ng/ml, el
paciente era dado de alta; si era mayor, ingresaba al hospital.
En los 20 pacientes para quienes se había planteado el
alta inicial, la TnT fue negativa. Entre los 70 pacientes para
quienes se planteó el ingreso, 10 tuvieron TnT positiva,
por lo que fueron ingresados. Otros 24 pacientes de este grupo
también fueron ingresados por el médico tratante, a
pesar del resultado negativo del test. En los 30 días
siguientes nueve pacientes presentaron eventos isquémicos
agudos (dos muerte y siete angor recurrente) entre los 10
pacientes con TnT positiva, y tres pacientes presentaron angor
recurrente entre los 78 con TnT negativa. El valor predictivo
negativo del test fue de 96,2% y el valor predictivo positivo fue
de 90,0%. El empleo del test de TnT significó un ahorro de U$S
105.304, que podría haber llegado a U$S 137.280 si todos
los pacientes con TnT negativa hubieran sido dados de alta. El
test de TnT es una herramienta de diagnóstico altamente
efectiva en el Departamento de Emergencia en pacientes con angor
sin sobreelevación de ST, pues permite optimizar su manejo
y reducir los costos de hospitalización, por lo que
debería ser el marcador estándar en los servicios de
emergencia. (17)
Los cálculos han demostrado que el uso de las
pruebas de Troponina I para el diagnóstico del infarto del
miocardio (IM) y el daño en el músculo
cardíaco, pueden mejorar no solo los resultados
médicos, sino que reducen la estancia hospitalaria en los
hospitales en más del 8%, a la vez que disminuyen los
costos anuales asociados en las unidades de cuidado coronario en
más del 7%.
De acuerdo con Robert Parson, un bioestadístico
clínico de Beckman Coulter, Inc. (Fullerton, CA, EUA),
empresa que
mercadea la prueba AccuTnI troponina I, en un departamento de
emergencia típico con una unidad hospitalaria de cuidado
crítico (UCC) las pruebas de Troponina I pueden
representar ahorros de cerca de US $1 millón por
año.
Parson cita dos factores principales con implicaciones
financieras significativas en las salas de emergencia
hospitalarias relacionados con el diagnóstico de la
enfermedad cardíaca. Estos factores son, las admisiones
hospitalarias innecesarias, y las salidas inadecuadas de las
salas de emergencia. El primer factor lo causan los pacientes que
son admitidos al hospital con una sospecha de enfermedad
cardíaca, pero en el 50% de los casos se encuentra que no
tienen problemas cardíacos o de riesgo, y son dados de
alta. El segundo factor es causado por pacientes a quienes se da
de alta como casos no cardíacos, pero con un
diagnóstico errado, habiendo tenido un infarto del
miocardio agudo.
Por lo tanto, las salas de emergencia que puedan identificar a
los pacientes cardíacos de manera más rápida
y exacta, tienen un mejor control de costos, mejoran el cuidado
del paciente, optimizan los resultados clínicos y usan los
recursos de
manera más eficiente. Los estudios muestran que los
marcadores de troponina son las herramientas
más efectivas para el diagnóstico del IM y del
daño muscular cardíaco. Por lo tanto, la
determinación de los niveles de troponina I, puede acortar
la estancia hospitalaria, y reducir las admisiones a las unidades
de cuidado crítico de los pacientes que no las
requieren.
"Debido a su sensibilidad y especificidad clínicas, los
análisis de troponina I son el método de
selección para identificar a los pacientes con dolor
anginoso con daño cardíaco, IM e isquemia", dijo
Parsons. (19)
1.-Owen Avril. Cardiac troponins: improved diagnosis and
cost benefits. 2001. Clinical Laboratory International. Volume
25. No. 8. p.14-15.
2.- http://www.enfermundi.com/laspalmas/boletin/mayo01/iam.htm
3.-Ross Michael, Romrell, Lynn y Kaye Gordon. Histología. Texto y Atlas
color.1997. 3a.
edición. Editorial Médica Panamericana.
Capítulo 10. p. 212-227.
4.-
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu33222.html
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu31593.html
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu32648.html
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu31749.html
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu33325.html
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu33773.html
http://escuela.med.puc.cl/paginas/Cursos/segundo/histologia/HistologiaWeb/paginas/mu32235.html
5.-Giese, Arthur C. Fisiología Celular y General. 1984. 5ta.
ed. Editorial Interamericana. Capítulo 23. pp.
574-576.
6.-http://www.uam.es/personal_pdi/medicina/algvilla/cyta/cont.html
7.- http://www.suc-uruguay.org/revista/v14n3/sasson-tc.htm
8.-http://www.egalenia.com/ega/es_12.htm
9.-
http://www.medicos.sa.cr/revista/revista3/revision3.htm
10.-
http://www.scoeur.intramed.net.ar/click7.html
11.-Lehninger, Albert L. Bioquímica. Las bases moleculares de la
estructura y función celular. 1985. 2da. ed. Ediciones
Omega. Capítulo 27. pp. 768-769
12.-
http://cariari.ucr.ac.cr/~gacetapc/TROPONIN.HTM
13.-
http://www.fjd.es/WebOtrosServicios/Residentes/Sesiones/TroponinaInsfRenal.htm
14.-
http://www.galenica.cl/bioquimica/access_troponina_i.html
15.- http://www.roche.com/poc
16.-http://www.humv.es/funciones/servicios/centrales/FAR/Información_Medi…/B2000-01.ht
17.-
http://www.suc-uruguay.org/Revista/v16n3/htlm/pag_editor.htm
18.-http://www.sacardiologia.org/sac/revista29/292122.html
19.-
http://pcvc.sminter.com.ar/fec/foros/interv/05oshea/index.htm
20.-
http://www.sac.org.ar/Publicaciones/busqueda/2001_1/frisc%20II.htm
21.-Willerson, James T; Roberts, William; Rackley,
Charles, Graham, Thomas; Mason, Dean y Parmely, William.
Cardiología. 1998. 1ra. Ed. Editorial Futura Publishing
Company, Inc. Tomo II. Pp. 140-141.
María Teresa Croda Todd
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |