2. Desarrollo
experimental. del equilibrio
iónico
Se inicia haciendo el cálculo
del la cantidad de HCl necesario para preparar 100ml. De
solución 0.1 M. Posteriormente se mide el volumen
determinado en una pipeta y se lleva a un . matraz aforado de
100ml, se llena el matraz hasta el aforo con agua y se
marca con la
etiqueta de pH= 1. Seguido
de esto, en un vaso de precipitados de 100ml. Se agregan 10ml de
la solución que se encuentra en el matraz aforado con la
etiqueta de pH=l y 90ml de agua destilada. Por último se
marca este vaso con la etiqueta de pH=2.
Enseguida se calcula la cantidad de NaOH para preparar
100ml. de solución 0.1M, misma que se pesa en un vidrio de reloj
en la balanza granataría. Una vez que se peso el NaOH se
vacía en un vaso de precipitado y se disuelve con 20ml de
agua destilada, llevando luego esta solución a un matraz
aforado de 100ml. Finalmente con agua destilada se completa el
volumen hasta el aforo y se marca el matraz con una etiqueta de
pH=13.
Del matraz aforado con etiqueta pH=13 se miden 10ml. con
una pipeta y se llevan a un vaso de precipitados de 100ml y
después de agregar 90ml. de agua destilada se etiqueta con
pH= 12.
Posteriormente se realiza el cálculo de la
cantidad de Acetato de Sodio necesaria para preparar 100ml de una
solución con un pH de 4.75, para lo cual se mide en un
vaso de 250ml un volumen de 100ml de ácido acético
0.1M y se considera como un ácido débil cuya Ka=
1.8 x 10-5.
Una vez pesado la cantidad de acetato de sodio
requerida, se agrega al vaso que contiene el ácido
acético y se agita hasta que se disuelve
completamente.
Finalmente se llevan al potenciómetro los vasos
etiquetados incluyendo el del ácido acético, y se
mide el pH de todas las soluciones
preparadas .
En un vaso de precipitado de 250ml se mide un volumen
de 100ml. de ácido acético 0.1M y se registra su
pH, con este dato se calculan las concentraciones de los iones
hidronio y acetato.
Enseguida se agrega 1ml de HCl concentrado al vaso que
contiene el ácido acético 0.1M y se agita para
mezclar el contenido, por último se mide su pH en el
potenciómetro.
Material Y Equipo
2 matraces aforados de 100 ml
2 pipetas graduadas de 10 ml
2 vasos de precipitados de 250 ml
4 vasos de precipitados de 100 ml
2 vidrios de reloj
2 agitadores de vidrio
1 espátula
Reactivos:
Agua Destilado (H2O): El agua es
una sustancia, en el estado de
agregación de la materia en
líquido, es incolora, inodora e insípida,
cualquier cambio en
estas propiedades se debe a la impurezas que están
disueltas en ella, con una densidad (g/ml,
20ºC) de 0.998 » 1, su valor
máximo es 1 g/ml, este valor sirve como patrón en
los cálculos en donde se utiliza la densidad relativa,
su calor
específico es de 1 cal/g ºC o de 4.18
´
103 J/kg ºK, su punto de fusión
en grados Celsius es de un valor de cero, su punto normal de
ebullición es de 100 ºC, dentro de la química subre
electrólisis para formar hidrógeno
y oxígeno.
Ácido acético (CH3 COOH) líquido
incoloro, de olor irritante y sabor amargo. En una
solución acuosa actúa como ácido
débil. El ácido etanoico puro recibe el nombre de
ácido etanoico glacial, debido a que se congela a
temperaturas ligeramente más bajas que la ambiente. En
mezclas con
agua solidifica a temperaturas mucho más bajas. El
ácido etanoico es miscible (mezclable) con agua y con
numerosos disolventes orgánicos.
Hidróxido de Sodio (NaOH), combinación
que deriva del agua por sustitución de uno de sus
átomos de hidrógeno por un metal. Se denomina
también hidróxido el grupo OH
formado por un átomo de
oxígeno y otro de hidrógeno, característico de las bases y de los
alcoholes y
fenoles.
Concluimos el que la importancia de conocer los
factores industriales que modifican la velocidad de
un proceso es
de gran uso, ya que gracias a dichos factores podemos
determinar o mejor aún lograr el tiempo
necesario o requerido para que un proceso se lleve a cabo en la
industria,
lo anterior es importante, puesto que es de gran utilidad el
aplicar los factores que puedan hacer que un proceso se acelere
o se vuelva lento si así lo requerimos, ya que en muchas
ocasiones se requerirá modificar la velocidad de un
proceso. Un ejemplo es obtener cierto número de producción en menor tiempo que el normal,
requiriendo así que los procesos se
aceleren haciendo uso de los factores que logren un aumento en
la velocidad del proceso y una disminución en el tiempo
de realización del mismo. A lo largo de esta investigación hemos adquirido mas
conocimientos del tema de la cinética de las reacciones
y esto me facilitara la compresión de temas similares
que le siguen. Posterior a esto podremos resolver problemas de
aplicación en la industria a estos temas con mayor
facilidad.
Las propiedades, conceptos y aplicaciones del
equilibrio iónico son importantes para la industria, ya
que algunas máquinas
como los vaporizadores y las bombas
centrífugas (por mencionar algunos) requieren el
conocimiento perfecto del valor de gama para determinar en
que aparato se utilizaron. Por ejemplo, el vaporizador de
tubos, se requieren un conocimiento
conciso y preciso de los procesos, y en su aplicación,
en donde los tubos se puede determinar si es un sistema cerrado
en donde si hay o no hay transferencia de calor, ya que muchas
veces la transferencia de calor puede ser sumamente importantes
y manejar el comportamiento para poder
manejarlos adecuadamente ya que esto reduce costos y se
aprovechan al máximo para obtener mayor eficiencia en
la industria, ya que gracias a estos se necesita saber el
tiempo de reacción. En la determinación de la
acidez del acetato de sodio 0.1 molar, es decir; en la
determinación de su pH, observamos que este valor
depende mucho de la preparación de la solución.
En este caso, la preparación no fue la correcta, ya que
el valor real del pH se diferenció mucho del valor
esperado, en mas de un 100%.
Cabe mencionar, que el pH del ácido
acético varió mucho al agregarle el ácido
clorhídrico, y cuando se midió el pH del
ácido acético 0.1 molar, este presento un pH mas
bajo.
Finalmente, los resultados obtenidos no diferenciaron
mucho de los resultados esperados, podemos considerar que la
practica se realizó exitosamente, y no hubo
complicación alguna para realizar los cálculos
pertinentes.
Es de suma, importancia saber' calcular el pH de las
soluciones, debido a que en la industria es de vital
importancia conocer el pH de los productos,
ya que con este hasta el sabor de los alimentos
cambia.
Desarrollo
1.-Cantidad del HCl necesario para preparar 100ml. De
solución 0.1M.
M = n/V 0.1M = n/ 0.1l t. n = 0.01mol
N = W/PM 0.1 = W/36.5 W = 0.365gr
0.365 36% X =1.01388 gr. Al 36 %
X 100%
P = 1.19 g/ml p = m/v v = m/p v = ![]()
2.-Cantidad de NaOH necesario para preparar 100ml. De
solución 0.1M.
M = n /V 0.1M = n / 0.1l t. n =0.01
n. = W/PM 0.01 = W/40g/mol W= 0.4 gr
0.4 98% x=0.4081 gr
x 100%
3.- Cantidad de Acetato de sodio necesaria para
preparar 100ml. De solución con un pH de 4.75
![]()
![]()
![]()
Si ![]()
![]()
![]()
![]()
![]()
![]()
![]()
pH. = 4.75
PH = -log ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
Se tiene: n = MV n =![]()
n.= 0.0101677 mol m = nPM ![]()
m =0.8337gr
0.8337gr —-100%
x —-99% x = 0.8412 gr
4.-Calcular las concentración de los iones
hidronio y acetato, con el pH obteniendo
anteriormente:
pH = 3.8
pH = -log ![]()
![]()
![]()
![]()
pH DE LAS SOLUCIONES PREPARADAS
SOLUCIÓN | pH. Esperado | PH Real |
HCL 0.1M | 1 | 2.1 |
HCL 0.01M | 2 | 1.96 |
NaOH 0.1M | 13 | 12.9 |
NaOH 0.01M | 12 | 11.9 |
Ácido Acético y su sal | 4.75 | 3.94 |
Ácido Acético 0.1M | 2.8 | 3.8 |
Ácido Acético y HCL | — | 1.99 |
Calculos y resultados:
1.-¿Encuentra usted alguna diferencia entre ls
valores de
pH reales y los esperados, para cada una
de las soluciones?
Explique en cualquier caso.
Las diferencias más marcadas de pH, se
localizaron en el HCl 0.1M, en el ácido acético y
su sal,
Y en el ácido acético 0.1M Estas
diferencias, tal vez se deben a que su preparación no
fue adecuada.
En el caso del HCL 0.1M, el valor de su pH esperado es
de 1 y en nuestros experimento resultó ser de 2.1,
observando que hay más del 100% de
diferencia.
Para el ácido acético y su sal, su valor
esperado de pH es de 4.75 y en la practica resulto ser de 3.94,
observando que hay un 17% de diferencia.
Y finalmente para el ácido acético 0.1M
observamos un valor de su pH real de 3.8, mientras que el pH
esperado era de 2.8
2.-¿Cuál es el % de ionización
(%ά) del ácido acético 0.1M?(puntos 12 y
13)
%a
=![]()
%a
=![]()
%a =
2.511 ![]()
3.-De acuerdo con lo obtenido en los pasos 14 y 15,
calcule:
El pH del ácido acético 0.1M y HCl
fue de 1.99, por lo que:

- La concentración de ión
 de la nueva
de la nueva
solución. - La concentración final de ión

– para lo cual debe considerar la
relación:
![]()
despejando a ![]()
Ka =1.8
Como Ka es muy pequeña:
![]()
![]()
4.-¿Qué es una solución
tampón, buffer o reguladora?
Es una solución que tiene la propiedad de
mantener constante el Ph, en inglés
es solución buffer. Las soluciones reguladoras tienen un
ácido débil y sus sal, o una base débil su
sal.
5.- Cite cinco ejemplos donde a nivel industrial sea
necesario controlar el pH, ya sea en un proceso o en la calidad de
algún producto.
- En la producción de medicamentos, ya sea
vitamínicos minerales. - En la preparación de soluciones inyectables,
sueros, etc. - E n la preparación de reactivos
químicos para diagnosticos y reactivos Químicos
para alimentos de diferentes presentaciones. - En la preparación de soluciones
orales. - En industrial importantes que se dediquen a todo los
procesos químicos
6.- Calcule el pH de una solución 0.2M de
![]()
![]()

![]()

7.- Calcule el grado de ionización (a) de un
ácido acético 0.5M si su pH es de 3.25
![]()

![]()
8.- Calcule el pH de una solución que resulta de
agregar 2g de ![]() a
a
250ml de solucion0.1M. Considerar que el volumen no
varia.

Nota: ![]() se
se
disocia totalmente produciendo la misma cantidad de aniones y
cationes.
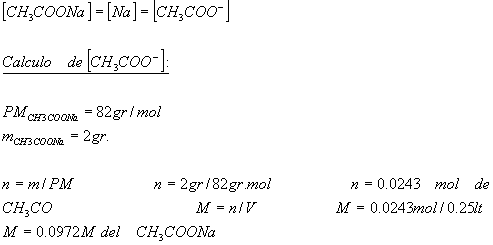
La concentración total de aniones
será:
![]()
Con respecto a ![]()
![]()
![]()

Garzón G. Guillermo, "Fundamentos de
Química General", Segunda Edición, Editorial: Mc
Graw Hill, México
D.F., 1986, Pag: 244 – 245
GORDON J. VAN WYLEN Y RICHARD E. SONNTAG "Fundamentos de TERMODINÁMICA", Primera Edición,
Editorial: Limusa, S.A. México,1967. Páginas:
39-41, 125-126, 200-201.
MARON Y PRUTTON, "Fundamentos de FISICOQUÍMICA",
Editorial: Noriega – Limusa, México, D.F., 1990
Páginas: 237-238,239-243, 245.252-253.
Whittaker Roland M, "Química General" Editorial:
C.E.C.S.A., México, D.F., 1984, Página: 150 –
151
Autor:
Iván Escalona M.
Ocupación: Estudiante
Materia: Química
Estudios de Preparatoria: Centro Escolar Atoyac
Estudios Universitarios: Unidad Profesional Interdisciplinaria de
Ingeniería y Ciencias
sociales y Administrativas (UPIICSA) del Instituto
Politécnico Nacional (I.P.N.)
Ciudad de Origen: México, Distrito Federal
Fecha de elaboración e investigación: Noviembre de
1999
Profesor que revisó trabajo: Romero Sánchez
María del Rocío (Catedrática de la
U.P.I.I.C.S.A.)
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |