Principios de la Estructura atómica de la materia (página 2)
17
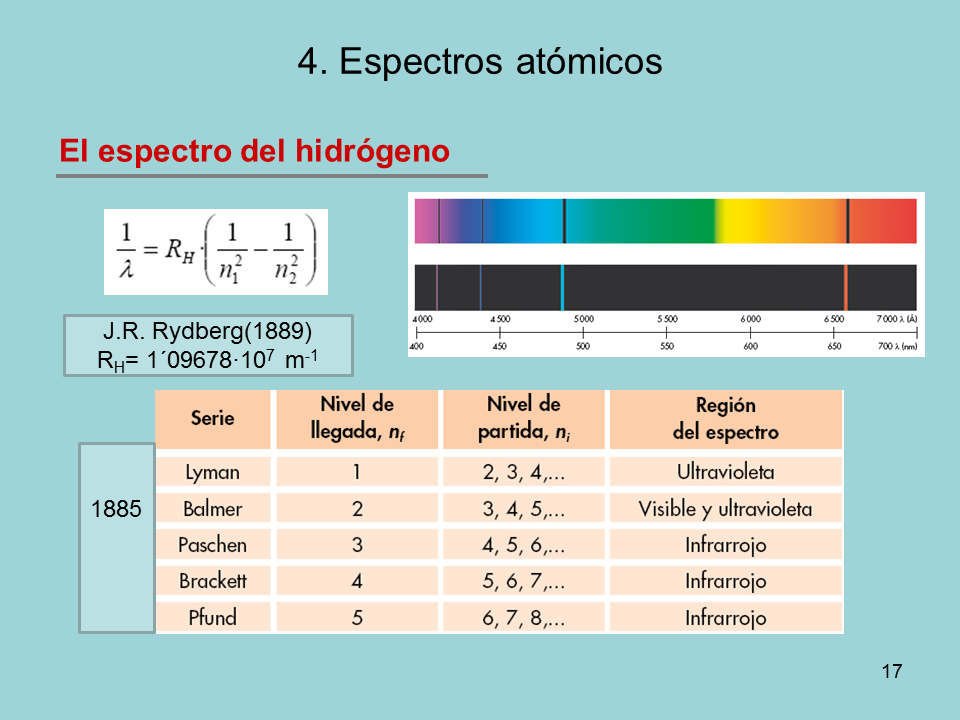
El espectro del hidrógeno
4. Espectros atómicos
J.R. Rydberg(1889)
RH= 1´09678·107 m-1
1885

18
Antecedentes: modelo de Rutherford
5. Modelo atómico de Bohr

19
Modelo de Rutherford (1911)
5. Modelo atómico de Bohr
Inconvenientes:
Según las leyes del electromagnetismo, cualquier cuerpo cargado eléctricamente y en movimiento acelerado, desprende energía. Colapso del electrón hacia el núcleo
No explica satisfactoriamente los espectros atómicos

20
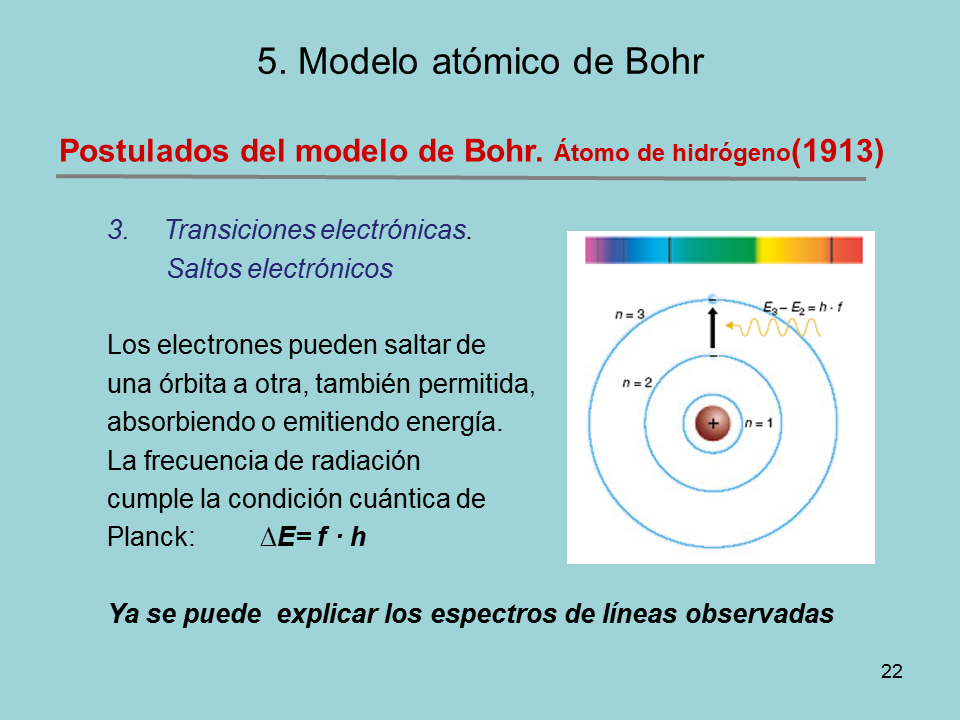
Postulados del modelo de Bohr. Átomo de hidrógeno(1913)
Introduce como aproximación que las órbitas son circulares
Estados estacionarios.
Fcentrípeta= F electrostática
me·v2 = K· e2
r r2
Ya no hay ni absorción ni emisión
de radiación y, por tanto, el electrón
mantendrá su nivel energético u órbita
5. Modelo atómico de Bohr

21
Postulados del modelo de Bohr. Átomo de hidrógeno(1913)
2. Condición de cuantización.
De las infinitas órbitas posibles para la física clásica, sólo se
aceptan los estados estacionarios, aquellas cuyo valor del
Momento angular “L” , sea múltiplo entero de h/2p
L= me·v·r= n· h/2p
Teniendo en cuenta: me·v2 = K· e2
r r2
r = ao·n2 ; (ao= 5´29·10-11 m) y v= 2p ·K· e2 1
h n
5. Modelo atómico de Bohr
22
Postulados del modelo de Bohr. Átomo de hidrógeno(1913)
Transiciones electrónicas.
Saltos electrónicos
Los electrones pueden saltar de
una órbita a otra, también permitida,
absorbiendo o emitiendo energía.
La frecuencia de radiación
cumple la condición cuántica de
Planck: ?E= f · h
Ya se puede explicar los espectros de líneas observadas
5. Modelo atómico de Bohr
23
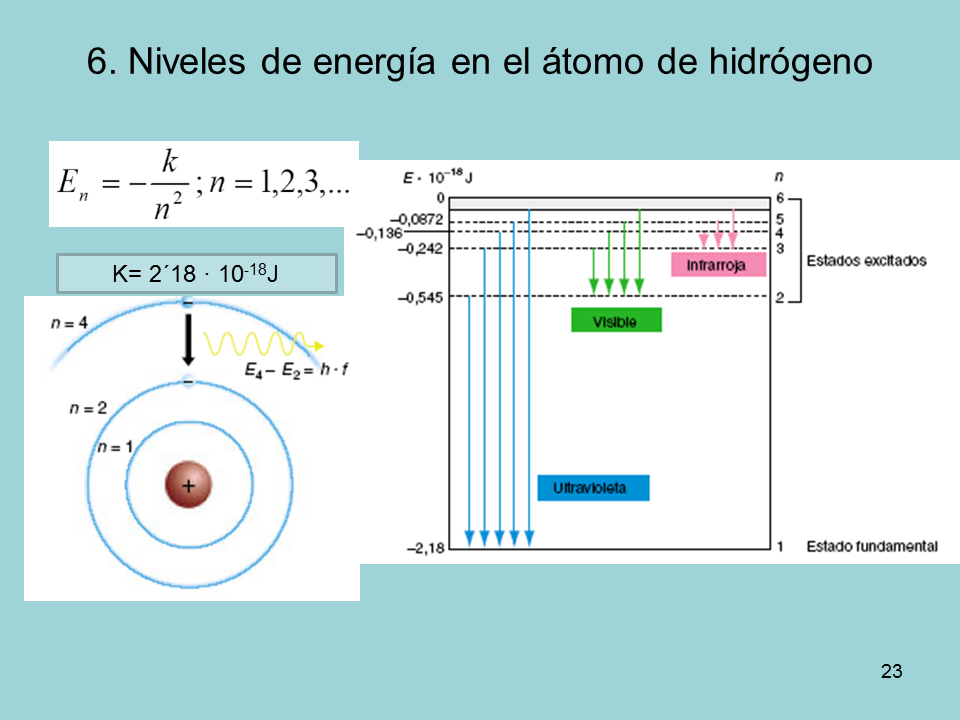
6. Niveles de energía en el átomo de hidrógeno
K= 2´18 · 10-18J

24
Aciertos del modelo de Bohr
Justifica la estabilidad del átomo (órbitas estacionarias).
Introduce el concepto de niveles de energía, lo que permite explicar el espectro atómico del hidrógeno mediante la hipótesis de los saltos electrónicos.
Relaciona las propiedades químicas de los elementos con su estructura electrónica (Sistema Periódico).
7. Desarrollo y limitaciones del modelo de Bohr
Inconvenientes del modelo de Bohr
Los resultados para los átomos polielectrónicos eran defectuosos.
Falta de coherencia: mezcla de ideas clásicas con ideas cuánticas.

25
Dualidad onda-corpúsculo para la materia (De Broglie) 1924
El electrón en el átomo de hidrógeno debe comportarse como una onda estacionaria.
8. Mecánica cuántica
Como onda estacionaria que se considera a un electrón enlazado a su núcleo, dicho electrón tiene permitidas ciertas órbitas
2p r = n ?
Como se postula una doble naturaleza
para el electrón, se cumple:
me·v·r= n· h/2p
(2º Postulado de Bohr, condición de cuantización)

26
Principio de incertidumbre
W. Heisemberg 1927
Ecuación de Schrödinger 1926
Ecuación de ondas del electrón.
Orbital atómico.
Al resolver la ecuación obtenemos una serie de soluciones, cada una
de las cuales describe un posible estado de energía para los electrones
en el átomo.
Cada e- de un átomo dado viene descrito por una combinación de
valores de los tres números cuánticos
n l ml
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |