Introducción
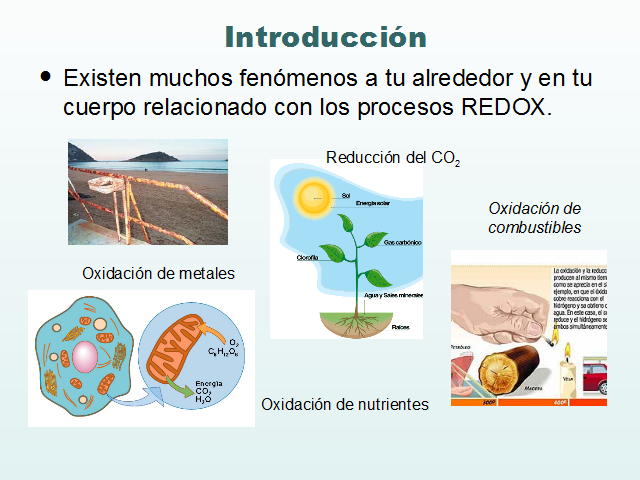
Existen muchos fenómenos a tu alrededor y en tu cuerpo relacionado con los procesos REDOX.
Oxidación de combustibles
Reducción del CO2
Oxidación de metales
Oxidación de nutrientes

Alcance y Campo de Aplicación
La disciplina que estudia las leyes de que rigen los procesos redox y su relación con la producción de electricidad se llama electroquímica.

Reacciones Ácido base v/s reacciones REDOX

Concepto de oxidación y reducción
Oxidación:
Un átomo o ion se oxida
Aumenta su estado de oxidación
Cede o pierde electrones
Zn
Zn
2+
+
2e-
Agente Reductor: Es la especie química que se oxida, es decir, la que cede electrones.
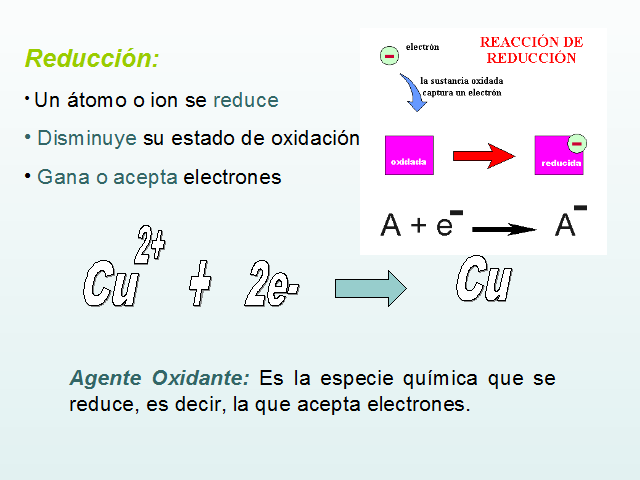
Reducción:
Un átomo o ion se reduce
Disminuye su estado de oxidación
Gana o acepta electrones
Cu
2+
Cu
+
2e-
Agente Oxidante: Es la especie química que se reduce, es decir, la que acepta electrones.

Observaciones
En los procesos de óxido reducción, la transferencia de electrones ocurre siempre desde un agente reductor a un agente oxidante.
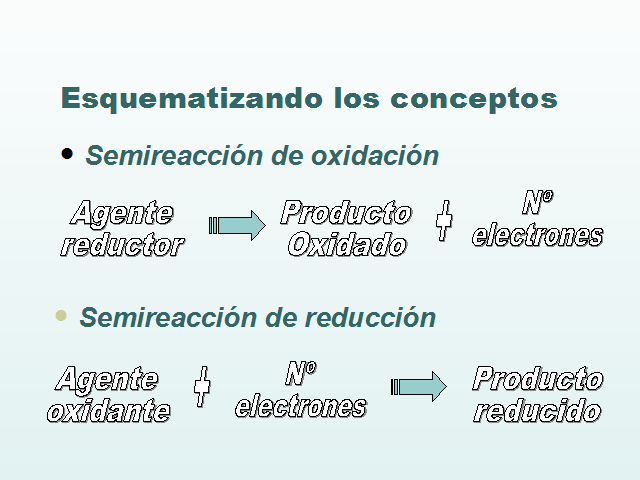
Esquematizando los conceptos
Semireacción de oxidación
Semireacción de reducción
Agente
oxidante
Nº
electrones
+
Producto
Oxidado
Agente
reductor
Producto
reducido
+
Nº
electrones
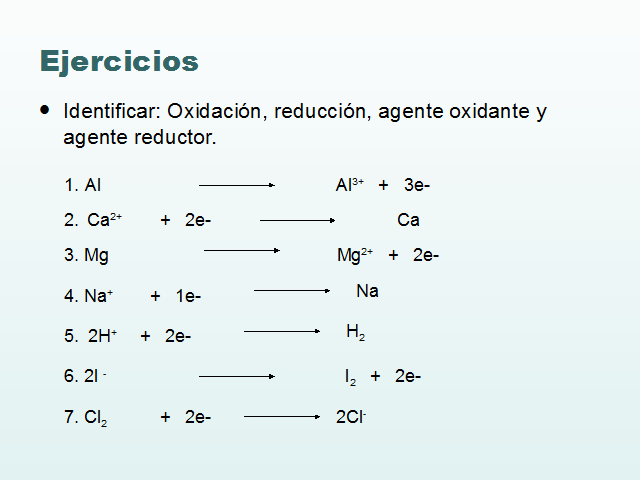
Ejercicios
Identificar: Oxidación, reducción, agente oxidante y agente reductor.
1. Al
2. Ca2+
3. Mg
4. Na+
5. 2H+
6. 2I –
7. Cl2
Al3+ + 3e-
Ca
+ 2e-
Mg2+ + 2e-
Na
+ 1e-
H2
+ 2e-
I2 + 2e-
+ 2e-
2Cl-

Estado o número de oxidación
Se define como la carga asignada a cada átomo que forma de un compuesto.
Indica la cantidad de electrones que podría ganar, perder o compartir en la formación de un compuesto.
Para determinar el estado de oxidación se debe seguir las siguientes reglas.

Reglas para determinar Estado de oxidación
1. El estado de oxidación de cualquier átomo en estado libre, es decir, no combinado, y moléculas biatómicas es CERO.
Elementos no combinados
Cu, Al, Ar, Ag
Moléculas biatómicas
H2, O2, Cl2, Br2

2. El estado de oxidación del hidrógeno es +1, excepto en el caso de los hidruros (MHv), donde es -1.
Ácidos Hidruros
H2SO4 NaH
+1 -1
Reglas para determinar Estado de oxidación

El estado de oxidación del oxígeno en la mayoría de los compuestos es -2, excepto en los peróxidos (M2O2v) donde es -1 y cuando se encuentra unido con el fluor, donde actúa con estado de oxidación +2.
Peróxidos Con Fluor
Na2O2 F2O
-1 +2
Reglas para determinar Estado de oxidación
Página siguiente  |