
Números cuánticos El modelo atómico de Bohr
introdujo un sólo número cuántico (n) para
describir una órbita. Sin embargo, la mecánica
cuántica, requiere de 3 números cuánticos
para describir al orbital (n, l, m,s):

Número cuántico principal (n): Representa al nivel
de energía y su valor es un número entero positivo
(1, 2, 3, ….) Se le asocia a la idea física del volumen
del orbital. n = 1, 2, 3, 4, …….

Número cuántico secundario o azimutal (l):
Identifica al subnivel de energía del electrón y se
le asocia a la forma del orbital. Sus valores dependen del
número cuántico principal (n), es decir, sus
valores son todos los enteros entre 0 y n – 1, incluyendo al
0.

Número cuántico magnético (m o ml): Describe
las orientaciones espaciales de los orbitales. Sus valores son
todos los enteros entre -l y +l, incluyendo al 0.

Valor de m según el ingreso del último
electrón al orbital.

Número cuántico de spin (s o ms): Informa el
sentido del giro del electrón en un orbital. Indica si el
orbital donde ingreso el último electrón
está completo o incompleto. Su valor es +1/2 o -1/2

En una configuración electrónica, un
electrón puede ser representado simbólicamente por:
Los números cuánticos para el último
electrón en este ejemplo serían: n = 3 l = 1 m = -1
s = +1/2 3p1 Indica la cantidad de electrones existentes en un
tipo de orbital Indica el número cuántico
secundario (l) Indica el número cuántico principal
(n)

Configuración electrónica Corresponde a la
ubicación de los electrones en los orbitales de los
diferentes niveles de energía.
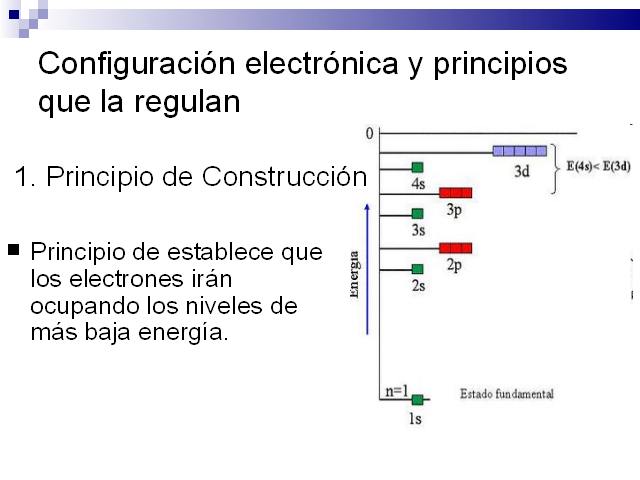
Configuración electrónica y principios que la
regulan Principio de establece que los electrones irán
ocupando los niveles de más baja energía. 1.
Principio de Construcción

Principio de exclusión de Pauling Establece que no pueden
haber 2 electrones con los cuatro números cuánticos
iguales. Primer electrón n= 1 l= 0 m= 0 s= +1/2 Segundo
electrón n= 1 l= 0 m= 0 s= -1/2

Principio de máxima multiplicidad: Regla de Hund Establece
que para orbitales de igual energía, la
distribución más estable de los electrones, es
aquella que tenga mayor número de espines paralelos, es
decir, electrones desapareados. Esto significa que los electrones
se ubican uno en uno (con el mismo espin) en cada orbital y luego
se completan con el segundo electrón con espin
opuesto.

Escribiendo configuraciones electrónicas Conocer el
número de electrones del átomo (Z = p = e). Ubicar
los electrones en cada uno de los niveles de energía,
comenzando desde el nivel más cercano al núcleo.
Respetar la capacidad máxima de cada subnivel (orbital s =
2e, p =6e, d = 10e y f = 14e). Verificar que la suma de los
superíndices sea igual al número de electrones del
átomo.

11Na Configuración electrónica para 11 electrones
1s2 2s2 2p6 3s1 Números cuánticos n = 3 ? = 0 m = 0
Notación global

Entre los elementos cuya configuración electrónica
no puede ser predicha por la regla de las diagonales se
encuentran el cromo, cobre, niobio, molibdeno,rutenio, rodio,
paladio, plata , lantano, cerio, gadolinio, platino, oro,
actinio, torio, protactinio, uranio, neptunio, plutonio y curio
(los nombres en rojo son los de elementos importantes para el
hombre).No olvides que, de entrada, un subnivel no podrá
comenzar a llenarse si todos los orbitales de un subnivel de
menor energía a él no se han llenado por
completo

Con el cromo (Cr Z = 24) surge otra aparente anomalía
porque su configuración es [Ar] 3d5 4s1. La lógica
de llenado habría llevado a [Ar] 3d4 4s2, sin embargo la
distribución fundamental correcta es la primera. Esto se
debe a que el semillenado de orbitales d es de mayor estabilidad,
puesto que su energía es más baja.

Con el cobre Cu Z = 29 sucede algo similar al cromo, puesto que
su configuración fundamental es [Ar] 3d10 4s1. La
configuración [Ar] 3d9 4s2 es de mayor energía. La
configuración con 10 electrones en orbitales d, es decir,
el llenado total de estos orbitales es más estable.

Notación global externa Es más compacta que la
anterior. Se remplaza parte de la configuración
electrónica por el símbolo del gas noble de Z
inmediatamente anterior al elemento. Gases nobles: 2He; 10Ne;
18Ar; 36Kr; 54Xe; 86Rn. 1s2 2s2 2p6 3 s 1 (10Ne) 3s1

Configuración de iones Cationes: Átomos que pierden
electrones Aniones: Átomos que ganan electrones. 11Na+
16S2- 1s2 2s2 2p6 (10Ne) 3s23p6 10 e- 18 e-