Primer principio de la termodinámica (Presentación PowerPoint)

1 PRIMER PRINCIPIO ENERGÍA INTERNA Y CALOR SISTEMAS
CERRADOS SISTEMAS ABIERTOS IRREVERSIBILIDAD MECÁNICA
PROCESOS EQUIVALENTES LEY DE JOULE CAPACIDADES
CALORÍFICAS

2 Como se indicó en la introducción del libro, el
primer principio de la Termodinámica no es otra cosa que
la ley de la conservación de la energía, aplicada a
un proceso en el que intervengan o puedan intervenir calor y/o
energía interna, que son las energías que la
Termodinámica aporta a la Física.

3 u = u(T,v) energía interna la energía interna es
una propiedad del sistema. Si apoyamos el sistema A sobre el B,
el émbolo podría subir hasta la posición II,
con lo que A realizaría un trabajo; luego el sistema ha de
poseer una energía propia, u:

4 No se nos escapa el hecho de que el sistema A recibió,
mientras tanto, energía del sistema B; es una nueva
energía a la que llamaremos calor, Q. El calor es una
energía de paso que cruza la frontera entre dos sistemas,
como consecuencia exclusivamente de una diferencia de temperatura
entre los mismos

5 La experiencia anterior podemos hacerla también
calentando el sistema con un ventilador por ejemplo, en lugar de
con calor. Llamaremos a esta energía trabajo de rozamiento
y/o rozamiento interno Wr . Conviene separar conceptualmente
ambas energías: Wr sólo puede ser recibido por el
sistema.

6 La experiencia anterior podemos hacerla también
calentando el sistema con un ventilador por ejemplo, en lugar de
con calor. Llamaremos a esta energía trabajo de rozamiento
y/o rozamiento interno Wr . Conviene separar conceptualmente
ambas energías: Wr sólo puede ser recibido por el
sistema.

7 Al pasar el émbolo de I a II:

8 Al pasar el émbolo de I a II: El calor y el trabajo son
energías de paso que cruzan los límites del
sistema: ambas energías modifican el estado del mismo y
con ello su energía interna; pero una vez que pasaron,
dejan de ser calor y trabajo.

9

10

11

12

13

14

15

16 Es un caso particular de trabajo interior: cuando la trans-
formación termodinámica está definida.

17 Es un caso particular de trabajo interior: cuando la trans-
formación termodinámica está definida.

18 Es un caso particular de trabajo interior: cuando la trans-
formación termodinámica está definida.

19 Es un caso particular de trabajo interior: cuando la trans-
formación termodinámica está definida. No es
función de estado, pues por cada camino el trabajo resulta
diferente

20 En la expansión dv > 0 W positivo En la
compresión dv < 0 W negativo

21 En la expansión dv > 0 W positivo En la
compresión dv < 0 W negativo Si un ciclo está
realizado en sentido de las agujas del reloj se trata de un
motor. Si es en sentido contrario, de una máquina
consumidora de energía mecánica.

22 En la expansión dv > 0 W positivo En la
compresión dv < 0 W negativo Si un ciclo está
realizado en sentido de las agujas del reloj se trata de un
motor. Si es en sentido contrario, de una máquina
consumidora de energía mecánica. W = área
A1M2B -?área A1N2B?

23 Primer principio En función del trabajo exterior

24 Primer principio En función del trabajo exterior En
función del trabajo interior

25 Primer principio En función del trabajo exterior En
función del trabajo interior En función del trabajo
de expansión

26 Primer principio En función del trabajo exterior En
función del trabajo interior En función del trabajo
de expansión Wr lo hemos pasado al primer miembro porque
ejerce sobre el sistema el mismo efecto que una recepción
de calor.

27 Isócoras, o a volumen constante Trabajo de
expansión en las transformaciones teóricas

28 Isócoras, o a volumen constante Trabajo de
expansión en las transformaciones teóricas
Isobaras, o a presión constante
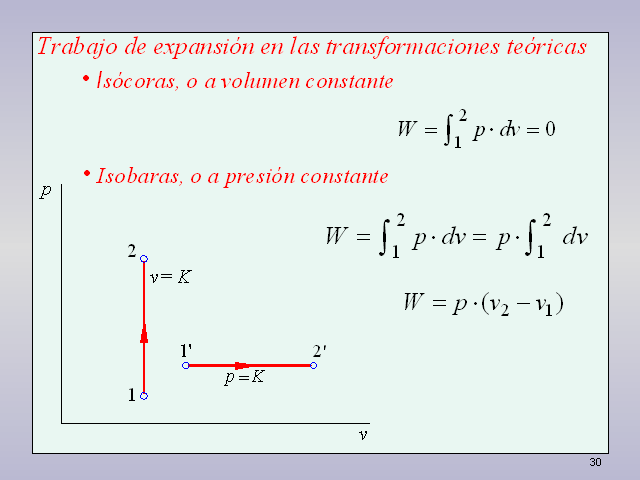
29 Isócoras, o a volumen constante Trabajo de
expansión en las transformaciones teóricas
Isobaras, o a presión constante

30 Isócoras, o a volumen constante Trabajo de
expansión en las transformaciones teóricas
Isobaras, o a presión constante gas perfecto (p?v =
R?T)

31 gas perfecto (p?v = R?T) Isotermas

32 gas perfecto (p?v = R?T) Isotermas

33 gas perfecto (p?v = R?T) Isotermas

34 Adiabáticas

35 Adiabáticas

36 Adiabáticas

37 gas perfecto (p?v = R?T) Adiabáticas
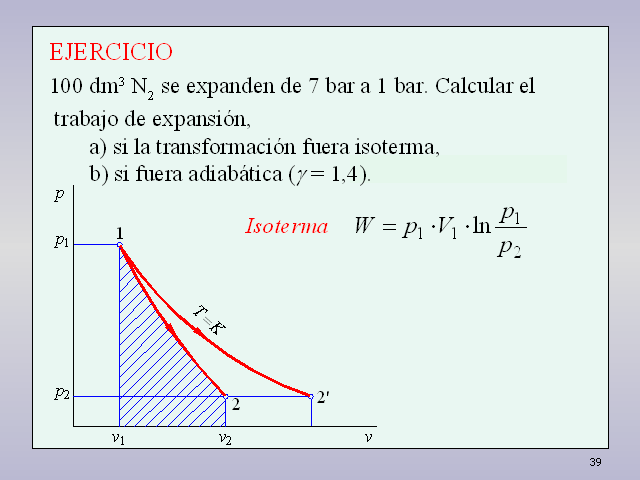
38 EJERCICIO 100 dm3 N2 se expanden de 7 bar a 1 bar. Calcular el
trabajo de expansión, a) si la transformación fuera
isoterma, b) si fuera adiabática (? = 1,4). Isoterma

39 EJERCICIO 100 dm3 N2 se expanden de 7 bar a 1 bar. Calcular el
trabajo de expansión, a) si la transformación fuera
isoterma, b) si fuera adiabática (? = 1,4). Isoterma

ESTA PRESENTACIÓN CONTIENE MAS DIAPOSITIVAS DISPONIBLES EN
LA VERSIÓN DE DESCARGA