Introducción
La relevancia que tiene la cinética
química, es porque da a conocer la rapidez con la que
sucede una reacción química, que se refiere al
cambio en la concentración de un reactivo o de un producto
en función al tiempo.
Por lo que es imprescindible saber sobre los
parámetros y propiedades que rigen la velocidad de la
reacción y como estos son afectados por factores como la
temperatura, presión, la concentración de las
especies inertes así como también de los
catalizadores.
Y es preciso el estudio de esta área para el
diseño de equipos, el control y el procesamiento de
productos, por ejemplo en las industrias farmacéuticas y
alimentarias, ya que estas buscan más acelerar la
velocidad de una reacción que mejorar el rendimiento de
esta.
I. OBJETIVOS
Se estudiara la velocidad con la que ocurre una
reacción en función de las concentraciones de
los reactivos y los productos respecto al tiempo.Se definirá la ley de rapidez o velocidad de
una reacción en relación con la constante de
rapidez y el orden de reacción.Hallar la velocidad de una reacción de manera
teórica mediante la ley de velocidad, para ser usado
con fines industriales en la creación de
fármacos.
Desarrollo del
tema
CINÉTICA: Estudia el movimiento de los
cuerpos sin tomar en cuenta las causas que lo
originan.CINÉTICA QUIMICA: Es un área de
la fisicoquímica que se encarga de explicar la
velocidad de una reacción que se manifiesta en la
variación de concentraciones de los reactivos o
productos referente al tiempo.
La velocidad no es constante por lo que cambia
frecuentemente a medida que varía la
concentración.
Habiendo así cierta curiosidad del por qué
ocurren las reacciones a distintas velocidades Por ejemplo: A una
velocidad alta que se produce en un tiempo corto, como la
fotosíntesis y la digestión; y a una velocidad baja
que se produce en un tiempo prolongado, como la conversión
del grafito en diamante.
Una reacción se representa:

LEYES DE LA VELOCIDAD:
¿QUÉ ES UNA LEY DE
VELOCIDAD?
Es la dependencia de una velocidad de reacción de
las concentraciones de las especies reactivas, o los productos y
de la constante de rapidez elevados a una potencia.

ORDEN DE UNA REACCIÓN: Es la suma de las
potencias a las que están elevadas las concentraciones de
dichos reactivos en la ley de rapidez. Se determina
experimentalmente.
REACCIONES DE ORDEN CERO: La rapidez de una
reacción de orden cero es una constante, que no depende de
la concentración de los reactivos.

REACCIONES DE PRIMER ORDEN: Es una
reacción donde la rapidez depende de la
concentración de un reactivo elevado a la primera
potencia.
Donde A es el producto:
Sabemos que la ley de velocidad es la igualdad de dos
fórmulas de velocidad de una reacción:

VIDA MEDIA DE UNA REACCIÓN: Es otra forma de
determinar la rapidez de una reacción de primer orden, en
la que se toma en cuenta el tiempo que se requiere para el
reactivo disminuya a la mitad del valor que tenía al
principio de la reacción. Esta forma de determinar la
velocidad de reacción no depende de la
concentración.
Siendo la ecuación de la siguiente
manera:

REACCIONES DE SEGUNDO ORDEN: La rapidez con que
ocurra una reacción depende que la concentración
del reactivo elevado al cuadrado o de dos reactivos cada uno
elevado a la uno.
Con una sola molécula como
reactivo:
Donde A es el producto:

FACTORES QUE ALTERAN LA VELOCIDAD DE UNA
REACCIÓN:
TEMPERATURA: Al incrementar la temperatura se aumenta la
velocidad con la que ocurre una determinada reacción. Pero
a mayor temperatura, se disminuye el rendimiento y los productos
que se formaron pueden percibir otras reacciones.
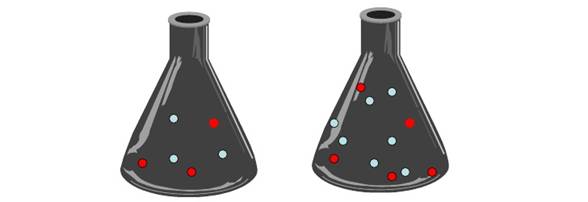
CONCENTRACIÓN: La velocidad de reacción se
incrementa al aumentar la concentración de reactivos, ya
que aumenta el número de choques entre las
partículas de los reactivos.
MAMIFESTACIÓN DE UN ACTALIZADOR: Catalizador es
el disminuye la energía de activación, acelerando
la velocidad de una reacción ya que forma un intermediario
con el reactivo, pero que no se consume sino que se recupera al
final de la reacción.
En una reacción:

En presencia de un catalizador:
La constante de velocidad que era K se
denominar velocidad catalítica Kc, el catalizador aumenta
la frecuencia de los choques de A y disminuye la energía
de activación.
CATÁLISIS HOMOGÉNEA: El catalizador y los
reactivos se encuentran en la misma fase o estado, puede llevarse
a condiciones atmosféricas, disminuyendo costos en
producción y evitando la pérdida de producto por la
acción del calor.
CATÁLISIS HETEROGÉNEA: El reactivo y el
catalizador se encuentra en distintas fases así como el
catalizador (sólido) y los reactivos (líquido o
gas), que es de gran importancia en la industria
química.
CATÁLISIS ENZIMÁTICA: Realizados por
enzimas que son catalizadores biológicos, que solo
actúa sobre moléculas específicas (sustrato)
sin alterar el resto del sistema, esta catálisis es
homogénea por que se producen en una disolución
acuosa.
Estas se encuentran en cantidades de 3000 enzimas
diversas en una célula viva.
TEORIA DE COLISIONES: El resultado del choque
de moléculas de los reactivos es una reacción
química. Y la velocidad de una reacción es
directamente proporcional al número de colisiones o
choques por segundo.

Existe cierta dependencia entre las concentraciones y el
número de colisiones, ya que al aumentar la
concentración el número de colisiones
también lo haría y así la rapidez
también aumentaría de manera que se expresa de la
siguiente manera:
Velocidad = K [A] [B]
Siempre ocurre una reacción cuando hay el choque
de un molécula de A con otra de B.
Para llevarse a cabo una reacción necesita una
energía cinética mínima (Energía de
activación Ea) para que sus enlaces se puedan romper, y
así puedan iniciar una reacción.
Una reacción pasa por un estado de
transición formando un complejo activado, que si es
más estable que los reactivos, libera calor durante la
reacción (exotérmica).
Y si es menos estable que los reactivos,
absorberá calor durante la reacción
(endotérmica).
LA ECUACIÓN DE ARRHENIUS: Relación de la
constante de rapidez con la temperatura.

APLICACIÓN EN LA INDUSTRIA
FARMACÉUTICA:
CINETICA DE MEDICAMENTOS:
La administración de medicamentos es el objetivo
de una materia llamada Farmacocinética. Las dos
vías más habituales son la intravenosa y la
oral
(Inyecciones y pastillas). Las inyecciones se utilizan
cuando es necesario que el medicamento este en sangre de forma
inmediata, para que se absorba a las células y tenga
actividad. Sin embargo, las pastillas se utilizan en tratamientos
prolongados.
Tanto la absorción de medicamentos hasta la
sangre como su eliminación, sobre todo en los
riñones, siguen cinéticas de orden uno. No son
procesos químicos, sino físicos, pero el
tratamiento matemático es similar. Fíjate en las
imágenes, en las que se marca en verde el nivel eficaz,
concentración mínima en sangre para que el
medicamento sea eficaz, y en rojo el nivel toxico, que no se debe
sobrepasar. En la dosificación intravenosa se alcanza un
nivel de medicamento en sangre más alto, pero se baja
antes del nivel eficaz. Sin embargo, en la dosificación
oral las dosis deben ser más altas.


Conclusiones
La cinética química es de
gran importancia en la rama de la farmacología, ya que
mediante su conocimiento podemos dar a conocer las reacciones que
ocurren con los medicamentos y ver en qué fase hay un
mejor rendimiento y una respuesta adecuada.
Para esto es necesario el conocimiento de
la ley de reacción, factores que influyen en la velocidad
de reacción y conceptos básicos de química
cinética.
Cualquier fármaco requiere una
concentración adecuada, para que actúe sobre
malestar, obteniendo el efecto deseado mediante la
disminución de concentración del fármaco a
medida que avanza el tiempo.
Bibliografía
RAYMOND CHANG (2010)
"Química", Editorial Mc Graw Hill
México, Décima
edición.
KUHN, FÓRSTERLING, WALDECK
(2012) "Principios de Fisicoquímica", Editorial
CENGAGE Learning Segunda edición.
II. WEB GRAFIA
http://es.wikipedia.org/wiki/sin%c3%A9tica
http://iesdmjac.educa.aragon.es/departamentos/fq/asignaturas/quimica2bac/materialdeaula/QUI2BAC%20Tema%202%20Cinetica%20quimica/QUI2BAC_Tema_2_Cinetica_quimica_Resumen.pdf
Autor:
Ccaso Chua, Yosselin
Yaneth
Mamani Yuca, Edith
Quispe Cano, Liz Thalia
Ramos Quispe, Aracely
Rusmery


UNIVERSIDAD ANDINA NESTOR CACERES
VELASQUEZ
FACULTAD: Ciencias de la Salud
C.A.P.: Farmacia y
Bioquímica
DOCENTE: Ing. Qco. VALDEIGLESIAS
JARA,
Jorge Raúl