Determinación del índice de bacterias mesofilas aerobias presentes en la leche (página 3)
La lucha contra la salmonelosis transmitida por la leche, requiere de un conocimiento exacto de la vía infecciosa animal leche- hombre y la manera de cortarla en la parte más conveniente.
5.1.13.8 Estreptococias Los estreptococos del grupo A pueden provocar en el hombre diversas enfermedades agudas: anginas, otitis media, escarlatina, erisipela, etc.
La leche puede contaminarse con gérmenes procedentes de personas que se encuentran en el período de incubación de una infección estreptocócica, así como de convalecientes y de portadores asintomáticos. En algunos casos, las personas que diseminan el m.o. infectan al ganado lechero provocando en él mastitis subclínicas o clínicas que determinan el paso a la leche de gran número de estreptococos.
La leche que se consume cruda o sometida a tratamientos térmicos insuficientes puede ser causa de infecciones humanas de tipo esporádicos o epidémicos.
Los estreptococos del grupo B (Str. agalactiae) son una causa corriente de mastitis en los países templados, pero su acción patógena para el hombre es poco acusada y sólo proliferan en tejidos muy susceptibles, como son los del útero después del parto y los del recién nacido.
La lucha contra las estreptococias transmitidas por la leche se basa en las medidas siguientes: vigilancia médica estricta de los operarios de las granjas y plantas, eliminación de la leche procedente de cuartos mamarios infectados o que presenten anomalías, enfriamiento adecuado de la leche y, sobre todo, tratamiento térmico correcto de toda la leche, comprendida le destinada a la preparación de mantequilla, queso y otros productos.
5.1.13.9 Tuberculosis El consumo de leche cruda representa el vehículo principal por el que los bacilos tuberculosos pasan del animal al hombre.
Las vacas lecheras infectadas son con mucho el reservorio más importante de bacilos tuberculosos. La incidencia de tuberculosis bovina en el hombre depende sobre todo de su presencia en el ganado vacuno y de la cantidad de leche cruda o insuficiente tratada que consume la población.
Los bacilos tuberculosos de la leche proceden unas veces del medio exterior contaminado (estiércol, polvo, etc.) y otras, las más, de las ubres afectadas; se ha observado, sin embargo, que los bacilos pueden pasar de la sangre a la leche a través de la ubre sin lesiones clínicas perceptibles. En términos generales puede decirse que el 4% aproximadamente de las vacas tuberculinas positivas eliminan bacilos tuberculosos en la leche, pero que sólo el 25% de los animales que excretan bacilos presentan lesiones evidentes de la ubre.
El bacilo tuberculoso de la variedad humana puede contaminar directamente la leche a partir de los ordeñadores y otros operarios, y llegar al consumidor del mismo modo que tantos otros gérmenes patógenos transmitidos por la leche, a menos que se destruya a tiempo con un tratamiento térmico adecuado.
5.1.13.10 Adenovirus Este grupo está integrado por unos veinte tipos diferentes de virus, aunque solamente algunos tienen carácter patógeno.
La vía común de transmisión parece ser la respiratoria; encontrándose algunos tipos en las heces. Es probable que la leche intervenga en la transmisión de los adenovirus.
5.1.13.11 Hepatitis Infecciosa El virus se transmite por vía oral, los convalecientes y las personas clínicamente sanas pueden intervenir en la difusión.
La hepatitis infecciosa debe considerarse como una de las virosis más graves que puede transmitir la leche.
Ni siquiera el agua clorada puede frenar la proliferación de virus. Por consiguiente, dejando aparte la contaminación directa por las manos sucias, la infección puede propagarse por agua de mala calidad.
5.1.13.12 Fiebre Q Enfermedad producida por una rickettsia, la Coxiella burnetti y se halla muy difundida en todo el mundo. En lo que a la infección humana se refiere, los principales reservorios se encuentran principalmente en tres especies de animales lecheros: la vaca, la oveja y la cabra. La infección humana se produce sobre todo por inhalación del polvo contaminado con líquido amniótico o con membranas fetales de animales infectados, pero también se observan casos causados por la ingestión de leche cruda contaminada.
El ganado infectado elimina Coxiella burnetti por la leche durante períodos prolongados (más de 200 días) aunque en cantidad variable de un día a otro.
La Coxiella burnetti pasa de la leche cruda a los productos lácteos, si antes no se efectúa una pasteurización adecuada.
5.1.13.13 Encefalitis transmitidas por las Garrapatas En sus focos naturales el virus encefalítico pasa de unos vertebrados a otros a través de garrapatas y los ácaros, las infecciones del hombre pueden producirse por picadura de garrapata o por vía oral, sobre todo por la ingestión de leche no tratada y procedente de animales infectados.
5.1.13.14 Botulismo El Clostridium botulinum y el C1. parabotulinum tienen esporas resistentes que se encuentran muy difundidas en el suelo y frecuentemente contaminan la leche y los productos lácteos, los tratamientos térmicos ordinarios no suelen destruirlo se han encontrado esporas viables en el queso, aunque generalmente sin las toxinas.
Aunque no se sabe con exactitud cuales son los factores que provocan la inhibición de estos microorganismos en la leche y el queso, es posible que la acidez de la leche y de algunos productos lácteos desarrollen un importante papel.
5.1.13.15 Gastroenteritis Enterotóxica Estafilocócica El peligro mayor que tiene la contaminación de la leche con estafilococos, reside en que algunas cepas de estos microorganismos, pueden producir una enterotoxina capaz de causar en el hombre gastroenteritis agudas. Esta enterotoxina es termoestable y los estafilococos que la producen se encuentran con mucha frecuencia en operarios aparentemente sanos y en el ganado lechero.
Sólo algunas cepas de estafilococos son toxígenas. La proporción de portadores de estafilococos potencialmente patógenos (coagulasa positivos) en la población general, varía según las zonas y las épocas; pudiéndose afirmar, sin embargo, que un 30-50% de las personas transportan estos estafilococos en las fosas nasales o en la piel, sobre todo si presentan forúnculos, heridas o ántrax.
Otra importante fuente de infección son las ubres y la piel de las vacas lecheras, infectada en ocasiones, por el contacto con portadores humanos.
El estafilococo no es termo resistente. Las combinaciones de tiempo y temperatura empleados normalmente en la pasteurización, destruyen la mayor parte de las especies de Micrococos.
Se han dado casos en los que, después de destruir todos los estafilococos mediante tratamiento térmico correcto de la leche, infectada, la enterotoxina conservaba potencia suficiente para producir gastroenteritis y otros trastornos.
La lucha contra la gastroenteritis producidas por la enterotoxina estafilocócica plantea un problema sumamente difícil.
No es nada fácil eliminar completamente todos los estafilococos existentes en la leche, que proceden algunas veces de infecciones latentes de las ubres, otras del propio personal de las lecherías y de las plantas elaboradoras.
Los operarios con heridas, forúnculos u otras lesiones estafilocócicas en las manos, no deberán manipular en ningún caso la leche ni los productos lácteos. Sin embargo, lo fundamental, es impedir la multiplicación de los estafilococos, evitando de este modo la formación de enterotoxina.
La leche recién ordeñada debe enfriarse con la mayor rapidez posible hasta 10 ºC por lo menos, conservándola así hasta su tratamiento térmico. Una vez realizado el tratamiento térmico correcto, es preciso evitar la recontaminación y multiplicación de los estafilococos. Bajo ningún concepto se debe permitir, por ejemplo, que la leche sometida a un tratamiento térmico parcial, permanezca a una temperatura favorable a la rápida multiplicación.
5.1.13.16 Infección por Clostridium Perfrigens (Welchii) El Clostridium perfrigens, aparece con mucha frecuencia en las heces de las personas, animales e insectos. Sus esporas son muy resistentes y se encuentran muy difundidas en los establos y granjas.
Bajo ciertas condiciones, este germen puede multiplicarse rápidamente en los alimentos almacenados luego de la cocción o de un calentamiento previo, provocando gastroenteritis en los consumidores.
La única medida realmente eficaz para combatir a este microorganismo es el enfriamiento rápido y la conservación de la leche a una temperatura inferior a 15ºC antes y después de la pasteurización.
5.1.13.17 Infección por Gérmenes Coliformes Se han atribuido, no pocos trastornos gastrointestinales a la acción de las bacterias coliformes de los géneros Escherichia, Pseudomonas, Citrobacter, Klebsiella y Proteus, generalmente sobre la base de información heterogénea e insuficiente. Lo que se ha demostrado claramente es que algunos Escherichia coli de los grupos 0, son causantes de la aparición de gastroenteritis agudas en niños y en adultos, actuando solos o en asociación con enterovirus.
Estudios efectuados , han mostrado que el 1% de las leches remitidas por los productores o centrales lecheras contiene E. coli enteropatógenos de los grupos 0, gérmenes que generalmente están implicados en la aparición de gastroenteritis.
Se ha observado que en las mastitis del ganado vacuno, se encuentran a veces E. coli enteropatógenos de los tipos que provocan con frecuencia gastroenteritis infantiles.
La investigación microbiológica de los gérmenes coliformes forma parte de los exámenes de leche cruda y pasteurizada en la mayor parte de los laboratorios de análisis de leche. Los resultados que se obtienen demuestran que estos gérmenes nunca aparecen en la leche correctamente pasteurizada, que ha dado prueba de fosfatasa negativa, excluyendo la recontaminación.
5.1.14 Toma de muestras para el análisis microbiológico Cuando las muestras de leche se destinan a análisis de tipo microbiológicos, es necesario tomar una serie de precauciones que además de garantizar la obtención de muestras verdaderamente representativas, eviten la contaminación por fuentes externas y la proliferación de la carga bacteriana ya presente en los productos. Entre esas precauciones destacan las siguientes:
a)Todos los equipos empleados en la toma de muestras deben encontrarse estériles y desinfectados antes de cada recolección. Por ejemplo,para el caso de los frascos para tomar muestras de leche cruda puede esterilizarse en una solución que contenga 250 a 500 ppm de cloro residual ("esterilización química") cuyo exceso se elimina por enjuague en agua estéril a fin de evitar que el desinfectante contamine el producto, donde actuaría como inhibidor microbiano.
b)Recolectar porciones representativas (no menos de 500 ml) directamente de tanques, recipientes de transporte , envases al por menor.
c)Tomar además las precauciones señaladas para muestras destinada al análisis físico o químico (1:1) con el propósito de obtener, conservar e identificar muestras representativas, excepto en lo que se refiere a la adición de preservativos, los cuales solo pueden adicionarse para recuentos bacterianos por el método microscópico directo (0,08 % de formaldehído para un análisis a efectuarse dentro de las 36 horas que siguen a la recolección) pero nunca para otros exámenes microbiológicos (ROBINSON,1997).
5.1.15 Determinación de la calidad microbiológica en la leche cruda PINZON, 1995. en su trabajo anota que para el análisis de la leche cruda existen diferentes métodos que permiten medir de manera indirecta o directa su calidad sanitaria.
5.1.15.1 Método indirecto Se fundamentan en la modificación de algunas propiedades por parte de los microorganismos. Dentro de este grupo están la determinación del sedimento (lacto filtración), temperatura, pH, acidez titulable, lacto fermentación y las pruebas de reducción de colorantes (azul de metileno, resazurina) 5.1.15.1.1 Sedimento: el sedimento obtenido por el método de lacto filtración mide la calidad sanitaria. La presencia de abundante partículas de sucio y su tipo (heces, insectos, tierra, restos de alimentos), puede indicar el cuidado que se ha tenido durante el ordeño y almacenamiento de la leche cruda.
5.1.15.1.2 Lacto fermentación: esta prueba permite observar las características del coagulo obtenido de la fermentación de una muestra de leche incubada a temperatura ambiente (35-37 ºC) por 24 horas. Según las características observadas se puede presumir acerca del tipo de bacterias predominantes, ya que un coagulo homogéneo sin o con pequeñas burbujas de gas, indicara predominio de bacterias lácticas homo fermentativas, por el contrario un coagulo grumoso con abundante gas puede indicar la presencia de bacterias coliformes.
5.1.15.1.3 Acidez Titulable y pH: ya se ha estudiado estas dos propiedades de la leche en el tema de físico químico. Esta claro que la fermentación microbiana modifica estos valores, aumentando la acidez y reduciendo el pH. Sin embargo hay que tener en cuenta que ciertos microorganismos proteo líticos pueden causar la coagulación dulce de la leche, es decir, sin acidez o con alcalinización de la leche.
5.1.15.1.4 Tiempo de reducción-TRAM-:esta prueba se fundamenta en como por el metabolismo microbiano hace variar el potencial de óxido reducción de la leche,para ello se utiliza como indicador el azul de metileno.
5.1.15.2 Método directo Se fundamentan en determinar la presencia y/o el número de microorganismo en los alimentos. En el análisis de la leche cruda se emplean los siguientes:
5.1.15.2.1 Recuento Microscópico Directo: el recuento microscópico directo es una técnica que tiene poco uso en el análisis de la leche cruda. En el se analiza un frotis de una muestra diluida la cual se colorea con un colorante especial (Newman Lambert), y se hace recuento de las células bacterianas observadas en varios campos. El promedio del conteo se multiplica con el factor del microscopio (valor relacionado al área del frotis, el diámetro del objetivo y la dilución de la muestra) para obtener el número de bacterias por mililitro de muestra. Se debe tener en cuenta que en el conteo intervienen las células vivas y las muertas.
5.1.15.2.2 Recuento Estándar en Placa (REP): también conocido como recuento de aerobios mesófilos, es el análisis directo mayormente empleado para determinar la calidad microbiológica de la leche y otros alimentos. El método consiste en hacer diluciones de la muestra y sembrar en placas de petri con agar estándar; luego de 24 a 48 horas de incubación a 37 ± se cuentan las colonias observadas las cuales permiten obtener el número de unidades formadoras de colonias por mililitro o gramo de muestra (ufc/mL o ufc/g). Los resultados obtenidos siempre son inferiores a los reportados con el recuento directo, ya que aquí solo intervienen microorganismos vivos capaces de formar colonias, además una colonia puede estar originada por uno o más de una unidad formadora de colonias.
5.1.15.2.3 Recuento de Bacterias Termodúricas, Termófilas, Psicrófilas: cuando se desea determinar los tipos microbianos presentes en la leche se utilizan análisis específicos. Usando el método del REP pero variando la temperatura de incubación se pueden seleccionar los diferentes grupos de bacterias según su temperatura optima de crecimiento.
5.1.15.2.4 Coliformes Totales, Coliformes Fecales, Número mas Probable (NMP): en los apartes anteriores ya se discutió la importancia del estudio de las bacterias del grupo coliforme. Su determinación puede hacerse en placas con agar rojo bilis cristal violeta (coliformes totales) o en tubos con caldo verde brillante (NMP), donde además se puede observar la acumulación de gas.
5.1.15.3 Pruebas Específicas (Determinación de Salmonelas, Staphylococcus): ciertas especies bacterianas tienen especial interés en alimentos, especialmente por su poder patógeno. En leche en polvo se exige la determinación de Salmoneras y en productos lácteos es conveniente hacer determinaciones de estafilococos específicamente Staphylococcus aureus.
Además de los análisis mencionados anteriormente existen otros especiales que se relacionan con la calidad sanitaria.
5.1.16 Tiempo de Reducción de Azul de Metileno Continuando con las pruebas para evaluar la calidad microbiológica de la leche cruda, se analizará el tiempo de reducción de azul de metileno "TRAM" antiguamente llamado Reductasa.
Para explicar mejor los fundamentos de esta prueba, se inicia con el procedimiento que se usa para su montaje:
En un tubo se vierten 10 c.c de leche a examinar y se agrega 1 c.c. de una solución estandarizada de Azul de metileno. Inmediatamente la mezcla se torna azul, el tubo se coloca en un baño de agua a 37 °C y se inicia el control del tiempo con lecturas cada 30 minutos; cuando el tubo cambie de color a blanco. Anotando el tiempo que demoró este cambio y el resultado se expresa en horas o fracción de media Cada media hora se revisan los tubos y cuando haya cambiado de color de azul a blanco se determina el tiempo que demoró este cambio y se expresa en horas o fracción de media.
Para explicar esta reacción es necesario hacer las siguientes consideraciones:
** El colorante azul de metileno el cual es un indicador de oxido- reducción, es azul cuando está oxidado e incoloro cuando está reducido.
** Varias especies de bacterias, no todas las que pueden contaminar la leche, tienen la capacidad de secuestrar el oxígeno presente en el medio y por lo tanto generar la reducción del azul de metileno con la consecuente pérdida del tono azul.
** Básicamente la velocidad con la cual se reduce el azul de metileno depende del número de microorganismos que tienen el efecto reductor, es decir que a mayor número de bacterias con esa propiedad, menor será el tiempo necesario para que se produzca el cambio de color en el tubo. Esto es lo que comúnmente se describe en bacteriología como un recuento metabólico indirecto. Internacionalmente la tabla de interpretación del TRAM se relaciona con las siguientes recuentos de bacterias /mL.
Tabla 1.Interpretación del TRAM

Como se puede ver en la tabla las variaciones pueden ser de número de bacterias para determinado rango de variación es muy variable, razón por la cual la prueba a nivel mundial ha perdido aplicación como elemento para medir el número de bacterias.
A lo anterior se suma el hecho de que un gran número de bacterias que hacen parte de la contaminación de la leche durante el ordeño tienen poca actividad reductora del azul de metileno y los números de bacterias para un determinado TRAM se ven incrementado en forma muy significativa, en aquellos ordeños donde las practicas de higiene son deficientes.
En la investigación consignada en la tesis de grado de la Universidad Javeriana "Actividad de microorganismos en leches crudas de la sabana de Bogotá y su relación con la prueba TRAM" bajo la dirección de Blanca Cecilia Gaviria, donde se examinaron 397 muestras de leche para prueba de acidez , TRAM , Recuento de bacterias mesófilas Aerobias y Recuento de Termodúricos, que llegaron a una planta pasteurizadora en la sabana de Bogotá se muestran variaciones mas amplias con relación a la tabla estandarizada . Los hallazgos en esta investigación muestran la siguiente tabla:

Como se puede observar mientras que en la tabla internacional, 6 horas de TRAM significan menos de 500.000, en nuestro medio ese mismo tiempo corresponde aproximadamente a 2 millones de bacterias. Estas grandes diferencias se originan en la diversidad de fuentes de contaminación a que se ve sometida la leche cuando fallan las prácticas de higiene y se facilita la contaminación con microorganismos provenientes del intestino de los animales, que en general tienen muy poca actividad reductora, comparativamente con bacterias de los géneros Streptococcus y Lactobacillus que son habitantes normales de la glándula mamaria y que a través de ella pueden llegar a la leche.
Basados en la actividad metabólica de los diferentes microorganismos que pueden contaminar la leche, la prueba TRAM puede castigar leches que tienen poca contaminación ambiental pero con presencia de bacterias con gran capacidad reductora, como las mencionadas, y de otra parte favorecer al leches con alto número de bacterias contaminantes ambientales producto de ordeños antihigiénicos pero que demoran mucho en reducir el azul de metileno.
Otra razón para tener largo tiempo de TRAM frente a un alto número de bacterias es, que la leche examinada contenga sustancias que inhiban el crecimiento bacteriano, por ejemplo, preservantes químicos o antibióticos, compuestos que cuando se está haciendo el Recuento en Placa, por el factor de dilución a que se somete la muestra, pierden actividad o capacidad inhibitoria.
El hecho de tener cortos tiempos de TRAM y Recuentos bajos de bacterias, es posible cuando varias células bacterianas se encuentran agrupadas y una Colonia (UFC) es el resultado de uno de estos grupos o de una sola célula. Por esto en los recuentos de Bacterias Mesófilas se usa el término Unidades Formadoras de Colonia (UFC). En la Prueba de TRAM el hecho de que las bacterias estén agrupadas o separadas no influye porque independientemente cada célula cumple su acción metabólica.
Por todas las razones que se han comentado, la prueba TRAM tiene muy poca capacidad para evaluar el número real de microorganismos presentes en leche cruda, y es así como cada día es menos utilizada en la industria para tal efecto. Si el Acuerdo de Competitividad existente en Colombia contempló esta posibilidad como criterio de calidad higiénica, se debe a las limitantes que existen en muchas regiones del país para implementar los Recuento de Bacterias viables, pero como el mismo Acuerdo lo contempla se hace necesario que en poco tiempo se cambie a los recuentos viables como ya se hace por parte de muchas plantas procesadoras en diferentes partes del país. Ojalá que este tránsito se haga en el menor tiempo posible.
5.2 MARCO LEGAL Para la realización de este trabajo se tomaron como referentes para el análisis de los resultados, los Decretos números 616 del 28 de febrero de 2006 y el 2838 del 24 de agosto del 2006 emanados por el Ministerio de la Protección Social. en los cuales se expide el Reglamento Técnico sobre los requisitos que debe cumplir la leche para el consumo humano que se obtenga, procese, envase, transporte, expenda, importe o exporte en el País.
6. Metodología
6.1. LOCALIZACIÓN GEOGRAFICA El proyecto de investigación se realizo en la zona urbana del municipio de Popayán, con una altura sobre el nivel del mar de 1750 mts. en terrenos con topografía suave. La temperatura anual promedio varía entre 16° y 20° C y la precipitación entre 2000 y 2300 mm. (POT. Municipio de Popayán, 2002).

Mapa 1.Zona Urbana del Municipio de Popayán FUENTE:P.O.T.2002
6.2. TAMAÑO DE LA MUESTRA Para este estudio y determinar realmente las condiciones en particular que se encuentra la leche en el momento de la comercialización al consumidor, se tomaron aleatoriamente 30 muestras de leche cruda esto en razón de que no es fácil determinar el total de minoristas que existen en la ciudad, ya que los mayoristas venden la leche a todo aquel que llega con una tina o recipiente sea cliente frecuente o no el cual recorre la ciudad vendiendo el producto en bicicletas,motos,triciclos o en forma ambulante, así mismo y al azar en tiendas expendios autorizados de las diferentes leches pasterizadas mas representativas para un total de 10 muestras en dos muestreos.
6.3. ZONAS DE MUESTREO

Mapa 2.Zonas por comunas para toma de muestras Teniendo en cuenta que la zona urbana del municipio de Popayán, esta dividida en 9 comunas se han determinado 3 zonas definidas de acuerdo al tamaño de las mismas por barrios y numero de habitantes. (POT 2002) El trabajo de campo se realizo durante mes de agosto del 2006,con el fin de evaluar la carga bacteriana se tomaron muestras de leche cruda en horas diferentes para este caso entre las 8 y 10 de la mañana, para la leche pasteurizada en tiendas y puntos de venta autorizados determinando en estos la cadena de frío.
Para recolectar muestras de leche cruda se tomaron directamente de los recipientes que en forma minoritaria se vende a los consumidores.
Para leches pasteurizadas se tomo la muestra de la bolsa, con el fin de diferenciarlas de las muestras de leche cruda se determino marcar estas muestras con letras.( A,B,C,D,E ) Cualquiera que sea el caso, una vez obtenida la muestra se transfiere a un frasco estéril y se conserva de acuerdo a lo indicado en las instrucciones generales.
6.4.DETERMINACIÓN DE BACTERIAS MESOFILAS EN LA LECHE Cuando se habla del tema de cómo determinar la Calidad Microbiológica de la Leche Cruda, se trata las diferentes clases de Recuentos de Bacterias haciendo énfasis en el Recuento de Bacterias Mesófilas Aerobias, el cual es considerado como la "prueba de oro" para evaluar la calidad higiénica de la leche.
La leche tiene múltiples fuentes de contaminación:
–La ubre sana que en condiciones normales puede aportar hasta 1.000 microorganismos / ml –La ubre con mastitis donde dependiendo del microorganismo que la cause, un solo cuarto afectado mezclado con la leche de 99 sanos, puede incrementar el recuento hasta de 100.000 bacterias en la leche del hato.
–La contaminación ambiental durante el ordeño, producto de deficientes prácticas de manejo, permite que microorganismos de la piel de los pezones, manos del ordeñador, pezoneras, equipos de ordeño, baldes y todo el entorno del ordeño, lleguen a la leche. Esta es la fuente de contaminación más importante y variable, ya que aporta un gran número de microorganismos con diferentes propiedades microbiológicas.
A la contaminación inicial de la leche debe sumarse la multiplicación que sufren las bacterias, debido a que esta es un excelente Medio de Cultivo para la mayoría de los microorganismos.
Algunos ejemplos en el siguiente cuadro permiten explicarlo:
Cuadro 13.Tiempos de duplicación de bacterias presentes en la leche cruda

Esto explica y justifica, la importancia que tiene la refrigeración entre 3 y 5 °C para la conservación de la leche cruda.
En la leche cruda se encuentran microorganismos con diversas características metabólicas donde los grupos más importantes son las Bacterias Mesófilas Aerobias las cuales conforman el grupo más amplio y es el que se aplica como criterio de calidad en la leche cruda y se usa como base para las bonificaciones o sanciones.
Provee la mayor información sobre la calidad higiénica de un producto. Es mal llamado, Recuento Total de Bacterias, ya que muchos otros tipos de bacterias no quedan incluidas, porque sus rangos de temperatura óptima de crecimiento son diferentes o el oxígeno les es inhibitorio. Como la lectura se hace contando el número de colonias que aparece en la placa, como producto de la multiplicación a partir de una sola célula bacteriana o de un grupo de ellas, el resultado se expresa en unidades formadoras de colonia U.F.C. / ml.
Aunque las normas internacionales fijan que la leche cruda debe tener menos de 100.000 UFC/ml de este grupo, la Industria quiere y bonifica leches con un menor número de bacterias y es así como los mejores precios están para leches que tienen menos de 30.000 UFC/ml.
Parecería utópico pensar que leches con estas cifras, fueran posibles en el mercado colombiano, pero existen hatos que entregan leches con menos de 20.000 y aún menos de 10.000 UFC/ml, indicando que es factible hacerlo cuando se aplican unas buenas prácticas de manejo en el proceso de ordeño y acopio de la leche.
6.4.1.Recuento estándar en placas de agar (Recuento de aerobios Mesófilos) El recuento estándar en placas (REP) o recuento de aerobios mesófilos, es un método macroscópico, empírico, universalmente utilizado para determinar en forma aproximada la carga bacteriana. Esencialmente consiste en determinar el numero de colonias que se desarrollan cuando se siembra una cantidad medida o pesada de muestras, en placas de agar de composición estándar preparadas bajo condiciones estipuladas, a objeto de obtener reproductividad en los resultados en diferentes laboratorios.
Antes de la siembra, la muestra se prepara para asegurar su homogeneidad, dispersar los grumos de bacterias y distribuirlas uniformemente. Esto se logra por agitación bajo condiciones especiales. Luego, la muestra se diluye por lo menos dos veces (1:10 y 1:1000) con agua amortiguada (amortiguador de fosfato) en botella especiales que se agitan con la muestra. Seguidamente, con pipetas esterilizadas de 1,1 mL, se transfieren 0,1 y 1,0 mL de cada dilución a placas de Petri estériles, donde se mezclan con 10- 12 mL de agar estándar fundido a 45°C. Una vez solidificado el agar, las placas se incuban invertidas a 32 o 35°C por 48 ± 3 horas y finalmente se cuentan aquellas placas que presentan entre 30 y 300 colonias (25 a 250 según las nuevas normas de la APHA). Multiplicando él número de colonias de una placa, aproximadamente hasta el segundo digito, por la dilución correspondiente, se obtiene él número aproximado de bacterias que se desarrollan a partir de 1 mL o g de muestra, el cual se expresa como recuento total en placas.
Los resultados obtenidos por este método permiten establecer la calidad sanitaria de la leche.
Este método puede aplicarse tanto a la leche y derivados fluidos como a los productos lácteos semisólidos o sólidos, variando fundamentalmente el procedimiento de preparación de las diferentes muestras y de la primera dilución. Particularmente en los productos sólidos es necesario pesar la muestra directamente sobre una botella de dilución bajo condiciones asépticas.
6.5 MATERIALES Y EQUIPOS ! Pipetas de 1,1 y 11 mL.
! Botellas de dilución (180 mL) graduadas a 99 ± 1 mL con tapas de rosca.
! Mechero de Bunsen.
! Placas de Petri 100 * 15 mm, de vidrio o plástico.
! Baño termoregulado ( 45 ± 1°C).
! Estufa de incubación 32 o 35 ± 1°C).
! Contador de colonias, tipo Québec, de campo oscuro.
! Balanza 500g, de sensibilidad reciproca de 53g.
! Equipos comunes para preparación de medios de cultivo 6.5.1 Reactivos y medios de cultivo ! ("Estándar Methods AHPA").
! Glucosa (Dextrosa).1 g.
! Agar, grado de bacteriológico 15 g.
! Agua destilada.1000 mL PH 7,0 +/- 0,1 ! Azul de metileno grado bacteriológico 6.5.2 Muestras ! Leche cruda ! Leches pasteurizadas de diversas marcas 6.5.3.Procedimiento 6.5.3.1 Limpieza y esterilización del materia de vidrio.
a)Limpiar las botellas de dilución, tubos de ensayo, placas de Petri, pipetas y demás material de vidrio sucesivamente con agua jabonosa tibia, agua del grifo y agua destilada. El material de vidrio, específicamente las pipetas, deben mantenerse sumergidos en agua de grifo hasta el momento de la limpieza y periódicamente debe sumergirse en mezcla sulfocromica. Después del lavado, el material debe escurrirse, secarse y protegerse del polvo. b)Esterilizar el material de vidrio limpio y seco.Para ello las pipetas se colocan en estuches metálicos que se llenan solamente hasta 2/3 de su capacidad, o bien se envuelven en papel. La boca de los frascos de vidrio se tapan con algodón y encima se recubren con papel que se fija al cuello con hilo o liga. El horno no debe llenarse en forma excesiva y su temperatura debe mantenerse por encima de 160°C . La esterilización se obtiene por calentamiento a 170°C durante 2 horas. El material esterilizado debe conservarse en gabinetes adecuados, protegidos del polvo y la humedad.
6.5.3.2 Preparación y esterilización del medio de cultivo en autoclave:
a) Disolver el medio deshidratado o los ingredientes del mismo, en 500 mL de agua en un recipiente de vidrio o acero inoxidable. Aplicar agitación ocasional durante 3-5 minutos, seguida de calentamiento. Ajustar el pH, si es necesario, a 7,0 +/- 0,1, haciendo las mediciones con un potenciómetro a 45°C.
b) Diluir hasta 1000 mL a 20°C.
c) Distribuir el medio en frascos (120 mL) o en tubos (10-12 mL) y taparlos con algodón.
d) Esterilizar en el autoclave a 121°C durante 15 minutos y conservar al abrigo del polvo y humedad.
6.5.3.3 Identificación de las diluciones y placas:
a)Antes de hacer las diluciones de la (s) muestra (s) se deben colocar en orden sobre el mesón perfectamente horizontal y cerca del mechero encendido, se requieren de 2 blancos de dilución y 4 placas de Petri por cada muestra a analizar. A veces se utilizan una quinta placa para sembrar la muestra no diluida.
b).Rotular las botellas con la dilución a obtener, por ejemplo 1:10 (1:101 o 10-1) y 1:1000 (1:103 o 10-3). Rotular las placas indicando el número de la muestra, la dilución que se ha de sembrar, la fecha y hora de la siembra.
6.5.3.4 Preparación de la muestra y diluciones:
a).El tiempo empleado entra la dilución de la primera muestra y la siembra de la última placa de una serie, no debe ser superior a 20 minutos. Por lo tanto, el trabajo debe planificarse de modo que se ajuste a esta condición.
b).Mezclar la muestra en forma completa y vigorosa hasta homogeneizarla bien. Además, inmediatamente antes de transferir un volumen de muestra o dilución, agitar el frasco 25 veces en 7 segundos, con movimientos de vaivén vertical de aproximadamente 30 cm.
c).Preparar una dilución 1:10 (10-1). Para ello, con pipeta estéril, transferir 11 mL de leche a un blanco de dilución (99 mL). La operación debe hacerse introduciendo la punta de la pipeta en la muestra no mas de1,5-2,5 cm para evitar succionar aire o espuma, tocando con ella la parte inferior interna del frasco y ajustando el volumen a medir hasta la señal (11 mL) de manera que se mantengan un ángulo de 45° entre la pipeta y la normal. Descargar el volumen medido en el blanco de dilución rotulado, tocando con la punta la parte inferior del cuello, dejando caer él liquido durante 2- 3 segundos y tocando luego una sola vez un punto seco en el vidrio, sin soplar la ultima gota.
d).Preparar una dilución 1:1000 (10-3) transfiriendo, con pipeta estéril, 1 mL de la dilución 1:10 (10-1) a un segundo blanco de dilución rotulado, siguiendo la misma técnica anterior.
e).Si es necesario, se pueden continuar haciendo diluciones en la misma forma anterior.
6.5.3.5 Siembra e incubación de las placas:
a).Colocar los frascos o tubos conteniendo el medio de cultivo en un baño Maria hirviendo para fundirlo. Esta operación debe hacerse sin emplear mas medio del que pueda utilizar en un espacio de 3 horas, evitando su exposición prolongada a temperaturas excesiva altas durante y después de la fusión. Una vez fundido el medio, mantenerlo en baño Maria o incubadora a 45 ± 1°C, controlando la temperatura con un termómetro que se introduce en un frasco o tubo similar a los del medio, pero conteniendo agua.
b).Utilizando una pipeta estéril de 1,1 mL, transferir 0,1 mL y 1 mL de la primera dilución (10-1) a las placas correspondiente, debidamente rotuladas (10-2 y 10-1). Esta operación debe hacerse manteniendo la pipeta de manera que forme un ángulo de 45°, levantando la tapa de la placa solo lo suficiente para introducir la punta de la pipeta, tocando el fondo de la placa durante la descarga y luego levantando la pipeta sin tocar otra área seca de la placa. c).Con una nueva pipeta estéril, repetir la operación anterior transfiriendo 0,1 y 1,0 mL de la siguiente dilución (10-3) a las placas rotuladas (10-4 y 10-3). Continuar con las siguientes diluciones en la misma forma, en caso de que se hayan preparado. d).Verter 10-12 mL del medio de cultivo fundido (45 ± 1°C) en cada placa de Petri, flameando la boca del recipiente antes de la adición. En cada caso mezclar completamente el medio con las porciones liquidas previamente colocadas, haciendo girar la placa primero en una dirección y luego en la opuesta, evitando derramar la mezcla por los bordes y dejando solidificarse sobre una superficie nivelada (5-10 minutos).
e).Es conveniente preparar un control de esterilidad utilizando 1 mL de agua de dilución a fin de verificar la asepsia del proceso y la esterilidad del medio y demás materiales empleados.
f).Llevar las placas solidificadas a la incubadora (35°C) en forma invertida, donde deben distribuirse en pilas de no más de 6 placas, separadas entre sí por lo menos 2,5 cm. Mantener la incubación durante 48 ± 3 horas en condiciones de humedad relativa normal. La perdida de peso del medio durante las 48 horas de incubación no debe ser superior al 15 %.
6.5.3.6 Selección de las placas y recuento de las colonias: a).Después del periodo de incubación, seleccionar aquellas que presentan de 30 a 300 colonias no difusas.
b) Contar las colonias con ayuda de amplificación, preferiblemente con un contador de colonias tipo Québec de campo oscuro, provisto de una placa guía marcada en centímetros cuadrados. Deben contarse las colonias incluyendo las puntiformes, que no deben confundirse con partículas de medio no disueltas o sustancias precipitadas.
c).Multiplicar el numero total de colonias por él reciproco de la dilución correspondiente, haciendo la aproximación hasta el segundo digito que se sigue de tantos ceros como sean necesarios para indicar la dilución correcta. Por ejemplo, sí el conteo de una placa cuya dilución es de 10-3 muestra el desarrollo de 128 colonias, el resultado se expresara "Recuento estándar en placas por mL = 130.000". No deben expresarse los resultados como "numero de bacterias por mL".(PINZON,1995) d). Cuando se preparan placas de la misma dilución en duplicado, se debe tomar el promedio de los recuentos obtenidos. Si solo una de las placas presenta 30-300 colonias, debe promediarse ese resultado con el otro aunque se salga de dichos valores.
e) .Cuando se observa ausencia de placas con 30-300 colonias, se debe contar aquella cuyo recuento se aproximan más a 300 colonias.
f).Si él número de colonias observado es excesivamente alto y por lo tanto difícil de contar, se puede calcular contando solamente 13 cuadros (centímetros cuadrados) representativos diferentes y multiplicando el resultado por el factor 5. Si él número de colonias por centímetros cuadrados es mayor de 10, se pueden contar solamente las colonias presentes en 5 cuadros y multiplicar el resultado por 13.
g).Cuando ninguna placa presenta mas de 30 colonias, se debe contar aquellas de menor dilución señalándose como menos de 30 veces la dilución correspondiente; así, en el caso de la dilución 10- 2, el resultado se expresará "Recuento estándar en placas = menos de 3.000".
h) Si se observan colonias difusas, el recuento total puede estimarse contando áreas representativas bien distribuidas pero libres de dichas colonias. Sin embargo esto solo puede hacerse cuando el área cubierta por esas colonias no es superior a la mitad de la placa.
6.6 OBSERVACIONES Existen diferentes métodos menos costosos y más rápidos que el recuento estándar en placas para la determinación del número de gérmenes viables en la leche y derivados. Estos métodos, aunque relativamente menos exactos, entre ellos se encuentran el método del tubo ovalado, el método de la siembra en placa con asa calibradas, el método de la microplaca y el método del tubo rotatorio. Pueden emplearse técnicas aun más sencillas pero que permiten obtener cierta información cualitativa, como son el método de la tira de papel impregnada con medio de cultivos ("Bactostrip"). (PINZON,1995)
7.Resultados
De acuerdo a los análisis fisicoquímicos y microbiológicos realizados podemos determinar a grandes rasgos las condiciones en que al llegar a los consumidores se encuentran las leches cruda y pasteurizada que se comercializan en la zona urbana de la cuidad de Popayán.
Para un mejor interpretación de los de los mismos a través de los siguientes gráficos vamos a reflejar los resultados teniendo en cuenta las tablas con valores determinados en el Decreto 616 del 28 de Febrero del año 2006 y el Decreto 2838 del 24 de Agosto de 2006 expedidos por el Gobierno Nacional y así como la revisión de literatura.
Tabla 2. Características de la leche cruda

Tabla 3. Características fisicoquímicas de la leche entera

1.Acidez de la leche

En el estudio se determinaron 13 rangos de acidez iguales en las 30 muestras analizadas, de las cuales 10 estaban debajo del rango mínimo de Acidez el cual esta establecido en 0.130,19 dentro del rango promedio de 0.130 y 0.170 y solo 1 muestra estuvo fuera del rango máximo de 0.170

A diferencia de la leche cruda se pudo determinar que para la leche pasteurizada los valores que arrojaron las muestras se encontraron dentro de los rangos establecidos en la norma.
2.Densidad

Como se puede observar en el grafico anterior la densidad de la leche cruda de acuerdo a los parámetros establecidos 13 muestras están por debajo de los mismos que la norma establece que es de 1.030 mínimo a 1.0.33 máximo y 17 muestras están dentro del rango establecido para tal fin.

En cuanto a la leche pasteurizada se puede notar que se aproxima en la mayoría de las muestras a lo requerido en la norma 3.Materia Grasa

En este grafico puede apreciar que un total de 2 muestras no tienen el porcentaje de grasa mínimo para las leches crudas que es de 3.00,pero también puede observarse que hay una muestra cuyo valor es de 5.00,para las demás cumplen con el requerimiento mínimo

Como se puede notar el porcentaje de grasa de la mayoría de las muestras de leche pasteurizada esta por encima del limite requerido por la norma solo la muestra 1A no cumple con el mínimo solicitado que es del 3 % 4.Sólidos Totales ( Extracto Seco Total )

Teniendo en cuenta que el porcentaje de sólidos totales requeridos para la leche cruda es de 11.30 %,en este resultado ,de un total de 30 muestras solo 8 de las mismas no cumplieron con el valor mínimo requerido en la norma.

El total de sólidos totales en cuanto a la leche pasterizada solo la muestra 1A no cumple con porcentaje mínimo requerido para esta determinación.
5.Sólidos no grasos (Extracto seco desengrasado)

Como se puede notar la línea de tendencia esta de la muestra esta casi paralela lo que denota que estas leches están en el limite exigido por la norma en cuanto a la grasa se refiere,7 muestras analizadas arrojaron un valor menor a 8.30.

Para este caso el número de muestras del total analizado mas del 50% no arrojaron el resultado del 8.30 que considera la norma deben tener las leches pasteurizadas.
6.Tiempo de Reducción de Azul de Metileno-TRAM Teniendo en cuenta los tiempos resultantes de la prueba se recomienda de acuerdo a normas internacionales clasificar el producto dentro de ciertos grados aceptables o no aceptables, en base a los siguientes valores:
Tabla 4.Clasificación de la leche de acuerdo a la prueba TRAM


De acuerdo a resultados de una de las pruebas que ayudan la determinar la Calidad Higiénica de la leche cruda y en concordancia a la tabla 5 podemos determinar que:
Tabla 5.Resultado de la prueba TRAM para leche Cruda

De acuerdo al análisis anterior podemos decir que el 73.34% de las muestras son aceptables, esto no determina en ningún caso que el producto sea recomendable consumir ya de acuerdo a la Tabla 1 de Interpretación del TRAM estas leches pueden contener de 500.000 a 4.000.000 millones de bacterias por mililitro.

El los resultados de la prueba TRAM para las leches pasteurizadas podemos determinar lo siguiente.
Tabla 6.Resultado de la prueba TRAM para leche Pasteurizada

Con los resultados anteriores podemos determinar que el 80% de las muestras de leches pasteurizadas son aptas para su consumo.
7.Recuento Total Mesofilos ( UFC ) El Gobierno Nacional expidió del Decreto 2838 de fecha 24 de agosto de 2006 en donde fijo el recuento de mesofilos para la leche cruda así:
El Artículo 12 fija las siguientes características para la leche cruda para consumo humano la cual debe cumplir con los siguientes requisitos microbiológicos Tabla 7.requisitos microbiológicos


De acuerdo al grafico anterior podemos notar que el Recuento Total de Mesofilos esta dentro de la norma para 21 muestras para un total en porcentaje del 70%, lo que no garantiza que hasta terminar la venta de leche que en casos es pasado del medio día la carga permanezca igual,la tendencia es que esta aumente, pero es preocupante que ese 30% restante tenga índices que llegan hasta 26.000.000 de UFC,lo que puede denotar el estado de esas muestras y lo que esa leche puede causar a quien la consume.
Tabla 8. Características microbiológicas de la leche pasteurizada


De acuerdo al grafico anterior podemos establecer que para la leche pasteurizada se han encontrado índices más altos de los permitidos para las leches A y B en el primer muestreo, lo que puede obedecer a una mala pasteurización o bien a un mal manejo de la cadena de frío.
Para el segundo muestreo se tomo como parámetro inicial para la recolección de la muestra que en el punto de venta se hiciera un buen manejo de la cadena de frío.

Los análisis en este segundo muestreo determinaron que para las leches pasteurizadas los índices resultantes están por debajo de los mínimos permitidos en la norma concluyendo así la importancia de la cadena de frió para la conservación de estas leches y evitar así el aumento de las Bacterias Mesofilas.
8. Discusión
Es preocupante la determinación del gobierno nacional en la expedición del Decreto 2838 del 2006, al determinar que el índice permitido en Recuento de mesófilos aeróbios es de 700.000 ufc/ ml cuando en el ámbito de calidad higiénica en los países productores de leche proponen clasificar las leches sin tratar de la siguiente manera:
Grado A: Con parámetros internacionales, es decir, Recuento de Bacterias: menos de 100.000 UFC/mL; Recuento de Células Somáticas: Menos de 450.000/ml, Punto Crioscópico de -0.540, y Ausencia de Residuos de Antibióticos Grado B: Recuento de Mesófilos: Menor de 1.000.000 UFC/mL, RCS menos de 750.000/mL. Punto Crioscópico y Residuos de Antibióticos: Igual a Grado A.
Grado C: Mas de 4 horas de TRAM o menos de 5.000.000 de bacterias mesófilas por mL; Menos de 1.000.000 de Células Somáticas. Parámetros iguales a Grado A, para Residuos de antibióticos y Punto Crioscópico.
Teniendo en cuenta la clasificación anterior podemos pensar que el Decreto 2838 del 24 de agosto de 2006 es bastante elástico y permisivo en cuanto a temas de salud se trata ya que considera aceptables las leches que en el ámbito internacional están determinadas como Grado B lo que no garantiza ni la calidad ni la higiene de la misma y menos que su consumo no produzca alteraciones en el organismo de quien la toma.
Es claro que las leches crudas al someterlas a un proceso de choque térmico o pasterización bajan sus niveles de bacterias mesofilas, pero también se debe tener en cuenta que un deficiente manejo de la cadena de frió las aumenta.
La leche recién ordeñada es peligrosa de por sí, y mucho más si proviene de un lugar sin las necesarias condiciones de higiene, o manipulada por intermediarios inescrupulosos que pueden adulterarla para obtener un rendimiento mayor.
Nuestra cuidad no es ajena a que ha proliferado la comercialización de leche cruda, la Alcaldía a través de la Secretaria de Salud Municipal no ha tenido ninguna manifestación acerca del problema, ya que no ha informado sobre controles, inspecciones y constataciones de infracciones, ni tampoco ha salido -frente a una realidad social que podría arrasar en los hechos con cualquier intento de prohibición- con campañas educativas, preventivas y asistenciales tendientes a eliminar o disminuir el riesgo de contraer enfermedades a través del consumo de leche contaminada.
Sería importante que las autoridades dieran a conocer cuál es su política sobre esta problemática en la que está en juego la salud de la población, acosada por el hambre y la desnutrición por un lado, y el riesgo de enfermar por el otro.
Es determinante crear la conciencia de consumo de leche higienizadas así como el seguimiento que deben hacer las empresas comercializadoras de la forma como sus distribuidores manejan la cadena de frío además de dar incentivos al productor primario para que realice unas buenas prácticas de manejo en su producción.
9. Conclusiones
El Recuento de Bacterias Mesófilas Aerobias es la prueba que realmente mide la calidad higiénica de la leche.
De acuerdo a los resultados obtenidos podemos determinar la desventaja del consumo de leche cruda por las siguientes razones:
? Los índices de bacterias mesófilas aerobias con respecto al acuerdo marco de competitividad y de calidad higiénica de la leche cruda internacional sobrepasan los permitidos, así:

Por lo anterior y teniendo en cuenta que para las leches crudas el índice de UFC/ml no debe sobrepasar las 100.000 UFC/ml, solo un 6.67% de las 30 muestras analizadas serian las aceptadas para su consumo.
? Como el análisis se realizo aplicando la normatividad del Decreto 2838 del 2006,emanado del Ministerio de la Protección Social en el cual determina que el índice permitido es de 700.000 UFC/ml podemos concluir lo siguiente:

En el Recuento Total de Mesófilos 21 muestras están dentro del limite permitido para un total en porcentaje del 70%, lo que no garantiza que hasta terminar la venta de leche que en casos es pasado del medio día la carga bacteriana permanezca igual, la tendencia es que por efectos de la temperatura se incremente, pero es preocupante que ese 30% restante tenga índices que llegan hasta 26.000.000 UFC/ml.
? Para las leches pasteurizadas podemos concluir que el Decreto 616 del 28 de febrero del 2006,determina que los índices permitidos están de 40.000 UCF/ml a 80.000 UFC/ml los rangos obtenidos son los siguientes:

Con los resultados obtenidos se podría afirmar que el 80% cumplen con la norma lo que indica que es apta para su consumo, ese 20% con índices mayores a los permitidos obedeció a una mala refrigeración por parte del expendedor, el mal manejo de la cadena de frío en los expendios de venta de leche pasteurizada hace que las bacterias mesofilas aumenten su carga bacteriana afectando así a quien en forma posterior la consuma.
? Debido a la diversidad de marcas de leche pasteurizada que se comercializan, a la hora de comprar es importante fijarse en el manejo a que esta sometido este producto como es la forma de almacenamiento (cadena de frío) así como su fecha de vencimiento.
10. Recomendaciones
Desde el punto de vista de Salud Publica, no es recomendable el consumo de leche cruda debido a que no se le hacen controles de calidad además de la ausencia de cadena de frió, ya que quienes hacen la venta o comercialización de la misma no cuentan con equipos ni recipiente para que la leche se conserve a temperaturas adecuadas, lo hace que sea una fuente para la multiplicación de bacterias entre las que están determinadas las bacterias mesofilas aerobias, La calidad se conserva cuando se aplica una refrigeración oportuna y que tenga una temperatura entre 3 y 5 °C.
Teniendo en cuenta que la leche pasteurizada no se puede considerar como un producto de larga duración, se debe mantener siempre en refrigeración y conviene consumirla en el plazo de 2-3 días Se recomienda que para trabajos posteriores relacionados con este tema que y compromete la salud de una comunidad hacer un seguimiento de los Decretos 616 y 2838 del 2006, además de desarrollar una estrategia que lleve a la elaboración de un MANUAL DE HIGIENE DE LA LECHE CRUDA donde estén comprometidos todos y cada uno de los eslabones de la cadena así como los que directa e indirectamente están relacionados con la producción de la misma.
Es importante que para aquellos quienes están en la parte de venta y comercialización de la leche cruda cumplan con todas y cada una de las condiciones de higiene.
Además deben tener en cuenta que el Decreto 2838 es muy claro cuando anota en su Artículo 3°. "Plan de reconversión. Para el cumplimiento de lo establecido en el artículo anterior del presente decreto, todo comercializador de leche cruda y de leche cruda enfriada, deberá presentar dentro de los seis (6) meses siguientes a la expedición de este decreto, ante la alcaldía de su jurisdicción, un plan de reconversión conforme a la guía técnica que para el efecto expidan los Ministerios de Agricultura y Desarrollo Rural y de la Protección Social"
Bibliografía
ALAIX, CH.Ciencia de la Leche.Editorial continental.5ta Edición.México DF, México.1994 AMITO; JEAN.Ciencia y Tecnología de la Leche.Principios y Aplicaciones.Editorial Acribia.Zaragoza, España 1991.
CASADO, P.; BLANCO, Métodos Instrumentales para el Análisis de la leche. Madrid.Asociación Nacional de Químicos de España.1998. CODEX ALIMENTARIO.FAO,Madrid, 2002 DEMETER,K. Lactobacteriología. Editorial Acribia. Zaragoza. España.
1999.
FAO.Modulo I.Higiene y Manejo de la Leche. Equipo Regional de Fomento y Capacitacion en Lechería para América Latina.Santiago de Chile.1991. LARRAÑAGA,I.;CARBALLO,J;RODRGUEZ,M.;FERNÁNDEZ,J.;Control e Higiene de los Alimentos.Grado Superior.Editorial McGraw Hill/Interamercana de España S.A.1999.
LERCHE;M.Inspeccion Veterinaria de la Leche. Editorial Acribia. Zaragoza. España. 1999.
LESSER,A.Instalaciones y Equipos de Ordeño.Editorial Hemisferio Sur.Buenos Aires.1999.
MINISTERIO DE LA PROTECCIÓN SOCIAL Decreto 616 de 2006, Bogota D.C.28 de Febrero de 2006.
MINISTERIO DE LA PROTECCIÓN SOCIAL Decreto 2838 de 2006, Bogota D.C.Agosto 24 de 2006 MOSSEL,D.Microbiologia de los Alimentos. Editorial Acribia. Zaragoza. España. 1995.
MUNICIPIO DE POPAYÁN.P.O.T.Plan de Ordenamiento Territorial.2002 PASCUAL ANDERSON,Ma.Microbiologia Alimentaria,Metodología Analítica para Alimentos y Bebidas.Editorial Diaz de Santos.Madrid 1992.
PEREZ GAVILAN ESCALANTE,J.Bioquímica y Microbiología de la Leche.Editorial Limusa.México 1993.
PINZON CASTILLA,V.Evaluación de las Razas Lecheras en la Meseta de Popayán,Trabajo de Investigación.1980.
PINZON FERNÁNDEZ A.Montaje de una Planta piloto para la producción y comercialización de leche pasteurizada en empaque biodegradable en la meseta de Popayán.Trabajo para optar el titulo de Tecnólogo en Producción Animal.UNAD.2004.
PINZON FERNÁNDEZ M.V.Recuento Microbiano de la Leche.Trabajo de Investigación Universidad Javeriana.1995. ROBINSON,R.K.Microbiologia Lactologica.Vol I. Editorial Acribia. Zaragoza. España. 1997.
TETRAPAK.Manual de Industrias Lacteas.Editorial Madrid.Madrid 1998.
THOMAS S.B.Técnicas Bacteriológicas para el control Bacteriológico. Editorial Acribia. Zaragoza. España. 1991.
VEISSERE,R.Lactologia Técnica. Editorial Acribia. Zaragoza. España.
1992.
WALSTRA,P. Y JANNES,R.Química y Física Lactologica. Editorial Acribia. Zaragoza. España. 1997.
Anexos
ANEXO A HOJA DE TRABAJO RELACION DE TOMA DE MUESTRAS


ANEXO B RESULTADOS DE MUESTRAS
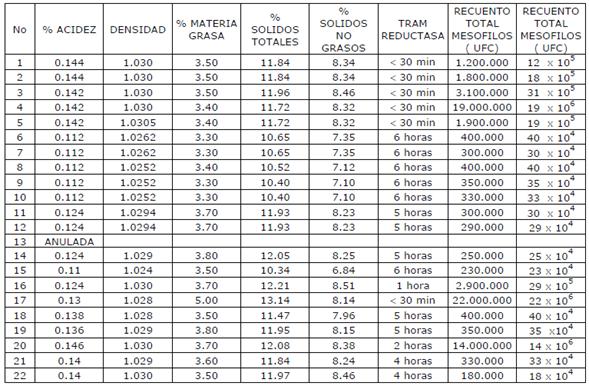

ANEXO C

VENTA DE LECHE Y TOMA DE MUESTRAS Foto 1.Tinas de leche

Foto 2.Venta de leche directa de camión

Foto 3.Camión mayorista de leche

Foto 4.Venta de leche

Foto S.Entrega de leche

Foto 6.Venta de leche en triciclo
 .
.
Foto 7.Venta de leche en Moto

Foto S.Venta de leche en Mota con Remolque

Foto 9.Venta de leche en Bicicleta

Foto 10.Venta de leche puerta a puerta

Foto 11.Frasco esteril para toma de muestra

Foto 12.Toma directa de leche cruda

Foto 13.Empaque de las muestras

Foto 14.Empaque de la muestra con gel refrigerente

Foto 15.Muestras debidamente empacadas

Foto 16.Revisión de la Hoja de trabajo

Foto 17.Trasporte de la muestra a Laboratorio DETERMINACIÓN DEL INDICE DE BACTERIAS MESOFILAS AEROBIAS PRESENTES EN LA LECHE CRUDA VERSUS LECHE PASTEURIZADA QUE SE COMERCIALIZAN EN LA ZONA URBANA DE LA CIUDAD DE POPAYAN.

POPAYÁN 2006
Autor:
Alfredo Pinzon Fernandez.
Zootecnista.
 Página anterior Página anterior |   Volver al principio del trabajo Volver al principio del trabajo | Página siguiente  |