 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
O experimento foi desenvolvido no Setor de Ovinocultura, Departamento de Zootecnia da Universidade Federal de Lavras, Minas Gerais. Foram utilizados 24 cordeiros machos inteiros com peso inicial de 15 kg da raça Santa Inês, mantidos sob regime de confinamento, em gaiolas individuais. A dieta utilizada foi constituída de feno triturado de coastcross (Cynodon dactylon), farelo de soja (Glicine max L.), grão de milho (Zea mays L.), calcário calcítico, suplemento mineral e vitamínico, calculada com base nas exigências nutricionais estabelecidas pelo ARC (1980), para ganho de peso diário esperado de 300 g.
Os cordeiros foram sorteados para serem sacrificados com diferentes pesos: 15, 25, 35 e 45 kg de peso vivo, com aproximadamente as respectivas idades de 50, 100, 140 e 190 dias. O abate foi feito por meio de um corte na artéria carótida e nas veias jugulares, com coleta e pesagem do sangue e posterior evisceração, depois de retirada a pele. Após a evisceração e retirada da cabeça, dos pés e da cauda, obteve-se a carcaça, a qual foi pesada para obtenção do peso da carcaça.
A carcaça quente foi levada à câmara fria, à 2º C, por um período de 24 horas. A carcaça foi mantida pendurada pela articulação tarso metatarsiana em ganchos próprios, com distanciamento de 17 cm. Após esse período, procedeu-se à retirada do pescoço e, em seguida, mediante corte longitudinal, obtiveram-se metades aproximadamente simétricas.
A meia carcaça esquerda foi dividida em cinco cortes comerciais: perna, lombo, costeleta (carrê), costela/fralda e paleta (
Figura 1), que tiveram a seguinte base anatômica:
Perna: compreendeu a região sacral e os seguintes seguimentos anatômicos do membro pélvico: cíngulo pélvico e perna. Seccionou-se ao nível da articulação da última vértebra lombar e primeira sacral e ao nível da posição mediana dos ossos do tarso. Obteve-se por um corte transversal, que passou entre a articulação da última vértebra lombar e a primeira sacral, seccionando o ligamento superespinhoso lombo sacro, ligamento interespinhoso e ligamento longitudinal ventral e dorsal, terminando aproximadamente na aponeurose, que une o músculo recto do abdome (M. rectus abdominis) com a porção carnosa do obliquo interno do abdômen (M. obliquus internus).
Lombo: a base óssea deste corte compreendeu da primeira à última vértebras) vértebra lombar (pode ter 6 ou 7). Foi feito um corte entre a última vértebra torácica e a primeira lombar e outro entre a última lombar e a primeira sacral.
Costeleta: compreende a região localizada entre a 1ª a 12a vértebra torácica, junto com aproximadamente 1/3 dorsal do corpo das costelas correspondentes.
Costela/Fralda : este corte compreendeu a região anatômica da parede abdominal e metade ventral da torácica. Sua base óssea foi metade correspondente do esterno cortado sagitalmente, a 2/3 ventral das oito primeiras costelas e 2/3 ventral das cinco restantes. Obteve-se fazendo-se um corte aproximadamente paralelo à coluna vertebral, partindo desde a prega inguinal e acabando no cordão testicular .Termina no vértice da cartilagem do manubrio esternal ou na articulação da primeira costela com a primeira esternebra.
Paleta: as regiões anatômicas que compreenderam este corte foram o cíngulo escapular e braço antebraço. A base óssea foi formada pela escápula, úmero, rádio e ossos do carpo. Obteve-se mediante secção da região axilar, dos músculos que unem a escápula e o úmero na parte ventral do tórax. Depois, contornou-se a escápula, seccionando os músculos braquiocefálico, omo transversal, trapézio cervical e serrato cervical, pela parte superior, e trapézio torácico e romboides, pela parte posterior do tronco.
Os cortes foram pesados e acondicionados em sacos plásticos e mantidos no freezer a -10ºC até o momento da dissecação, ou seja, separação dos componentes teciduais (osso, músculo e gordura) de cada corte. Assim, foram obtidos proporção e crescimento relativo dos mesmos em cada corte, nos intervalos de pesos estudados.
O estudo do crescimento relativo foi realizado mediante o modelo da equação exponencial, Y = aXb
ei, transformada logaritmicamente em um modelo linear, lnY = lna + b lnX + lnei ( HUXLEY, 1932) em que Y é o peso de cada componente tecidual (osso, músculo e gordura); X, o peso de cada corte comercial (perna, lombo, costeleta, costela/fralda, paleta) a, a intercepção do logaritmo da regressão linear sobre Y e "b"; b, o coeficiente de crescimento relativo ou coeficiente de alometria; ei, o erro multiplicativo.As análises para obtenção dos coeficientes alométricos foram realizadas por intermédio do SAS (1996). Para verificação da hipótese b=1, foi realizado o teste "t" (Student Newman Keuls) (a = 0,05 e a = 0,01). Se b = 1, o crescimento foi denominado isogônico, indicando que as taxas de desenvolvimento de cada componente (X) e do respectivo corte (Y) foram semelhantes no intervalo de crescimento considerado. Quando b ¹ 1, o crescimento foi chamado heterogônico, sendo positivo (b > 1), tecido de desenvolvimento tardio; ou negativo (b < 1), tecido de desenvolvimento precoce em relação ao desenvolvimento do corte.
Na
Tabela 1, são apresentadas as equações de alometria para os componentes teciduais: osso, músculo e gordura de cada corte obtido na meia carcaça esquerda dos cordeiros Santa Inês. Os coeficientes de alometria do tecido ósseo de todos os cortes estudados, perna, lombo, costeletas, costela/fralda e paleta, indicam que o osso teve desenvolvimento precoce (b < 1) em relação ao desenvolvimento dos cortes, concordando com a afirmação de ESMINGER et al. (1990) de que esse tecido se desenvolve mais rapidamente que o muscular e o adiposo.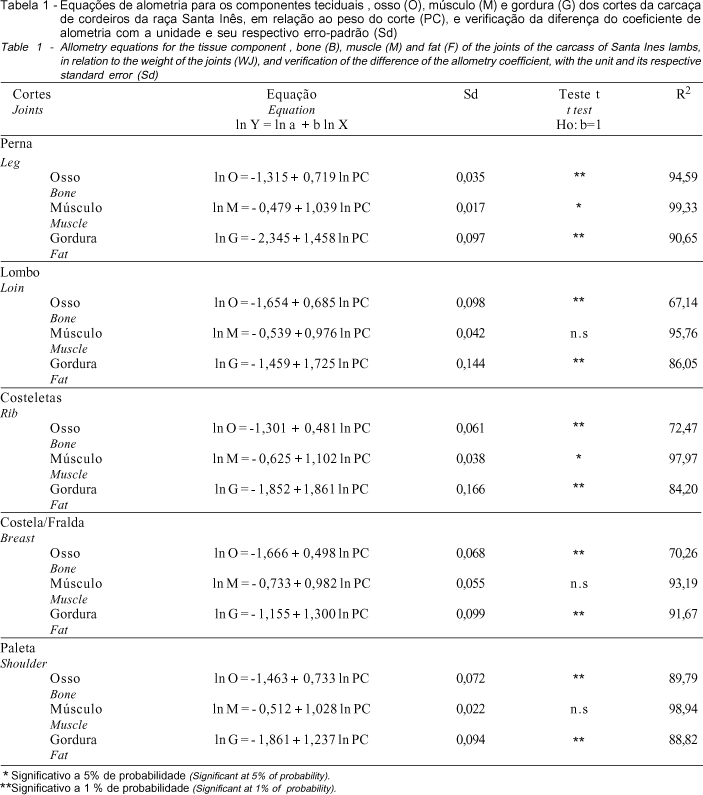
Os coeficientes de determinação do tecido ósseo do lombo, das costeletas e costela/fralda, comparados com os demais coeficientes referentes a este mesmo tecido na perna e paleta, apresentaram valores menores, 67,14; 72,47; e 70,26%, o que é explicado pela anatomia dos cortes, os quais possuem maior estrutura óssea, o que leva a desvios no processo de dissecação, no entanto, com essas variações totais, o modelo proposto foi adequado aos pontos observados, uma vez que, com desvios pequenos, a maioria dos pontos ficou em consonância com o modelo, sempre em seu entorno.
O tecido muscular da perna e costeleta apresentou coeficiente de alometria diferente de 1 (b
¹ 1), caracterizando crescimento heterogônico positivo para esse componente tecidual (b > 1) (Figuras 2 e 3, respectivamente), ou seja, o tecido muscular teve desenvolvimento relativo tardio em relação ao desenvolvimento relativo da perna e da costeleta . Para os demais cortes: lombo, costela/ fralda e paleta, o crescimento muscular acompanhou o desenvolvimento relativo do corte, apresentando crescimento isogônico (Figuras 4, 5 e 6, respectivamente). O tecido adiposo apresentou desenvolvimento tardio em todos os cortes, tendo crescimento heterogônico positivo (b > 1) em relação ao desenvolvimento de cada corte como um todo.




Com o avançar da idade e, conseqüentemente, aumento do peso, a quantidade de gordura eleva-se nas diferentes partes da carcaça, o que pode ser explicado por KOLB(1976) e HOOD e THORNTON (1979), citados por SIQUEIRA (1990), os quais constaram aumento do número de células adiposas, tomando-se por base a fase de crescimento compreendida entre 28 e 45 kg de peso vivo.
À medida que aumenta o peso de abate, eleva-se a quantidade de gordura na carcaça dos animais e, por intermédio de determinados cortes efetuados na mesma, é possível verificar de forma mais acentuada o crescimento do tecido adiposo como no corte costela/fralda.
Os cordeiros abatidos entre 15 e 35 kg de peso vivo foram os que apresentaram cortes com as melhores deposição de gordura, levando em consideração que uma quantidade elevada deste componente significa qualidade de carne de caráter inferior.
Com o aumento da idade, a qualidade dos cortes fica comprometida, uma vez que as características organolépticas se modificam com a idade do animal, havendo decréscimo da maciez, do sabor e da solubilidade de colágeno muscular.
Para atender as exigências do mercado consumidor atual, a faixa de peso de abate para que se obtenham cortes com adequadas deposições de gordura encontra-se entre 15 e 35 kg de peso vivo, uma vez que, acima deste peso, na maioria dos cortes estudados, o tecido adiposo apresentou crescimento heterogônico positivo.
AGRICULTURAL RESEARCH COUNCIL - ARC. 1980. The nutrient requeriments os farm livestock. London. 351p.
CORRADELLO, E.F.A.1988. Criação de ovinos: antiga e contínua atividade lucrativa. São Paulo: Ícone. 124p.
ESMINGER, M.E., OLDFIELD, J.E., HEINEMANN, W.W. 1990. Feeds and Nutrition. 2.ed., Califórnia. 1544p.
HAMMOND, J. 1960. Carne: Producción y tecnologia: conferencias, observaciones. Mesas redondas, s. l. CAFADE. 160p .
HAMMOND, J.1965. Farm animal; their growth breeding and inheritance. London: E. Arnould. 322p.
HUXLEY, J.S. 1932. Problems of relative growth. London: Methuen. 577p.
PRESCOTT, J.H.D. 1982. Crecimiento y desarrollo de los corderos. In: HAPEZ, E.S.E. (Ed.) Crescimento e desarollo de los corderos.. Zaragoza: Acribia. p.35-369.
ROBELIN, J., THÉIRIEZ, M., ARNAL, M. et al. 1977. Évolution de la composition chimique des jeunes ageneause mâles jusquí a âge de 16 semaines. Anim. Zoot., 26:68-81.
SAINZ, R.D. Qualidade de carcaças e de carne de ovinos e caprinos. In: REUNIÃO ANUAL DA SOCIEDADE BRASILEIRA DE ZOOTECNIA, 33, 1996, Fortaleza. Anais... Fortaleza: SBZ, 1996. p.3-14.
SAS INSTITUTE. 1996. In: Procedures. Versão 6, v.1. 3.ed. Cray.
SIQUEIRA, E.R. Estratégias de alimentação do rebanho e tópicos sobre produção de carne ovina. In: PRODUÇÃO DE OVINOS, 1990. Jaboticabal. Anais... Jaboticabal: FUNEP, 1990. p.157-171.
TAYLOR, C.S. 1985. Use of genetic size scaling in evaluation of animal growth. J. Anim. Sci., 61(2):119-143.
THÉIRIEZ, M., TISSIER, M., ROBELIN, J. 1980. The chemical composition of the intensively fed lamb. Anim. Prod.,32(1):29-37.
WOOD, J.D., MACFIE, H.J.H., POMEROY, R.W. et al. 1998. Carcass composition in four sheep breeds the importance of type of breed and staje of maturity. Anim. Prod., 30(31):135-152.
Cristiane Leal dos Santos1, Juan Ramon Olalquiaga Pérez2, Joel Augusto Muniz3, Luciana Castro Geraseev1, Edson Ramos Siqueira4 -
lgeraseev[arroba]nca.ufmg.br1
Doutorando do Curso de Zootecnia da UFLA, Caixa Postal, 37-37200-000-Lavras-MG.2
Professor PhD do Departamento de Zootecnia , UFLA, Caixa Postal, 37 - CEP: 37200-000 - Lavras, MG.3
Professor DSc do Departamento de Ciências Exatas, UFLA, Caixa Postal, 37 - CEP: 37200-000 - Lavras, MG.4
Professor DSc do Departamento da Faculdade de Medicina Veterinária, UNESP - Botucatu. Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|