 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
TRATAMENTO ENDOVASCULAR (TIPS)
Outra alternativa conservadora de controlar o sangramento é a introdução de prótese vascular, através da veia jugular, até o interior do fígado, objetivando conectar um ramo intra-hepático da veia porta com um afluente das veias hepáticas que drenam para a cava inferior (Figura 2). Esse método, concebido por Rosch e colaboradores em 1969, recebeu o nome de TIPS (transjugular intrahepatic portosystemic shunt ) e tem sido usado nos centros maiores que dispõem da prótese e de equipamento de imagem apropriado para a sua colocação9 11.
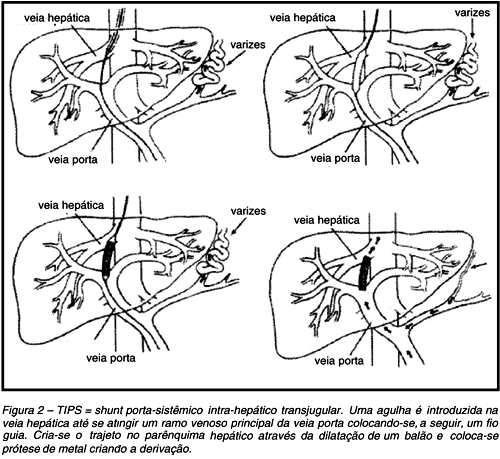
Trata-se de procedimento dispendioso; a sua eficácia não ultrapassa alguns poucos anos, tendo que ser trocada. A colocação de nova prótese requer equipe médica experiente e a segunda prótese possui durabilidade ainda menor. Outro inconveniente ao se colocar a prótese é a possível lesão de ductos biliares, resultando em hemobilia o que pode reduzir o tempo de perviedade da prótese a poucas semanas ou meses9 11. Portanto, tal terapêutica, aplicável aos casos de cirrose avançada, em pacientes inscritos em programas de transplante de fígado ou que tenham expectativa de vida pequena, não é aconselhável na hipertensão porta esquistossomática.
A terapêutica cirúrgica tem por objetivo tratar e prevenir o sangramento. Quanto aos casos de hemorragia intra-abdominal, o tratamento consiste apenas na transfixação ou colocação de clipes no vaso que esteja sangrando. Esse procedimento pode ser realizado por laparotomia ou, mais recentemente, por via laparoscópica e não constitui motivo de controvérsia médica.
Em hipertensão porta, há diversas situações que podem levar à necessidade de operar o doente. Todavia a indicação cirúrgica deve ser ponderada com base no estado clínico do paciente e em conhecimentos científicos atualizados sobre a doença e as diferentes opções terapêuticas.
Hemorragia: durante muitos anos prevaleceu o conceito de que varizes esofágicas e gástricas de calibre maior sempre iriam sangrar e que, portanto, a indicação cirúrgica aplicava-se a todos os casos. Entretanto, estudos bem conduzidos mostraram que, mesmo os pacientes portadores de grandes varizes, raramente apresentavam hemorragia digestiva. A possibilidade torna-se ainda menor quando o parasita é erradicado pelo tratamento clínico eficaz. As varizes persistem pelo resto da vida assim como a hipertensão porta, mas o sangramento não ocorre. Dessa forma, apenas a presença de varizes não constitui indicação cirúrgica.
Por outro lado, se o paciente apresenta episódio de hemorragia comprovadamente proveniente de variz esofágica ou gástrica, a possibilidade de novo sangramento é grande. Tendo em vista a gravidade de cada hemorragia, que pode levar à morte pelo próprio sangramento ou em decorrência de suas complicações, o paciente que sangrou deve ser tratado adequadamente.
A maioria das hemorragias em hipertensão porta esquistossomática ocorre em adultos jovens sem outras doenças. Sendo indivíduos hígidos, eles toleram bem o ato operatório, que pode lhes conceder resolução duradoura e geralmente definitiva para essa complicação de sua moléstia. Por outro lado, se houver risco cirúrgico maior, em doentes idosos ou que sejam portadores de outras afecções graves, pode-se optar por tratamentos alternativos, como o endoscópico. A terapêutica alternativa também deve ser indicada nos casos em que a hemorragia de grande vulto agravou as condições gerais do paciente de tal forma que o risco cirúrgico tornou-se elevado, ou quando não houver equipe cirúrgica com experiência para tratar esse tipo de afecção.
Há ainda doentes que recusam o ato operatório ou proíbem a transfusão sangüínea. Nesses casos, se não houver risco de morte iminente, o médico deve respeitar a vontade do paciente e oferecer os tratamentos alternativos. Já em situação de emergência, o cirurgião tem a obrigação e o amparo legal para submeter o paciente ao procedimento cirúrgico necessário com o objetivo de interromper a hemorragia.
Esplenomegalia e pancitopenia: a esplenomegalia não constitui indicação cirúrgica. Na forma hepatoesplênica da esquistossomose o baço cresce, mas mantém as suas funções normais. Nesse sentido, destaca-se seu papel de armazenamento dos elementos sangüíneos, com conseqüente redução do número de leucócitos e plaquetas circulantes. Esse fato não deve ser confundido com hiperesplenismo, no qual há disfunção esplênica, com destruição indiscriminada dos elementos sangüíneos.
Na esplenomegalia congestiva, apesar da pancitopenia, os elementos sangüíneos não são destruídos, mas apenas armazenados em maior número no baço. Em caso de necessidade, como acontece na vigência de infecção aguda ou no trauma com hemorragia maior, o baço libera os elementos sangüíneos na quantidade necessária. Dessa forma, em presença de sepse, há leucocitose com o número total e diferencial dos leucócitos semelhante ao encontrado na população geral. Por isso, os pacientes com esquistossomose não apresentam fenômenos sépticos mais freqüentes do que o encontrado em indivíduos normais10 32 40 44.
Também não há registro de discrasia sangüínea, com distúrbios de coagulação em pacientes esquistossomáticos, apesar de seu coagulograma mostrar-se alterado tanto no número de plaquetas quanto no RNI e nos tempos de protrombina e tromboplastina parcial. Não é raro operarem-se doentes com menos de 20.000 plaquetas/mm3 , tempo de protrombina abaixo de 50% e RNI acima de 2, sem aumento do sangramento operatório. Nesses casos, não há necessidade de transfusão de plaquetas e a administração de vitamina K altera pouco o coagulograma.
O autor deste artigo já realizou esplenectomia subtotal e desconexão portavarizes, sem intercorrências, em paciente portadora de esquistossomose e esplenomegalia, com 8.000 plaquetas/mm3 e tempo de protrombina de 38%. Apesar de surpreendente, essa característica dos esquistossomáticos, já tornou-se familiar aos hematologistas e aos médicos que cuidam desses doentes.
Em contrapartida, quando a esplenomegalia responsabiliza-se pela anemia grave, há indicação para cirurgia esplenorredutora ou de descompressão venosa esplênica. Ao contrário de vários animais que, em caso de necessidade, liberam hemácias para a circulação sangüínea, o baço humano não possui essa característica. Nesses pacientes, o baço retém as hemácias sem destruí-las por um período médio de 120 dias, que é o tempo de vida eritrocitário, e, somente ao iniciarem suas alterações bioquímicas de membrana, os macrófagos esplênicos as fagocitam.
Cirurgia profilática:as indicações cirúrgicas de mais difícil decisão são as que envolvem aspectos socioeconômicos e culturais. A esquistossomose acomete populações mais pobres e do meio rural. As condições habitacionais de muitos pacientes são precárias, sem recursos de comunicação e de transporte para centro médico bem equipados para oferecer tratamento adequado em caso de complicação da hipertensão porta. Portanto, se houver hemorragia volumosa, há grande risco de morte.
Cabe, pois, considerar a indicação cirúrgica profilática. O paciente deve ser esclarecido sobre a sua doença, utilizando a linguagem coloquial que ele compreenda bem. Após serem respondidas todas as dúvidas deve-se discutir a possibilidade de ele ser operado. Há doentes que preferem mudar da região rural para uma cidade que possua recursos médicos suficientes para tratá-lo. Nesses casos, contra-indica-se a operação profilática.
Há portadores de hipertensão porta esquistossomática que residem em grandes centros urbanos e solicitam o tratamento cirúrgico, mesmo sem indicação formal. O pedido do doente se deve, na maioria das vezes, à esplenomegalia. O desconforto provocado pelo baço de grandes dimensões, as limitações às atividades físicas e, principalmente, as dificuldades profissionais, inclusive de conseguir emprego, faz com que o paciente solicite o tratamento operatório. Outro motivo de requisitar-se a cirurgia profilática é a preocupação com o sangramento, com risco de morte. Nesses casos, quando o médico percebe que o paciente encontra-se determinado e disposto a correr os riscos inerentes ao procedimento cirúrgico, é pertinente atendê-lo e operá-lo eletivamente.
Objetivos da cirurgia: a cirurgia de hipertensão porta visa controlar os mecanismos envolvidos no sangramento das varizes e da anemia por represamento sangüíneo exagerado dentro do baço. No caso da hipertensão porta da cirrose, há a alternativa do transplante hepático, que, de fato, trata a hepatopatia e suas conseqüências4 24 60. Contudo, essa operação não se aplica à forma hepática da esquistossomose, em que a função do fígado mantém-se preservada, portanto, não havendo motivo para o fígado ser substituído.
O princípio cirúrgico fundamenta-se em dois parâmetros maiores que sustentam todas as operações para sangramento digestivo decorrente de varizes esofágicas e gástricas: reduzir a pressão dentro do sistema porta ou nas varizes e interromper o fluxo porta para o território das varizes. Ambos os procedimentos apresentam vantagens e são passivos de complicações.
Redução pressórica intravascular:apesar de não se conhecer a fisiopatologia do sangramento pelas varizes, não há dúvida de que a hipertensão porta possui papel destacado nesse evento. O organismo procura compensar todos os seus desequilíbrios e a diferença pressórica entre os dois sistemas vasculares do abdome - cava e porta -, por meio de múltiplas mudanças morfológicas tendendo ao equilíbrio funcional.
Princípios fisiológicos de compensação: as duas formas que o organismo dispõe para reduzir a pressão porta são o aumento do continente venoso e o desenvolvimento de derivações venosas do fluxo porta para a circulação sistêmica. A ampliação da trama vascular ocorre com o aumento do calibre de todos os afluentes da porta, desde as menores vênulas até suas veias principais. A estase vascular promove a redução da drenagem do líquido intersticial para os capilares venosos, provocando congestão sangüínea em todo o sistema digestório pré-hepático e no baço. Essa situação manifesta-se com esplenomegalia e repercussões nos órgãos digestórios.
A segunda maneira de aliviar a hipertensão porta se faz através de derivações do sangue porta, com abertura ou desenvolvimento de fluxos sangüíneos para territórios que normalmente não recebem o sangue porta. Entre essas derivações estão as conexões entre os dois plexos venosos retais, do superior para o inferior; as derivações mesentericocava, esplenorrenal e portassistêmica de todo plexo retroperitoneal. Através do ligamento redondo do fígado, o sangue porta é desviado para a circulação sistêmica da parede anterior do abdome e, por último, o sangue da região esofagogástrica é parcialmente drenado para as veias ázigo e hemiázigo do tórax que são tributárias da cava superior. Outra derivação do fluxo porta para a cava superior ocorre pelo sistema intersticial que aumenta em muito a drenagem para o sistema linfático do fluido que deveria ser captado pelos capilares porta.
Aplicação cirúrgica: a cirurgia segue a orientação natural de redução pressórica no sistema porta. As derivações venosas são possíveis de serem confeccionadas em maior número e com calibres mais amplos, por meio cirúrgico.
A primeira derivação portacava foi realizada experimentalmente por Eck, em 1877, apenas como ensaio de fisiologia. Essa operação, que recebeu o nome de fístula de Eck, passou a ser aplicada no tratamento da hipertensão porta por Vidal e Angers, em 1903, sem muito sucesso. Outros cirurgiões realizaram essa operação, porém somente após os trabalhos de Whipple, e Blakemore e Lord, em 1945, esse procedimento passou a ser utilizado em cirróticos, com resultados melhores5 6 27 63. Essa anastomose, que pode ser término-lateral ou látero-lateral direta e por interposição de prótese, resolve completamente a hipertensão porta de origem hepática e pré-hepática.
Entretanto o amplo desvio de sangue provoca complicações graves sobre o fígado, o sistema cardiopulmonar e o encéfalo. O fígado necessita do sangue porta, não apenas para metabolizar o fluido digestório, mas também para a própria sobrevivência do hepatócito, pois ao redor de 70% do sangue hepático provém da veia porta, enquanto apenas 30% da artéria hepática. Assim, ao derivar grande parte do sangue porta para a cava, ocorrerá insuficiência hepática e desenvolvimento ou agravamento da cirrose hepática, com todas as repercussões orgânicas decorrentes desse evento patológico. Na forma hepática da esquistossomose, o fígado, apesar da intensa fibrose, mantém a função preservada. Contudo, após a derivação portassistêmica cirúrgica, pode ocorrer progressiva insuficiência do órgão em decorrência de sua cirrotização.
Ao derivar grande quantidade de sangue da circulação porta para a cava, ocorrerá aumento súbito da volemia nas câmaras direitas do coração e, conseqüentemente, no pulmão. Em pacientes jovens e com a função cardiopulmonar normal, essa sobrecarga sangüínea é bem tolerada, porém, se houver afecção miocárdica, esse evento poderá cursar com insuficiência cardíaca que poderá variar desde lentamente progressiva ou culminar em quadro agudo de extrema gravidade. Não são raros os casos em que há a necessidade de se reoperar o doente de urgência para desfazer a anastomose, mesmo com o risco de sangramento digestivo alto imediato48 54 .
Em relação aos pulmões, deve-se ressaltar a forma pulmonar da esquistossomose, que pode evoluir com restrições vasculares. Dessa forma, a sobrecarga volêmica aos pulmões, em decorrência da derivação portacava, poderá provocar congestão pulmonar grave e progressiva, com risco inclusive à vida do doente48 54.
Um outro aspecto negativo das derivações portassistêmicas é a encefalopatia. Essa afecção acomete mais freqüentemente os pacientes acima dos 40 anos de idade e os que apresentaram distúrbios neurológicos prévios. Essa enfermidade caracteriza-se por cefaléia intensa e distúrbios de comportamento, principalmente após refeições ricas em proteína animal. Sua fisiopatologia ainda permanece obscura, mas entre as hipóteses mais prováveis há o efeito adverso provocado por substâncias alimentares absorvidas e que alcançam o cérebro sem serem previamente processadas pelo fígado. Outra possibilidade é a elevação da osmolaridade sangüínea pelos metabólitos alimentares. Essa complicação pode ser intensa e resultar em qualidade de vida insuportável, que requeira nova cirurgia para desfazer a anastomose18 53 54.
Com o objetivo de reduzir os efeitos adversos das anastomoses portacava amplas foram desenvolvidas derivações alternativas entre veias do sistema porta e o sistema cava. Entre essas operações destaca-se a derivação mesentericocava com interposição de prótese, idealizada pelo Professor João Baptista Resende Alves, na Faculdade de Medicina da UFMG e realizada por ele a partir da década de 1950. Outras derivações são a esplenorrenal proximal, idealizada por Blalock e realizada em 1946, a esplenocava, de Raia e Silva (1975), a gástrica esquerda-cava, proposta por Moreno Gonzalez (1978), e, mais recentemente, a mesentericorrenal realizada pelo Professor Alcino Lázaro da Silva, em 19911 2 7 19 20 21 22 23 27 29 46 52 55.
Todas essas derivações reduzem a pressão no sistema porta, porém em níveis menos eficazes do que a portacava. As complicações descritas para as anastomoses portacava também ocorrem quando se realizam as derivações alternativas, em intensidade e freqüência menores. No caso da derivação esplenorrenal proximal, outro inconveniente é a esplenectomia total, que retira um órgão de grande importância funcional e que não está doente, mas apenas sofre a conseqüência da dificuldade de sua drenagem sangüínea.
Para evitar esse inconveniente, idealizamos, em 1979, a esplenectomia subtotal, preservando apenas o pólo superior do baço suprido pelos vasos esplenogástricos12. Essa operação permite que a veia esplênica seja anastomosada à veia renal esquerda, sem a perda do baço. Contudo, as outras complicações das anastomoses portassistêmicas persistem34 35 36 38 39 41 42 43 54.
Na última década, a derivação portacava com interposição de prótese voltou a ser utilizada em hipertensão porta em cirróticos. São doentes geralmente inscritos para transplante hepático e nos quais essa derivação, além de tratar o sangramento, também facilita a operação, ao drenar o sangue mesentérico enquanto se opera o fígado. O inconveniente dessa cirurgia deve-se à utilização de próteses de menor calibre, para reduzir as complicações já descritas, mas que obstruem com maior facilidade, não sendo indicadas para tratamentos de longo prazo, como é o caso da esquistossomose, que requer conduta cirúrgica, se possível, definitiva.
Em 1967, de maneira independente, Teixeira et al58 e Warren et al62 propuseram uma outra alternativa de derivar o sangue, a anastomose esplenorrenal distal58 61 62. Em vez de reduzir a pressão porta, desviando parte do sangue desse vaso ou de seus afluentes, nessa operação ocorre a diminuição pressórica nas varizes do fundo gástrico e do esôfago inferior. Ao seccionar-se a veia esplênica próximo à veia porta e confeccionar-se sua anastomose com a veia renal esquerda, o sangue esplênico em vez de drenar para a porta, drena para a circulação sistêmica, cuja pressão é muito mais baixa. Com isso, a pressão intra-esplênica torna-se menor e o baço reduz o seu tamanho. Através dos vasos esplenogástricos, que conectam o fundo do estômago ao pólo superior do baço há a derivação do sangue do território das varizes para dentro do baço e deste, pela veia esplênica, para a veia renal e cava inferior. Com essa derivação, os níveis pressóricos esofagogástricos tornam-se menores e reduz-se o risco de sangramento54.
A maior vantagem dessa operação é manter-se o baço, com todas as suas funções, principalmente a de defesa orgânica. Outra qualidade desse procedimento é a manutenção da pressão no sistema porta, não prejudicando, assim, a irrigação hepática e permitindo que o sangue mesentérico drene todo para o fígado. Dessa forma, o risco de encefalopatia é menor, apesar de manter-se presente. Todavia, essa operação, por aumentar o afluxo sangüíneo cardiopulmonar, também pode acompanhar-se de insuficiência cardíaca e de congestão pulmonar. Outro inconveniente é a pressão sangüínea na anastomose, que é menor do que nas derivações portassistêmicas, aumentando o risco de obstrução anastomótica3 20 49 54.
Como o sangue esplênico é todo desviado para a circulação sistêmica, muitos dos doentes submetidos a essa derivação passam a apresentar icterícia permanente. Esse sinal decorre da bilirrubina indireta, que é formada nos macrófagos esplênicos e, normalmente, segue para o fígado, onde é conjugada em bilirrubina direta. Com a interrupção do fluxo espleno-hepático, a bilirrubina indireta segue para a circulação sistêmica. Além da icterícia, que pode incomodar seu portador, não se conhecem outras complicações decorrentes desse fenômeno.
Ainda sem explicação definitiva, constata-se que grande número dos doentes submetidos à derivação esplenorrenal distal desenvolvem ascite volumosa no período pós-operatório imediato. Essa complicação geralmente regride em poucos meses, porém pode persistir por tempo prolongado. Acredita-se que a ascite se deva ao desarranjo no sistema de drenagem linfática decorrente das múltiplas ligaduras de ductos linfáticos durante a mobilização das veias esplênica e renal. Essas ligaduras devem ser cuidadosas, pois, caso contrário, haverá grande derrame de linfa, provocando o quadro de quiloperitônio.
INTERRUPÇÃO DO FLUXO PARA AS VARIZES ESOFÁGICAS E GÁSTRICAS
O primeiro procedimento que interrompeu parte do fluxo porta para o território das varizes foi a esplenectomia. Na realidade, essa operação havia sido proposta e realizada em decorrência do desconforto provocado pela esplenomegalia e por se acreditar que ela era responsável pelo sangramento. Os bons resultados obtidos em parte dos doentes fez com que a retirada completa do baço se tornasse tratamento de rotina na hipertensão porta, independente de sua etiologia.
Ao se verificar que o crescimento do baço não mostrava relação com a hemorragia das varizes, considerou-se que o sangramento seria controlado pela diminuição pressórica na veia porta, já que aproximadamente 30% do sangue venoso que aflui ao fígado provém do baço. Dessa forma, a hipertensão porta seria reduzida em 30%. Entretanto, essa afirmação também era incorreta, pois tal diminuição pressórica, quando ocorria, era transitória. Após a esplenectomia, o afluxo de sangue arterial para as vísceras abdominais redistribuía-se e, em curto período, a veia porta voltava a receber dos órgãos digestórios volume de sangue semelhante ao fluxo prévio à retirada do baço.
Posteriormente, compreendeu-se que o sangramento das varizes cessava não pela redução dos níveis pressóricos do sistema porta, mas por interrupção parcial do afluxo sangüíneo à região esofagogástrica pelos vasos esplenogástricos e pelos vasos curtos, afluentes da veia esplênica, e que eram ligados durante a esplenectomia. Portanto, essa cirurgia desconectava o sistema porta das varizes em sua parte esquerda30. Por ser apenas uma desconexão parcial, muitos doentes voltavam a sangrar.
Uma outra complicação da esplenectomia advém da ligadura da veia esplênica. Com a interrupção do fluxo sangüíneo nesse vaso, forma-se trombo de dimensões variáveis, que pode permanecer apenas junto à ligadura ou estender-se por toda a veia e, eventualmente, até progredir para dentro da porta, agravando a hipertensão. Na maioria das vezes, essa trombose regride espontaneamente em menos de seis meses. Uma situação mais grave ocorre, quando o trombo cresce para dentro das veias mesentéricas inferior e superior. Tal complicação pode provocar angina abdominal durante vários meses e, ocasionalmente, evoluir com necrose mesentérica3 47 52 55.
No final da década de 1950, começaram, em diversos países, inclusive no Brasil, com Lemos-Torres, Bernardes de Oliveira, Degni, Hassab e Couto Jr, entre outros, os estudos voltados à desconexão venosa entre o sistema porta e a região esofagogástrica, de onde provinha a maior parte das hemorragias. O procedimento recebeu o nome de desconexão porta-ázigo ou azigoporta59. Todavia, esse nome revela-se inadequado, já que não há como desconectar esses dois sistemas venosos diante da ampla rede vascular que os conecta, no diafragma, pelo retroperitônio e mediastino posterior, além de drenagens viscerais torácicas e abdominais para ambos os sistemas. A denominação mais apropriada é desconexão portavarizes, pois o procedimento, na verdade, reduz o fluxo sangüíneo entre o sistema porta hepático e a região das varizes esofágicas e gástricas.
Essa operação consiste em ligar todas as veias periesofágicas e perigástricas craniais, complementando o procedimento com a sutura das varizes que percorrem o esôfago inferior, a cárdia, o fundo gástrico e o corpo do estômago17 31. Alguns cirurgiões, a partir de Sugiura e Futugawa, em 1973, passaram a acrescentar a esse procedimento a secção completa do esôfago e subseqüente anastomose esofágica, para interromper o fluxo para as varizes torácicas57. A esplenectomia faz parte tradicionalmente da desconexão, por causa da veia esplênica e de seus afluentes provenientes do estômago: vasos gástricos curtos, veia gastro-omental esquerda e vasos esplenogástricos54 56.
Em alguns casos, o baço é rodeado de grande trama de varizes, que se estende por todos os seus ligamentos. Esses vasos fazem parte das vias portafugas para a circulação sistêmica e são úteis para reduzir a pressão porta. Nessa situação, prefere-se evitar a esplenectomia, não apenas pela grande dificuldade técnica, devido ao risco de sangramento de difícil controle, mas também para preservar essa via portafuga e o próprio baço. Em outros casos as dimensões do baço mostram-se reduzidas, mesmo com níveis pressóricos elevados, não justificando a esplenectomia, já que o sistema porta não fez desse órgão uma via de represamento ou fuga sangüínea. Quando não se puder ou não se justificar a esplenectomia, mostra-se útil, ao menos, ligar a artéria esplênica que irá reduzir consideravelmente a pressão intra-esplênica e, indiretamente, diminuirá a pressão no território esofagogástrico.
Em estudos que desenvolvemos a partir de 1979, observamos que os vasos esplenogástricos constituíam, de fato, uma segunda circulação do baço, independente de seu pedículo vascular. A drenagem dos vasos esplenogástricos para a veia esplênica era facultativa e indireta, através de vasos intermediários intra e extra-esplênicos42. Graças a esse conhecimento passamos a realizar a esplenectomia subtotal, na qual preservamos apenas o pólo superior do baço suprido pelos vasos esplenogástricos e removemos o restante do órgão, após a ligadura de seu pedículo vascular37. Por esse procedimento, o pólo superior esplênico torna-se um órgão anexo ao fundo gástrico sem relação com a veia esplênica, portanto, sem transmitir à região das varizes a pressão porta38. Dessa maneira, preserva-se a função esplênica por meio de parte do baço e não há contraposição aos princípios da desconexão para tratar a hipertensão porta39 43.
Atualmente, consideramos o melhor tratamento cirúrgico para hipertensão porta o procedimento que consiste em:
- esplenectomia subtotal;
- ligadura de todos os vasos da parede posterior do estômago, principalmente a veia gástrica esquerda e a chamada veia gástrica posterior13;
- ligadura da veia gástrica direita (pilórica);
- ligadura dos vasos da curvatura menor do estômago acima da incisura angular;
- ligadura completa de todos os vasos que envolvem a cárdia e o esôfago abdominal;
- abertura longitudinal da parede anterior do estômago, seguindo a orientação de um cateter nasogástrico, e sutura contínua de todas as varizes gástricas até o esôfago distal.
A desconexão portavarizes interrompe o fluxo venoso, entre o território porta, em hipertensão, e a região das varizes que mais sangram nessa afecção. Esse bloqueio cranial ao sangue porta faz com que novas vias portafugas sejam criadas em sentido caudal do abdome e também no retroperitônio. A gastropatia hipertensiva também pode ser beneficiada por esse procedimento, por que há redução do aporte de sangue porta para o estômago. Outra vantagem dessa operação consiste em não diminuir o fluxo venoso para o fígado. Não havendo derivação sangüínea portassistêmica, evita-se a sobrecarga volêmica cardiopulmonar e previne-se a encefalopatia.
A recidiva do sangramento, a longo prazo, constitui o principal inconveniente da desconexão, pelo desenvolvimento de novas vias portafugas em direção ao estômago e esôfago inferior. Consideramos essa possibilidade mais provável quando realizou-se a desconexão de forma tecnicamente incompleta.
Em algumas situações excepcionais, as derivações venosas e as desconexões são insuficientes para interromper o sangramento de grandes varizes que percorrem todo o esôfago e grande parte do estômago. Nessa situação, felizmente rara, para salvar a vida do doente, podem-se realizar procedimentos mais agressivos como a substituição do esôfago inferior por alça jejunal (operação de Merendino, proposta para o tratamento da hipertensão porta por Nachalas, em 1956, ou esofagectomia total, ou ainda esofagogastrectomia, seguidas de interposição colônica28 . Essas cirurgias, por seu porte, em doentes debilitados pelo sangramento, acompanham-se de elevada mortalidade, mas podem representar a única alternativa de interromper o sangramento.
Desde o fim da década de 1980, a cirurgia pela via laparoscópica vem ganhando terreno na prática cirúrgica. A via de acesso menor permite que o doente tenha recuperação pós-operatória mais favorável e seu retorno às atividades normais em prazo menor. Deve-se, entretanto, considerar que a via laparoscópica é apenas o acesso para o procedimento operatório, que precisa seguir todos os princípios terapêuticos da doença que esteja sendo abordada.
Um outro aspecto fundamental é a limitação dessa via em algumas afecções. Diante de tais empecilhos ou quando houver qualquer complicação que dificulte o prosseguimento da cirurgia pela via laparoscópica, deve-se converter imediatamente a operação para a via aberta tradicional.
Na hipertensão porta, já existem algumas publicações preliminares que mostram ser factível a ligadura da artéria esplênica e a desconexão portavarizes externa do esôfago abdominal e estômago, pela via laparoscópica. Realiza-se também a esplenectomia quando o baço não estiver muito aumentado ou rodeado por grande quantidade de varizes. Esse procedimento, por ser incompleto, é útil apenas nos casos menos graves25.
Em presença de sangramento intenso e com repercussões hemodinâmicas graves, é preferível não operar o doente de imediato, pois o risco operatório torna-se muito elevado. Deve-se tentar inicialmente coibir a hemorragia com medicamentos (beta-bloqueadores, somatostatina e octreotida) e esclerose endoscópica. Se essa conduta revelar-se insuficiente ou indisponível, pode-se passar o balão de Sengstaken-Blakemore, por um tempo não superior a 24 horas3 4.
Enquanto se tenta interromper o sangramento por meio de medidas conservadoras, o paciente deve ser compensado em seus distúrbios hematológicos, com transfusões de hemácias, administração de vitamina K, a cada 12 horas e, se necessário, transfusões de plaquetas e fatores de coagulação isolados ou diluídos em plasma fresco. A parte bioquímica também deve ser tratada, principalmente com respeito às alterações hidroeletrolíticas. Impõe-se ainda verificar o estado funcional do rim para propor o tratamento necessário.
Logo que o paciente estabilizar-se, deve-se programar a cirurgia definitiva, de acordo com a conduta da equipe médica que assumir o caso. Se o paciente continuar sangrando ou não se puder estabilizar suas condições gerais por meios conservadores, a operação impõe-se no menor prazo possível.
O tratamento cirúrgico de urgência tem o objetivo maior de manter o paciente vivo. Para isso, o cirurgião deve limitar o procedimento aos conhecimentos que já possua e sobre os quais tem maior domínio. De imediato, o estômago deve ser amplamente aberto longitudinalmente para remover todos os coágulos e, com fio 0 de absorção lenta, suturar as varizes sangrantes, com delicadeza, para não agravar o sangramento. Após a interrupção da hemorragia, deve-se suturar as demais varizes intragástricas e esofágicas distais. Em seguida, impõe-se suturar o estômago, decidir, ouvindo-se o anestesiologista, pelo prosseguimento da cirurgia e optar pela desconexão ou derivação, ou a interrupção do ato operatório para estabilizar melhor o paciente e reoperá-lo eletivamente em melhores condições.
O pré e o pós-operatório das cirurgias eletivas para tratar a hipertensão porta esquistossomática, em geral, não requerem cuidados especiais além dos habituais nas operações abdominais maiores.
Pré-operatório: os exames pré-operatórios são os rotineiros e incluem o perfil hematológico e o coagulograma. Deve-se ter em mente que a leucopenia, a trombocitopenia e a elevação do tempo de protrombina são comuns e não apresentam repercussão clínica maior, nem requerem preparo especial. Muitas vezes, para tranqüilidade da equipe cirúrgica e anestesiológica, reservam-se concentrados de plaquetas e até fatores de coagulação para o ato operatório. Todavia, esses elementos raramente são utilizados, pois o paciente não apresenta distúrbios de coagulação durante as cirurgias.
Na parte bioquímica, deve-se conhecer a glicemia, o valor da creatinina, para se ter certeza da boa função renal, e a albumina, para ter a garantia de uma boa reserva nutricional, que terá de compensar as repercussões do trauma operatório. Cabe ressaltar que toda operação maior repercute desfavoravelmente sobre as reservas orgânicas, utilizando por completo o glicogênio armazenado e reduzindo os valores da albumina. Por isso, em cirurgia eletiva, é importante reforçar o aporte nutricional dos pacientes, elevando as reservas de glicogênio e os valores da albumina.
Os cuidados pré-operatórios imediatos são os rotineiros das operações abdominais maiores e incluem jejum, cateterização venosa central, cateterização vesical e antibioticoprofilaxia, dentro da rotina hospitalar. Se for indicada a esplenectomia total impõe-se a vacinação prévia múltipla, tendo especial atenção para os diplococos pulmonares e meníngeos, além dos hemófilos. A passagem de cateter nasogástrico mostra-se indispensável para esvaziar o estômago e facilitar as operações, independente da cirurgia escolhida. Não há risco real de que essa cateterização possa provocar sangramento das varizes, apesar de alguns profissionais temerem essa possibilidade. Ao final da cirurgia, esse cateter pode ser retirado.
Pós-operatório: todas as operações abdominais de grande porte requerem cuidados especiais por seu elevado potencial de complicações graves e, por vezes, despercebidas precocemente. Desde o primeiro dia pós-operatório, o paciente deve ser examinado com atenção e demoradamente em busca de alguma alteração, principalmente abdominal e torácica. Exames complementares, incluindo o hemograma, o ionograma (sódio, potássio e cálcio), glicemia, creatinina e albumina sérica trazem informações úteis sobre as repercussões do trauma operatório e a resposta endocrinometabólica do doente. A radiografia de tórax também complementa a ausculta pulmonar; deve-se manter o sinal de alerta para a presença de atelectasia, congestão parenquimatosa e, eventualmente, derrames cavitários.
O paciente deve ser examinado pelo cirurgião responsável pelo procedimento operatório várias vezes ao dia, para detectar, o mais precocemente possível, complicações pós-operatórias. Todos os distúrbios observados aos exames físico e complementar devem ser corrigidos de imediato.
A mobilização do paciente deve ocorrer tão logo o paciente tenha condições de se levantar, para evitar fenômenos tromboembólicos. Entre os dados vitais, destaca-se a febre, que a maioria dos doentes apresenta. De início, convém pesquisar a presença de atelectasia ou sepse pulmonar, infecção urinária ou de ferida operatória e a presença de abscesso intra-abdominal. Descartadas as afecções pirogênicas evidentes, atribui-se a febre à resposta orgânica ao trauma, principalmente se houve manipulação do baço (ligadura da artéria esplênica, esplenectomias parciais ou totais e auto-implante esplênico). Qualquer operação que envolva esse órgão pode evoluir, no pós-operatório, com febre persistente por até três meses, sem repercussão orgânica maior.
Os pacientes submetidos a operações sobre o baço apresentam com certa freqüência, coleções líquidas no hipocôndrio esquerdo. Na maioria das vezes, eles representam acúmulos serossangüíneos e não devem ser confundidos com abscesso subfrênico. Há risco ao puncionar-se a coleção líquida estéril que, geralmente, desaparece espontaneamente. A punção e drenagem de tais coleções podem evoluir com abscessos subfrênicos, por vezes de difícil tratamento.
A hemorragia abdominal e, mais especificamente, digestiva alta é outra complicação que pode ocorrer no pós-operatório de hipertensão porta. No caso de sangramento por deficiência de hemostasia cirúrgica, o paciente deve ser reoperado de imediato e ligar, com cuidado, os vasos sangrantes. Não se justificam procedimentos conservadores, com reposição volêmica, transfusões, administração de fatores de coagulação ou uso de medicamentos nessas situações.
Quanto à hemorragia digestiva, a endoscopia mostra-se decisiva na definição da causa do sangramento. Trata-se de sangramento pelas varizes, erosão aguda da mucosa gastroduodenal, ou úlcera péptica que foi ativada pelo ato operatório? No caso das varizes, a esclerose endoscópica revela-se suficiente para interromper o sangramento, já que a cirurgia reduziu a pressão na região esofagogástrica, permitindo que a endoscopia seja mais eficaz. As outras causas de hemorragia são controladas por meio de inibidores da bomba de prótons na mucosa gástrica.
No pós-operatório de derivações portassistêmicas, podem ser detectadas complicações cardiopulmonares de intensidade variável. Se houver sinais de descompensação aguda cardiopulmonar, impõe-se a reoperação, para desfazer a derivação vascular e complementar o procedimento com desconexão portavarizes14 51.
A dieta dos pacientes deve ser reintroduzida ao se perceber o retorno do peristaltismo eficaz, em torno do terceiro dia de pós-operatório. Não é necessário o escalonamento dietético, iniciando com líquido e progredindo diariamente até a dieta completa. Pode-se oferecer desde o início o alimento que o paciente solicitar e com o qual ele se sentir mais confortável.
No período pós-prandial, os pacientes com trombose esplenoporta e esplenomesentérica apresentam dor de intensidade variável. Nesses casos, são indicadas refeições em menor quantidade e divididas ao longo do dia. Esses doentes devem ingerir grande quantidade de líquidos, para prevenir hemoconcentração, que pode piorar a trombose. Os pacientes devem ser orientados a procurar o hospital se houver piora da dor para investigar-se a possibilidade de isquemia mesentérica. Nessa situação, cabe a angiografia e, nos casos mais graves, a laparotomia.
Outra causa de dor abdominal decorre de isquemia do baço, nos casos de ligadura exclusiva da artéria esplênica. Essa dor é mais acentuada no hipocôndrio esquerdo e irradia-se para o dorso e ombro esquerdo. Indica-se apenas tratamento sintomático durante o período em que persistir a dor que pode estender-se a poucos meses.
No acompanhamento pós-operatório tardio, o paciente deve submeter-se a endoscopias anuais. Muitas vezes as varizes persistem por tempo prolongado, porém sem sinais de sangramento. Ainda não há explicação para a persistência varicosa em alguns casos, enquanto, em outros, há o completo desaparecimento das varizes. O mais importante é que o paciente não tenha a recorrência da hemorragia39 41 43.
Dentro de protocolos específicos, o baço pode ser estudado por meio de ultra-som, tomografia computadorizada e cintilografia com tecnécio, para avaliar suas dimensões e função fagocitária. Exames hematológico e imunológico (contagem de linfócitos e dosagem de imunoglobulinas) completam a investigação da função esplênica36 40.
As múltiplas alternativas de abordagem da hipertensão porta revelam a insatisfação em relação às opções terapêuticas existentes. Portanto, ainda não há indícios de que uma conduta definitiva melhor para o paciente venha dominar as demais.
O médico experiente deve personalizar as opções terapêuticas. Outros fatores importantes na escolha do melhor procedimento, incluem: a infra-estrutura do seu hospital e o estado geral do paciente no momento da decisão. Todo paciente com hipertensão porta esquistossomática e que necessita de tratamento cirúrgico deve ser considerado como portador de doença grave e ser tratado como tal.
1. Alves JBR. Das anastomoses porto-cavas. Hospital 59: 859-867, 1961.
2. Alves JBR. Operação de escolha no tratamento da hipertensão portal. Jornal Brasileiro de Cirurgia 2: 1061-1067, 1963.
3. Araujo ID, Pinto PMM, Petroianu A. Evolução pós-operatória tardia de pacientes esplenectomizados e portadores de derivação portossistêmica. Revista Brasileira de Medicina 48: 271-274, 1991.
[ Lilacs ]
4. Bismuth H, Adam R, Mathur S, Sherlock D. Options for elective treatment of portal hypertension in cirrhotic patients in the transplantation era. American Journal Surgery 160: 105-110, 1990.
5. Blakemore AH. Portacaval anastomosis. Surgery, Gynecology and Obstetrics 87: 277-279, 1948.
6. Blakemore AH, Lord JW. The technique of using vitallium tubes in establishing portacaval shunts for portal hypertension. Annals of Surgery 122: 476-489, 1945.
7. Blalock A. The use of shunt or by-pass operations in the treatment of certain circulatory disorders including portal hypertension and pulmonic stenosis. Annals of Surgery 125: 129-141, 1947.
8. Bogliolo L. Sôbre o quadro anatômico do fígado na forma hépato-esplênica da esquistossomose mansônica. Hospital 45: 283-306, 1954.
9. Bouldghene F, Grange JD, Faintuch JM, Lame S. Dérivation portocave intra-hépatique par voie transjugulaire. Presse Médicale 20: 2108, 1991.
10. Buttrerworth A, Dunne D, Fulford A, Capron M. Immunity in human schistosomiasis mansoni. Biochimie 70: 1053-1063, 1988.
11. Cabrera J, Maynar M, Granados R. Transjugular intrahepatic portosystemic shunt versus sclerotherapy in the elective treatment of variceal hemorrhage. Gastroenterology 110: 832-839, 1996.
[ Medline ]
12. Campos Christo MB. Esplenectomias parciais regradas. Hospital 56: 645-50, 1959.
13. Carvalho JBV, Petroianu A. Estudo anatômico da veia gástrica esquerda humana, enfatizando aspectos cirúrgicos. Revista do Colégio Brasileiro de Cirurgiões 23: 93-97, 1996.
14. Castell DO, Conn HO. The determination of portacaval shunt patency. Medicine 51: 315-336, 1972.
[ Medline ]
15. Cello JP, Grendell JH, Crass RA, Weber TE, Trunkey DD. Endoscopic sclerotherapy versus portacaval shunt in patients with severe cirrhosis and accute variceal hemorrhage. New England Journal of Medicine 316: 11-15, 1987.
[ Medline ]
16. Conn HO. Ideal treatment of portal hypertension in 1985. Clinical Gastroenterology 14: 259-292, 1985.
17. Crile Jr G. Transesophageal ligation of bleeding esophageal varices. Archives of Surgery 61: 654-660, 1950.
18. Dagenais MH, Bernard D, Marleau D, Morgan S. Surgical treatment of severe postshunt hepatic encephalopathy. World Journal of Surgery 15: 109-114, 1991.
[ Medline ]
19. Détrie P, Bakaloudis P. L'anastomose mésentérico-cave. Journal de Chirurgie 79: 398-411, 1960.
20. Fischer JE, Bower RH, Atamian S, Welling R. Comparison of distal and proximal splenorenal shunts. Annals of Surgery 194: 531-544, 1981.
[ Medline ]
21. Goffi FS, Bastos ES, Thiago JBS, Silva LC, Ferrarini E. A anastomose esplenorrenal no tratamento da hipertensão portal de origem esquistossomótica. Revista Paulista de Medicina 59: 2341-237, 1961.
22. Gonzalez EM, San Martin JH, Abella PC, Aguyo JLR, Jevalik D. Interposition left gastric-caval shunt using internal jugular vein autograft in the treatment of portal hypertension. British Journal of Surgery 65: 115-117, 1978.
[ Medline ]
23. Inokuchi K, Kobayashi M, Kusaba A, Ogawa Y, Saku M, Shiizaki T. New selective decompression of esophageal varices. Archives of Surgery 100: 157-162, 1970.
[ Medline ]
24. Iwatsuki S, Starzl TE, Todo S, Gordon, RD. Liver transplantation in the treatment of bleeding esophageal varices. Surgery 104: 697-705, 1988.
[ Medline ]
25. Jaroszewski DE, Schlinkert RT, Gray RJ Laparoscopic splenectomy for the treatment of gastric varices secondary to sinistral portal hypertension. Surgical Endoscopy 14: 87, 2000.
26. Leite Sobrinho GB, Alves JB, Lázaro da Silva A. Estudo oximétrico venoarterial na síndrome de hipertensão porta por esquistossomose mansoni hepatoesplênica. Revista Associação Médica Brasileira 26: 316-323, 1980.
27. Linton RR, Jones CM, Volwiler W. Portal hypertension. Surgical Clinics of North America 27: 1162-1170, 1947.
28. Nachlas MM. Treatment of bleeding esophageal varices by resection of the lower esophagus. Archives of Surgery 72: 634-643, 1956.
29. Nay HR, Fitzpatrick HF. Mesocaval "H" graft using autogenous vein graft. Annals of Surgery 1983: 114-119, 1976.
30. Okumura M, Shiroma M, Nakashima Y, Ferreira JM, Raia A, Meira JA, Corrêa Netto A. Esplenectomia intracapsular. Revista do Hospital das Clínicas da Faculdade de Medicina de São Paulo 31: 161-165, 1976.
[ Medline ]
31. Oliveira AB, Goldenberg S. Estudo dos resultados imediatos e tardios do tratamento cirúrgico das varizes do esôfago pela técnica da ligadura extramucosa e esplenectomia. Revista Paulista de Medicina 68: 303-328, 1966.
[ Medline ]
32. Oliveira AE, Petroianu A. Hiperesplenismo em hipertensão porta esquistossomática. Arquivos de Gastroenterologia, 2002.
33. Orozco H, Mercado MA, Chan C, Navarro EG, Martinez LML. A comparative study of the elective treatment of variceal hemorrhage with beta-blockers, transcendoscopic sclerotherapy and surgery. Annals of Surgery 232: 216-219, 2000.
[ Medline ]
34. Petroianu A. Esplenectomia subtotal e anastomose esplenorrenal proximal para o tratamento da hipertensão portal. Revista Brasileira de Cirurgia 73: 101-104, 1983.
[ Lilacs ]
35. Petroianu A. Treatment of portal hypertension by subtotal splenectomy and central splenorenal shunt. Postgraduate Medical Journal 64: 38-41, 1988.
[ Medline ]
36. Petroianu A. Avaliação imaginológica da esplenectomia subtotal e anastomose esplenorrenal centralizada para o tratamento da hipertensão portal esquistossomática. Revista Médica de Minas Gerais 3: 106-108, 1993.
[ Lilacs ]
37. Petroianu A. Subtotal splenectomy and portal variceal disconnection in the treatment of portal hypertension. Canadian Journal of Surgery 36: 251-254, 1993.
[ Medline ]
38. Petroianu A. Esplenectomia subtotal preservando o pólo superior suprido pelos vasos esplenogástricos. Revista do Colégio Brasileiro de Cirurgiões 21: 21-26, 1994.
39. Petroianu A. Subtotal splenectomy for the treatment of retarded growth and sexual development associated with splenomegaly. Minerva Chirurgica, 2002.
40. Petroianu A, Antunes LJ. Immune profiles in hepatosplenic schistosomiasis mansoni after surgical treatments. Journal of International Medical Research 26: 43-49, 1998.
[ Medline ]
41. Petroianu A, Petroianu LPG. A twelve-year-follow-up of subtotal splenectomy and central splenorenal shunt for treatment of schistosomatic portal hypertension. Folha Médica 116: 107-109, 1998.
42. Petroianu A, Petroianu S. Anatomy of splenogastric vessels in patients with schistosomal portal hypertension. Clinical Anatomy 7: 80-83, 1994.
43. Petroianu A, Silva RG, Simal CJR, Carvalho DE, Silva RA. Late postoperative follow-up of patients submitted to subtotal splenectomy. American Surgeon 63: 735-740, 1997.
[ Medline ]
44. Pinto AD, Penteado JG. Hipertensão portal e hiperesplenismo. Revista Paulista de Medicina 47: 247-253, 1955.
45. Raia S, Mies S, Macedo AL. Portal hypertension in schistosomiasis. Clinical Gastroeneterology 14: 57-82, 1985.
46. Raia S, Silva AT. Descompressão portal seletiva por anastomose espleno-cava com interposição de prótese de Dacron. Revista do Hospital das Clínicas da Faculdade de Medicina de São Paulo 30: 69-76, 1975.
47. Rattner DW, Ellman L, Warshaw AL. Portal vein thrombosis after elective splenectomy. An under appreciated potentially lethal syndrome. Archives of Surgery 128: 565-569, 1993.
48. Rosenberg D, Saraiva JAM, Vilella MP. Avaliação dos resultados da anastomose porto-cava no tratamento cirúrgico da hipertensão portal. Jornal Brasileiro de Medicina 3: 609-672 e 778-829, 1960.
49. Rotstein LE, Makowka L, Langer B, Blendis LM, Stone RM, Colapinto RF. Thrombosis of the portal vein following distal splenorenal shunt. Surgery, Gynecology and Obstetrics 149: 847-851, 1979.
[ Medline ]
50. Sakai P, Maluf F, Gurgel J, Ishioka S. Late results of endoscopic sclerotherapy of bleeding esophageal varices in patients with hepatic cirrhosis and schistosomiasis. Arquivos Brasileiros de Cirurgia Digestiva 10: 17-21, 1995.
51. Silva AL, Nunes TA. Estudo radiológico da anastomose espleno-renal proximal através da veia gastro-omental direita, em pacientes portadores de hipertensão porta esquistossomótica. Revista Goiana de Medicina 37: 23-28, 1991.
[ Lilacs ]
52. Silva AL, Petroianu A. Interposition mesorenal shunt for treatment of portal hypertension. Arquivos Brasileiros de Cirurgia Digestiva 7: 16-17, 1992.
53. Silva LC, Raia S. Tratamento cirúrgico da encefalopatia porto-sistêmica. Revista do Hospital das Clínicas da Faculdade de Medicina de São Paulo 35: 223-224, 1980.
54. Silva LC, Strauss E, Gayotto LCC, Mies S, Macedo AL, Silva AT, Silva EF, Lacet CM, Antonelli RH, Fermanian J, Foster S, Raia A, Raia S. A randomized trial for the study of the elective surgical treatment of portal hypertension in mansonic schistosomiasis. Annals of Surgery 204: 148-153, 1986.
[ Medline ]
55. Simeone FA, Hopkins RW. Portarenal shunt for hepatic cirrhosis and portal hypertension. Surgery 61: 153-168, 1967.
[ Medline ]
56. Skinner DB. Transthoracic, transgastric interruption of bleeding esophageal varices. Archives of Surgery 99: 447-453, 1969.
[ Medline ]
57. Sugiura M, Futugawa S. A new technique for treating esophageal varices. J Thoracic and Cardiovascular Surgery 66: 677-685, 1973.
58. Teixeira ED, Yu H, Bergan JJ. Nova técnica na cirurgia da hipertensão porta. Revista Brasileira de Cirurgia 53: 443-446, 1967.
59. Torrès UL, Degni M. Bases d'une nouvelle technique chirurgicale pour le traitement de l'hypertension portale. Journal de Chirurgie 91: 571-582, 1966.
[ Medline ]
60. Vasconcelos E. Terapêutica cirúrgica da hipertensão portal. Revista Paulista de Medicina 45: 577-578, 1954.
61. Warren WD, Galambos J, Riepe SP, Henderson JM, Millikan WJ, Brookes WS, Salan AA, Kutun MA. Distal splenorenal shunt versus endoscopic sclerotherapy for long-term management of variceal bleeding. Annals of Surgery 203: 454-462, 1986.
[ Medline ]
62. Warren WD, Zeppa R, Fomon JJ. Selective trans-splenic decompression of gastroesophageal varices by distal splenorenal shunt. Annals of Surgery 166: 437-455, 1967.
[ Medline ]
63. Whipple AO. The problem of portal hypertension in relation to the hepatosplenopathies. Annals of Surgery 122: 499-475, 1945.
Andy Petroianu
petroian[arroba]medicina.ufmg.br
Faculdade de Medicina da Universidade Federal de Minas Gerais, Belo Horizonte, MG
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|