 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Região estudada e amostragem
O estudo foi realizado com amostras de soro de bovinos de nove municípios da mesorregião Norte Fluminense do estado do Rio de Janeiro, de acordo com a divisão político-administrativa da Fundação CIDE (1997).
Coletou-se, assepticamente, o sangue de 532 animais puros Bos indicus ou mestiço B. indicus x B. taurus. A coleta e a amostragem dos soros foram realizadas segundo metodologia descrita, em estudos anteriores, com Babesia bigemina, para a mesma mesorregião do presente trabalho (Souza et al. 2000).
Divisão por grupos
As 532 amostras de soro coletadas estão distribuídas entre nove municípios: Campos (n= 186), Macaé (n= 91), São Fidélis (n= 55), Carapebus (n= 10), Quissamã (n= 50), Conceição de Macabú (n= 27), São Francisco de Itabapoana (n= 69), Cardoso Moreira (n= 25) e São João da Barra (n= 19). Os animais estudados foram divididos por grupos; quanto à faixa etária: 1 a 3 anos (n= 110), 3 a 6 anos (n= 241) e > 6 anos (n= 181); quanto ao sexo: fêmeas (n= 497) e machos (n= 35) e quanto à aptidão zootécnica: animais com aptidão zootécnica para corte (n= 444) e animais com aptidão zootécnica para leite (n= 88).
Ensaio imunoenzimático (ELISA) indireto
Procedeu-se o ensaio ELISA indireto para detecção de imunoglobulinas do isotipo IgG anti A. marginale. Na obtenção de antígeno utilizou-se A. marginale proveniente de sangue de bezerros com parasitemia de 80,0% (Kessler et al. 1987). Microplacas de poliestireno com 96 orifícios foram sensibilizadas com extrato total antigênico de A. marginale obtido segundo metodologia descrita por Madruga et al. (1996), diluído em tampão carbonato pH 9,6. Os soros controles negativo e positivo, bem como os soros testes foram diluídos à 1:500 em tampão salino fosfatado com Tween 20 a 0,05% (PBST) pH 7,4. Foi utilizado como conjugado IgG de coelho anti IgG bovina marcada com fosfatase alcalina (Sigma Chemical) diluído em PBST pH 7,4. Utilizou-se como substrato-cromógeno para-nitrofenil fosfato (Sigma Chemical) diluído em tampão glicina pH 10,5. A leitura do ensaio foi realizada em espectrofotômetro multicanal para microplacas de 96 orifícios (Bio Rad Laboratories, model 550 Microplate Reader) ao comprimento de onda de 405hm.
Análise estatística
Para o ELISA a linha de corte (cut-off) foi estabelecida com grau de confiança de 99,99%, o qual é determinado pela média mais três vezes o desvio padrão da densidade óptica dos soros controles negativos. Realizou-se a análise estatística dos dados utilizando os testes de Fisher e Qui-quadrado (c2) com P variando de 0,000 a 0,05.
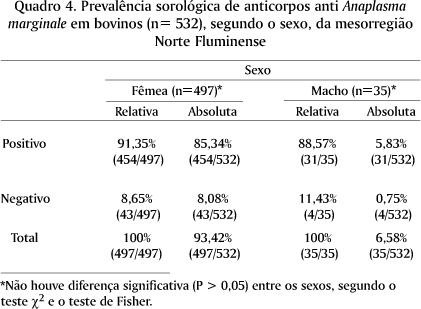
A análise das 532 amostras de soro demonstrou que 485 (91,16%) foram reagentes positivas ao ELISA indireto, dos quais: 55,45% com título de 1:500, 22,18% com título de 1:1000, 6,77% com título 1:2000, 3,01% com título de 1:4000, 1,50% com título de 1:8000, 0,94% com título de 1:16000, 0,75% com título de 1:32000, 0,56% com título de 1:64000 e 8,84% foram negativos (Quadro 1).
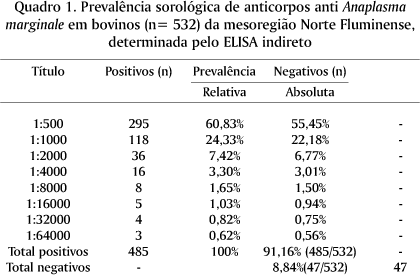
A análise da prevalência segundo a faixa etária, dividindo-se em três grupos: 1 a 3 anos, 3 a 6 anos e > 6 anos de idade; revelou que 91,82%, 92,95% e 88,95% dos animais foram positivos, respectivamente. Não houve diferença significativa (P > 0,05) entre os grupos etários, segundo o teste c2 (Quadro 2).
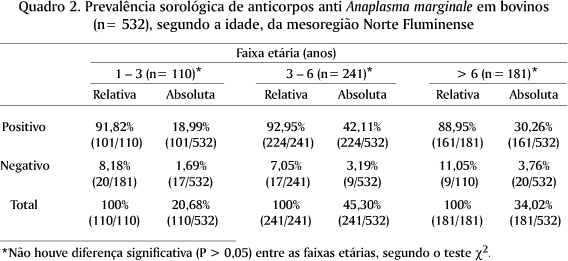
Para a aptidão zootécnica, a análise da soroprevalência encontrada foi de 91,22% dos bovinos com aptidão para corte e 90,91% dos bovinos com aptidão para leite. Não houve diferença significativa (P > 0,05) entre as aptidões, pelo teste c2 e o teste de Fisher (Quadro 3).
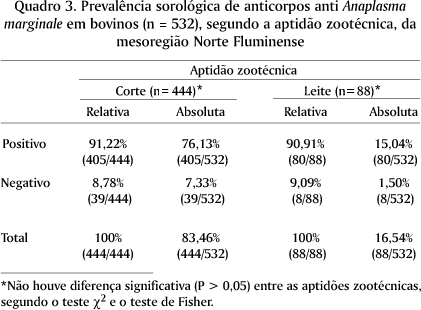
Quanto a soroprevalência segundo o sexo, 91,35% das fêmeas e 88,57% dos machos foram positivos. Não houve diferença significativa (P > 0,05) entre os sexos, pelo teste c2 e o teste de Fisher (Quadro 4).
Ao analisar a prevalência entre os nove municípios, observou-se não haver diferença significativa (P > 0,000), segundo o teste c2. A soroprevalência de A. marginale para cada município foi de: Campos 94,62% (176), Macaé 91,21% (83), São Fidelis 85,45% (47), Carapebus 100% (10), Quissamã 96% (48), Conceição de Macabú 100% (27), São Francisco de Itabapoana 81,16% (56), Cardoso Moreira 96% (24) e São João da Barra 73,68% (14) (Fig.1).
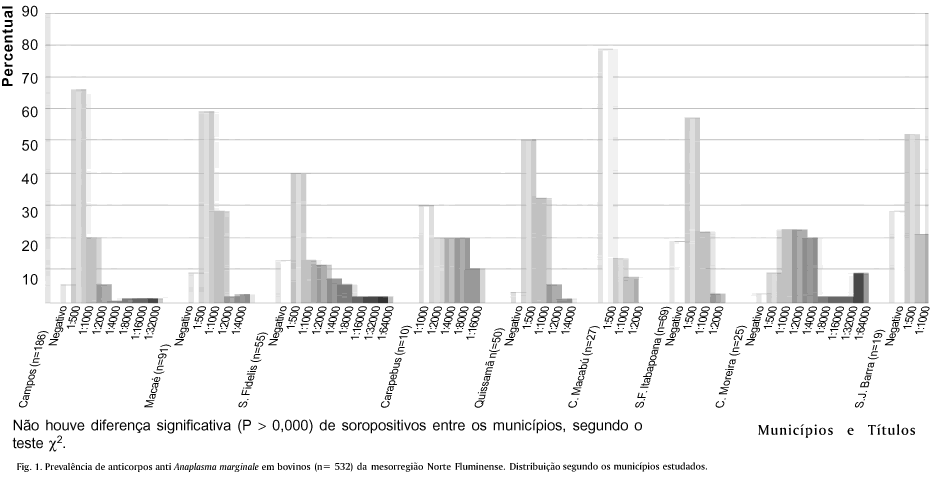
A prevalência encontrada caracteriza a mesorregião estudada como uma área de estabilidade enzoótica para A. marginale. Esta situação é pertinente, pois a anaplasmose bovina é endêmica na maioria das regiões de clima tropical, sub-tropical e temperado do globo (Rogers et al. 1978, Payne & Scott 1982). A não observação de diferença estatística das prevalências entre os municípios, demonstrou que a infecção por A. marginale é alta e homogênea na mesorregião Norte Fluminense. Estas afirmativas são corroboradas pelo fato de esta rickettsia possuir diferentes meios de transmissão mecânica, além da transmissão biológica por B. microplus (Ribeiro 1991, Kessler et al. 1992).
As áreas de instabilidade enzoótica para A. marginale, no Brasil, são regiões onde os vetores deste agente não têm condições favoráveis para o seu desenvolvimento. Em um levantamento realizado no estado de Sergipe, sob as regiões climáticas árida, semi-árida, transição semi-árida e transição semi-úmida, foi observado a prevalência média de 16,30% para A. marginale (Oliveira et al. 1992). Outra área nesta condição é o extremo sul do país onde a prevalência para este hematozoário é de 64% (Artiles et al. 1995). Ambos os estudos utilizaram o teste do cartão (TC) na análise epidemiológica.
Os estudos realizados em outras regiões demonstraram o predomínio da situação de estabilidade enzoótica. No estado de Minas Gerais a prevalência observada, pelo TC, para as regiões do Alto Paranaíba, Metalúrgica, Sul de Minas e Triângulo Mineiro, foi de 86,5%, 93,1%, 91,6% e 86,1%, respectivamente (Ribeiro & Reis 1981a). Enquanto para a região da Zona da Mata, deste estado, avaliada pela imunofluorescência indireta (IFI), foi de 81,1% (Ribeiro et al. 1984). Em Santa Catarina, Dalagnol et al. (1995) observaram, pela IFI, que 86,0% de bovinos foram soropositivos.
Na microrregião de Londrina no Paraná foi verificado, pela IFI, a prevalência de 68,0% para a anaplasmose (Vidotto et al. 1995). No entanto, em estudo posterior estes autores observaram, utilizando um ELISA competitivo, na mesma área o percentual de positivos de 87,5% (Vidotto et al. 1997); comprovando a superioridade do ELISA. Ao analisar 324 amostras de três microregiões do estado da Bahia, observou-se que a prevalência pelo ELISA indireto (96,9%) não diferiu significativamente da resultado pela IFI (97,2%); embora, diferissem do teste de conglutinação rápida (91,0%) (Araújo et al. 1998).
Não houve diferença estatística entre os grupos etários, aptidões zootécnicas e sexos, o que demonstra que a infecção por A. marginale nesta mesorregião é independente destes parâmetros. Ribeiro & Reis (1981a) e Madruga et al. (1985), também observaram que a prevalência de anticorpos anti A. marginale é independente do fator racial; e que a partir de quatro meses, independe da idade. Mesmo em condições de instabilidade enzoótica, o parâmetro idade não influencia na situação epidemiológica (Oliveira et al. 1992).
A soroprevalência observada no presente trabalho indica que os animais se infectam quando jovens e sofrem sucessivas reinfecções, mantendo o estado de portador e a imunidade. Muitos estudos comprovam que a resistência natural à anaplasmose perdura por pouco tempo; em torno do 12o ao 60o dia de vida do bezerro (Ribeiro & Reis 1981b, Madruga et al. 1985), quando os níveis de anticorpos colostrais garantem proteção. A anaplasmose é uma enfermidade freqüente em bezerros no Brasil, mesmo em áreas de estabilidade enzoótica (Fonseca & Braga 1924, Tokarnia & Döbereiner 1962, Ribeiro & Reis 1981b, Oliveira et al. 1992).
A superioridade do ELISA demonstrada em diferentes pesquisas fortalece a utilização deste ensaio no presente estudo, onde este foi capaz de qualificar e quantificar anticorpos anti A. marginale.
Araújo F.R., Madruga C.R., Bastos P.A.S., Marques A.P.C. 1998. Freqüência de anticorpos anti Anaplasma marginale em rebanhos leiteiros da Bahia. Arq. Bras. Med. Vet. Zootec. 50(3): 243-246.
Artiles J., Alves-Branco F.P.J., Martins J.R., Correa L.B. & Sapper M.F.M. 1995. Prevalências de Babesia bovis, B. bigemina e Anaplasma marginale no município de Bagé, RS. Revta Bras. Parasitol. Vet. 4(2, Supl.1): 179.
CIDE, Fundação de Informação e Dados do Rio de Janeiro. 1997. Território, Rio de Janeiro. 80p.
Dalagnol C.A., Martins E. & Madruga C.R. 1995. Prevalência de anticorpos contra Babesia bovis, Babesia bigemina, Anaplasma marginale em bovinos de corte na região de clima Cfb. Revta Bras. Parasitol. Vet. 4(2, Supl.1): 220.
Dalgliesh R.J., Jorgensen W.K. & De Vos A.J. 1990. Australian frozen vaccines for the control of babesiosis and anaplasmosis in cattle - A review. Trop. Anim. Hlth Prod. 22: 44-52.
Fonseca A. & Braga A. 1924. Noções sobre a tristeza parasitária dos bovinos. Officina Typográfica do Ministério da Agricultura, Rio de Janeiro. 216p.
Kessler R.H., Madruga C.R., Jesus E.F. & Semprebom D.V. 1987. Isolamento de cepas puras de Babesia bovis, Babesia bigemina e Anaplasma marginale em área enzoótica. Pesq. Agropec. Bras. 22: 747-752.
Kessler R.H., Schenk M.A.M., Madruga C.R., Sacco A.M.S. & Miguita M. 1992. Tristeza parasitária dos bovinos (TPB), p. 1-30. In: Charles T.P. & Furlong J. (ed.) Doenças Parasitárias dos Bovinos de Leite. Embrapa-CNPGL, Coronel Pacheco, MG.
Madruga C.R., Kessler R.H., Gomes A., Schenk M.A.M. & Andrade D.F. 1985. Níveis de anticorpos e parasitemia de Anaplasma marginale em área enzoótica, nos bezerros da raça nelore, ibagé e cruzamento de nelore. Pesq. Agropec. Bras. 20(1): 135-142.
Madruga C.R., Marques A.P.C., Miguita M., Schenk M.A.M. & Kessler R.H. 1996. A preliminary evaluation of an enzyme-linked immunosorbent assay (ELISA) for detection of antibodies, against Anaplasma marginale. Annals XV Panamerican Congress of Veterinary Sciences, Campo Grande, MS, Brazil, p.297. (Summary)
Oliveira A.A., Pedreira P.A.S. & Almeida M.F.R.S. 1992. Doenças de bezerros. II. Epidemiologia da anaplasmose no estado de Sergipe. Arq. Bras. Med. Vet. Zootec. 44(5): 377-386.
Payne R.C. & Scott S.M. 1982. Anaplasmosis and babesiosis in Sahadan. Trop. Anim. Hlth Prod. 14: 75-80.
Ribeiro M.F.B. & Reis R. 1981a. Prevalência da anaplasmose em quatro regiões do estado de Minas Gerais. Arq. Esc. Vet. UFMG. 33(1): 57-62.
Ribeiro M.F.B. & Reis R. 1981b. Exposição natural de bezerros, em áreas endêmicas de Anaplasma marginale, de Minas Gerais. Arq. Esc. Vet. UFMG. 33(1): 63-66.
Ribeiro M.F.B., Patarroyo J.H., Santos J.L. & Farias J.E. 1984. Epidemiologia da anaplasmose bovina no estado de Minas Gerais. I. Prevalência de anticorpos aglutinantes e fluorescentes na Zona da Mata. Arq. Bras. Med. Vet. Zootec. 36(4): 425-432.
Ribeiro M.F.B. 1991. Morfologia, evolução e reprodução do Anaplasma marginale Theiler, 1910 em células epiteliais intestinais de teleóginas de Boophilus microplus (Canestrini, 1887). Estudo ao microscópio óptico e eletrônico. Tese de doutorado, UFMG, Belo Horizonte. 134p.
Rogers R.J., Blight G.W. & Knott S.S. 1978. A study of the epidemiology of Anaplasma marginale infections of cattle of complement-fixing antibodies. Aust. Vet. J. 54(3): 115-120.
Souza J.C.P., Soares C.O., Scofield A., Madruga C.R., Cunha N.C., Massard C.L. & Fonseca A.H. 2000. Soroprevalência de Babesia bigemina em bovinos na mesorregião Norte Fluminense. Pesq. Vet. Bras. 20(1): 26-30.
Tokarnia C.H., Döbereiner J. 1962. A importância da anaplasmose em nossos bezerros e as medidas de seu controle. Veterinária, Rio de J., 15(3-4): 11-19.
Vidotto O., Yamamura M.M., Andrade G.M., Barbosa C.S., Freire R.L. & Vidotto M.C. 1995. Ocorrência de Babesia bigemina, B. bovis e Anaplasma marginale em rebanhos de bovinos leiteiros da região de Londrina, PR. Revta Bras. Parasitol. Vet. 4(2, Supl.1): 184.
Vidotto O., Vidotto M.C., Andrade G.M., Palmer G., McElwain T. & Knowles D.P. 1997. Seroprevelence of Anaplasma marginale on cattle in Paraná state, Brazil, by major surface protein 5 competitive enzyme-linked immuno-sorbent assay. Revta Bras. Parasitol. Vet. 6(2, Supl.1): 321.
José Carlos P. Souza /2, Cleber O. Soares /2, Carlos L. Massard /2, Alessandra Scofield /3 e Adivaldo H. Fonseca /2
souzajcp[arroba]agricultura.gov.br
2. Curso de Pós-Graduação em Medicina Veterinária - Parasitologia Veterinária, Universidade Federal Rural do Rio de Janeiro (UFRRJ). Km 47, Seropédica, RJ 23890-000. E-mail: csoares[arroba]ufrrj.br
3. Acadêmica de Medicina Veterinária da UFRRJ, Bolsista de Iniciação Científica / CNPq.
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|