 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
A área experimental localizou-se em talhão com cana-de-açúcar, do cultivar SP 80–1842, 4° corte (3a soca), na Fazenda São Pedro, município de Piracicaba, estado de São Paulo, pertencente à Usina Iracema S/A.
A colheita mecanizada sem a despalha a fogo foi realizada em 10 de outubro de 1997. O solo, classificado como Argissolo Vermelho Amarelo (Paleudalf), apresentou, na camada de 0-25 cm: pH (CaCl2)4,6; fósforo (resina) 13,0 mg dm-3; potássio 5,1 mmolc dm-3; cálcio 19,0 mmolc dm-3; magnésio 10,0 mmolc dm-3; CTC de 72,1 mmolc dm-3; V = 47 % e 163, 249, 588 g kg-1 de areia, silte e argila respectivamente.
O experimento teve duração de 315 dias, período em que as médias das temperaturas mínimas e máximas foram, respectivamente, de 15,8 e 30,0 °C, e a precipitação foi de 1.335 mm.
Empregou-se o delineamento em blocos inteiramente casualizados, com quatro tratamentos e quatro repetições. Cada parcela foi constituída de 10 segmentos de linhas de cana-de-açúcar, espaçadas de 1,40 com 12 m de comprimento, totalizando uma área de 168 m2, sendo a parcela útil de 90 m2. Os tratamentos foram: (T1) mistura de vinhaça e uréia (100 m3 ha-1 e 100 kg ha-1 de N, respectivamente) aplicada em área total sobre o solo coberto com palhada de cana-de-açúcar, contendo a subparcela 2 x 1,4 m: palhada marcada com 15N e uréia não marcada; (T2) mistura de vinhaça e uréia (100 m3 ha-1 e 100 kg ha-1 de N, respectivamente) aplicada em área total sobre o solo coberto com palhada de cana-de-açúcar, com a subparcela: palhada não marcada e uréia marcada com 15N; (T3) mistura de vinhaça e uréia (100 m3 ha-1 e 100 kg ha-1 de N, respectivamente) aplicada em área total sobre o solo sem cobertura de palhada, com a subparcela: uréia marcada com 15N; (T4) uréia enterrada em sulcos com 15 cm de profundidade, distantes 25 cm dos dois lados das linhas da cana (100 kg ha-1 de N), com prévia aplicação de vinhaça, (100 m3 ha-1) sobre o solo sem cobertura de palhada, contendo a subparcela: uréia marcada com 15N.
A vinhaça aplicada ao solo apresentou, antes da adição de uréia, a seguinte composição química (kg m-3): 0,41 de N; 0,07 de P2O5; 2,72 de K2O; 0,91 de CaO; 0,38 de MgO; e pH de 4,9. Após adição da uréia à vinhaça, a mistura elevou seu teor de N para 1,43 kg m-3. A uréia-15N aplicada nas subparcelas dos tratamentos T2 e T4 apresentou abundância isotópica de 5,802 % em átomos de 15N e, no tratamento T3, abundância isotópica de 2,789 % em átomos de 15N.
A massa do material vegetal da palhada, depositada sobre o solo na área experimental, foi determinada, retirando-se 11 amostras de 0,1 m2. As amostras foram secas em estufa (65 °C) para obter a massa de material seco, sendo uma subamostra moída em moinho Willey e usada na determinação do teor de nitrogênio e carbono. Assim, a massa de material seco da palhada originalmente presente no campo experimental foi de 17 ± 2 Mg ha-1 com uma relação C:N de 97, (389,0 g kg-1 de C e 4,0 g kg-1 de N).
A palhada do mesmo cultivar, marcado com o isótopo 15N e originário de um experimento prévio, foi usada nas subparcelas do T1. Esse resíduo vegetal foi pesado separadamente para determinação da massa de material natural. Em subamostras do material seco em estufa (65 °C), foi obtida a massa de material seco. Nas subamostras secas em estufas, foram determinados: o teor de carbono, por combustão a seco em analisador LECO CR-412; o teor de nitrogênio, por digestão-destilação Kjeldahl, e a abundância de 15N (% em átomos), por espectrometria de massa (Hauck, 1982).
Como a subparcela abrangia uma área de 2,8 m2, foram necessários 4,7 kg de material seco de palhada-15N por subparcela no T1. A palhada-15N apresentou abundância isotópica de 1,502 % em átomos de 15N, e uma relação C:N média de 100 (400 g kg-1 de C e 4,0 g kg-1 de N).
Nos tratamentos T1, T2 e T4, as avaliações da produção de fitomassa da parte aérea da cana-de-açúcar foram realizadas a partir do 3° mês após a adubação ou do 103 DAC (dias após o último corte da soqueira), de janeiro de 1998 até o 9° mês ou 299 DAC, julho de 1998.
Foram realizadas determinações da massa total de matéria natural da parte aérea da soqueira, em amostras colhidas em 2 m de linha. Em cada amostra, após a determinação da massa total de matéria natural, foi retirada uma subamostra, depois de ter sido picada em triturador de forragem.
Nas subamostras, determinaram-se a massa de material seco e o teor de nitrogênio por digestão-destilação Kjeldahl. Com esses resultados, considerando existirem 7.143 m de colmo de cana-de-açúcar num hectare, foram estimados a produção média da massa de material seco e o nitrogênio total acumulado na parte aérea da cana-de-açúcar, nos diferentes estádios de crescimento.
Do 3° ao 9° mês após a adubação, correspondentes ao período de 103 a 299 DAC, nas subparcelas dos tratamentos T1, T2 e T4, foram realizadas coletas mensais de folhas inteiras +3 (folhas com 3a aurícola visível, segundo o sistema Kuijper) de plantas localizadas no metro central da subparcela e em posições correspondentes nas linhas adjacentes às mesmas. Nessas amostras, após serem secas em estufa e moídas em moinho tipo Willey, foi determinada a abundância de 15N ( % em átomos) por espectrometria de massa (Hauck, 1982).
A colheita das plantas localizadas nas subparcelas foi realizada de 16 a 18 de agosto de 1998 (10° mês após a fertilização ou 315 DAC). Recolheu-se todo o material vegetal em um metro linear no centro das linhas das subparcelas e em posições correspondentes nas linhas adjacentes, conforme método definido por Trivelin et al. (1994).
As plantas foram divididas em amostras de folhas secas, colmo e ponteiro (folhas verdes, cartucho e palmito), das quais foi obtida a massa de material natural por tratamento. A matéria seca, o teor de nitrogênio e de abundância de 15N foram determinados em subamostras obtidas das amostras totais, após serem passadas em picadeira de forragem e secas em estufas (65 °C) até massa constante.
Com os resultados de abundância isotópica de nitrogênio ( % em átomos de 15N), das amostras de folhas +3 das colheitas parciais e da parte aérea da cana-de-açúcar na colheita final, foi calculado o nitrogênio na planta proveniente da fonte marcada (NPPFM), palhada-15N e uréia-15N, bem como a recuperação percentual do N-palhada e do N-fertilizante (R), conforme Trivelin et al. (1994).
Os resultados foram submetidos à análise de variância, utilizando o teste F a 95 % de confiança e, posteriormente, realizou-se o teste de Tukey a 5 %.
Acumulação de material vegetal, nitrogênio e estimativa de recuperação do N da uréia (15N) em soqueira de cana-de-açúcar com ou sem cobertura do solo por palhada
O acúmulo de material vegetal, de nitrogênio total e de nitrogênio na planta proveniente da fonte marcada (NPPFM), uréia-15N, encontram-se no quadro 1. O tratamento sem cobertura de palha e com aplicação de uréia enterrada (T4) mostrou média geral significativamente maior que o tratamento T2. Esses resultados indicam a possibilidade de a soqueira de cana-de-açúcar, sem a presença de palhada, apresentar maior produtividade, nas condições experimentais do trabalho, embora, em cada estádio de crescimento, no período de 103 aos 299 DAC, as médias e o erro-padrão não tenham indicado efeito dos tratamentos na produção de massa de material natural e seco, do nitrogênio total e do nitrogênio na planta proveniente da fonte marcada, na parte aérea da soqueira de cana-de-açúcar.
Em experimento realizado por Aude et al. (1993), verificou-se que a cobertura do solo por palhada de cana-de-açúcar teve efeito negativo sobre a produtividade da cultura. Entretanto, efeito positivo da presença de palhada sobre a produtividade da cana-de-açúcar foi relatado por Wood (1991) e Mcyntere et al. (1996) em solos com boa drenagem ou em regiões com precipitação insuficiente ou irregular. Ball-Coelho et al. (1993) observaram que a manutenção da palhada sobre o solo causou aumentos de 43 % na produção de matéria seca da cana-de-açúcar.
As variações na produtividade da cana-de-açúcar decorrentes da cobertura do solo pela palhada estão relacionadas com o tempo de implantação do sistema sem queima, com as condições climáticas de cada região, com a compactação do solo e com o cultivar utilizado (Wood 1991; Aude et al.,1993; Ball-Coelho et al., 1993; Mcyntere et al., 1996), o que explica os resultados do presente trabalho.
Nos dois tratamentos, o acúmulo de nitrogênio na parte aérea (Quadro 1) foi acompanhado por aumento de matéria seca até 169 DAC (março de 1998), posteriormente, decresceu ligeiramente no período de 204 aos 237 DAC (abril a maio de 1998), e voltou a crescer entre 267 e 299 DAC (junho a julho de 1998). O acúmulo de matéria seca na parte aérea das plantas no período posterior a 204 DAC não se correlacionou com o acúmulo de nitrogênio, pois, enquanto, nesse período, houve incremento da ordem de 25 % para a matéria seca, para o nitrogênio o aumento foi superior a 80 %.
Trivelin et al. (1995; 1996) obtiveram resultados semelhantes aos deste experimento e levantaram a hipótese da translocação do nitrogênio da parte aérea ao sistema radicular no começo da época de estiagem. Neste caso, em abril de 1998, a translocação estimularia o desenvolvimento do sistema radicular no período de 204 aos 237 DAC. A emissão de novas raízes teria proporcionado maior exploração de volume de solo, aumentando, assim, a absorção e o acúmulo de nitrogênio do solo, observados no período de 267 aos 299 DAC. Esse aumento na absorção de N mineral do solo, associado à menor perda de N por volatilização pela parte aérea, pode ser um dos fatores que contribuiu para maior taxa de acúmulo de N nesse período. Com a diminuição da temperatura, ocorreria também redução nas perdas gasosas de nitrogênio pela folhagem, à semelhança do observado por Stutte & Weiland (1978), levando, portanto, a um maior acúmulo de N na parte aérea da planta.
Pode-se ainda considerar que o incremento no N total da parte aérea na soqueira de cana-de-açúcar, no final de seu ciclo, tenha sido devido aos microrganismos associados à cultura que fixam o nitrogênio atmosférico (Döbereiner et al., 1972; Cavalcante & Döbereiner, 1988). No final do ciclo da cultura, época de maturação da cana-de-açúcar, ocorre maior disponibilidade de açúcares e estes poderiam promover maior potencial de fixação biológica de nitrogênio para a cultura, que ocorreria pela exsudação radicular de compostos energéticos na rizosfera da cana-de-açúcar ou, também, no próprio tecido da planta (Döbereiner et al., 1972; Cavalcante & Döbereiner, 1988).
Em todos os estádios de crescimento (Quadro 1), verificou-se, no tratamento com palhada (T2), comparativamente ao tratamento sem palhada (T4), tendência de menor acúmulo de nitrogênio total, do NPPFM uréia-15N e menor recuperação do fertilizante-15N. Esses resultados poderiam ser atribuídos à maior imobilização microbiológica do N-fertilizante no T2, uma vez que os resíduos de cana-de-açúcar depositados no solo continham elevada relação C:N.
Estimativa do acúmulo de nitrogênio derivado da palhada (15N) na parte aérea da soqueira de cana-de-açúcar, em diferentes estádios de crescimento
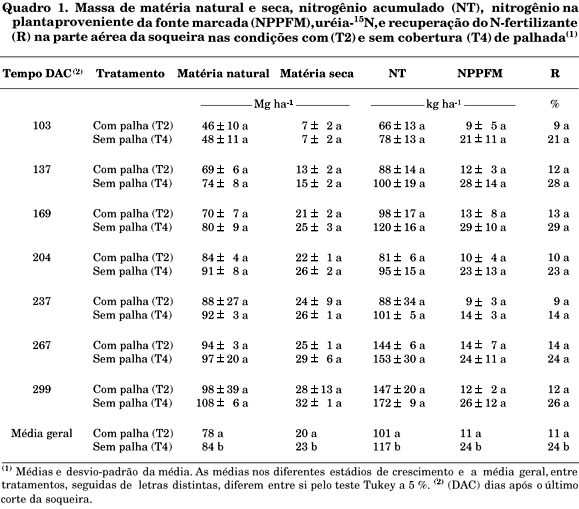
Verifica-se que o nitrogênio na planta proveniente da fonte marcada (NPPFM), palhada-15N, na parte aérea da soqueira de cana-de-açúcar, apresentou um comportamento exponencial positivo (Figura 1).

A quantidade de N da palhada presente na parte aérea da soqueira aumentou com o tempo, evidenciando que a mineralização líquida do N do resíduo vegetal da cana-de-açúcar é lenta, se comparada à disponibilidade de N do fertilizante (Quadro 1). Considerando que a palhada de cana-de-açúcar continha, no início, 68 kg ha-1 de N, em média, apenas 2,4 kg ha-1 de N foram acumulados na parte aérea da soqueira de cana-de-açúcar, indicando que cerca de 4 % do nitrogênio presente da palhada foi recuperado na parte aérea da soqueira em um período de 299 dias. Esta estimativa é da mesma grandeza dos resultados obtidos por Ng Kee Kwong et al. (1987) e Chapman et al. (1992) que verificaram valores variando de 5 a 10 % para o nitrogênio da palhada recuperado na soqueira da cana-de-açúcar.
Possivelmente, o nitrogênio mineralizado de parte do resíduo vegetal de fácil decomposição, ligado a compostos como açúcares, celulose, aminoácidos livres, ou, ainda, de proteínas, ácidos nucléicos e nucleotídios, ao ser despolimerizado e desaminado (Killham, 1994), foi imobilizado pela biomassa microbiana do solo, ou, mesmo, complexado com os componentes fenólicos derivados da degradação da lignina da palhada (Martin & Haider, 1980).
Nesse sentido, a baixa recuperação do N da palhada, na parte aérea da cana-de-açúcar, principalmente no início do ciclo vegetativo, deveu-se a uma decomposição incompleta da palhada (Ng Kee Kwong et al., 1987) e a um elevado grau de partição e transferência ("turnover") no solo, do nitrogênio mineralizado do resíduo vegetal.
Durante a decomposição de um resíduo vegetal, existe uma partição do nitrogênio nos "pools" de N-mineral, N-húmico e N-incorporado à biomassa microbiana do solo, bem como uma contínua transferência ("turnover") desse nitrogênio entre os compartimentos (Myers et al., 1994).
Do início ao final do período experimental, verificou-se uma diminuição da relação C:N do resíduo vegetal, que está relacionado com a diminuição do C (descarboxilação) liberado na forma de CO2, razão por que a concentração relativa de N do material aumenta, promovendo a mineralização líquida que pode ser observada a partir do momento em que se encontra quantidade significativa do isotópo 15N acumulado na parte aérea da soqueira de cana-de-açúcar (Figura 1).
Jadhav (1996) verificou que a relação C:N do resíduo de cana-de-açúcar era de 120:1 no início de seu experimento e, após a decomposição, diminuiu para 20:1, sendo esta relação próxima à dos microrganismos presentes no solo, que é de aproximadamente 12:1 (Lynch, 1986; Siqueira & Franco, 1988; Killham, 1994). Nesta fase final, possivelmente, ocorreu a mineralização líquida do N e a disponibilidade do nutriente deixou de ser limitante no sistema solo-planta.
Recuperação do N da uréia (15N) e da palhada(15N) na parte aérea da soqueira de cana-de-açúcar na colheita final
A produção de material vegetal natural e seco, de N-total, do nitrogênio na planta proveniente da fonte marcada (NPPFM) e a recuperação percentual do N da palhada e da uréia nos diversos componentes da parte aérea da soqueira de cana-de-açúcar constam no quadro 2.
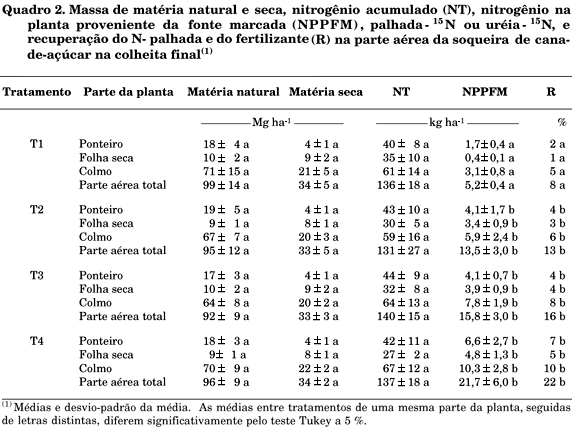
Os resultados dos tratamentos que receberam a uréia-15N (T2, T3 e T4) não se mostraram diferentes pela análise estatística. Entretanto, existiu tendência de menor recuperação da uréia-15N quando se aplicou a mistura vinhaça e fertilizante sobre o solo e em área total (tratamentos T2 e T3).
As possíveis explicações para essa tendência de menor aproveitamento do nitrogênio do fertilizante para os tratamentos T2 e T3 podem ser atribuídas: (a) ao efeito da incorporação e localização da fonte nitrogenada e à aplicação do fertilizante próximo ao sistema radicular da cultura (T4), que apresentou maior eficiência de aproveitamento, se comparada à aplicação em área total; (b) à uréia aplicada no tratamento T3, que pode ter sofrido maior efeito do "run off" (escorrimento superficial), em razão da ausência da palhada no solo. Neste caso, o resíduo vegetal, provavelmente, reduziu a perda de solo e do N-fertilizante, e (c) à aplicação do nitrogênio, que permaneceu temporariamente imobilizado na biomassa microbiana, em virtude da maior atividade dos microrganismos quimiorganotróficos na superfície do solo (Lynch, 1986; Siqueira & Franco, 1988; Killham, 1994), fato que também proporcionou menor aproveitamento do N-fertilizante.
A presença da palhada na superfície do solo no tratamento T2 pode ter ocasionado maior perda de NH3 do fertilizante. Resultados obtidos por Prammanee et al. (1989) constataram que a uréia-15N aplicada na forma sólida, sobre a palhada, reduziu a eficiência de utilização (R) do N da uréia pela soqueira de cana-de-açúcar. Gava et al. (2001) verificaram maior perda por volatilização de NH3 no tratamento T2 deste experimento, comparada à do T3 e T4.
A quantidade do N-uréia presente na parte aérea da cana-de-açúcar representou, em média, 13, 16 e 22 kg ha-1, do N-fertilizante aplicado em diferentes formas no solo, respectivamente, para os tratamentos T2, T3 e T4.
Os valores de recuperação do fertilizante (R), da parte aérea total da soqueira de cana-de-açúcar (Quadro 2) mostraram-se semelhantes aos obtidos por Takahashi (1967) em relação às diferentes condições climáticas a que foi submetida a cultura, com uma recuperação de 12a 27 %. Camargo (1989) avaliou as fontes nitrogenadas uréia e aquamônia na adubação de soqueira de cana-de-açúcar e obteve eficiência de utilização do fertilizante (R) que variou de 4 a 18 % do N-fertilizante aplicado ao solo. Por outro lado, esses valores de eficiência de recuperação do fertilizante (R) podem ser considerados baixos, se comparados com os de Trivelin et al. (1995), que obtiveram valores de aproximadamente 40 %, para a mesma época, ou seja, em final de safra (setembro de 1985), mas usando outra variedade de cana-de-açúcar e em condições diferentes de solo.
O nitrogênio na planta proveniente da fonte marcada (NPPFM) uréia-15N representou, respectivamente, 10, 11 e 16 % do total acumulado na parte aérea na soqueira de cana-de-açúcar nos tratamentos T2, T3 e T4. Estes valores mostraram-se concordantes com o de 15 % obtido por Chan & Weng (1983); ao de Sampaio et al. (1984), de aproximadamente 10 %; e de Carnaúba (1989) que obteve 12 %. Trivelin et al. (1995; 1996) observaram valores de 12 a 14 % do nitrogênio total acumulado na parte aérea da soqueira de cana-de-açúcar. É importante ressaltar que todos os trabalhos mencionados foram realizados em condições de manejo convencional, ou seja, sem a presença da cobertura de palhada no solo, sendo o fertilizante incorporado ao solo como no tratamento T4.
Com base nos resultados da literatura e nos deste trabalho, pode-se afirmar que, em condições variadas de solo, clima e variedade de cana-de-açúcar, o NPPFM uréia-15N representa uma pequena fração do nitrogênio total (N-total) acumulado na parte aérea da cultura. Esse fato evidencia que aparentemente as principais fontes fornecedoras de nitrogênio para a cana-de-açúcar são, principalmente, a mineralização da matéria orgânica nativa do solo e de resíduos vegetais (Bittencourt et al., 1986; Ng Kee Kwong et al., 1987; Chapman et al., 1992; Sampaio et al., 1995) e a fixação biológica do nitrogênio atmosférico por microrganismos (Döbereiner et al., 1972; Cavalcante & Döbereiner, 1988; Urquiaga et al., 1992).
Devem-se mencionar os efeitos que ocorrem no solo associados ao N do fertilizante (15N), quando em presença de materia orgânica fresca, como a "pool substitution" e "priming effect" que levaram Jenkinson et al. (1985) a propor o conceito do "ANI" (interação no solo do nitrogênio mineral adicionado). Em condições como as deste trabalho, pode ter ocorrido subestimativa na recuperação do N-fertilizante pela técnica com 15N e, como conseqüência, o aproveitamento do N de outras fontes ficam superestimados.
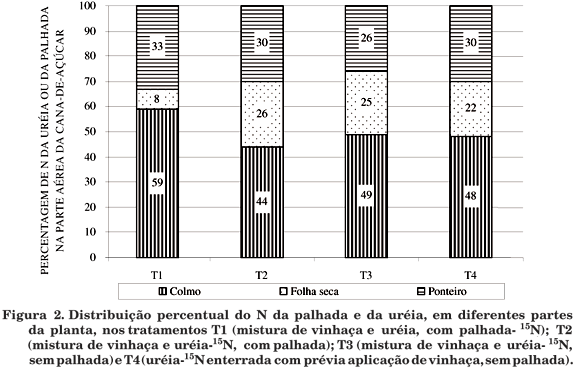
Do NPPFM uréia-15N, no tratamento T2, 26 % foi acumulado nas folhas secas, 30 % no ponteiro e 44 % no colmo; no tratamento T3, 25 % foi alocado nas folhas secas, 26 % no ponteiro e 49 % no colmo, e no T4, 22 % foi encontrado nas folhas secas, 30 % no ponteiro e 48 % no colmo (Figura 2).
O nitrogênio da planta proveniente da fonte marcada, palhada-15N, na parte aérea da planta em T1, representou 5,2 kg ha-1, valor este que correspondeu a uma recuperação de 8 % do N da palhada e 4 % do N-total da parte aérea da cultura.
Resultados muito próximos a estes foram obtidos por Ng Kee Kwong et al. (1987) e por Chapman et al. (1992), utilizando palhada de cana-de-açúcar marcada com 15N. Em média, foram recuperados pela soqueira de cana-de-açúcar 5 a 10 % do N-total contido na palhada.
Para T1, do NPPFM palhada-15N, 8 % foi acumulado nas folhas secas, 33 % no ponteiro e 59 no colmo (Figura 2). Esses valores, comparados aos do N-uréia, especialmente para folhas secas, confirmam que o nitrogênio mineralizado da palhada só é disponibilizado para a soqueira subseqüente no final do ciclo vegetativo. Em T1, somente 8 % do N derivado da palhada acumulou-se nas folhas secas, diferindo dos demais tratamentos. No início do ciclo de desenvolvimento da soqueira de cana-de-açúcar, quando as folhas estavam metabolicamente ativas, não ocorreu elevado acúmulo de nitrogênio da fonte palhada-15N nas plantas do T1, isto porque o N da palhada ainda não se encontrava disponível no solo às plantas.
Embora os resíduos vegetais de cana-de-açúcar apresentem baixa quantidade de N, quando comparado à reserva do solo, a palhada depositada no solo em colheitas sucessivas pode contribuir para um maior acúmulo de N-orgânico do solo. Estudos simulados, realizados na Austrália por Vallis et al. (1996), indicaram que a palhada de cana-de-açúcar deixada sobre a superfície do solo por um período de 20 anos pode resultar na redução da adubação em até 40 kg ha-1 de N.
No início do manejo de canaviais sem despalha a fogo, a maior contribuição da palhada de cana-de-açúcar é a de manter ou mesmo aumentar o teor de matéria orgânica no solo principalmete nas camadas superficiais (Ng Kee Kwong et al., 1987; Wood, 1991).
É importante ressaltar que, somando-se os tratamentos T1 e T2, a recuperação total do N das fontes uréia-15N e palhada-15N apresentou uma média de 21 %. Este resultado é praticamente igual à recuperação de nitrogênio da uréia no tratamento T4. A menor recuperação do N da uréia em T2 foi compensada pela absorção do N mineralizado da palhada, podendo em parte explicar o efeito "ANI" (Jenkinson et al., 1985), como mencionado anteriormente. Nesse sentido, o N-fertilizante imobilizado na biomassa microbiana pode ter possibilitado a mineralização do N-palhada que foi absorvido pelas plantas.
A modificação do manejo, seja na mudança do sistema de adubação, seja na cobertura do solo com palhada, pouco influenciou a distribuição do nitrogênio entre as partes da planta (Quadro 2 e Figura 2). A produção média de palhada nesse canavial alcançaria a ordem de 13 Mg ha-1 de material seco (Quadro 2). Considerando que as folhas secas e o ponteiro deste material acumularam, em média, 70 kg ha-1 de N, provavelmente, parte desta quantidade seria lançada à atmosfera na forma de óxidos, se fosse utilizada a queimada do canavial e dos resíduos culturais. Sem a queima, esse nutriente, além de outros que não são aqui discutidos, são ciclados e passam a ser disponíveis à cultura pela ação dos microrganismos do solo.
1. O desenvolvimento vegetal de soqueiras fertilizadas com vinhaça (100 m3 ha-1) e uréia (100 kg ha-1) foi semelhante nas condições com ou sem cobertura da superfície do solo por palhada.
2. Do nitrogênio total acumulado na parte aérea da soqueira de cana-de-açúcar, 10 a 16 % foram absorvidos da uréia e 4 %, em média, do nitrogênio mineralizado da palhada.
3. A eficiência de utilização do nitrogênio da uréia pela soqueira de cana-de-açúcar foi, em média, de 17 %, consideradas as formas de aplicação da uréia, em superfície ou em sulcos.
4. A eficiência de utilização do nitrogênio da palhada pela soqueira de cana-de-açúcar foi, em média, de 8 %, quando se aplicou uréia misturada à vinhaça sobre a superfície do solo.
5. Os maiores acúmulos de nitrogênio na planta proveniente da palhada ocorreram no final do ciclo da cultura da cana-de-açúcar.
Os autores agradecem à FAPESP (Projeto 97/01985-6), pelo apoio financeiro; à Usina Iracema S/A, pelo apoio logístico; à COPERSUCAR, nas pessoas do Eng.-Agro. Claudimir P. Penatti e José A. Forti, pela colaboração no desenvolvimento deste projeto.
AUDE, M.I.S.; MARCHEZAN, E.; DARIVA, T. & PIGNATARO, I.H.B. Manejo do palhiço da cana-de-açúcar. 1. Efeito na produção de colmos industrializáveis e outras características agronômicas. Ci. Rural, 23: 281-286,1993.
BALL-COELHO, B.; TIESSEN, H.; STEWART, J.W.B.; SALCEDO, I.H. & SAMPAIO, E.V.S.B. Residue management effects on sugarcane yield and soil properties in Northeastern Brazil. Agron. J., 85: 1004-1008, 1993.
BITTENCOURT, V.C.; FAGANELLO, B.F. & SALATA, J.C. Eficiência da adubação nitrogenada em cana-de-açúcar (planta). STAB – Açu., Álcool Sub-Produtos, 5:25-29, 1986.
BLACK, A.L. N and P fertilization for prodution of crested wheatgrass and native grass in northeastern Montana. Agron. J., 60:213-216, 1968.
CAMARGO, P.B. Dinâmica do nitrogênio dos fertilizantes: Uréia (15N) e aquamônia (15N) incorporados ao solo na cultura de cana-de-açúcar. Piracicaba, Escola Superior de Agricultura "Luiz de Queiroz", 1989. 104p. (Tese de Mestrado)
CARNAÚBA, B.A.A. Eficiência de utilização e efeito residual da uréia - 15N em cana-de-açúcar (Saccharum spp), em condições de campo. Piracicaba, Escola Superior de Agricultura "Luiz de Queiroz", 1989. 193p. (Tese de Mestrado)
CAVALCANTE, V.A. & DÖBEREINER, J. A new acid-tolerant nitrogen bacterium associated with sugarcane. Plant Soil, 108:23-31, 1988.
CHAN, Y. & WENG, T. Use of 15N to study the efficacy of nitrogen for sugarcane; nitrogen recovery on spring planting cane. Taiwan Sugar, 50:161-164, 1983.
CHAPMAN, L.S.; HAYSOM, M.B.C. & SAFFIGNA, P.G. N cycling in cane fields from 15N labelled trash and residual fertiliser. In: AUSTRALIAN SOCIETY OF SUGAR CANE TECHNOLOGISTS, 14., Brisbane, Proceedings. Brisbane, Watson Ferguson, 1992. p.84-89.
DÖBEREINER, J.; DAY, J.M. & DART, P.J. Nitrogenase activity in the rhizosphere of sugar cane and some other tropical grasses. Plant Soil, 37:191-196, 1972.
GAVA, G.J.C.; TRIVELIN, P.C.; OLIVEIRA, M.W.; PENATTI, C.P. & VITTI, A.C. perdas de amônia proveniente da mistura de vinhaça e uréia aplicada ao solo coberto ou descoberto por palha de cana-de-açúcar. STAB-Açú., Álcool Subprodutos, 19:40-42, 2001.
HAUCK, R.D. Nitrogen tracers in nitrogen cycle studies-past use and future needs. J. Environ. Qual., 2:317-327, 1973.
HAUCK, r.d. Nitrogen-Isotope-ratio analys. In: PAGE, A.L.; MILLER, R.H. & KEENEY, D.R., eds. Methods of soil analysis. 2.ed. Madison, America Society of America, 1982. p.735-788. (Agronomy, 9)
JADHAV, S.B. Effect of incorporation of sugacane trash on cane productivity and soil fertility. In: INTERNATIONAL SOCIETY OF SUGAR CANE TECHNOLOGISTS CONGRESS, 22., Cartagena, 1995. Proceedings. Cali, 1996. v.2. p.345-347.
JANSSON, S.L. & PERSSON, J. Mineralization and imobilization of soil nitrogen. In: STEVENSON, F.J., ed. Nitrogen in agricultural soils. Madison, American Society of American, 1982. p.229-252. (Agronomy, 22)
JENKINSON, D.S.; FOX, R.A. & RAYNER, J.H. Interactions between fertilizer nitrogen and soil nitrogen. The so called "priming effect". J. Soil Sci., 36:425-444, 1985.
KILLHAM, K. Soil ecology. Cambridge, Cambridge University Press, 1994. 242p.
LYNCH, J.M. Biotecnologia do solo: fatores microbiológicos na produtividade agrícola. São Paulo, Manole, 1986. 209p.
MARTIN, J.P. & HAIDER, K. Microbial degradation and stabilisation of 14C-labeled lignins, phenols, and phenolic polymers in relation to soil humus formation. In: KIRK, T.K.; HIGUCHI, T. & CHANG, H.M., eds. Lignin biodegradation: microbilogy, chemistry and potential applications. Boca Raton, CRC Press, 1980. v.1. p.77-100.
MCYNTERE, G.; Seruttun, S. & Barbe, C. Trash management in Marutian sugarcane plantations. In: INTERNATIONAL SOCIETY OF SUCAR CANE TECNOLOGIST, 22., Cartagena, 1995. Proceedings. Cali, 1996. v.2. p.213-216.
MYERS, R.J.K.; PALM, C.A.; CUEVAS, E.; GUNATILLEKE, I.U.N. & BROSSARD, M. The synchronisation of nutrient mineralisation and plant nutrient demand. In: WOOMER, P.L. & SWIFT, M.J., eds. The biological management of tropical soil fertility. New York, Wiley-Sayce Publications, 1994. p.81-112.
NG KEE KWONG, K.F.; DEVILLE, J.; CAVALOT, P.C. & RIVIERE, V. Value of cane trash in nitrogen nutrition of sugarcane. Plant Soil, 102:79-83, 1987.
PRAMMANEE; P.G.; SAFFIGNA, P.G.; WOOD, A.W. & Freney, J.R. Loss of nitrogen from urea and ammonium sulfate applied to sugar cane crop residues. In: AUSTRALIAN SOCIETY OF SUGAR CANE TECHONOLOGISTS, 11., Mackay, 1989. Proceedings. Mackay, Watson Fergunson, 1989. p.76-84.
SAMPAIO, E.V.B.S.; SALCEDO, I.H. & BETTANY, J. Dinâmica de nutrientes em cana-de-açúcar. I. Eficiência na utilização de uréia (15N) em aplicação única ou parcelada. Pesq. Agropec. Bras., 19:943-949, 1984.
SAMPAIO, E.V.S.B.; SALCEDO, I.H.; SILVA, V.M. & ALVES, G.D. Capacidade de suprimento de nitrogênio e resposta à fertilização de vinte solos de Pernambuco. R. Bras. Ci. Solo, 19:269-279, 1995.
SIQUEIRA, J.O. & FRANCO, A.A. Biotecnologia do solo: fundamentos e perspectivas. Brasília, Ministério da Educação e Cultura, ABEAS/ESAL/FAEPE, 1988. 177p.
STUTTE, C.A. & WEILAND, R.T. Gaseous nitrogen loss and transpiration of several crop and weed species. Crop Sci., 18:887-889, 1978.
TAKAHASHI, D.T. Effect of amount and timing of the fate of fertilizer nitrogen in lysimeter studies with 15N. The Hawaiian Planters' Record, 57:292-309, 1967.
TRIVELIN, P.C.O.; LARA CABEZAS, W.A.R.; VICTORIA, R.L. & REICHARDT, K. Evaluation of a 15N plot design for estimating plant recovery of fertilizer nitrogen applied to sugar cane. Sci. Agric., 51:226-234, 1994.
TRIVELIN, P.C.O.; RODRIGUÊS, J.C.S. & VICTORIA, R.L. Utilização por soqueira de cana-de-açúcar de início de safra do nitrogênio da aquamônia-15N e uréia-15N aplicado ao solo em complemento à vinhaça. Pesq. Agropec. Bras., 31:89-99, 1996.
TRIVELIN, P.C.O.; VICTORIA, R.L. & RODRIGUÊS, J.C.S. Aproveitamento por soqueira de cana-de-açúcar de final de safra do nitrogênio da aquamônia-15N e uréia-15N aplicado ao solo em complemento à vinhaça. Pesq. Agropec. Bras., 30:1375-1385, 1995.
URQUIAGA, S.; CRUZ K, H.S. & BODDEY, R.M. Contribuition of nitrogen fixation to sugar cane: Nitrogen-15 and nitrogen balance estimates. Soil Sci. Soc. Am. J., 56:105-114, 1992.
VALLIS, I.; CATCHPOOLE, V.R.; HUGHES, R.M.; MYERS, R.J.K.; RIDGE, D.R. & WEIER, K.L. Recovery in plants and soil of 15N applied as subsurface bands of urea to sugarcane. Austr. J. Agric. Res., 47:355-370, 1996.
WOOD, A.W. Management of crop residues following green harvesting of sugarcane in north Queensland. Soil Till. Res., 20:69-85, 1991.
G. J. C. GavaI; P. C. O. TrivelinII; A. C. VittiIII; M. W. OliveiraIV
pcotrive[arroba]cena.usp.br
IDoutorando em Ciências, Área de Concentração: Energia Nuclear na Agricultura, Laboratório de Isótopos Estáveis, Centro de Energia Nuclear na Agricultura – CENA/USP. Caixa Postal 96, CEP 13400-970 Piracicaba (SP). Bolsista da FAPESP. E-mail: ggava[arroba]soloplanta.bio.br
IIProfessor Associado do Centro de Energia Nuclear na Agricultura, Laboratório de Isótopos Estáveis, CENA/USP. Bolsista do CNPq. E-mail: pcotrive[arroba]cena.usp.br
IIIDoutorando em Ciências, Área de Concentração: Energia Nuclear na Agricultura, Laboratório de Isótopos Estáveis, CENA/USP. Bolsista da FAPESP. E-mail: acvitti[arroba]cena.usp.br
IVEngenheiro-Agrônomo, Universidade Federal de Viçosa – UFV. Caixa Postal 342, CEP 35430-970 Ponte Nova (MG). E-mail: mwagner[arroba]mail.ufv.br
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|