 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Reagentes, isótopos e soluções
Todas as soluções foram preparadas com reagentes de qualidade química analítica e com água desionizada.
O (15NH4)2SO4 com enriquecimento na faixa de 1 a 80% em átomos de 15N e o Na234SO4 enriquecido com 5 a 17% em átomos de 34S, produzidos no próprio Laboratório de Isótopos Estáveis do CENA/USP25,28,30, foram utilizados como fonte dos isótopos pesados 34S e 15N, para a produção do sulfato de amônio duplamente marcado ((15NH4)234SO4). Com o objetivo de verificar possível fracionamento isotópico, no processo de troca iônica, utilizou-se de Na234SO4 enriquecido com 8,4% em átomos de 34S e (15NH4)2SO4 com 15,2% em átomos de 15N.
Linha de produção
A linha de obtenção do (15NH4)234SO4 foi composta de uma coluna acrílica com 2,1 cm de diâmetro interno e 150 cm de altura, preenchida até 20 cm do topo com resina catiônica fortemente ácida, tipo poliestireno-divinilbenzeno Dowex 50W-X8 (grupo funcional sulfônico, malha 100-200 com diâmetro das pérolas de 74-149 µm, capacidade de troca de 1,7 mmol H+ mL-1). O volume de resina na forma H+ equilibrada em água, totalizou 450 mL. A Figura 1 representa um esquema da coluna utilizada, bem como as equações envolvidas no processo.
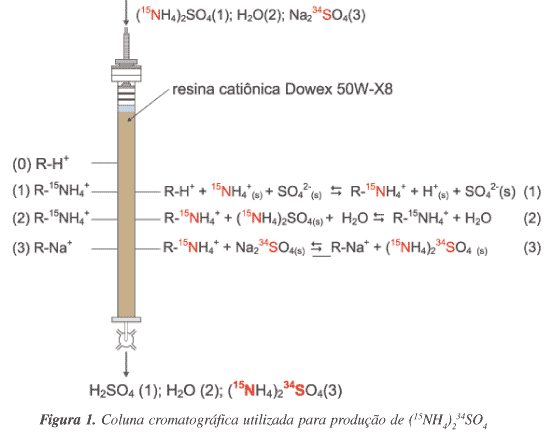
O mesmo sistema de coluna foi utilizado para a obtenção de ácido sulfúrico enriquecido em 34S (H234SO4) para posterior produção de (15NH4)234SO4, a partir da reação do H234SO4com 15NH3(aq).
Procedimentos experimentais
Antes do empacotamento na coluna, a resina foi lavada várias vezes com água desionizada, com a finalidade de retirar as impurezas e traços de resíduos orgânicos provenientes do processo de síntese. Posteriormente a resina foi acondicionada na coluna de acrílico e submetida ao choque eletrolítico, objetivando a ativação dos seus sítios ativos que foram saturados às formas NH4+ (R-NH4+) e H+ (R-H+), alternadamente, por 3 ciclos com solução 1,0 mol L-1 de (NH4)2SO4 e 1,0 mol L-1 de H2SO4, respectivamente. Finalmente foi realizada a lavagem da resina, com a finalidade de eliminar o ácido sulfúrico contido em seu volume intersticial. O fluxo de soluções deu-se por gravidade, com os reservatórios localizados à 5 m de altura em relação à base da coluna.
Produção de (15NH4)234SO4 por troca iônica
No topo da coluna de resina catiônica, inicialmente na forma R-H+, foi admitido solução 0,5 mol L-1 de (15NH4)2SO4 visando a saturação dos sítios ativos da resina à forma R-15NH4+, Eq. (1) da Figura 1. Após a carga com íons 15NH4+ procedeu-se à lavagem da resina pela passagem de H2O desionizada, para eliminação da solução de (15NH4)2SO4 contida no volume intersticial, ficando a resina na forma R-15NH4+ equilibrada em água, conforme Eq. (2), Figura 1. Nesta etapa, o volume do efluente foi coletado em alíquotas de 100 mL para determinação da concentração de 15NH4+ em sistema de destilação por arraste a vapor.
Em seqüência, utilizando-se do método de cromatografia por deslocamento frontal, foi admitida uma solução eluente de Na234SO4 no topo da coluna de resina. Este procedimento teve a finalidade de eluir os íons 15NH4+, ligados aos sítios ativos da resina, pelos íons trocadores Na+ (Na234SO4) ficando esta na forma R-Na+. Com esse procedimento obteve-se no volume eluído, solução de (15NH4)234SO4, conforme a Eq. (3) da Figura 1, que foi quantificada. A concentração de Na+ no eluído foi também determinada, por fotometria de chama, objetivando-se verificar o ponto de ruptura do elemento, dado pelo momento em que o íon Na+ é detectado no eluído, juntamente com o NH4+33.
Após a completa eluição dos íons amônio, encerrou-se o processo com a retirada do excesso de Na234SO4, contido no volume intersticial da resina, sendo o mesmo recuperado.
Foram avaliadas três concentrações diferentes para a solução eluente de Na234SO4 (30, 50 e 70 g L-1) e os testes foram realizados em triplicata.
Produção de (15NH4)234SO4 a partir do H234SO4 e (15NH4)2SO4
O H234SO4 foi obtido a partir do Na234SO428,29 empregando-se o mesmo sistema de coluna de resina catiônica descrito anteriormente.
Inicialmente, os sítios ativos da resina foram saturados à forma R-H+ pela admissão de solução 0,5 mol L-1 de H2SO4 (abundância isotópica natural em 34S – 4,22% em átomos de 34S) no topo da coluna. A solução efluente da resina foi recolhida em alíquotas de 100 mL, determinando-se a concentração de H+ por titulometria, com o objetivo de se verificar o ponto final de carga. Depois de saturados os sítios ativos da resina (R-H+), eliminou-se o excesso de H2SO4 do volume intersticial da resina pela lavagem com H2O desionizada. Em seguida, foi realizado o descompactamento das camadas de resina com água em processo de retrolavagem. Na etapa seguinte, os íons H+ foram eluídos com solução eluente de Na234SO4, sendo avaliadas (em triplicatas) as concentrações de 30, 50 e 70 g L-1. A Figura 2 ilustra as etapas realizadas na produção de H234SO4.

Nos testes de produção de H234SO4, os íons H+ foram deslocados da resina para a fase solução e na presença do ânion sulfato ocorreu a produção do ácido. A quantificação da massa de H234SO4 no volume eluído (a cada 100 mL) foi realizada por titulometria (nas alíquotas dos volumes). Nas mesmas amostras determinou-se a concentração de Na+ (g L-1 de Na) para se verificar quando ocorria a mistura entre o H234SO4 e o Na234SO4 no volume eluído, indicando a curva de ruptura do sódio.
Partindo-se de soluções de H234SO4 e (15NH4)2SO4 e utilizando-se sistema de destilação (Figura 3), foi possível a obtenção do (15NH4)234SO4 de acordo com as reações (1) e (2).
![]()

Inicialmente pesou-se o sal de (15NH4)2SO4 que foi dissolvido em água desionizada. A quantidade do sal (15NH4)2SO4 foi utilizada em proporções estequiométricas em relação à massa de H234SO4. A solução resultante foi colocada no balão de reação do destilador onde ocorreu a reação (1) com a adição de 20 mL solução 15 mol L-1 de NaOH (excesso). A 15NH3(aq) produzida foi arrastada pelo vapor de água e recebida em solução de H234SO4, contida em um recipiente acrílico, sob agitação, sendo o volume de ácido calculado pela estequiometria das reações (1) e (2). Por medida de segurança utilizou-se um medidor de pH, para monitorar a acidez da solução resultante (reação 2), evitando-se, deste modo, possíveis perdas de 15NH3. O final do processo foi identificado pela manutenção do pH na solução contendo (15NH4)234SO4, indicando a neutralização total da amônia-15N. O ajuste final do pH na faixa de 5,5 a 6,0 foi realizado, quando necessário, pela adição de pequenas quantidades de 15NH3aq ou H234SO4 diluído. Na última etapa a solução contendo o composto duplamente marcado ((15NH4)234SO4) foi transferida para o sistema de secagem à temperatura de 50 ºC, sendo o sal amoniacal cristalizado.
Produção de (15NH4)234SO4 por troca iônica
A saturação dos sítios ativos da resina à forma NH4+(R-H+®R-NH4 +) foi obtida com 2700 mL de solução 0,5 mol L-1 de (15NH4)2SO4 com fluxo de aproximadamente 2 mL cm-2 min-1. Este volume de (15NH4)2SO4 foi determinado pela quantificação do NH4+ nas frações coletadas no volume eluído (alíquotas de 100 mL). Neste ponto (2700 mL) a relação entre a concentração de NH4+ no afluente (solução 0,5 mol L-1 de NH4+) e do volume eluído foi aproximadamente igual a 1, indicando a saturação ou carga dos sítios ativos da resina à forma NH4+ (R-NH4+). A solução eluída foi totalmente coletada para posterior recuperação do (15NH4)2SO4 , que correspondeu a aproximadamente 100 g.
Numa etapa seguinte, como descrito anteriormente, foi realizada a lavagem para eliminação completa do (15NH4)2SO4 remanescente no volume intersticial da resina, sendo necessário 300 mL de água desionizada, no qual pôde-se recuperar 14,3 ± 0,5 g de (15NH4)2SO4 .
Na etapa seguinte utilizou-se de solução de Na234SO4 (30, 50 e 70 g L-1) como eluente dos íons NH4+. A troca entre os íons Na+(s) e NH4+(r) possibilitou a formação do (15NH4)234SO4 no eluído.
A massa de (15NH4)234SO4 no volume útil (levando-se em consideração a concentração de Na+) a partir da eluição do NH4+ dos sítios ativos da resina, com solução de Na234SO4, nas concentrações (30, 50 e 70 g L-1), pode ser visualizada na Tabela 1. São apresentados, também, o volume eluído recuperado, a massa de sódio no volume útil considerado, a massa de (15NH4)234SO4 residual (não considerado no volume útil) e a porcentagem do resíduo em relação a massa total de (15NH4)234SO4.

As curvas de eluição do 15NH4+, para as três concentrações de eluente, estão representadas na Figura 4, onde se verifica a variação da concentração de Na+ em função do volume eluído.
A resina catiônica apresenta maior seletividade para o Na+ em relação ao NH4+31,32, favorecendo o processo de troca envolvendo o deslocamento do íon NH4+ pelo Na+ (íon trocador). Concluída a eluição, a concentração do íon NH4+ foi inversamente proporcional à do íon Na+. A Figura 4 apresenta a eluição dos íons 15NH4+ que é finalizada após a utilização de 2800, 2000 e 1600 mL da solução eluente de Na234SO4, para as concentrações de 30, 50 e 70 g L-1, respectivamente.

O início da produção do composto (15NH4)234SO4, para todas as concentrações avaliadas do eluente, foi constatada a partir do volume de 200 mL e a concentração máxima do sal no eluído foi atingida a partir de 300 mL. Após este volume notou-se que a produção se manteve praticamente constante, até atingir o ponto de inflexão de cada curva, quando ocorreu o ponto de ruptura do íon trocador Na+.
A curva de ruptura33 foi caracterizada pelo início da detecção do trocador Na+ no eluído e indicou o momento de início da saturação dos sítios ativos da resina pelos íons Na+. Esta etapa ocorreu aos 1900, 1200 e 900 mL do eluído, respectivamente, para as concentrações de 30, 50 e 70 g L-1. A partir desse ponto o eluído passou a conter o Na+ (Na234SO4), além do (15NH4)234SO4. A determinação do ponto de ruptura é um indicativo da pureza do sal (15NH4)234SO4 produzido. Desta forma, tornou-se importante saber qual o nível de pureza necessário para o (15NH4)234SO4 ou até que nível de contaminação pode ser tolerado para o tipo de aplicação a que se destina. Nos resultados da Tabela 1 foram considerados os volumes eluentes que apresentaram quantidade de Na+ inferiores a 1% (m/v). Assim, para o teste com o eluente Na234SO4 30 g L-1, foram considerados os primeiros 2300 mL, como volume útil na produção do (15NH4)234SO4. A partir dos 2300 mL (fração 2300 a 2400 mL) o teor de (15NH4)234SO4 foi muito baixo e a concentração de Na+ no eluído (9,64 g L-1 de Na+, equivalente a 29,75 g L-1 Na234SO4) foi praticamente a mesma da solução eluente (30 g L-1). O volume de eluente utilizado (2300 mL), para 450 mL de resina, representou um valor de 5,1 VL (volume leito), que pode se considerado uma boa relação para troca iônica.
Em relação à solução eluente 50 g L-1 de Na234SO4, pode-se considerar que o volume de 1400 mL (3,1 VL) seria o ideal objetivando a produção de (15NH4)234SO4 com baixa concentração de sódio (Figura 4). A partir desse ponto, a concentração de sódio no eluído atingiu valores médios de 9,50 g L-1 de Na+, muito próximo ao obtido nos testes com solução 30 g L-1 de Na234SO4. O volume utilizado para eluir praticamente todo 15NH4+ contido em 450 mL de resina foi adequado, representando 3,1 de VL.
Para os testes com solução eluente 70 g L-1 de Na234SO4, pôde-se verificar que aproximadamente 1100 mL (2,4 VL) foram utilizados na produção de (15NH4)234SO4, (Figura 4). Nessas condições verificou-se que a concentração média de Na+ foi de 13,7 g L-1 (1,37 g/100 mL). A eluição com Na234SO4 70 g L-1 foi excepcionalmente boa, considerando-se que praticamente todo 15NH4+ foi eluído com 1100 mL em 450 mL de resina, que representou um ótimo valor de volume leito (2,4 VL). Os 100 mL finais, referentes ao intervalo de 1000 a 1100 mL com concentração de Na+ de aproximadamente 0,9% (m/v), superior à encontrada nos testes anteriores (30 e 50 g L-1), foi considerada em razão da expressiva massa de (15NH4)234SO4 contida neste volume (aproximadamente 4,55 g).
Nos testes com as três diferentes concentrações da solução eluente, pôde-se verificar que a massa de (15NH4)234SO4 residual recuperada, não considerada no processo de produção, foi de 1,3; 2,9 e 2,8 g, respectivamente, para as concentrações de 30, 50 e 70 g L-1 de Na234SO4 (Tabela 1).
A produção média de (15NH4)234SO4 foi de 55 ± 1 g; 54,1 ± 0,6 g e 55,2 ± 0,3 g nos testes utilizando Na34SO4 com concentração de 30, 50 e 70 g L-1, respectivamente (Tabela 1). Esses valores mostram que a produção de (15NH4)234SO4, por troca iônica, não se mostrou dependente da concentração do eluente (Na234SO4). No entanto, o volume útil (concentração de Na+ inferior a 1% m/v) de solução de Na234SO4, necessário para eluir os íons NH4+ dos sítios ativos da resina catiônica, foi em média de 2300, 1400 e 1100 mL, respectivamente, para as concentrações de 30, 50 e 70 g L-1 de Na234SO4. Desta forma, considerando o volume útil, pôde-se determinar que a massa de Na234SO4 necessária para a eluição dos íons NH4+ da resina catiônica foi de 69, 70 e 77 g, respectivamente, para as soluções de 30, 50 e 70 g L-1 de Na234SO4.
Deve-se destacar que a completa eluição dos íons NH4+ retidos nos sítios ativos da resina, demandou 2700, 2000 e 1600 mL para as concentrações de 30, 50 e 70 g L-1 de Na234SO4, respectivamente. A massa de (15NH4)234SO4 residual, contida no volume final da eluição (400, 600 e 500 mL com relação às concentrações de 30, 50 e 70 g L-1 de Na234SO4, respectivamente), foi quantitativamente recuperada em sistema de destilação (Figura 3).
Considerando um fluxo de 5 a 6 mL min-1, pôde-se determinar que o tempo de duração do processo completo para os testes com concentração de 30 g L-1 foi de aproximadamente 8 h, gastando-se 4 h a mais que no processo em que se utilizou a concentração de 50 g L-1 (4 h). Com os dados da Tabela 1, pode-se observar que a produção de (15NH4)234SO4 é praticamente a mesma, para as três concentrações de eluente avaliadas, e o consumo de Na234SO4 foi inferior quando se utilizou o eluente com concentração de 30 e 50 g L-1 (69 e 70 g). Desta forma, levando-se em consideração o tempo de produção, a solução eluente com concentração de 50 g L-1 de Na234SO4 foi a mais indicada.
A última etapa do processo de produção de (15NH4)234SO4 consistiu na lavagem do Na234SO4, do volume intersticial da coluna de resina, com água desionizada, recuperando-se o composto, principalmente, quando da utilização de 34S. Nessa etapa foram necessários de 400 a 500 mL de H2O desionizada, sendo possível a recuperação de 2,4 ± 0,1; 3,5 ± 0,1 e 4,8 ± 0,1 g de Na234SO4 quando se utilizou a solução eluente com concentrações de 30, 50 e 70 g L-1, respectivamente.
Em teste empregando os reagentes Na234SO4 e (15NH4)2SO4 , previamente enriquecidos nos isótopos 34S e 15N (8,40 e 15,2% em átomos de 34S e 15N, respectivamente), foi possível a obtenção de aproximadamente 54,5 g de (15NH4)234SO4 com marcação de 8,39 e 15,2% em átomos de 34S e 15N. Estes resultados mostraram que não ocorre fracionamento isotópico durante o processo de troca iônica na produção de sulfato de amônio duplamente marcado, pois o produto final apresentou a mesma abundância isotópica (34S e 15N) dos reagentes iniciais.
Produção de H234SO4 por troca iônica e produção de (15NH4)234SO4 na reação entre 15NH3(aq) e H234SO4
Os sítios ativos da resina catiônica Dowex 50w X8 foram saturados com H+, com aproximadamente 3000 mL de solução 0,5 mol L-1 de H2SO4. O excesso de H2SO4 do volume intersticial foi lavado com 3000 mL de água desionizada. Após a descompactação da resina (retrolavagem com H2O desionizada), pôde-se determinar que o volume da resina na forma H+(R-H+) e equilibrada em água foi de aproximadamente 450 mL.
Na etapa seguinte os íons H+, adsorvidos nos sítios ativos da resina, foram eluídos com soluções 30, 50 e 70 g L-1 de Na234SO4 (eluente), produzindo H234SO4 no eluído. Os testes foram realizados em triplicata para cada uma das concentrações do eluente. As três concentrações de eluente, o volume e a massa de eluente utilizado, a massa de H234SO4 obtida, a massa de (15NH4)234SO4 produzida e a % de H234SO4 e Na234SO4 obtidas a partir da massa de eluente empregado (volume útil) constam da Tabela 2.

O volume e a massa do eluente corresponderam ao montante com baixa concentração de Na (< 1% m/v) no eluído e é denominado de volume útil. Para a concentração de 30 g L-1 de Na234SO4 este volume foi em média de 2275 mL, de um total eluído de 2500 mL. Nos 225 mL finais tem-se aproximadamente 0,15 g de H234SO4, correspondendo a apenas 0,3% do total eluído. Entretanto, nesse volume final a concentração de Na+ foi da ordem de 11,0 g L-1, enquanto que no volume útil ficou em aproximadamente 0,5 g L-1 de Na (0,05%). Nos experimentos com concentração do eluente de 50 e 70 g L-1 de Na234SO4, o volume útil foi de 1475 e 1100 mL, respectivamente. A produção de H234SO4, para as três concentrações do eluente foi muito semelhante, sendo da ordem de 42 a 43 g do ácido (Tabela 2).
Nos ensaios empregando solução eluente 50 g L-1 de Na234SO4, verificou-se uma excelente eluição (VL de 3,3) com produção média de 43,04 ± 0,01 g de H234SO4 (solução 0,3 mol L-1 de H234SO4) e com concentração, no volume útil, de 0,4 g L-1 de Na. Nessas condições observou-se um maior percentual (86,00 ± 0,03%) de conversão do sal Na234SO4 (eluente) para o ácido (H234SO4) (Tabela 2). Considerando o volume útil de 1475 mL para o eluente (73,8 g) e fluxo de 6 ml min-1 (1,7 mL cm-2 min-1), o tempo consumido nesta etapa foi da ordem de 4 h. Pôde-se verificar, ainda, que o processo foi muito eficiente não apresentando perdas, principalmente quando se utilizou material enriquecido nos isótopos 15N e 34S.
Com o sistema proposto e utilizando-se de 74 g de Na234SO4 enriquecido com 9,8% em átomos de 34S foi possível obter 43,1 g de H234SO4 (1475 mL) com a mesma abundância isotópica do eluente (9,8% átomos de 34S).
Partindo-se de 58,1 g de (15NH4)2SO4 (0,44 mols) enriquecido em 10% em átomos de 15N (como obtido no laboratório de Isótopos Estáveis do CENA32,33) e de 43,1 g de H234SO4 (0,44 mols) com enriquecimento isotópico de 9,8% átomos de 34S, obtida no presente trabalho e, utilizando-se do sistema de destilação apresentado na Figura 3, foi possível a obtenção de sulfato de amônio duplamente marcado ((15NH4)234SO4). As reações estequiométricas para a produção do composto (15NH4)234SO4 estão representadas nas Equações (1) e (2).
O sal de (15NH4)2SO4 foi solubilizado em 300 mL de água (58,1 g do composto enriquecido a 10% em átomos de 15N) e a solução foi colocada em balão de reação do destilador (Figura 3), onde ocorreu a reação entre o (15NH4)2SO4 e NaOH (reação 1).
O procedimento foi realizado em aproximadamente 45 min e utilizou-se de 43,1 g de H234SO4 contido em 1500 mL de solução (0,3 mol L-1) para neutralização da 15NH3(aq). A solução final apresentou pH de 5,8 e volume de 1900 mL. Após secagem do sal, em chapa aquecedora a 50 ºC obteve-se 58,0 g de (15NH4)234SO4 enriquecido a 10,0 e 9,8% em átomos de 15N e 34S, respectivamente.
Para a produção de (15NH4)234SO4 em sistema de cromatografia de troca catiônica, a utilização de solução de Na234SO4 (50 g L-1) foi adequada. Partindo-se de 70 g de Na234SO4 e 64,2 g de (15NH4)2SO4 foi possível obter 54,1 g de (15NH4)234SO4. A metodologia empregada mostrou-se viável e o composto com dupla marcação poderá ser obtido, com alto grau de pureza e com níveis de enriquecimento em 15N e 34S dependentes das concentrações desses isótopos nos compostos (15NH4)2SO4 e Na234SO4.
A obtenção do (15NH4)234SO4 a partir da reação de neutralização entre o H234SO4 e 15NH3aq foi também eficiente. Neste processo foi possível produzir 58,0 g do composto duplamente marcado (15N e 34S) a partir de 43,1 g de H234SO4 (obtido por troca iônica com 74,0 g de Na234SO4) e de 58,1 g de (15NH4)2SO4 .
Nos dois processos foi possível obter 0,78 g de (15NH4)234SO4 para cada grama do eluente Na234SO4.
O processo mostrou-se operacional e economicamente viável, sendo possível obter (15NH4)234SO4 enriquecido a 10% em átomos de 15N e do 34S ao custo de US$ 30.00 por grama.
1. Leningher, A. L.; Fundamentos de bioquímica, Savier: São Paulo, 1980.
2. Zhao, F. J.; Verkampen, K. C. J.; Birdsey, M.; Blake-Kalff, M. M. A.; MaGrath, S. P.; J. Plant Nutr. 2001, 24, 1551.
3. Vitti, G. C.; Mutton, M. A.; Fornasiri Filho, D.; Perecin, D.; Rosolen, C. A.; Nociti, P. R. H.; Mendes, J. M.; Paranhos, S. B.; Piccin, C. R.; Malavolta, M. L.; Malavolta, E. Em Efeitos de Doses e Fontes de Enxofre em Culturas de Interesse Econômico; Malavolta, E., coord.; SN: Piracicaba, 1989.
4. Wood, A. W.; Soil Tittage Research 1991, 20, 69.
5. Vitti, A. C.; Tese de Doutorado, Universidade de São Paulo, Brasil, 2003.
6. Bull, L.T.; Cantarella, H.; Cultura do milho: Fatores que afetam a produtividade, Potafos: Piracicaba, 1993.
7. Rodrigues, M. B.; Kiehl, J. C.; Rev. Bras. Ci. Solo 1986, 10, 37.
8. Manechini, C.; Seminário Copersucar de Tecnologia Agronomica, Piracicaba, Brasil, 1997.
9. Trivelin, P. C. O.; Bendassolli, J. A.; Muraoka, T.; Carneiro Jr., F.; Sci. Agric. 2002, 59, 205.
10. Kiehl, J. C.; Rev. Bras. Ci. Solo 1989, 13, 75.
11. Prammanee, P.; Bootun, A.; Lairungreong, C.; Thumthong, P.; Sruttaporn, C.; Thongyai, C.; Proceedings of 22 Internacional Society of Sugar Cane Tecnologist congress, Cartagena, Tecnicanã, 1996.
12. Denmead, O. T.; Freney, J. R.; Jackson, A. V.; Smith, J. W. B.; Saffigna, P. G.; Wood, A. W.; Chapman, L.S.; Proceedings of 12a Australian Society of Sugar Cane Technologists, Brisbane, Austrália, 1990.
13. Trivelin, P. C. O.; Bendassolli, J. A.; Oliveira, M. W.; Muraoka, T.; STAB - Açúcar, Álcool e Subprodutos 1997, 16, 26.
14. Vitti, A. C.; Trivelin, P. C. O.; Gava, G. J. C.; Penatti, C. P.; Oliveira, M. W.; Anais do 8º Congresso Nacional da Sociedade dos Técnicos Açucareiros e Alcooleiros do Brasil, Recife, Brasil, 2002.
15. Trivelin, P. C. O.; Bendassolli, J. A.; Muraoka, T.; Carneiro Jr., F.; Sci. Agr. 2002, 59, 205.
16. Bissani, C. A.; Tedesco, M. J.; Resumos da 17a Reunião Brasileira de fertilidade do solo, Londrina, Brasil, 1986.
17. Vitti, G. C.; Seminário fósforo, cálcio, magnésio, enxofre e micronutrientes, São Paulo: Brasil, 1986.
18. Teixeira, G. M.; Trivelin, P. C. O.; Bendassolli, J.A.; Muraoka, T.; Gava, G. J. C.; Anais do 6º Encontro Nacional de Aplicações Nucleares, Rio de Janeiro, Brasil, 2002.
19. Lide, D. R.; Handbook of Chemistry and Physics, 78a ed., CRC Press: Boca Raton, 1997.
20. Charkson, D. T.; Smith, F. W.; J. Exp. Bot. 1983, 34, 1463
21. Larsson, C. M.; Larsson, M.; Purves, J. V.; Charkson, D. T.; Physiol. Plant 1991, 82, 345.
22. Fitz-Gerald, M. A.; Ugalde, T. D.; Anderson, J. W.; J. Exp. Bot. 1999, 50, 499.
23. Patnaik, M. C.; Santhe, A.; J. Nucl. Agric. Biol. 1993, 22, 75.
24. Bansal, K. N.; Moziramani, D. P. J.; Nucl. Agric. Biol. 1993, 22, 42.
25. Bendassolli, J. A.; Trivelin, P. C. O.; Carneiro Jr., F.; J. Braz. Chem. Soc. 1997, 8, 13.
26. Krouse, H. R.; Bernhard, M.; Schoenau, J. J.; Applications of Stable Isotope Techniques to Soil Sulfur Cycling in Mass Spectrometry of Soil, Marcel Dekker, Inc.: New York, 1996.
27. Hamilton, S. D.; Chalk, P. M.; Undovich, M. J.; Smith, C.; J. Appl. Radiat. Isot. 1991, 42, 1099.
28. Maximo, E.; Tese de Doutorado, Universidade de São Paulo, Brasil, 2002.
29. Maximo, E.; Bendassolli, J. A.; Trivelin, P. C. O.; Oliveira, C. R.; Rossete, A. L. R. M.; Abstracts of 4th International Conference on Isotope, Cape Town, África do Sul, 2002.
30. Maximo, E.; Bendassolli, J .A.; Trivelin, P. C. O.; Proceedings of 3th International Conference on Isotope, Vancouver, Canada, 2000.
31. Collins, C. H.; Braga, G. L.; Banato, P. S.; Introdução a métodos cromatográficos, Unicamp: Campinas, 1997.
32. Harland, C. E.; Ion Exchange. Theory and Practice, The Royal Society of Chemistry: Cambridge, 1994.
33. Khym, J.X.; Analytical Ion-Exchange Procedures in Chemistry and Biology, Prentice-hall International Inc.; London, 1974.
Everaldo Maximo; José Albertino Bendassolli; Paulo César Ocheuze Trivelin; Alexssandra Luiza Rodrigues Molina Rossete; Claudinéia Raquel de Oliveira; Clelber Vieira Prestes
pcotrive[arroba]cena.usp.br
Centro de Energia Nuclear na Agricultura, Universidade de São Paulo, CP 96, 13400-970 Piracicaba - SP
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|