 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
O fluxograma de produção de amônia anidra e aquamônia está esquematizado na Figura 1 e as Figuras 2, 3 e 4 detalham os sistemas usados.
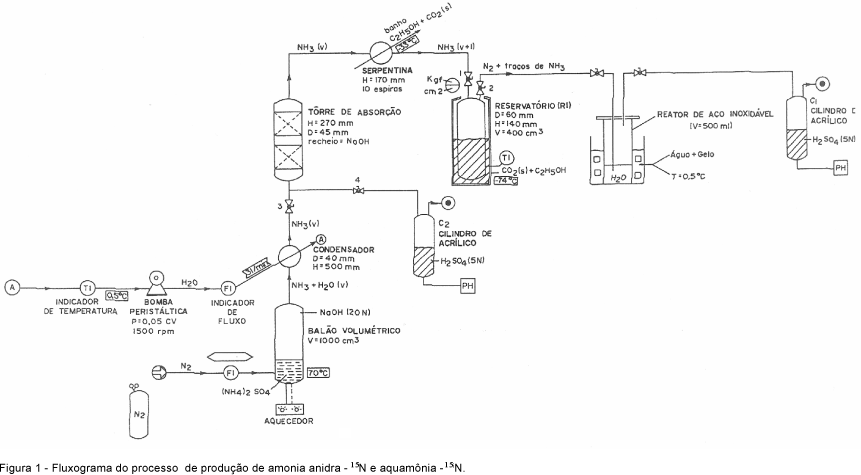
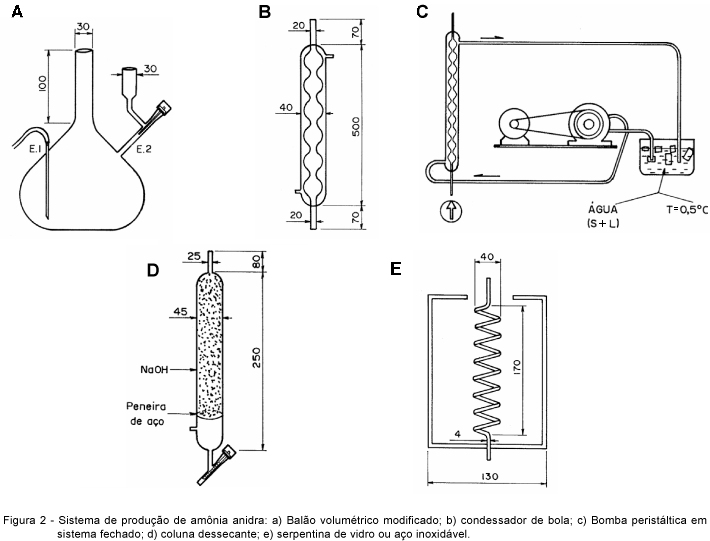
A Figura 2a mostra o balão volumétrico (1 L) modificado, contendo duas entradas (E1 e E2). Por E1, admitiu-se o gás de arraste (N2) e pela entrada E2, a solução de hidróxido de sódio 20 mol L-1. No início, admitiu-se, ao balão (Figura 2a), a solução de sulfato de amônio e no reator de aquamônia (ilustrado na Figura 1 e em detalhe na Figura 3), água desionizada. As massas de sulfato de amônio (solução de sulfato de amônio) e de água desionizada (reator de aquamônia) foram definidas, respectivamente, em função da quantidade de amônia anidra pretendida e da concentração de nitrogênio (% N) na solução final de aquamônia.
Na produção de amônia anidra, o reator de aquamônia (R2) foi retirado do sistema (Figura 1), ficando R1 ligado diretamente ao recipiente C1, que continha solução de ácido sulfúrico.
Na produção de aquamônia, após a montagem completa do sistema (Figura 1) foi admitido por E2 um volume de solução de hidróxido de sódio 20 mol L-1, que representou 50% em excesso na solução final. Em seguida, a solução do balão (Figura 2a) foi aquecida até a temperatura de teste (60; 70 e 75°C), ocorrendo a liberação de amônia de acordo com a reação:
![]()
A amônia (NH3) juntamente com o vapor de água foi arrastada do balão de reação por um fluxo de N2 passando pelo condensador Allinh (Figura 2b), de diâmetro de 40 mm e altura de 500 mm, onde o excesso de vapor de água se condensou. No condensador, foi mantido, em circuito fechado, um fluxo de água (0 a 5oC) de 3 L min-1, com auxílio de uma bomba peristáltica (Figura 2c). Após esse estágio, a amônia, contendo traços de vapor de água, passou por uma coluna preenchida por pastilhas de NaOH, como agente dessecante (Figura 2d), onde ficou retido todo o vapor de água presente junto à amônia.
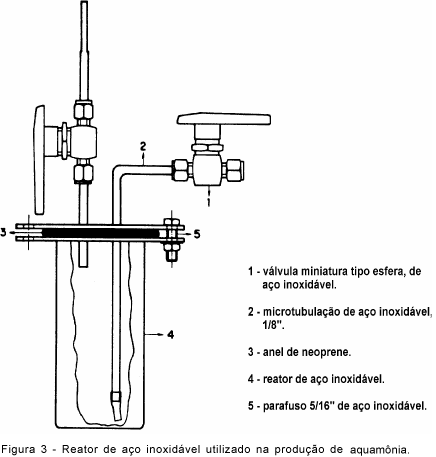
Os dois estágios seguintes promoveram a liquefação da amônia anidra por abaixamento da temperatura. No primeiro estágio, constituído de um trocador de calor (serpentina de vidro - Figura 2e), mergulhado em banho de gelo seco e etanol à temperatura aproximada de -33°C, a amônia passou ao estado de vapor saturado. No segundo, a amônia foi liqüefeita no interior do reator de aço inoxidável R1 (Figura 1 e Figura 3), imerso em banho de gelo seco/etanol/acetona (-73oC). A massa de amônia anidra obtida em R1 foi denominada de MAN.
Devido à pressão de vapor de NH3 à temperatura de -73°C, o gás (N2) na saída reator R1 pôde arrastar consigo uma pequena massa de amônia, que foi retida em água desionizada no reator (aquamônia) de aço inoxidável R2. A massa de água desionizada em R2 foi previamente estabelecida em função da porcentagem de N-amônia na solução final. O gás N2 efluente de R2 foi borbulhado em solução de ácido sulfúrico 2,5 mol L-1 no recipiente (C1), ficando retido possíveis traços de amônia arrastada do reator de aquamônia (R2). A quantidade de amônia arrastada de R1, em um determinado intervalo de tempo de reação, foi definida por MAR e determinada por titulometria nos testes de produção de amônia anidra, quando o recipiente C1 ficou ligado diretamente a R1.
Ao final de tempos pre-estabelecidos e antes da fase de hidratação da amônia anidra, inicialmente abriu-se a válvula 4 e, em seguida, fecharam-se, pela ordem, as válvulas 6, 5, 2, 1, e 3. Desligou-se, então, a bomba peristáltica que bombeava água de refrigeração no condensador Allinh e aumentou-se a temperatura da solução no balão volumétrico, assim como, o fluxo de gás N2 para 300 a 350 cm3 min-1. A quantidade de amônia liberada nesta etapa, definida como amônia residual (MRE), foi recebida no recipiente C2 em quantidade equivalente de solução de ácido sulfúrico (2,5 mol L-1), mantendo-se o pH da solução na faixa de 5 a 5,5. Das soluções contidas em C1 e C2, recuperou-se o sulfato de amônio-15N.
A quantidade de amônia anidra obtida no reservatório R1 (MAN) foi determinada por gravimetria.
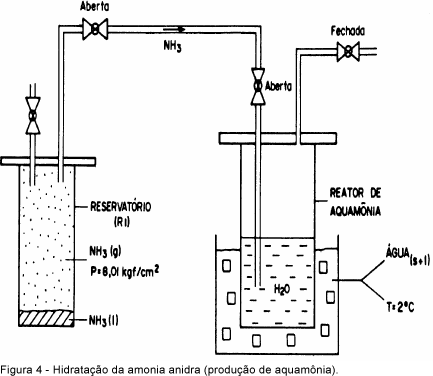
A última etapa envolveu a hidrólise da amônia anidra no reator de aquamônia (R2). A Figura 4 ilustra o sistema utilizado nesta etapa, onde a amônia anidra contida no reservatório R1, à temperatura ambiente, encontrava-se à pressão de vapor de 0,8 MPa, sendo R2 mantido a 0,5°C e à pressão de 0,1 MPa. Na transferência da amônia de R1 para R2, a porcentagem molar de amônia na solução de amônia aquosa aumentou com o tempo de reação, elevando a pressão parcial de vapor de NH3 (pNH3) em R2, sendo a pNH3 também função da temperatura (Perry & Chilton, 1980). Nas condições testadas para a produção de aquamônia com concentração em peso de 180 a 240 g kg-1 de NH3 (150 a 200 g kg-1 de N), a pressão de vapor foi relativamente baixa, atingindo aproximadamente 13,2 kPa a 4,4°C. Nessas condições, mantendo-se R1 em temperatura de aproximadamente 35°C, praticamente toda amônia foi transferida para o reator de aquamônia (R2).
Ao final do processo, o reator de aquamônia foi aberto e a solução contida em seu interior transferida para um reservatório apropriado a baixa temperatura (0-5°C), sendo determinado o teor de N na solução por titulometria.
Fundamentação Teórica do Processo
Produção de aquamônia
A massa A (g) de aquamônia com concentração P (%-m/m) de nitrogênio com base em massa do produto, a partir de uma massa M (g) de amônia anidra (17 g de NH3 correspondem a 14 g de N), é dada pela equação 1.
![]()
onde:
A = massa de aquamônia (g)
B = 14x + 15y e x = at% de 14N/100 y= at% de 15N/100
P = concentração de N-NH3aq na solução de aquamônia (%N, m/m)
Considerando-se que o reagente sulfato de amônio apresenta abundância isotópica natural (0,366 e 99, 634 átomos% em 15N e 14N, respectivamente), tem-se B=14.
Sendo Z (equação 2) a massa de água desionizada a ser utilizada na reação com a amônia anidra, tem-se que:
![]()
Sabendo-se, ainda, que a massa específica da solução de aquamônia (r) é dada pela equação 3.
![]()
onde: Vt é o volume da massa A de aquamônia (cm3).
A massa específica (r) da solução de aquamônia é função da porcentagem em peso de nitrogênio na aquamônia (P) e relaciona-se com M, P e Vt segundo a expressão descrita na equação 4.
![]()
Valores de r (D420 ) relacionados com a % em peso de amônia (NH3) no produto, % em peso de hidróxido de amônio no composto e concentração de NH3 na aquamônia (C NH3; g L-1), são encontrados na literatura (Perry & Chilton, l980).
No sistema de produção de amônia anidra e de aquamônia, o rendimento (% conversão de N-amônio em N-NH3aq) na produção de aquamônia (RAq), em função da massa utilizada de sulfato de amônio (MSA) e da massa total de amônia anidra produzida (Mt), pode ser obtido pela equação 5.

No processo de produção de aquamônia deve-se considerar a massa de amônia anidra obtida em R1 (MAN), bem como a fração da amônia arrastada de R1, que foi retida no reator de aquamônia R2 (f MAR), sendo: 0 <f <1. Desta forma, a equação 5 pode ser definida de acordo com a equação 6.
![]()
Produção de amônia anidra
Para a produção de amônia anidra, deve-se considerar somente a quantidade obtida no reator R1 (amônia anidra na forma líquida), definida como sendo MAN. Dessa maneira, o rendimento (% de conversão de N-amônio em N-NH3 anidra) em relação à amônia anidra (RAN), é expresso pela equação 7.
![]()
Delineamento Experimental
O rendimento do processo de produção de amônia anidra foi investigado em função dos fatores: temperatura (60;70 e 75oC); tempo de reação (75, 90, 120, 150, 165, 210 e 255 min); fluxo de gás de arraste (140, 180 e 220 mL min-1 de N2) e massa de sulfato de amônio utilizada na reação (40, 72,6, 106, 132 e 200 g).
Inicialmente, avaliou-se a influência da temperatura de reação na produção de amônia anidra, em função dos tempos de reação: 90; 120; 150; 165; 210 e 255 min, a partir de 72,6 g de sulfato de amônio e um fluxo de 180 cm3 min-1 de N2. Os testes foram realizados em triplicatas e os resultados foram submetidos a análise de variância (teste F a 95%) e ajustados por equações de regressão polinomial, representando o rendimento do processo de produção de amônia anidra em função do tempo de reação, para as três temperaturas.
A influência do fluxo do gás de arraste na produção de amônia anidra foi avaliada em função dos tempos de reação: 75, 120, 165, 210 e 255 min, utilizando-se da massa de sulfato de amônio de 72,6 g e o melhor rendimento obtido nos testes anteriores com relação ao fator temperatura. Os testes foram realizados em triplicatas e as condições de máximo rendimento foram obtidos a partir de equações de regressão polinomial. Os resultados foram submetidos a análise de variância (teste F a 95%).
As melhores condições relativas ao tempo de reação e ao fluxo de gás de arraste para a produção de amônia anidra foram utilizadas na obtenção de aquamônia. Nessas condições, determinou-se inicialmente, o rendimento da produção utilizando-se um valor fixo de 72,6 g de sulfato de amônio. Os resultados foram ajustados por equações de regressão polinomial, representando o rendimento do processo de produção de aquamônia em função do tempo de reação.
Por fim, foram realizados testes, em triplicatas, objetivando a produção de amônia anidra e de aquamônia (concentração de N, na solução, variando de 15 a 20% (m/m)), nas mesmas condições (temperatura de 70°C; tempo de reação de 210 min e fluxo de 180 mL min-1 de N2) e para a massa de sulfato de amônio variando de 40 a 250 g.
A análise da variância dos dados relativos à temperatura e ao tempo de reação mostrou efeito desses fatores e de sua interação sobre a produção de amônia anidra. A Tabela1 apresenta os dados de rendimento médio na linha de produção de amônia anidra, em função dos fatores tempo (t) e temperatura de reação (T). Os maiores valores foram obtidos para o tempo de reação de 210 minutos, nas temperaturas de 70 ou 75oC. Neste tempo de reação, o rendimento de produção da amônia anidra foi semelhante para as temperaturas de 70 e 75oC.

As equações de regressão que representam o efeito da temperatura e do tempo de reação na produção de amônia anidra, para a massa de sulfato de amônio de 72,6 g e o fluxo de gás de arraste de 180 cm3 min-1 de N2, são apresentadas na Tabela 2. O modelo quadrático representou adequadamente a variação do rendimento em função do tempo de reação, para as diferentes temperaturas. Com base nas equações da Tabela 2, foram determinados os rendimentos máximos para as temperaturas de 60, 70 e 75oC, os quais correspondem aos tempos de 224, 210 e 256 min, respectivamente. Mesmo não se observando diferença entre o rendimento da produção de amônia anidra para as temperaturas de 70 e 75oC (Tabela 1), o aumento da temperatura de reação de 70 para 75oC foi inconveniente, devido à elevação da pressão de vapor d'água de 29,6 kPa para 38,4 kPa, resultando em compactação da coluna de hidróxido de sódio, devido à taxa de água e também às dificuldades na obtenção da amônia anidra. Outro fator importante refere-se ao tempo de reação para atingir o rendimento máximo. Na temperatura de 70oC, esse tempo (210 minutos) é inferior ao observado quando se utiliza a temperatura de 75oC (256 min).

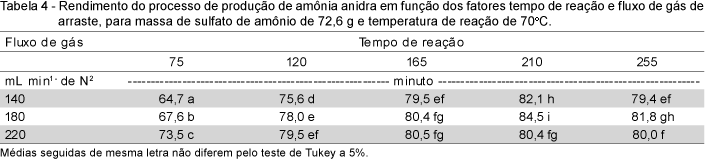
A influência do fluxo de gás de arraste (N2) também foi verificada na produção de amônia anidra. A Tabela 3 mostra as equações de regressão que relacionam o rendimento do processo ao tempo de reação, para os três fluxos em estudo e para uma massa de sulfato de amônio de 72,6 g e temperatura de reação de 70oC. O rendimento máximo na linha de produção de amônia anidra praticamente não foi alterado pelo fluxo de gás de arraste. Entretanto, a análise de variância dos dados relativos ao fluxo de gás (140, 180 e 220 cm3 min-1 de N2) e ao tempo de reação (75, 120, 165, 210 e 255 min) mostrou efeito desses fatores sobre a produção de amônia anidra, bem como sobre a interação entre os fatores.

O melhor rendimento do processo de produção de amônia anidra em função dos fatores fluxo de gás de arraste e tempo de reação foi obtido com 180 mL min-1 de N2 (gás de arraste) e para um tempo de reação de 210 minutos (Tabela 4). Os tempos correspondentes aos rendimentos máximos foram calculados a partir das equações de regressão obtidas para cada fluxo de gás de arraste. Das equações de regressão (Tabela 3), verifica-se que para os tempos superiores a 210 minutos, o rendimento da produção de amônia anidra decresceu. Isso é decorrente da massa de sulfato de amônio ter sido praticamente toda consumida na reação com o hidróxido de sódio. Assim, a quantidade de amônia anidra que entra no cilindro R1, por unidade de tempo, foi inferior à quantidade arrastada do mesmo cilindro em igual intervalo de tempo.
Com as melhores condições (temperatura de 70oC e fluxo de gás de arraste de 180 mL min-1 de N2) estabelecidas na linha de produção de amônia anidra, foram realizados testes, em triplicatas, na linha de obtenção de aquamônia, procurando-se estabelecer uma equação de regressão relacionando o rendimento do processo (RAq) em função do tempo de reação (t), a partir de uma massa de sulfato de amônio de 72,6 g.
Nessas condições, o tempo de máximo rendimento para aquamônia foi superior (253 min) àquele obtido para a amônia anidra (210 minutos), porém na conversão de N-NH4 (sulfato de amônio) para N-NH3aq (93,9% - aquamônia), o rendimento foi muito maior que aquele observado para N-NH3 (83,0% - amônia anidra). Estes resultados são justificados pelo fato de a amônia anidra arrastada do cilindro R1 (MAR) ficar retida na água desionizada do reator R2 de aquamônia. A amonia arrastada de R2 para o cilindro de acrílico C1(Figura 1), contendo solução 2,5 mol L-1 de H2SO4, foi praticamente nula (f=1), até o tempo de reação de 250 min. Os dados foram obtidos por titulometria (solução 0,1 mol L-1 de NaOH padrão tritisol) da solução ácida contida no cilindro C1 após o término da reação. Desta forma, em relação à aquamônia, a partir de 253 min, a entrada de amônia (MAR) no reservatório R2 passa a ser inferior a saída (amônia que entra no cilindro C1), devido ao incremento na porcentagem molar de amônia em solução (aumento da pressão parcial de amônia em R2).
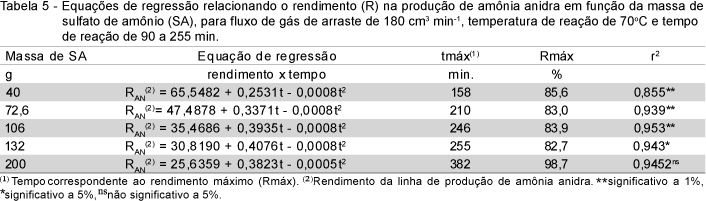
Verificou-se, também, a influência do tempo de reação (90 a 255 min) na produção de amônia anidra em função da massa de sulfato de amônio (40 a 200 g), para um fluxo de gás de arraste de 180 cm3 min-1 e uma temperatura de reação de 70oC, (Tabela 5). O modelo quadrático representou adequadamente a variação do rendimento em função do tempo de reação, para massas de sulfato de amônio na faixa de 40 a 132 g. Para massa na faixa de 40 a 106 g, o modelo quadrático apresentou nível de confiança de 99% e para a massa de 132 g, confiabilidade de 95%. Entretanto, para massas superiores a 132 g, o modelo não foi significativo a 95%. Para a massa de 200 g, utilizando-se do modelo quadrático, houve pequeno aumento na produção para os tempos de reação superiores a 255 min, indicando que, nessas condições, a quantidade de amônia anidra que entra no cilindro R1 foi superior à saída (arraste do reator R1 para o reator de aquamônia R2). Tempos de reação superiores a 255 min não foram estudados devido a dificuldades operacionais e, principalmente, pela impossibilidade de realizar duas bateladas diariamente. O sistema pode operar com maior segurança com o emprego de sulfato de amônio na faixa de 40 a 132 g e atender à demanda pelo produto enriquecido.
Como não houve perda (real) no sistema proposto, mesmo utilizando-se de massas de sulfato de amônio (MSA) superiores a 132 g (200 g), o tempo de 210 min de reação (temperatura de 70oC e fluxo de gás de arraste de 180 cm3 min-1) é o indicado. Nessas condições, o rendimento médio na produção de amônia anidra (massa de sulfatro de amônio de 200 g) foi de 86,8 ± 0,6%.
Para o tempo de 210 minutos de reação, temperatura de 70oC e fluxo de gás de arraste de 180 cm3 min-1 de N2 (Tabela 6), a taxa de produção de amônia anidra em função da massa de sulfato de amônio manteve-se praticamente constante na faixa de 0,99 a 1,06 mg NH3 min-1 g-1 de sulfato de amônio. Nessas condições em relação à massa de amônia arrastada do cilindro R1 (MAR) pelo gás N2, verificou-se variação de 1,86 a 2,76 g, quando se utilizou de 40 e 200 g de sulfato de amônio, respectivamente.
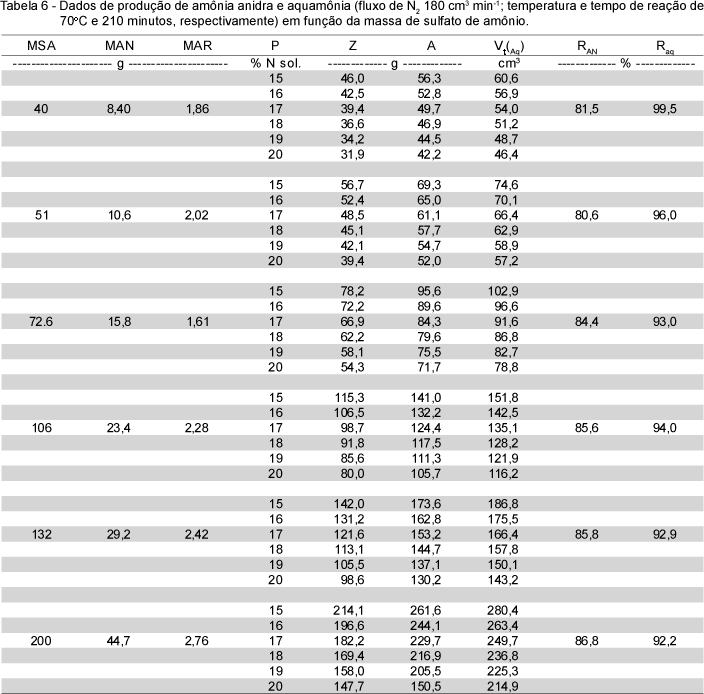
Estabelecidos os parâmetros da linha de produção de amônia anidra (temperatura de 70oC e 210 minutos de reação, fluxo de gás de arraste de 180 cm3 min-1) e utilizando-se as equações obtidas no desenvolvimento teórico e os valores tabelados dos parâmetros relativos as soluções aquosas de amônia (massa específica), foi possível obter os resultados expressos na Tabela 6. O rendimento relativo à produção de aquamônia foi superior a 90% para todas as massas de sulfato de amônio avaliadas. A diferença para completar o balanço de massa nitrogenado refere-se à amônia residual (MRE) e às perdas reais. Estas últimas foram devidas a vazamentos, perdas no manuseio do produto e a não recuperação de N do vaso de reação (Figura 2a). As perdas reais de amônia foram, em média, de 0,7%, ao variar-se a massa de sulfato de amônio de 40 a 200. Desta maneira, estabelecendo-se a quantidade de amônia anidra-15N ou aquamônia-15N a ser utilizada em um determinado trabalho de pesquisa, pode-se fixar os parâmetros experimentais para a linha de produção. Em relação à aquamônia, para produzir uma quantidade A (gramas), com uma concentração P de N (% N em peso na solução, ou g de N/100 g solução), estabelece-se inicialmente a massa Z (g) de água a ser introduzida no reator de aquamônia R2 e a massa de sulfato de amônio no balão volumétrico modificado(Figura 2a), obtendo-se o volume Vt final da solução e o rendimento do sistema.
O processo completo de produção de aquamônia, envolvendo todas as etapas descritas foi realizado em aproximadamente 240 minutos. Assim, com os dados da Tabela 6, pode-se determinar que para a obtenção de aquamônia enriquecida em 15N, a linha de produção tem capacidade diária para produzir aproximadamente 560 cm3 (2 bateladas diárias com volume de 280 cm3 cada, Tabela 6) do composto com concentração de 15% de N em peso. O enriquecimento isotópico nos compostos (amônia ou aquamônia) é função da concentração isotópica de 15N no reagente (sulfato de amônio), pois não foi verificado fracionamento isotópico na conversão de N-15NH4 (sulfato de amônio) à N-15NH3 (amônia) ou N-15NH3aq (aquamônia).
As melhores condições na produção de amônia anidra foram: temperatura de 70oC; tempo de reação de 210 minutos e fluxo de gás de arraste de 180 cm3 min-1 de N2;
A conversão de N-NH4+ à N-aquamônia foi superior a 90% para todas as massas de sulfato de amônio utilizadas, atingindo a 99,5% quando se utilizou de 40 g de sulfato de amônio;
O método utilizado mostrou-se adequado para produção de aquamônia enriquecida em 15N, com concentração nitrogenada na faixa de 15 a 20 % (m/m), pode-se obter até 47,5 g de NH3 anidra e 215 cm3 de NH3aq (20 % N, m/m) por batelada, a partir de 200 g de sulfato de amônio.
CAMARGO, P.B. Dinâmica do nitrogênio dos fertilizantes uréia (15N) e aquamônia (15N) incorporados ao solo na cultura de cana-de-açúcar. Piracicaba, 1989. 104p. Dissertação (Mestrado) - Escola Superior de Agricultura "Luiz de Queiroz", Universidade de São Paulo.
KNOWLES, R.; BLACKBURN, T.H. Nitroge isotope techniques. San Diego: Academic Press, 1993. 311p.
LARA CABEZAS, W.A.R.; TRIVELIN, P.C.O.; VICTORIA, R.L.; CAMARGO, P.B.; PICCOLO, M.C. Volatilização de amônia da uréia-15N e aquamônia-15N aplicadas na cultura da cana-de-açúcar em condições de campo. In: CONGRESSO NACIONAL DA SOCIEDADE DOS TÉCNICOS AÇUCAREIROS E ALCOOLEIROS DO BRASIL, 4.; CONVENÇÃO DA ACTALAC, 7., Olinda, 1987. Anais. Olinda: STAB, 1987. p.50-59.
MAXIMO, E.; BENDASSOLLI, J.A.; TRIVELIN, P.C.O. Enrichment of 15N by coupling three systems of ion-exchange chromatography columns. In: INTERNATIONOL COFERENCE ON ISOTOPE, 3., Vancouver, 2000. Isotope production and applications in the 21st century. Singapore: World Scientific Printers, 2000. p.137-139.
TRIVELIN, P.C.O. Enriquecimento isotópico de 15N por cromatográfia de troca iônica. Piracicaba, p. 95, 1976. Dissertação (Mestrado)- Escola Superior de Agricultura "Luiz de Queiroz", Universidade Metodista de São Paulo.
TRIVELIN, P.C.O.; VICTORIA, R.L.; RODRIGUES, J.C.S. Aproveitamento por soqueira de cana-de-açúcar de final de safra do nitrogênio da aquamônia-15N e uréia-15N aplicado ao solo em complemento à vinhaça. Pesquisa Agropecuária Brasileira, v.30, p.1375-1385, 1995.
TRIVELIN, P.C.O.; RODRIGUES, J.C.S.; VICTORIA, R.L. Utilização por soqueira de cana-de-açúcar de início de safra do nitrogênio da aquamônia-15N e uréia-15N aplicado ao solo em complemento à vinhaça. Pesquisa Agropecuária Brasileira, v.31, p.89-99, 1996.
PERRY, R.H.; CHILTON, C.H. Manual de engenharia química. Rio de Janeiro: Guanabara Dois, 1980. 1v.
José Albertino Bendassolli; Paulo Cesar Ocheuze Trivelin; Raquel de Fátima Ignoto
pcotrive[arroba]cena.usp.br
Lab. de Isótopos Estáveis - USP/CENA, C.P. 96 - CEP: 13400-970 - Piracicaba, SP.
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|