 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Os estudos foram realizados no Laboratório de Patologia de Insetos do Centro Nacional de Pesquisa de Arroz e Feijão (CNPAF), da EMBRAPA, com três isolados de Z. radicans, no tocante à viabilidade dos conídios e seus processos de germinação sobre ninfas do 5º ínstar de E. kraemeri, obtidas de criação em laboratório. As observações foram feitas no dorso do inseto, separadamente, nas regiões da cabeça, tórax e abdome. Os conídios não germinados foram considerados inviáveis, enquanto que os germinados foram considerados viáveis e submetidos a avaliações referentes a formação de conídios secundários, capiloconídios e tubos germinativos.
Os isolados do fungo utilizados foram o ARS-1590 e o ARS-1229, originados de Empoasca sp., respectivamente dos Estados de Goiás e Santa Catarina, no Brasil, bem como o ARS-1261, originado de E. fabae do Estado de Wisconsin, nos Estados Unidos, os quais foram fornecidos pelo Laboratório de Patologia de Insetos do Instituto Boyce Thompson em Ithaca, EUA. Esses foram produzidos na superfície de meio de cultura líquido à base de dextrose (1%) e extrato de levedura (1%) e utilizados na forma de micélio fresco. Para a instalação do experimento, o fungo foi previamente filtrado, pulverizado com maltose a 10% e transferido para uma câmara úmida formada dentro de uma placa de Petri, contendo papel de filtro umedecido com a mesma solução. Em seguida, a placa de Petri contendo o micélio fresco do patógeno foi acondicionada dentro de geladeira e mantida por aproximadamente quinze horas, visando estimular a conidiogênese.
As inoculações do fungo foram efetuadas mediante a utilização de pequenas gaiolas. Cada gaiola era constituída de uma placa de plástico de 4,0cm de diâmetro e de fundo aberto, contendo apenas um segmento de 0,5cm de largura, ligando as duas extremidades laterais opostas. A placa foi colocada sobre a face inferior de uma folha de caupi, que por sua vez foi estendida com a face superior sobre uma chapa de acrílico (15,5 x 10cm). O conjunto foi fixado com um parafuso ligando o segmento do fundo da placa com a chapa de acrílico. Na parte de dentro da tampa da gaiola foi colocada uma camada de ágar-água com antibiótico. Para a inoculação dos insetos, pequenos círculos de micélio fresco foram distribuídos sobre a camada de ágar-água da tampa, e acondicionados dentro de uma câmara úmida (saco plástico contendo papel toalha umedecido), no interior de uma incubadora regulada a 20 ± 0,5ºC, onde foram mantidos por mais quatro horas, visando aumentar a conidiogenese do fungo.
Em seguida, as gaiolas e as superfícies expostas das folhas foram umedecidas com uma fina névoa de água destilada, para simular o orvalho natural. Os insetos foram anestesiados com CO2 e colocados na superfície úmida da folha em cada gaiola. As tampas das gaiolas, contendo o fungo em conidiogênese, foram colocadas sobre os insetos e mantidas por aproximadamente cinco minutos (período de duração da anestesia), expondo-os à "chuva" de conídios. Durante cada período de exposição, as tampas contendo o fungo eram constantemente giradas para assegurar uma distribuição uniforme dos conídios.
Após cada inoculação, a tampa com o fungo era removida e substituída por outra limpa. As gaiolas contendo os insetos inoculados foram, então, colocadas dentro de sacos plásticos contendo umidade saturada (produzida através de papel toalha umedecido), e mantidas no escuro a 20 ± 0,5ºC. Os estudos foram feitos sobre os insetos, após duas, seis e doze horas da inoculação. No primeiro horário, foram utilizados dez, doze e oito insetos para os isolados ARS-1590, ARS-1261 e ARS-1229, respectivamente, enquanto que, no segundo, foram utilizados 13, 16 e 10 insetos, respectivamente, e, no terceiro, 20, 22 e 20 insetos. Os insetos foram coletados de dentro das gaiolas de inoculação, sendo um deles utilizado para as observações mais imediatas e os demais acondicionados em geladeira, para que o fungo inoculado fosse inativado e pudesse em seguida ser observado.
As observações foram feitas com uma objetiva de 400 x em um microscópio óptico com contraste de fase e fluorescência, tendo sido utilizado um excitador Schott BG-12 (350-490nm), um refletor Dichroic(500mm) e uma barreira Schott 06 515 (525nm). Os insetos foram colocados sobre uma gota de Calcofluor White (Sigma) a 0,5% (W/V) depositada sobre uma lâmina e cobertos, sem serem pressionados, por uma lamínula de vidro.
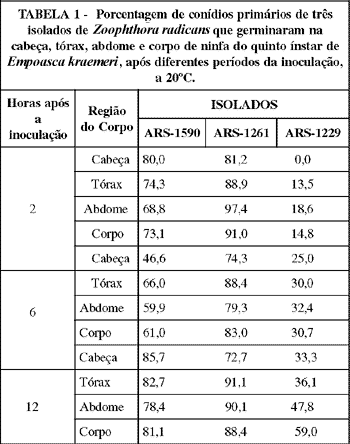
O isolado ARS-1261 apresentou uma viabilidade pouco maior que a do ARS-1590, e bastante superior em relação a do ARS-1229, tendo havido, respectivamente, 88,4, 81,1 e 59% de conídios primários germinados no corpo do inseto, doze horas após a inoculação (TABELA 1). A baixa viabilidade do ARS-1229 sobre os insetos pode limitar a eficiência deste isolado para o controle da praga. Smith & Grula (1981) constataram que uma fonte de carbono é necessária para a germinação de conídios de Beauveria bassiana (Bals.) Vuill.. Segundo Ferron (1983), conídios de fungos entomopatogênicos têm reserva de nitrogênio endógeno suficiente para a síntese de proteína e o processo de germinação. No entanto,necessitam de uma fonte de carbono para que este fenômeno ocorra. As principais fontes de carbono citadas pelo autor são ácidos nucléicos e alguns ácidos gordurosos. Considerando-se que a germinação de Z. radicans tem sido constatada em substrato inerte (Wraight (USDA), informação pessoal),é possível que fontes de carbono tenham pouca influência na germinação do fungo. A redução na porcentagem de germinação dos conídios inoculados,do abdome para a cabeça,em todos os tempos, para o isolado ARS-1229, pode ser devida a existência de algum composto químico inibidor da germinação deste isolado, presente na cutícula do hospedeiro em maior concentração nas camadas de maior espessura e esclerotizadas.
As porcentagens dos conídios germinados dos isolados, que produziram tubos germinativos, tubos capilares e conídios secundários, variaram conforme a região do corpo do hospedeiro (TABELA 2). O isolado ARS-1261 aumentou a produção de tubos germinativos da cabeça para o tórax e abdome em todos os períodos após a inoculação, visto que, na média dos tempos, esta forma foi gerada por 42,0; 54,4 e 66,5% dos conídios primários germinados nas respectivas regiões. Este comportamento, embora não tenha sido verificado para o isolado ARS-1590 e observado somente doze horas após a inoculação para o ARS-1229, pode ser característico do fungo, pois foi constatado também por Wraight et al. (1990). Segundo estes autores, a produção de tubos germinativos tende a aumentar da cabeça para o abdome devido ao fato dessa forma, produzindo apressório, ser favorecida nas regiões do hospedeiro com cutícula mais fina, como o abdome. Como conclusão, os autores relataram que um estimulante químico, presente em maior concentração no abdome, induz a produção de tubos germinativos. Van Roermund et al. (1984) mencionaram que a produção de tubos germinativos é governada também por estimulantes nutricionais, pois verificaram maior produção de tubos germinativos em substrato rico em nutriente do que em substrato composto de ágar-água.
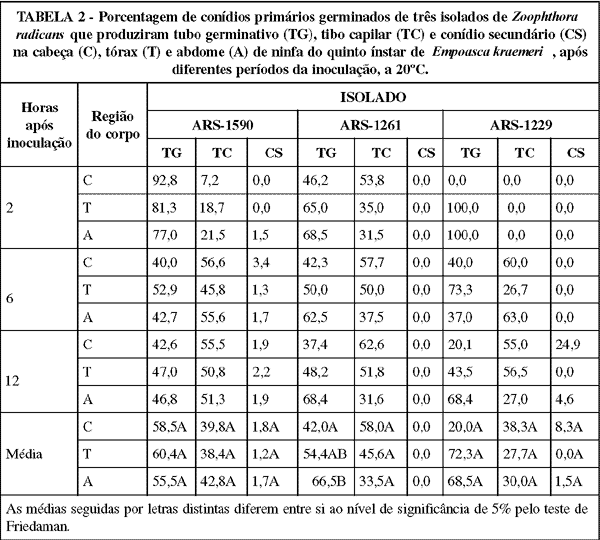
O isolado ARS-1261 apresentou uma redução na produção de tubos capilares da cabeça do inseto para o tórax e abdome, visto que, na média dos tempos, esta forma foi gerada por 58,0; 45,6 e 33,5% dos conídios primários germinados nas respectivas regiões. Essa redução deveu-se ao aumento da produção de tubos germinativos, provocado pelo aumento de estímulos para a geração desta forma. Já o isolado ARS-1590, apresentou um sensível aumento na produção de tubos capilares da cabeça para o tórax. Sampedro et al. (1984) mencionaram que o modo de germinação do fungo Conidiobolus obscurus Brefeld (1884) é dependente do isolado, bem como das condições físicas e nutricionais do substrato. Para qualquer um dos isolados, os inóculos germinados sobre o inseto apresentaram, doze horas após a inoculação, uma produção total de tubos germinativos equilibrada com a de tubos capilares.
No que se refere aos conídios secundários, estes representaram baixas porcentagens dentro das formas geradas pelo fungo, tendo sido produzido, 12 horas após a inoculação, por 1,9, 2,2 e 1,9% dos conídios primários germinados do isolado ARS-1590, nas regiões da cabeça, tórax e abdome, respectivamente, e por 24,9 e 4,6% dos conídios primários germinados do isolado ARS-1229 na cabeça e abdome, respectivamente.
A germinação dos inóculos dos isolados ARS-1590 e ARS-1261 iniciou-se e praticamente estabilizou-se duas horas após a inoculação do fungo. Assim, pode-se afirmar que o isolado ARS-1229 foi o mais lento quanto a germinação dos conídios, visto que, as porcentagens de conídios germinados nas diferentes regiões do corpo do inseto foram baixas duas horas após a inoculação, aumentando nos períodos posteriores. Além disso, a produção de tubos capilares não ocorreu antes das duas horas. De modo geral, pode-se afirmar que a germinação dos conídios de Z. radicans ocorre num período extremamente curto após a inoculação, tendo por comparação os Hifomicetos B. bassiana e Nomuraea rileyi Farlow (Samson), cuja germinação de conídios ocorre em cerca de 12 e 18 horas, respectivamente (Alves, 1986), bem como Metarhizium anisopliae (Metsch.) Sorokin, que leva, comumente, cerca de 18 a 24 horas (Samuels et al., 1989). Segundo Steinhaus (1949), a germinação dos conídios de fungos Entomophthorales ocorre logo após a descarga dos mesmos.
1) A germinação dos conídios primários dos isolados sobre o inseto iniciou-se dentro do período de duas horas após a inoculação.
2) A produção total de tubos germinativos tendeu a se igualar a de capiloconídios sobre o corpo do hospedeiro, doze horas após a inoculação.
3) A proporção de conídios secundários, dentro das formas geradas pelos conídios primários germinados sobre o inseto, não ultrapassou 25% em qualquer das regiões do corpo.
Ao convênio EMBRAPA/CNPAF-BOYCE THOMPSON INSTITUTE pelo apoio para realização dessa pesquisa.
L. G. Leite1; S. B. Alves2; S. P. Wraight3; S. Galaini-Wraight4; D. W. Roberts4
sebalves[arroba]esalq.usp.br
1. Seção de Controle Biológico das Pragas-IB, C.P. 70, CEP: 13001-970 - Campinas, SP.
2. Depto. de Entomologia-ESALQ/USP, C.P. 9, CEP: 13418-900 - Piracicaba, SP.
3. USDA, ARS/US Plant, Soil & Nutritions Lab., Ithaca, New York, 14853, USA.
4. Boyce Thompson Institute, Insect Pathology Resource Center, Tower Rd. Ithaca, New York, 14853, USA.
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|