 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Nos aviários, os insetos vivem em meio à cama do aviário, principalmente ao redor dos comedouros e, também no solo (até 20 cm de profundidade) onde se abrigam durante a fase pupal. Medidas de controle são necessárias, mas os hábitos do inseto e a presença constante das aves nos aviários dificultam a prática de medida de controle, principalmente aquelas que se baseiam no uso de produtos químicos, que embora eficientes podem causar problemas de intoxicação nas aves.Assim, o controle biológico pode ser uma alternativa viável, pois os microrganismos entomopatogênicos têm se mostrado inócuos aos animais endotérmicos, incluindo-se as aves (Alves 1998, Crawford et al. 1998). Tentativas sobre o uso desta estratégia para o controle do cascudinho foram relatadas na literatura, principalmente a partir da década de 90, sendo constatado o potencial de isolados do fungo Beauveria bassiana (Bals.) Vuilleman para o controle da praga (Crawford et al. 1998, Geden et al. 1998, Chernaki-Leffer 2004). Steinkraus et al. (1991) relataram a ocorrência natural desse fungo sobre larvas e adultos de cascudinho em aviários nos EUA, e também ressaltam que algumas condições verificadas na cama dos aviários, como temperatura estável, umidade relativa elevada e a presença de solo compactado abaixo da cama nos aviários, podem favorecer a ocorrência de epizootias de fungos entomopatogênicos, contribuindo para o controle da praga.
O presente trabalho registra a ocorrência natural de B. bassiana sobre larvas e adultos do cascudinho, tendo-se comprovado sua ação patogênica e elevada virulência.Quinzenalmente, entre os meses de setembro de 2002 e fevereiro de 2003 foram coletadas amostras de solo de aproximadamente 100 cm3, a cada 5 m, ao longo da margem externa de um aviário comercial localizado na Linha Alto Bom Retiro, Cascavel, PR.As amostras foram individualizadas em sacos plásticos identificados e no Laboratório de Zoologia da Unioeste foram transferidas para bandejas plásticas, sendo coletadas larvas, pupas e adultos vivos ou mortos, com ou sem sinal da presença de fungo. Os insetos vivos foram mantidos em placas de Petri com ração para aves e observados diariamente. Quando morriam eram desinfectados por imersão em álcool 70% durante 15 s e lavados em água destilada esterilizada e, em seguida, transferidos para câmara úmida, mantidos a 26 ± 1°C e fotofase de 14h, a fim de se comprovar o agente causal de mortalidade.
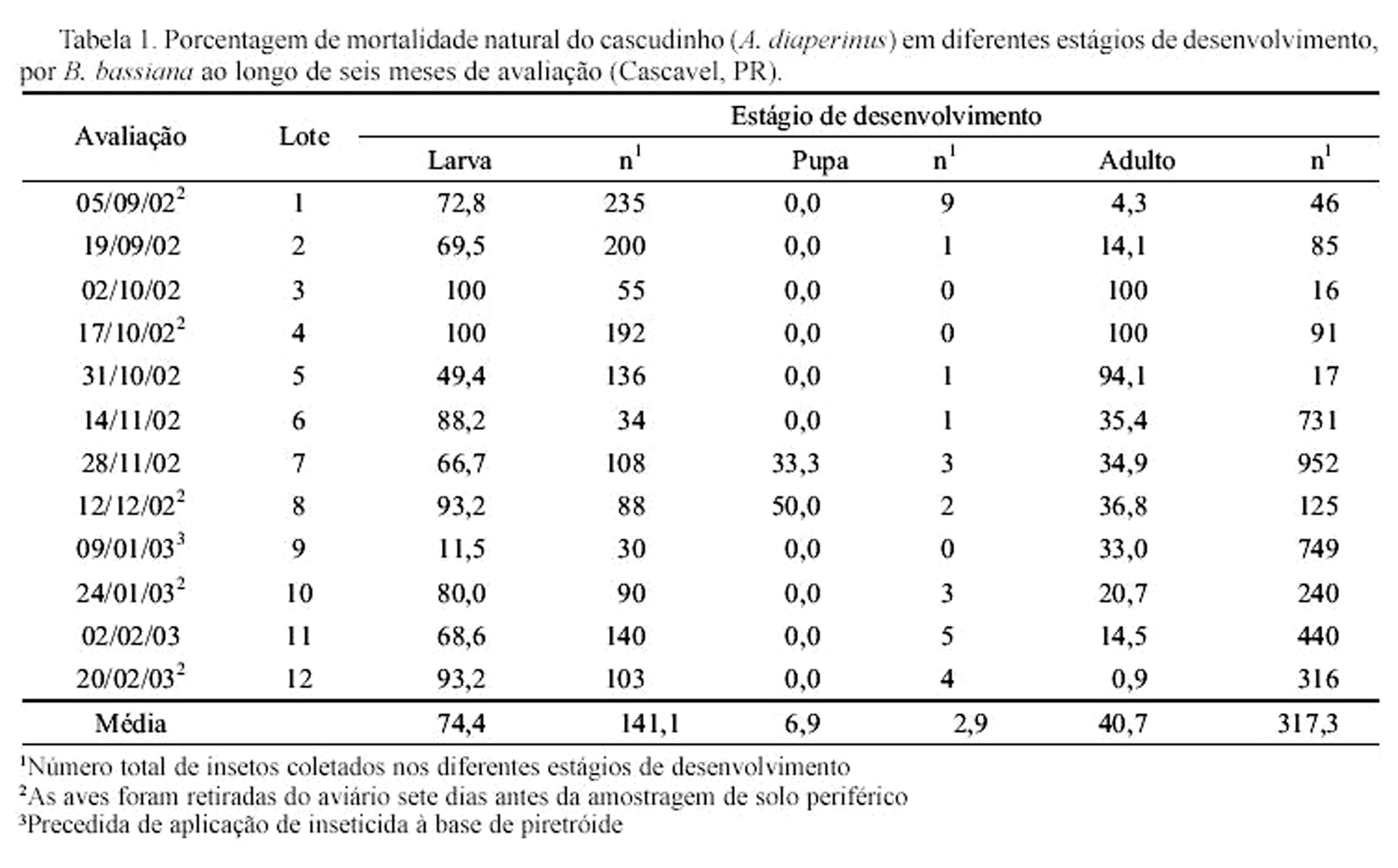
Adotou-se o mesmo procedimento para aqueles insetos encontrados mortos no campo e sem sinal da presença do fungo.O fungo foi isolado dos cadáveres, utilizando-se meio de cultura seletivo (aveia-Dodine) (Chase et al. 1986) e, em seguida, multiplicado em meio BDA ou em meio para esporulação (Alves et al. 1998), sendo em seguida identificado e armazenado no banco de patógenos da Universidade Estadual do Oeste do Paraná.A fim de comprovar sua patogenicidade foram realizados bioensaios com o isolado obtido, seguindo o postulado de Koch. Assim, o fungo foi produzido em placa de Petri, sobre meio para produção de esporos (Alves et al. 1998). Após 10 dias de incubação os conídios foram recolhidos, preparando-se uma suspensão de conídios em água destilada + espalhante adesivo Tween 80 (0,01%), padronizada na concentração de 109 conídios/ml, além da testemunha (água destilada + espalhante adesivo).Larvas e adultos do cascudinho provenientes da criação mantida no Laboratório de Zoologia da Unioeste foram imersos na suspensão por 10 segundos sob agitação, sendo divididos em quatro repetições de 15 indivíduos. Em seguida, as larvas foram individualizadas em caixas de acrílico e os adultos reunidos em placas de Petri, todas tendo o fundo recoberto por papel filtro e com uma pequena porção de ração, ambos esterilizados. Todo o conjunto foi mantido no interior de recipientes plásticos fechados contendo no fundo uma camada de espuma de poliuretano umedecida com água destilada até a saturação, incubados em câmara BOD (26 ± 1°C, fotofase de 14h), sendo observados diariamente. Os insetos mortos foram retirados, desinfectados externamente em álcool 70% e mantidos em uma câmara úmida para confirmação do agente causal da mortalidade, como descrito anteriormente.Em todas as avaliações foram encontrados insetos infectados pelo fungo B. bassiana e, embora tenham sempre sido coletados mais adultos que larvas (cerca de 380 e 141 indivíduos/avaliação, respectivamente), houve maior percentual de larvas infectadas em relação às pupas e adultos (74,4% e 40,7% de infecção para larvas e adultos, respectivamente) (Tabela 1).A porcentagem de larvas infectadas no solo aumentou aos sete dias após a retirada das aves, voltando a cair na avaliação seguinte. Provavelmente isso esteja relacionado ao aumento da permanência dos insetos no interior do aviário, o que fez reduzir a quantidade de insetos na periferia do mesmo. Em conseqüência, reduziu-se a incidência de fungo nos insetos coletados nesse local, até que nova perturbação interna voltasse a ocorrer e provocasse a saída dos insetos. No caso dos adultos essa tendência nem sempre foi constatada.Nos meses de setembro a dezembro de 2002 e fevereiro de 2003 a mortalidade principalmente de larvas pelo fungo esteve quase sempre acima de 70%, enquanto no início do mês de janeiro de 2003 houve uma queda brusca no número de larvas coletadas e, conseqüentemente na incidência de fungo neste estágio de desenvolvimento. Por outro lado, neste último período de avaliação, o número de adultos coletados elevou-se consideravelmente, mas não houve reflexo na incidência do fungo. Este fato provavelmente está associado à aplicação de inseticida à base de cipermetrina no aviário logo após a retirada das aves, no início do mês de janeiro, fato que não havia ocorrido na saída dos lotes anteriores.O manejo dos aviários, ao oferecer condições adequadas para o desenvolvimento do inseto (abrigo, temperatura e alimento), permite que sua população cresça a cada lote de aves, com sobreposição de gerações. Esse crescimento é interrompido periodicamente com a remoção das aves e revolvimento ou troca do substrato (cama) ou ainda com aplicações de inseticidas químicos. Nessa ocasião, parte da população na fase adulta busca outros locais para se abrigar (fendas no solo ou piso de cimento, em vigas e colunas internas), retornando à cama do aviário quando as aves são novamente alojadas. Parte das larvas busca o solo, onde se desenvolvem até a fase adulta, ovipositando neste local, restabelecendo a população dos insetos no aviário.Neste ciclo, a entrada de indivíduos infectados por B. bassiana provenientes da periferia do aviário pode contribuir com o controle natural da praga, pois gradativamente eleva-se o potencial de inóculo no interior do aviário, favorecendo a ocorrência de epizootias, conforme constatado durante o transcorrer do estudo de dinâmica populacional no aviário em questão e, também por Steinkraus et at. (1991), nos EUA. Além disso, a ocorrência de fungo na região periférica representa substancial redução no número de insetos que podem reinfestar o aviário, visto que na maioria das vezes a mortalidade larval nunca esteve abaixo de 65%.Sabendo-se que no aviário em estudo são adotadas práticas de manejo baseadas exclusivamente na aplicação de inseticida químico, verifica-se que este procedimento é ineficaz no controle do inseto em longo prazo. Além disso, quando não há compatibilidade entre o mesmo e os fungos entomopatogênicos, este procedimento pode afetar negativa e consideravelmente a eficiência do controle natural. Assim, são necessários estudos visando conhecer a compatibilidade entre inseticidas e outros produtos utilizados no manejo das aves e os fungos entomopatogênicos.
O fungo isolado foi patogênico aos insetos, em níveis comparáveis aos obtidos por Geden et al. (1998), que, tal como aqui verificado (Tabela 2), também constataram maior suscetibilidade larval, sugerindo que possa ser utilizado em futuros programas de controle biológico da praga.

Agradecimentos
Aos colegas que auxiliaram na leitura do manuscrito, ao CNPq pela concessão de Bolsa de Produtividade em Pesquisa e à empresa Globoaves Agroindustrial Ltda., por disponibilizar o aviário para a realização deste trabalho.
Literatura Citada
Luis F.A. AlvesI; Mariana H. GassenII; Fabiana G.S. PintoIII; Pedro M.O.J. NevesIV; Sérgio B. AlvesV
sebalves[arroba]esalq.usp.br
I. Lab. Zoologia, Univ. Estadual do Oeste do Paraná/CCBS, Bolsista de Produtividade em Pesquisa/CNPq
II. Lab. Controle Biológico, Instituto Biológico, Centro Experimental de Campinas, C. postal 70, 13001-970, Campinas, SP
III. Lab. Microbiologia, Univ. Estadual do Oeste do Paraná/CCBS, R. Universitária, 2069, 85819-110, Cascavel, PR
IV. Depto. Agronomia Universidade Estadual de Londrina/ C.postal 601, 86051-970, Londrina, PR
V. Depto. Entomologia, Fitopatologia e Zoologia Agrícola, Univ. São Paulo/Escola Superior de Agricultura "Luiz de Queiroz", C. postal 9, 13418-900, Piracicaba, SP
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|