 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
O presente trabalho foi conduzido no laboratório da Seção de Ecologia do Centro de Energia Nuclear na Agricultura da Universidade de São Paulo, Piracicaba, SP, durante o ano de 1992.Foram usados os inseticidas: endosulfan, (Thiodan 350 CE) (6,7,8,9,10,10 - hexacloro, 5, 5a,6,9,9a - hexahidro - 6,9 - metano -2,4,3- benzo-dioxatilpin -3- óxido) e aldicarbe (Temik 150), (2-metil - 2 (metiltio) - propionaldeido - o - (metilcar-bamoil) oxima.Foram usadas as concentrações de 2ppm (quando aplicadas nas taxas recomendadas, esses produtos raramente atingem mais que 2ppm FLETCHER, 1960) e 20ppm (correspondente a 10 vezes a concentração máxima, conforme recomendado por LAL, 1988). O controle constou de solo não tratado com inseticida.O solo utilizado, classificado como terra rocha estruturada série Luiz de Queiroz foi coletado nos primeiros 20cm da superfície, com auxílio de uma pá, seco ao ar, peneirado a 2mm e sua capacidade de campo determinada pelo método TFM.A análise química foi realizada pelo Departamento de Química da ESALQ/USP, Piracicaba,SP, incluindo: pH (CaCl) 6,25; matéria orgânica 8,73; fósforo 20,8; saturação por bases de 89% e capacidade de troca catrônica de 15,8 meq/100cm3.Sub-amostras de solo seco ao ar (l00g) foram colocadas em frascos com capacidade para 300 ml. O tratamento com o endosulfan foi feito distribuíndo-se 10ml de solução estoque apropriada de Thiodan, a cada frasco, para acertar a umidade a 2/3 da capacidade de campo; para aldicarbe distribuiu-se os granulos de Temik no solo, em seguida foi adicionada água destilada para acertar a umidade a 2/3 da capacidade de campo.O controle recebeu água destilada no volume equivalente a 2/3 da capacidade de campo do solo. Foram usadas 5 repetições para cada tratamento. Os frascos foram mantidos em sala climatizada à temperatura de 25°C. Após 12, 30, 60, 90 e 120 dias para endosulfan e 12, 30, 60 e 90 dias para aldicarbe foram coletadas amostras dos mesmos frascos para verificar o efeito dos inseticidas no número e na atividade da enzima urease. A cada 18 dias foi feita pesagem dos frascos com o objetivo de manter constante a umidade em 2/3 da capacidade de campo.Avaliação da População Microbiana do Solo foi feita através do método de diluição em série, de cada uma das diluições apropriadas foi pipetada uma alíquota de 0,1 ml e semeada em placas de petri contendo meio seletivo para o isolamento de cada grupo de microrganismos Actinomicetos: Meio Amido Caseina de KUSTER & WILLIANS, (1964); Fungos: Meio de MARTIN; Bactéria: Meio Nutriente Agar e, Protozoários: Ágar água. Foram utilizadas as diluíções 10-2, 10-3 10-4 para fungos e actinomicetos; 10-4, 10-5 e 10-6 para bactérias e 10-1, 10-2 e 10-3 para protozoários. As culturas de fungos e bactérias foram incubadas a 28°C, enquanto que as de actinomicetos foram incubadas a 25° C por 5-7 dias. Para contagem de protozoários foi utilizado o método de iscas e a população determinada pelo numero mais provável (NMP) através da tabela de Fisher e Yates (VICENT, 1970).
Avaliação da Atividade da Urease foi feita pelo método colorimétrico de DOUGLAS & BREMNER (1970) modificado por TABATABAI (1982).
Para a concentração de 2ppm de aldicarbe verificou-se uma inibição da população de actinomicetos em relação ao controle até os 60 dias. Já aos 90 dias observou-se a recuperação da população de actinomicetos (Figura 1A). Pela adição de 20ppm de aldicarbe ao solo observou-se um acréscimo na população de actinomicetos aos 12, 30, e 90 dias, enquanto que aos 60 dias verificou-se um decréscimo em relação ao controle. Em geral, tanto para os solos tratados com o inseticida como para o controle a população de actinomicetos aumentou durante o período de incubação até os 60 dias. Na presença de endosulfan (Figura 1B) verificou-se um acréscimo significativo na população de actinomicetos em relação ao controle para as duas concentrações. Até 90 dias de incubação não houve diferenças significativas entre as duas concentrações testadas. Aos 120 dias de incubação a população de actinomicetos na concentração de 20ppm aumentou consideravelmente.
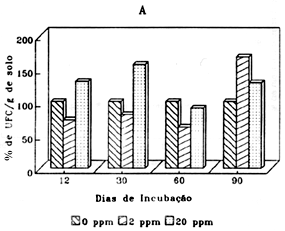
A adição 2ppm de aldicarbe causou um efeito inibitório significativo na população bacteriana (Figura 2A) em relação ao controle até 60 dias. Aos 90 dias verificou-se recuperação da população em numero igual ao controle. Na concentração de 20ppm de aldicarbe causou um significativo efeito inibitório que não diferiu daquelas observados para 2ppm até os 60 dias, no entanto, para esta concentração não houve recuperação da população bacteriana até aos 90 dias de incubação. A adição de endosulfan (Figura 2B) ao solo não resultou em mudanças significativas na população bacteriana.
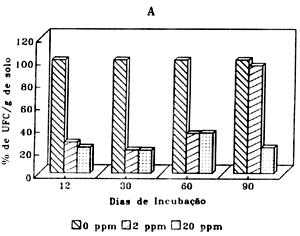
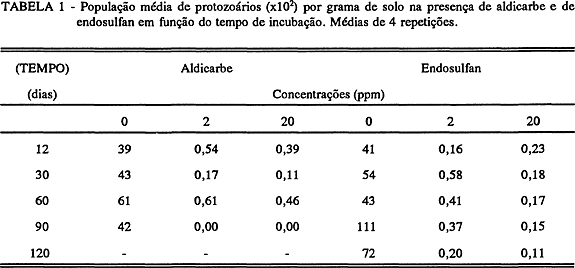
A adição de aldicarbe não apresentou efeitos significativos na população de fungos (Figura 3A). Por outro lado endosulfan causou um acréscimo significativo na população de fungos em relação ao controle. (Figura 3B). O efeito de aldicarbe e endosulfan na população de protozoários encontra-se na TABELA1. Observou-se uma forte inibição que variou de 98,61 a 100% para as duas concentrações durante todo período de incubação.
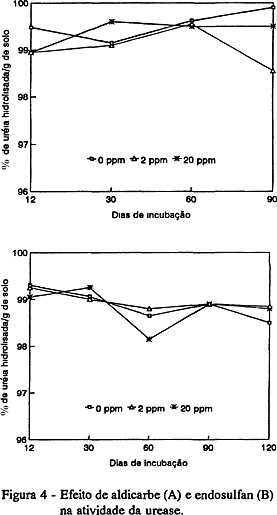
Os resultados obtidos para a atividade da urease estão apresentados na Figura 4. Tanto a adição de aldicarbe como de endosulfan não tiveram efeito na atividade da urease.
A TABELA 2 apresenta os coeficientes de correlação entre o numero de actinomicetos, bactérias, fungos e número total de microrganismos. Não foram detectadas correlações significativas entre a atividade da urease e as demais variáveis no bioensaio com aldicarbe. Para endosulfan detectou-se correlações significativas entre a atividade da urease e, o número de actinomicetos (positiva) e o número de fungos para concentração de 20ppm (negativa).

Um pesticida pode atuar em duas vias na microflora: de um lado ele pode influenciar os microrganismos responsáveis por sua degradação e essa ação pode também se estender aos organismos envolvidos na degradação de outras substâncias. Por outro lado, o pesticida pode atuar também como um substrato para a micro flora do solo. Na verdade sua degradação pode suprir certos organismos com carbono, energia e algumas vezes o nitrogênio necessário para seu crescimento. Em qualquer caso a conseqüência mais importante desses dois aspectos reside essencialmente na degradação do pesticida (SIMON-SYLVESTRE & FOURNIER, 1979).A inibição do crescimento da população microbiana ou de segmentos da mesma vai determinar a persistência do produto no solo, visto que a mineralização ou completa degradação é quase sempre uma atividade microbiana.Poucos processos abióticos de importância, convertem totalmente compostos orgânicos de qualquer grau de complexidade a produtos inorgânicos (SIMON-SYLVESTRE & FOURNIER, 1979).Os resultados obtidos sugerem que os actinomicetos usaram 20ppm de aldicarbe como fonte de carbono e energia e, 2ppm foi insuficiente para o desenvolvimento dos microrganismos. Pode ter ocorrido aqui um processo conhecido como enriquecimento que foi primeiro descrito por AUDUS (1949) em seu estudo com desintoxicação de 2,4-D no solo, onde se observa que a adição de certos biocidas ou a presença de certos metabólitos do mesmo no solo, determina a proliferação de certos grupos de microrganismos. Esse fenômeno pode ser usado para explicar os mecanismos de adaptação dos microrganismos do solo, na degradação de muitos produtos e significa que microrganismos utilizam tais substâncias como fonte de energia e carbono. Os resultados obtidos aqui, também concordam com aqueles obtidos por KUSESKE et al., (1974). Estes autores estudando o efeito de aldicarbe, nas concentrações de 5 a 500ppm, verificaram um acréscimo na população de actinomicetos, principalmente após aplicação de 500 ppm.Na presença de endosulfan, verificou-se um acréscimo significativo da população de actinomicetos, para as duas concentrações. Esse resultado também sugere a ocorrência de enriquecimento, porém, para esse inseticida a menor concentração foi suficiente para a proliferação dos actinomicetos; esse fato poderia estar ligado a estrutura química de endosulfan. MONTEIRO et al., (1989) observaram que a degradação de endosulfan ocorre por ação microbiana, sendo o diol o principal metabólico após 120-160 dias de incubação, em três tipos de solo, sendo que as porcentagens mais alta de evolução de 14CO2 ocorreu em solo rico em actinomicetos. Esse resultado verificado para os dois inseticidas também poderia ter ocorrido em função da esterilização parcial do solo pelos produtos, eliminando espécies ou grupos competidores favorecendo a proliferação dos actinomicetos.Em geral, a meia vida de aldicarbe e de seus metabólicos variam de quatro a oito semanas. Após o produto ser incorporado no solo, o aldicarbe é oxidado a sulfóxido de aldicarbe e parte do sulfóxido é então oxidado a sulfona de aldicarbe que têm ação inseticida. O sulfóxido e a sulfona de aldicarbe são hidrolisados através de reações químicas ou ação microbiana formando compostos não tóxicos.Os resultados obtidos no presente trabalho para a concentração de 2ppm estão de acordo com essas informações referentes ao período de toxicidade do produto, no entanto, foi observado que para a concentração de 20ppm a população continuou a sofrer ação inibitória até 90 dias.Levando em consideração as observações de DOMSCH (1980) que, altos déficits ( >50%) e longo e/ou duradouro período de déficit ( >60 dias) ou ambos caracterizam o efeito irreversível de um produto sobre a população microbiana, pode-se considerar os resultados obtidos para bactérias com 20ppm de aldicarbe como irreversíveis.Em geral, os inseticidas organoclorados, entre eles endosulfan, não têm qualquer efeito expressivo ou prolongado no total de bactérias do solo. Espécies ou grupos individuais podem ser atingidos, porém raramente esse efeitos são irreversíveis. O padrão usual é um decréscimo inicial no numero total de bactérias seguido de acréscimo até o restabelecimento ao nível inicial (LAL & SAXENA, 1982).A população fúngica de um modo geral, é mais sensível a ação de pesticidas do que outros grupos de microrganismos, sendo drasticamente reduzida logo após a aplicação dessas substâncias. E essa sensibilidade parece ser maior quando se trata de inseticidas carbamatos e organofosforados. No entanto, os resultados obtidos indicam que a presença de aldicarbe não afetou a população fúngica. READ (1987) verificou um decréscimo da população fúngica em solos tratados com 10, 50 e 100ppm de aldicarbe, sendo observado que a maior parte do crescimento ocorreu 15 a 30 dias após a aplicação. Com concentrações de 100, 1500 e 2000ppm o crescimento não foi visível no solo nos primeiros 12 dias. A 5000ppm os fungos não foram visíveis no solo por 5 meses e durante os próximos 6 meses apenas um leve crescimento de espécies de Penicillium foi observado.Os resultados obtidos neste trabalho, estão de acordo com observações feita por vários autores, que apesar dos inseticidas afetarem mais os fungos do solo do que bactérias e actinomicetos, essa ação não é observada com os inseticidas organoclorados, mesmo quando presentes no solo em altas concentrações. No entanto, isso não implica que todos os grupos de fungos não sejam afetados por esses inseticidas. COWLEY & LICHTENSTEIN (1970) observaram a inibição da população fúngica em concentrações acima de 40ppm dos inseticidas aldrin, lindane, paration, forate e carbaril. Os resultados obtidos no presente trabalho também sugerem que, assim como as actinomicetos, a população fúngica utiliza endosulfan como fonte de carbono e energia. Embora não tenham sido verificadas mudanças quantitativas significativas na população fúngica, tanto na presença de aldicarbe como de endosulfan, ocorreram mudanças qualitativas. Foi verificado uma predominância dos gêneros Penicillium e Trichoderma em contraste com uma maior diversidade observada na testemunha. Esse resultado está de acordo com observações feitas por PARR (1981) onde relata que os gêneros Aspergillus, Penicillium e Trichderma predominam em solos tratados com pesticidas.Verificou-se que a população de protozoários foi altamente sensível aos dois inseticidas nas duas concentrações. Na literatura, são escassos os trabalhos sobre o efeito de pesticidas na população de protozoáríos, no entanto, sabe-se que esses microrganismos não usam tais produtos como fonte de carbono e energia (LYNCH, 1986).A uréia pode ser hidrolisada por actinomicetos, bactérias e fungos, sendo as bactérias o grupo mais importante (LOYD & SHEAFF, 1973). A taxa de bactérias ureolíticas no solo, permanece constante enquanto que a população total pode variar. Desse modo, a atividade da urease, no solo, muitas vezes pode estar associada com o tamanho da população. Por outro lado, foi verificado por REED et al., 1990, que a atividade da urease pode estar relacionada com a degradação dos inseticidas carbofuran e ethoprophos.Sugerindo que os níveis de atividade de enzimas indígenas específicas do solo podem ser influenciados por certos pesticidas aplicados ao solo ou por seus metabolites formados através de degradação.
As correlações observadas no presente trabalho, podem indicar que 20ppm de endosulfan favoreceu os actinomicetos produtores de urease, enquanto que os fungos produtores de urease foram inibidos.
T. M .C. SantosI; R. T. R. MonteiroII
monteiro[arroba]cena.usp.br
IDepartamento de Agronomia, CECA/UFAL, BR 101 Norte, CEP: 57072-970-Maceió,Al
IICentro de Energia Nuclear na Agricultura - C.P. 96, CEP: 13416-000, Piracicaba - SP
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|