 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
O experimento foi desenvolvido na Fazenda Floresta do Lobo - Pinusplan, BR 050, km 93, no município de Uberlândia (MG), entre abril de 1999 e março de 2000, cultivando-se aveia preta (Avena strigosa Schieb.), no inverno, e o milho híbrido simples, precoce, Tork (Syngenta), em sucessão. A área em SPD foi cultivada com soja e milho alternadamente desde 1996/97, com sorgo granífero em 1997 e pousio no inverno de 1998.
Em 15/04/99, foi semeada a aveia preta na área total do talhão, numa densidade de 17,8 kg ha-1 de sementes (valor cultural: 83 %), com espaçamento de 0,5 m, sem adubação. A cultura foi manejada com rolo faca em 10/09/99, 145 dias após a semeadura, efetuando-se a determinação de massa de matéria seca (MMS) produzida com quadrante de 1 m2, lançado ao acaso na área experimental em quadruplicata, antes do acamamento do material. No laboratório, cada repetição foi pesada, triturada finamente com triturador de material vegetal, homogeneizada. Foram compostas três amostras para secagem em estufa, com circulação de ar forçado a 60 ºC até peso constante, e determinados C e N total por combustão a 1.440 ºC com oxigênio em via seca, no LECO CN-2000, CENA/USP, Piracicaba, para o cálculo da relação C/N. Previamente à semeadura do milho, foi determinada a resteva (resíduos da aveia preta e soja da safra anterior), utilizando-se um procedimento similar ao da determinação da MMS da aveia preta.
O Latossolo Vermelho ácrico típico fase cerrado subcadocifólio (Embrapa, 1999) apresentou, para a camada de 0–10 cm, pH (H2O) 5,5; 9,7 e 110,5 mg dm-3 de P (Mehlich-1) e K respectivamente; CTC de 59,5 mmolc dm-3; 56 % de saturação por bases e 43 g dm-3 de MO. A camada de 10–20 cm apresentou pH (H2O) 5,1; 11,6 e 55,4 mg dm-3 de P (Mehlich-1) e K; CTC de 64,6 mmolc dm-3; 37 % de saturação por bases e 40 g dm-3 de MO. A amostragem do solo foi efetuada em 20/09/99, sendo coletadas 20 amostras simples de cada camada, na entrelinha, coletadas na linha de plantas, segundo citado por Anghinoni & Salet (1998).
Previamente à semeadura do milho, foi feita a adubação de 82 kg ha-1 de K2O (KCl), a lanço, sem incorporação, como efetuado no restante da área comercial. O híbrido simples Tork, precoce, foi semeado em 15/11/99, com espaçamento de 0,8 m, numa densidade de 65.000 plantas por hectare. No sulco de semeadura, nos tratamentos descritos a seguir, realizou-se a aplicação de 40, 53 e 40 kg ha-1 de N; P2O5 e K2O nas formas de SA, MAP e KCl, respectivamente, e de 0,7 e 1,3 kg ha-1 de B e Mn, respectivamente. A adubação nitrogenada em cobertura foi feita em 16/12/99, com atraso, em razão das dificuldades com disponibilidade de maquinário. Foram executados, também, os tratos culturais de controle de pragas e plantas daninhas adequados para a região.
A colheita foi realizada em 24/03/2000. Nas quatro linhas centrais de cada parcela, foram determinadas a população efetiva de plantas e a produtividade de grãos (umidade corrigida para 130 g kg-1). O acompanhamento das temperaturas máximas e mínimas médias e da pluviosidade foi efetuado, durante todo o período experimental.
Utilizou-se o delineamento inteiramente casualizado, com quatro tratamentos e três repetições, em esquema de parcelas subdivididas no tempo. Os tratamentos foram: (1) U aplicada em pré-semeadura (43 dias antes) e (2) em cobertura (estádio de 5–6 folhas), na dose de 80 kg ha-1 de N, incorporada com haste escarificadora na profundidade de 5–7 cm de profundidade, no meio das futuras e atuais entrelinhas, respectivamente; (3) SA em pré-semeadura e (4) cobertura nas condições citadas anteriormente. Não houve tratamento-testemunha, desnecessário para os objetivos do estudo.
Cada parcela (fonte-época) ficou constituída de 14 linhas, espaçadas de 0,8 e 25 m de comprimento. Dentro de cada parcela correspondente aos tratamentos de U e SA em pré-semeadura, foram instaladas, aleatoriamente, seis subparcelas de 1,0 x 1,6 m, abrangendo o sulco de adubação e duas linhas adjacentes de plantas, onde foi substituído o adubo comercial por fertilizantes enriquecidos com 15N [U (46,8 % de N) com 5,037 ± 0,009 % e SA (21,4 % de N) com 5,029 ± 0,009 % em abundância de 15N], aplicados manualmente. Essas subparcelas foram utilizadas para quantificar o N imobilizado proveniente do fertilizante (Nispf) e o N na planta proveniente do fertilizante (Nppf) no sulco de adubação, após 19 e 40 dias da aplicação dos adubos e nos estádios de 5–6 folhas, 11–12 folhas, florescimento e ponto de maturação fisiológica (PMF). Não foi possível avaliar o Nispf e o Nppf no estádio de PMF nesses tratamentos, por falhas importantes do estande de plantas em duas das três subparcelas. De igual forma, nos tratamentos com aplicação de N em cobertura, foram instaladas três subparcelas com as fontes marcadas indicadas, em cada repetição, para serem efetuadas amostragens nos estádios de 11–12 folhas, florescimento e PMF.
O Nispf determinado nas subparcelas refere-se à fração orgânica do 15N determinado no sulco de adubação, que somente poderia constituir o N fertilizante assimilado pela biomassa microbiana, não sendo possível diferenciar do N fertilizante que tivesse passado a formar parte da fração húmica do solo com o passar do tempo. O Nispf, em cada época fenológica da cultura, foi calculado de forma indireta, pela diferença entre o N total no solo proveniente do fertilizante (Ntspf) e o N mineral total no solo proveniente do fertilizante (Nmispf), segundo Francis et al. (1993), de acordo com a seguinte expressão de balanço de massas:
![]()
O Ntspf e o Nmispf foram determinados a partir de amostras de terra coletadas num volume de 5 dm3 (50 x 10 x 10 cm de comprimento, largura e profundidade, respectivamente), no sulco de adubação, na entrelinha de cada tratamento, efetuando-se quarteio e transporte de amostras de aproximadamente 0,5 kg ao laboratório, conservadas a -18,0 ºC até o preparo para a determinação de N total, N mineral total e as respectivas concentrações de 15N. Para determinar o N total, foi separada uma subamostra de aproximadamente 70 g, seca em estufa com ar forçado a 60 ºC até peso constante, passada em peneira de 100 µm e acondicionada em saco plástico para seu envio ao CENA/USP, Piracicaba (SP) para análise do teor de N total e determinação da concentração de 15N por espectrometria de massas (ANCA modelo SL, 20–20, da Europa Scientific - Barrie & Prosser (1996)).
Para a análise de Nmispf, foi separada uma subamostra de 50 g com umidade atual, a qual foi, posteriormente, submetida à extração com KCl 2 mol L-1 (relação solo:solução = 1:3) e posterior destilação Kjeldahl (Kenney & Nelson, 1982). Após a titulação, cada amostra foi acidulada com H2SO4 0,05 mol L-1, seca em estufa com ar forçado a 50 ºC e posterior determinação da concentração de 15N por espectrometria de massas no CENA/USP. Os cálculos da concentração ( %) e da quantidade de N total (kg ha-1) do Ntspf e do Nmispf foram efetuados de acordo com as seguintes expressões:
![]()
significando A = concentrações de 15N ( % em abundância em átomos de 15N) no Ntspf e Nmispf, B = concentração de 15N do fertilizante e C = concentração isotópica natural do solo (0,363 % de abundância em átomos de 15N), respectivamente. Os cálculos, expressos em kg ha-1, foram referidos ao volume de 125 m3 ({0,005 x 12.500}/0,5), abrangido pelo fertilizante na entrelinha, num hectare. No cálculo, foi considerada a densidade média aparente de 1,20 kg dm-3, determinada pelo método do anel volumétrico. O Nispf foi expresso também como % do N aplicado (80 kg ha-1). Todos os valores foram referidos com base em solo seco em estufa a 105 ºC até peso constante.
Para a determinação do Nppf, foram efetuadas, nas subparcelas, amostragens de plantas (5–7), cortadas a 5 cm da superfície do solo. Até o estádio de florescimento, foram separadas em parte aérea (colmo + folhas + inflorescência) e raiz e, no estádio de PMF, separadas em raiz, parte aérea (colmo + folhas), sabugo, espiga e grãos. Cada parte da planta foi triturada, homogeneizada e subamostrada para secagem em estufa a 60 ºC até peso constante e moídas em moinho tipo Wiley. As raízes, em cada linha da subparcela, foram coletadas num volume predeterminado em 0,50 x 0,25 x 0,20 m de comprimento, largura e profundidade, respectivamente. As raízes de ambas as linhas foram reunidas, lavadas e colocadas para secar em estufa com ar forçado a 60 ºC, para determinação da MMS de forma similar à parte aérea. Os grãos foram pesados e colocados a secar em estufa, como descrito anteriormente, para posterior determinação de MMS. O Nppf foi determinado por espectrometria de massas e calculado como indicado nas expressões 2 e 3. A expressão em kg ha-1 do Nppf considerou a média das plantas coletadas na microparcela. Os valores de Nppf foram multiplicados pelo fator 2, em decorrência do modelo da subparcela empregado, ou seja, marcação de um segmento de sulco de um metro com fertilizante-15N e colheita das plantas nas linhas imediatamente adjacentes.
Para as características analisadas, testou-se a normalidade dos erros pelo teste de Lilliefors, bem como a homogeneidade das variâncias pelo teste de Cochran & Bartlett. Para as características que apresentaram falta de normalidade ou variância, heterogênea, foi feita a transformação dos dados. Após a análise de variância, aplicou-se o teste de Tukey a 5 % de probabilidade, para comparar as fontes em uma mesma época e diferentes épocas dentro de cada fonte.
A produção de MMS, o N acumulado na parte aérea e a relação C/N da aveia preta foram de 1,1 t ha-1, 13,2 kg ha-1 de N e 53,9, respectivamente. Apesar de ser uma cultura de outono-inverno adaptada para a região Sul e de ampla utilização no SPD no cerrado, a semeadura tardia (abril), não resultou nas vantagens comentadas por diferentes autores (Primavesi et al., 1999; Heinrichs & Fancelli, 1999; Bortolini et al., 2000), principalmente quanto à produção de MMS, devido principalmente à falta de água. Essa produção de MMS não estaria contribuindo efetivamente para o processo de imobilização das fontes nitrogenadas aplicadas, numa situação equivalente à verificada por Pauletti (1999) em Arapoti (PR). Na véspera da semeadura do milho, foi determinada uma resteva média de 3,17 t ha-1 (resteva da aveia preta e culturas anteriores).
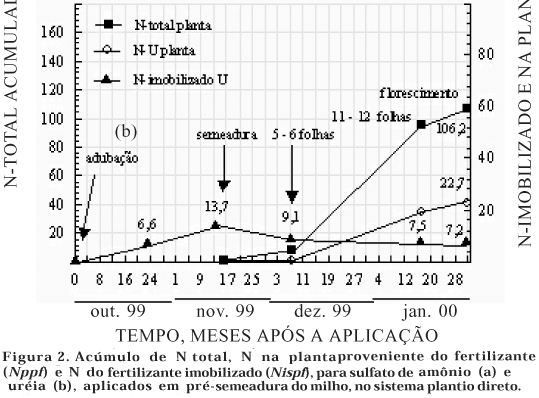
No quadro 1, observa-se a distribuição do N-SA e N-U nas formas Ntspf, Nmispf e Nispf após a aplicação incorporada das fontes em pré-semeadura (43 dias antes), até o florescimento.

Em relação a N-SA, após 19 dias da aplicação, antes da semeadura do milho, 65,0 kg ha-1 de Ntspf foi encontrado no sulco de adubação, principalmente na forma de Nmispf (51,7 kg ha-1) e 13,3 kg ha-1 de Nispf, correspondendo somente a 16,6 % do N aplicado, mostrando que a imobilização não foi expressiva, em razão da inexpressiva cobertura fornecida pela aveia preta (1,1 t ha-1). Portanto, grande proporção do N-SA retido no sulco de adubação foi quantificada como N mineral total na camada superficial. Aumento do N mineral total na camada superficial também foi detectado por outros autores com adubações nitrogenadas antecipadas à semeadura do milho e pluviosidade normal (Sá, 1996; Basso & Ceretta, 2000). Neste estudo, 19 dias após a aplicação do SA, não houve precipitação suficiente (< 10 mm), para deslocar o fertilizante fora do sulco de adubação, limitando sua lixiviação (Figura 1).

Antes da semeadura do milho (40 dias após a aplicação), houve uma queda significativa do Ntspf (16,3 kg ha-1), sendo 8,2 e 8,1 kg ha-1 de Nmispf e Nispf, respectivamente (Quadro 1). Na figura 1, pode-se observar que houve aumento da pluviosidade poucos dias antes da semeadura do milho, favorecendo o deslocamento do Nmispf fora do sulco de adubação e do N fertilizante reciclado da biomassa. No quadro 1, observa-se, também, nessa época, que a maior parte do N mineral total (12,3 kg ha-1) foi do Nmispf (66,8 % do total). Parte do Nmispf poderia estar constituído, nesta época, por N-SA reciclado da biomassa, previamente imobilizado segundo a rota de assimilação MIT ("mineralization-imobilization turnover"), como proposto por Jansson & Persson (1982).
Nos estádios sucessivos até o florescimento, observou-se uma estabilização no Ntspf (4,8 kg ha-1), quase na totalidade na forma de Nispf (4,7 kg ha-1). Basso & Ceretta (2000), de forma similar, observaram no milho em sucessão à aveia preta, quando foram aplicados 90 e 30 kg ha-1 de N em pré-semeadura e semeadura respectivamente, na camada de 0–5 cm, valores de 67,7; 8,0 e 2,8 kg ha-1 de N mineral total, respectivamente, para amostragens feitas imediatamente antes da semeadura do milho, antes da aplicação da cobertura e no florescimento, em ano de pluviosidade regular.
Em relação a U aplicada em pré-semeadura (Quadro 1), aos 19 dias da aplicação, foram encontrados 51,1 kg ha-1 de Ntspf, sendo 46,8 kg ha-1 de Nmispf e 6,6 kg ha-1 de Nispf, representando 8,3 % do N aplicado, inferior ao N-SA imobilizado à época. Aos 40 dias da aplicação da U, uma queda significativa do Ntspf (30,1 kg ha-1) foi observada, ocorrendo aumento significativo do Nispf (13,7 kg ha-1). A maior incidência de chuvas até esta época poderia ter contribuído para diluir a concentração do N-amoniacal oriundo da U, no sulco de adubação, favorecendo as condições micro-ambientais para a imobilização do N-amoniacal do fertilizante. Nos estádios sucessivos até o florescimento, na presença de sistema radicular, como foi observado com o N-SA, houve uma estabilização do Ntspf (7,3 kg ha-1) sendo principalmente constituído do Nispf.
A quantidade de Nppf assimilado pela planta das fontes aplicadas em pré-semeadura e sua correspondente recuperação (Nfrp) até o estádio de cinco a seis folhas mostraram que, praticamente, nada de N dos fertilizantes foi assimilado pela cultura (Quadro 2).
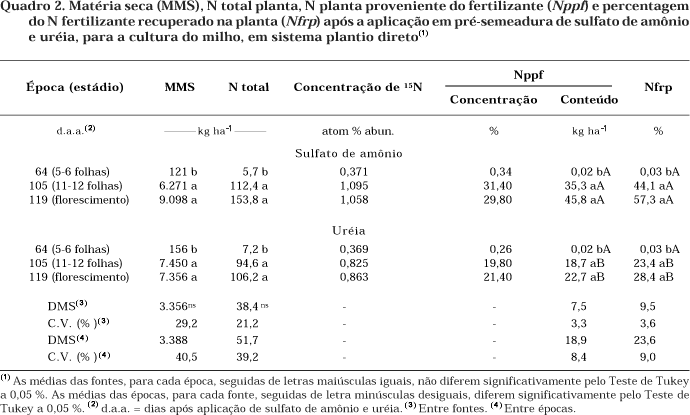
Até o estádio de 11–12 folhas, pode-se verificar o grande acúmulo de N total na planta (média de 112,4 e 94,6 kg ha-1 sob a aplicação do SA e U respectivamente), não havendo diferença entre os tratamentos, sendo o estádio de maior acúmulo de N fertilizante na planta (35,3 e 18,7 kg ha-1 respectivamente, para SA e U). Segundo Fancelli & Dourado-Neto (1997), até este estádio, o milho apresenta acentuada taxa de absorção de N e K, principalmente, em virtude do aumento da taxa de desenvolvimento da espiga, colmo e pendão. Até o estádio de florescimento, foi observado aumento na assimilação do N fertilizante, acumulando-se 45,8 e 22,7 kg ha-1 dos fertilizantes SA e U, respectivamente. Houve, portanto, uma recuperação de 57,3 % do N-SA aplicado, em relação ao N-U, que foi de 28,4 % até o florescimento. Esta assimilação correspondeu a 29,8 e 21,4 %, respectivamente, em relação ao N total acumulado pela planta. Portanto, segundo os resultados apresentados, o N-SA teve um "turnover" (imobilização-remineralização) mais dinâmico que o apresentado pelo N-U, favorecendo a maior assimilação pela planta nos estádios iniciais de 5–6 até 11-12 folhas.
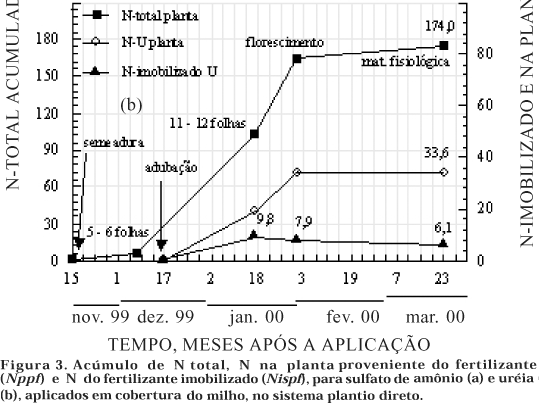
As avaliações feitas do Ntspf, Nmispf e Nispf nos estádios de 11–12 folhas, florescimento e PMF nos tratamentos com aplicação das fontes em cobertura, mostraram que o N-SA não foi alterado pelo processo de imobilização (Quadro 3), visto que proporção inferior a 3,5 % do N-SA aplicado foi imobilizada. Neste estudo, considerando que as doses normalmente utilizadas em cobertura não aumentaram significativamente a biomassa do solo, como um indicativo da falta de N para acentuar a imobilização (Blackmer & Green, 1995; Liang & MacKenzie, 1996), tampouco terem as condições de umidade do solo sido favorecidas pela regularidade na pluviosidade (Figura 1), haveria um predomínio da nitrificação do N-amoniacal do N fertilizante, em relação à imobilização, como observado por Francis et al. (1993). Isto, de forma indireta, tem sido observado em estudos realizados no País, quando afetada a produtividade do milho sob alta pluviosidade em adubações de pré-semeadura (Basso & Ceretta, 2000; Pauletti, 1999; Pöttker & Weithölter, 2004; Wolschick et al., 2003).
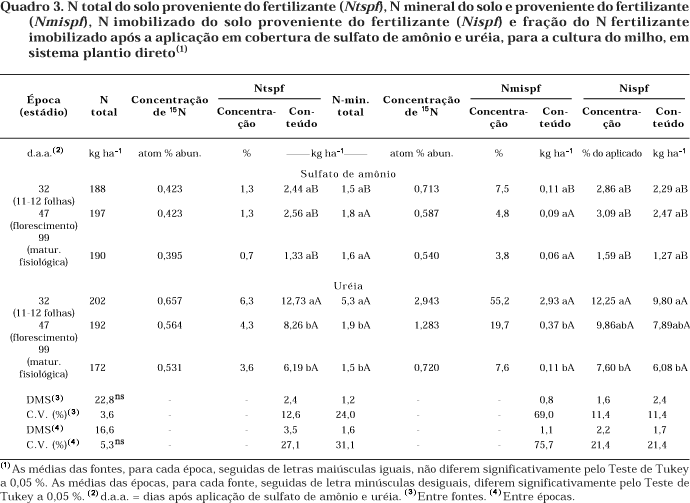
O rápido "turnover" observado com o N-SA em pré-semeadura estaria sendo coerente com o comportamento mostrado em cobertura. Talvez, uma amostragem mais próxima à adubação (inferior a 32 dias) teria mostrado valores superiores de N imobilizado do N-SA. Dados não publicados de um segundo ano de estudo (safra 00/01) evidenciaram sensível abaixamento do pH no sulco de adubação, indicando indiretamente, dentre outros fatores, a possibilidade da ocorrência de nitrificação do N-amoniacal do fertilizante.
Em relação a N-U aplicado em cobertura, foi verificado um comportamento completamente diferente (Quadro 3). Nos estádios avaliados, houve imobilização significativa em relação a N-SA, variando de 9,8 até 6,1 kg ha-1 entre o estádio de 11–12 folhas até PMF. É provável que, neste caso, em relação ao estádio crítico de desenvolvimento da cultura, tenha ocorrido imobilização mais expressiva do N-U que em pré-semeadura. De fato, até esse estádio, houve diferença na assimilação pela planta do N-SA em relação a N-U: 44,0 e 18,8 kg ha-1, respectivamente (Quadro 4). Isto também ocorreu com o N total acumulado na planta: 143,7 e 101,4 kg ha-1, respectivamente. No solo, até esse estádio, os resultados obtidos levam a acreditar que o N-U tenha sido mais imobilizado que o N-SA, refletindo-se no N assimilado pela planta. No estádio do florescimento (Quadro 4), observou-se que não houve maior acúmulo na planta, em termos de N total e Nppf com a utilização do N-SA. Por sua vez, foram observados um ganho de N total e um aumento do N-U na planta. Isto evidencia que parte do N imobilizado da U tenha sido remineralizado e aproveitado pela cultura. Até PMF, 61,8 e 42,0 % do N aplicado, respectivamente, do N-SA e N-U foram recuperados na planta. Estes valores representam praticamente o N-assimilado pela planta até à colheita, efetuada no dia seguinte (24/03/00).
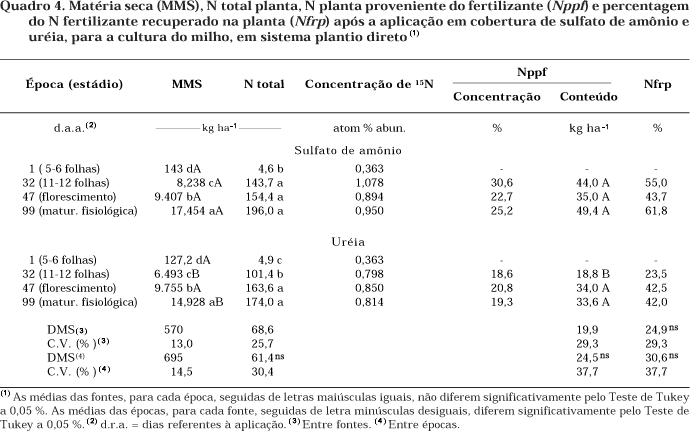
Nas figuras 2a e b, observa-se que os maiores valores de Nispf em pré-semeadura ocorreram aos 19 e 40 dias da aplicação do N-SA e N-U, respectivamente, sendo mais expressiva que o Nispf em cobertura (Figuras 3a e b). Em pré-semeadura, o Nispf estaria sendo favorável no sentido de constituir uma forma de reter o N fertilizante na camada superficial para a cultura em sucessão, se a pluviosidade não for elevada. Entretanto, na cobertura, com a pluviosidade mais intensa, estaria diminuindo o Nispf, principalmente, para o SA. Nessas figuras, cabe salientar também a coerência observada entre o N total e o N fertilizante acumulados na planta. Tanto para a adubação em pré-semeadura quanto de cobertura, houve maior acúmulo de N total na medida em que foi observada maior recuperação de N fertilizante na planta.
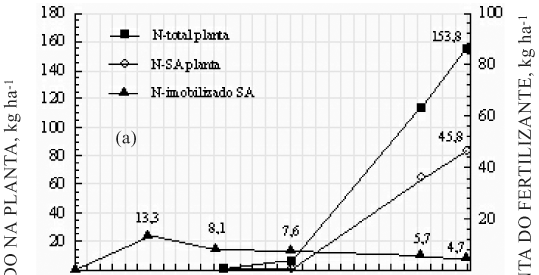

No quadro 5, mostra-se a relação Nppf /Nispf, como indicador da imobilização do N fertilizante (Nispf), nos estádios de 11 a 12 folhas e florescimento, comuns aos tratamentos de U e SA aplicados em pré-semeadura e cobertura. Com base em um hectare, o N-SA foi mais assimilado pela planta, quando aplicado em cobertura, sendo de 16,7 kg na planta por kg de N imobilizado em relação a 8,0 kg por kg de N imobilizado em pré-semeadura. Tanto em pré-semeadura quanto em cobertura, as quantidades do N-SA na planta foram superiores ao N-U por kg de N imobilizado. O N-U, por sua vez, independentemente da época de aplicação, não mostrou diferença, variando de 2,9 a 3,1 kg na planta, por kg de N imobilizado.

A produtividade do milho mostrou maior influência da fonte do que da época de aplicação (Figura 4). A aplicação do SA nas duas épocas proporcionou acréscimo médio de 847 kg ha-1 de grãos em relação à aplicação da U. A maior eficiência do N-SA (Quadros 2 e 4) e o indicador de imobilização (Quadro 5) explicam a maior produtividade do milho quando utilizado o SA em pré-semeadura e cobertura. O S presente no SA deve ter contribuído à melhor resposta pela planta. Por outro lado, não havendo diferença entre as épocas para cada fonte, sob o ponto de vista operacional (disponibilidade de maquinário para a semeadura de soja) e precipitação regular até à semeadura de milho, poder-se-ia efetuar a adubação em pré-semeadura (Sá, 1996). A imobilização do fertilizante mostrou-se, neste estudo, um processo importante na ausência de plantas (pré-semeadura), disponibilizando o N para a cultura posteriormente. No caso de chuvas intensas até à semeadura, o "turnover" do N aplicado aumentaria, com o agravante de não estar a cultura instalada, favorecendo a mineralização em relação à imobilização do N-aplicado, bem como seu posterior deslocamento fora do alcance do sistema radicular. Ainda assim, devem ser consideradas a quantidade e a qualidade do material de cobertura antecedente à cultura do milho, por ser fator determinante da intensidade da imobilização (Aoyama & Nozawa, 1993; Jensen, 1994; Zagal & Persson, 1994; MacKeeney et al., 1995; Sparling et al., 1996). Colocado desta forma, concorda-se com a seguinte frase colocada por Basso & Ceretta (2000): "No SPD, a aplicação de N em pré-semeadura do milho pode ser uma alternativa técnica, desde que o período de cultivo do milho não seja caracterizado pela ocorrência de intensas e freqüentes chuvas".
1. Na adubação em pré-semeadura do milho, no sulco de adubação, parte do N aplicado como U e SA foi imobilizada, apresentando o SA maior rapidez na ciclagem do N imobilizado-mineralizado ("turnover") e conseqüente maior assimilação pelo milho.
2. Na adubação em cobertura no milho, no sulco de adubação, somente ocorreu imobilização do N da U, retardando a sua assimilação pela planta, em relação ao N-SA.
3. Para cada kg de N fertilizante imobilizado no sulco de adubação, independentemente da época de aplicação das fontes, maior quantidade de N do SA foi recuperada pela planta entre os estádios de 11–12 folhas e florescimento.
4. Maior produtividade de grãos de milho foi obtida pela utilização do SA, independentemente da época de aplicação.
Os autores agradecem ao Convênio Embrapa-Petrobrás e à SN-Centro de Pesquisa e Divulgação do Sulfato de Amônio (Honeywell), pelo apoio financeiro recebido. Os autores fazem extensivos também os agradecimentos à Professora Dra. Denise G. de Santana, do Instituto de Ciências Agrárias (UFU), pelo auxílio nas análises estatísticas.
ANGHINONI, I. & SALET, R.L. Amostragem de solo e as recomendações de adubação e calagem no sistema plantio direto. In: NUEMBERG, N.J., ed. Conceitos e fundamentos do sistema plantio direto. Lages, Sociedade Brasileira de Ciência do Solo, Núcleo Regional Sul, 1998. p.27-52
AOYAMA, M. & NOZAWA, T. Microbial biomass nitrogen and mineralization-immobilization processes of nitrogen in soils incubated with various organic materials. Soil Sci. Plant Nutr., 39:23-32, 1993.
BARRIE, A. & PROSSER, S.J. Automated analysis of light-element stable isotopes by isotope ratio mass spectrometry. In: BOUTTON, T.W. & YAMASAKI, S., eds. Mass spectrometry of soils. New York, Marcel Dekker, 1996. p.1-46.
BASSO, C.J. & CERETTA, C.A. Manejo do nitrogênio no milho em sucessão a plantas de cobertura de solo, sob plantio direto. R. Bras. Ci. Solo, 24:905-915, 2000.
BORTOLINI, C.G.; SILVA, P.R.F. & ARGENTA, G. Sistemas consorciados de aveia preta e ervilhaca comum como cobertura de solo e seus efeitos na cultura do milho em sucessão. R. Bras. Ci. Solo, 24:897-903, 2000.
BLACKMER, A.M. & GREEN, C.J. Nitrogen turnover by sequencial immobilization and mineralization during residue decomposition in soils. Soil Sci. Soc. Am. J., 59:1052-1058, 1995.
BLEVINS, R.L.; SMITH, M. & THOMAS, G.W. Changes in soil properties under no-tillage. In: PHILLIPS, R.E. & PHILLIPS, S.H., eds. No tillage agriculture, principles and practices. New York, Reinhold, 1984. p.190-230.
CERETTA, C.A. & FRIES, M.R. Adubação nitrogenada no sistema plantio direto. In: NUERNBERG, N.J., ed. Conceitos e fundamentos do sistema plantio direto. Lages, Sociedade Brasileira de Ciência do Solo, Nucleo Regional Sul. 1998. p.111-120.
DORAN, J.W. Soil microbial and biochemical changes associated with reduced tillage. Soil Sci. Soc. Am. J., 44:765-771, 1980.
EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA - EMBRAPA. Centro Nacional de Pesquisa de Solos. Sistema Brasileiro de Classificação de Solos. Brasília, 1999. 412p.
FANCELLI, A.L. & DOURADO-NETO, D. Fenologia do milho. Inf. Agron., 78: 1-6, 1997. (Encarte Técnico)
FLOSS, E.L. Manejo de coberturas: aspectos físicos e químicos visando alta produtividade em milho. In: SEMINÁRIO SOBRE TECNOLOGIA DE PRODUÇÃO E COMERCIALIZAÇÃO DO MILHO, Passo Fundo, 2000. Resumo de Palestras. Passo Fundo, Aldeia Norte, 2000. p.39-51.
FRANCIS, D.D.; DORAN, J.W. & LOHRY, R.D. Immobilization and uptake of nitrogen to corn as starter fertilizer. Soil Sci. Soc. Am. J., 57:1023-1026, 1993.
HEINRICHS, R. & FANCELLI, A.L. Influência do cultivo consorciado de aveia preta (Avena strigosa Schieb.) e ervilhaca comum (Vicia sativa L.) na produção de fitomassa e no aporte de nitrogênio. Sci. Agric., 56:27-31, 1999.
HUNGRIA, M.; ANDRADE, D.S.; BALOTA, E.L. & COLOZZI-FILHO, A. Importância do sistema de semeadura direta na população microbiana do solo. Londrina, Empresa Brasileira de Pesquisa Agropecuária, 1997. 9p. (Comunicado Técnico, 56)
JANSSON, S.L. & PERSSON, J. Mineralization and immobilization of soil nitrogen. In: STEVENSON, F.J., ed. Nitrogen in agricultural soils. Madison, American Society of Agronomy, 1982. p.229-252 (Agronomy 22)
JENSEN, E.S. Mineralization-imobilization of nitrogen in soil amended with low C:N ratio plant residues with different particle sizes. Soil Biol. Biochem., 26:519-521, 1994.
KEENEY, D.R. & NELSON, D.W. Nitrogen - inorganic forms. In: PAGE, A.L.; MILLER, R,H. & KEENEY, D.R., eds. Methods of soil analysis. Part 2. Chemical and microbiological properties. 2.ed. Madison, American Society of Agronomy, 1982. p.687-693. (Agronomy, 9)
LIANG, B.C. & MACKENZIE, A.F. Effect of fertilization on organic and microbial biomass nitrogen using 15N under corn (Zea mays L.) in two Quebec soils. Fert. Res., 44:143-149, 1996.
McKEENEY, D.J.; WANG, S.W.; DRURY, C.F. & FINDLAY, W.I. Denitrification, imobilization, and mineralization in nitrate limited and nonlimited residue-amended soil. Soil Sci. Soc. Am. J., 59:118-124, 1995.
PAULETTI, V. A importância da palha e da atividade biológica na fertilidade do solo. In: CURSO SOBRE ASPECTOS BÁSICOS DE FERTILIDADE E MICROBIOLOGIA DO SOLO EM PLANTIO DIRETO, 3., Cruz Alta, 1999. Resumo de Palestras. Passo Fundo, Aldeia Norte, 1999. p.56-65.
PRIMAVESI, A.C.; PRIMAVESI, O. & GODOY, R. Extração de nutrientes e eficiência nutricional de cultivares de aveia, em relação ao nitrogênio e à intensidades de corte. Sci. Agric., 56:613-620, 1999.
PöTTKER, D. & WIETHöLTER, S. Épocas e métodos de aplicação de nitrogênio em milho cultivado no sistema plantio direto. Ci. Rural, 34:1015-1020, 2004.
ROS, C.O. & AITA, C. Efeito de espécies de inverno na cobertura do solo e fornecimento de nitrogênio ao milho em plantio direto. R. Bras. Ci. Solo, 20:135-140, 1996.
SÁ, J.C.M. Nitrogênio: Influência da rotação de culturas e resposta da cultura de milho em solos sob plantio direto. In: CURSO SOBRE MANEJO DO SOLO NO SISTEMA PLANTIO DIRETO, Castro, 1995. Anais. Castro, Fundação ABC para Assistência e Divulgação Técnica Agropecuária, 1995. p.212-227.
SÁ, J.C.M. Manejo de nitrogênio na cultura de milho no sistema plantio direto. Passo Fundo, Aldeia Norte, 1996. 23p.
SÁ, J.C.M. Reciclagem de nutrientes e parâmetros para recomendação de adubação das culturas em sistemas de produção sob plantio direto. In: CURSO SOBRE ASPECTOS BÁSICOS DE FERTILIDADE E MICROBIOLOGIA DO SOLO SOB PLANTIO DIRETO, 1., Rio Verde. 1998. Resumo de Palestras. Passo Fundo, Aldeia Norte, 1998. p.13-52.
SPARLING, G.P.; CHUNYA, Z. & FILLERY, I.R.P. Microbial immobilization of 15N from legume residues in soils of differing textures: measurement by persulphate oxidation and ammonia diffusion methods. Soil Biol. Biochem., 28:1707-1715, 1996.
WIETHÖLTER, S. Manejo da fertilidade do solo na cultura de milho. In: SEMINÁRIO SOBRE TECNOLOGIA DE PRODUÇÃO E COMERCIALIZAÇÃO DO MILHO. Passo Fundo, 2000. Resumo de Palestras. Passo Fundo. Aldeia Norte, 200. p.5-38.
WOLSCHICK, D.; CARLESSO, R.; PETRY, M.T. & JADOSKI, S.O. Adubação nitrogenada na cultura do milho no sistema plantio direto em ano com precipitação pluvial normal e com "El Niño". R. Bras. Ci. Solo, 2: 461-468, 2003.
ZAGAL, E. & PERSSON, J. Immobilization and remineralization of nitrate during glucose decomposition at four rates of nitrogen addition. Soil Biol. Biochem., 26:1313-1321, 1994.
Nota
1. Parte do trabalho apresentado no Iº Curso Avançado de Fertilidade e Biodinâmica no Sistema Plantio Direto, Uberlândia, setembro 2000. Financiado pelos convênios Embrapa-Petrobrás e o SN- Centro de Pesquisa e Promoção de Sulfato de Amônio Ltda.
Waldo Alejandro Ruben Lara CabezasI; Murilo Rodrigues de ArrudaII; Heitor CantarellaIII; Volnei PaulettiIV; Paulo Cesar Ocheuze TrivelinV; Jose Albertino BendassolliVI
pcotrive[arroba]cena.usp.br
IProfessor Visitante, Instituto de Ciências Agrárias, Universidade Federal de Uberlândia – UFU. Caixa Postal 593, CEP 38406-067 Uberlândia (MG). Bolsista CAPES. E-mail: waldolar[arroba]terra.com.br
IIDiscente PG-Instituto de Ciências Agrárias, UFU. E-mail: murilo[arroba]cpaa.embrapa.br
IIIPesquisador Científico da Seção de Fertilidade de Solo do Instituto Agronômico de Campinas – IAC. Caixa Postal 28, CEP 13001-970 Campinas (SP). E-mail: cantarella[arroba]iac.sp.gov.br
IVPesquisador, Área de Fertilidade de Solos, Fundação ABC. Caixa Postal 1003, CEP 84166-990 Castro (PR). E-mail: vpauletti[arroba]jundacaoabc.org.br
VProfessor Associado, Centro de Energia Nuclear na Agricultura, Universidade de São Paulo – USP. Caixa Postal 96, CEP 13400-970 Piracicaba (SP). E-mail: pcotrive[arroba]cena.usp.br
VIIProfessor do Centro de Energia Nuclear na Agricultura, USP. E-mail: jab[arroba]cena.usp.br
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|