 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Condições de armazenamento do solo
A secagem ao ar determinou aumento na velocidade de hidrólise da urease em se tratando do Latossolo Vermelho distrófico (F = 14,90**), não alterando, todavia, os resultados ao se considerar o Latossolo Vermelho Aluminoférrico (Quadro 1). Speir et al. (1980) observaram que a secagem ao ar teve pouca ou nenhuma influência sobre a atividade da urease em dois solos estudados, mas causou diminuição na atividade de um terceiro.
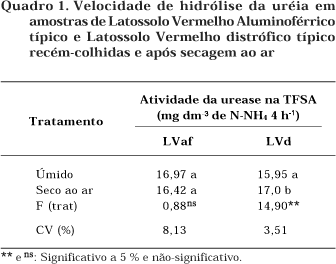
De forma geral, a secagem ao ar pode ou não alterar a hidrólise da uréia tanto de forma positiva como negativa. Cumpre observar que o método utilizado determina a atividade das exoenzimas, ou seja, aquelas que se encontram desvinculadas dos organismos vivos ou, no máximo, ligadas à parte externa da parede celular. Durante a secagem do solo, forças físicas e o próprio déficit em água determinariam a morte das células, colocando no solo novas exoenzimas, o que levaria a um aumento na atividade ureolítica.
Do exposto, pode-se concluir que o efeito da secagem ao ar sobre a hidrólise da uréia varia com o tipo de solo, sendo necessário um estudo preliminar para se optar pela secagem ao ar ou não. De forma geral, é recomendável, sempre que possível, trabalhar com amostras recém-coletadas.
Os resultados obtidos para o efeito das condições de umidade e tempo de armazenamento encontram-se apresentados na figura 1. Tanto para o Latossolo Vermelho Aluminoférrico típico quanto para o Latossolo Vermelho distrófico típico, a velocidade de hidrólise da uréia variou com o tempo e condições de armazenamento.
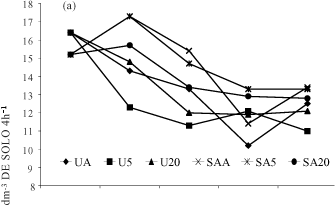

No caso do Latossolo Vermelho Aluminoférrico típico, a velocidade de hidrólise da uréia caiu até o 28º dia de armazenamento, para os seis tratamentos ensaiados (CV = 10,28 %), sendo o tratamento AS5 o único em que a atividade aos 28 dias não diferiu do início (Figura 1a). As amostras de Latossolo Vermelho distrófico típico (CV = 5,79 %) tiveram um comportamento diferenciado, ocorrendo do início até o 14º dia de armazenamento uma tendência de diminuição na velocidade de hidrólise da uréia em praticamente todos os tratamentos (exceto SA5). Depois, houve uma tendência de aumento, sendo mais acentuado nos tratamentos em que as amostras foram secas ao ar (Figura 1b).
A análise dos dados revelou que o tipo de solo influencia a possibilidade de armazenamento das amostras de terra para a determinação da atividade da urease. No caso, o Latossolo Vermelho distrófico típico evidenciou uma urease mais susceptível a perdas de atividade, o que pode ser atribuído ao fato de, provavelmente, o solo apresentar menor teor de argila e de matéria orgânica, os quais são responsáveis pela complexação da enzima e pela manutenção de sua atividade.
De modo geral, quando as amostras de solo foram armazenadas após a secagem ao ar e mantidas em temperatura ambiente ou a 5 ºC, tolerou-se um armazenamento por 7 dias, sem que a atividade da urease se modificasse de modo significativo.
Tempo de incubação
Analisando a figura 2, verificou-se que a produção de N-H(NH4) aumentou de modo significativo de uma a oito horas de incubação, para os dois solos estudados, fato que pode ser verificado, multiplicando-se o valor da atividade enzimática pelo número de horas de incubação. Considerando a velocidade de hidrólise da uréia, observou-se uma nítida tendência de diminuição nos diferentes tempos de incubação dos solos estudados.

No caso do Latossolo Vermelho Aluminoférrico típico, a queda da velocidade ocorreu do tempo 1 para o 8, e, após 8 horas de incubação, houve perda de, aproximadamente, 30 % na velocidade, comparada ao tempo de incubação de 1 h. Assim sendo, 4 h de incubação, utilizadas no método de May & Douglas (1976), acarretaram uma perda de atividade em torno de 18 %.
No Latossolo Vermelho distrófico típico, verificou-se que, nas primeiras 3 h, a queda na velocidade foi mais acentuada, estabilizando-se a partir de então. Nas primeiras 4 h, a queda na atividade já tinha atingido praticamente os 33 % observados após 8 h de incubação.
Portanto, quando se pretende ter uma idéia mais próxima possível da velocidade da hidrólise da uréia no solo ou comparar solos diferentes, é preciso tomar cuidado com o tempo de incubação, aconselhando-se tomar o menor tempo possível que permita detectar a produção de N-NH4+. Para determinações da velocidade da hidrólise da uréia nos solos estudados, sugere-se utilizar um período de uma hora de incubação.
Temperatura de incubação
Analisando o efeito da temperatura de incubação, observou-se que, tanto para o Latossolo Vermelho Aluminoférrico típico quanto para o Latossolo Vermelho distrófico típico, a velocidade de hidrólise da uréia aumentou significativamente dos 5 aos 50 ºC (Figura 3). Zantua & Bremner (1977) observaram que a atividade da urease aumentou significativamente com um aumento de temperatura de 40 a 70 ºC, mas houve um decréscimo rápido de 70–80 ºC.
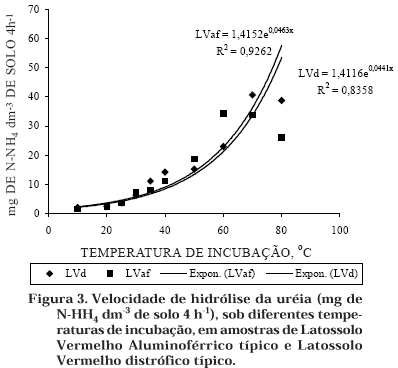
Para ambos, os aumentos iniciais de temperatura levaram a um aumento na velocidade de hidrólise, até um ponto em que novos aumentos passaram a ter efeitos negativos. Para o Latossolo Vermelho Aluminoférrico típico, a máxima velocidade foi obtida com a temperatura de 60 ºC, enquanto, para o Latossolo Vermelho distrófico típico, isto ocorreu a uma temperatura de 50 ºC. A 25 ºC, temperatura média do solo a 10 cm de profundidade, no município de Jaboticabal (Melo, 1974), a atividade da urease representou 14,4 % da atividade a 60 ºC. A 37 ºC, temperatura sugerida por May & Douglas (1976), a atividade obtida representou 35 % da atividade máxima (60 ºC).
Como o interessante é avaliar o papel que a urease desempenha no ciclo do nitrogênio, é importante que o ensaio seja realizado na temperatura do solo, não obstante isso possa representar apenas uma percentagem da atividade máxima possível. Indica-se, assim, para as condições apresentadas, o uso da temperatura de incubação de 30 ºC.
pH
A velocidade de hidrólise da uréia (Figura 4), tanto para as amostras de LVaf como para as de LVd, aumentou significativamente do pH 2,2 até o pH 8,0 (F = 74,5** e 35,5**, respectivamente). Em pH 5,2, próximo ao observado em grande número de solos tropicais, a atividade da urease situou-se na faixa de 42–44 % da atividade máxima encontrada (pH 8,0).
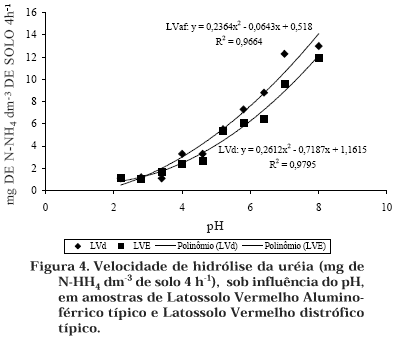
Embora vários estudos sobre os efeitos de diferentes pH sobre a atividade da urease tenham sido realizados, os resultados observados foram muito divergentes. Pettit et al. (1976) encontraram, como pH ótimo, valores variando de 6,5 a 7,0, enquanto Tabatabai & Bremner (1972) e May & Douglas (1976) encontraram valores de 8,8 a 9,0. Essas divergências podem ser atribuídas a diferenças nos tampões, tipo de solo e concentração de uréia usada no ensaio.
Assim, para avaliar a participação da urease no ciclo do nitrogênio do solo, é preciso que o pH do meio de incubação esteja próximo ao do pH do solo. Portanto, sugere-se que a incubação das amostras de terra seja feita sem a alteração do pH, ou seja, sem o uso de uma solução tampão.
Concentração do substrato
Os resultados obtidos para a velocidade de hidrólise, sob diferentes concentrações de uréia (0,039–5,0 g L-1) encontram-se na figura 5, apresentando comportamento diferenciado para os dois solos estudados. Para o LVaf, a velocidade máxima obtida foi de 10,42 mg dm-3 de N-NH4+ g 4 h-1. Nessa condição, uma concentração de uréia de 3,3 g L-1 foi suficiente para a saturação dos sítios ativos da enzima e obtenção da velocidade máxima inicial. No caso do LVd, a velocidade máxima foi de 14,8 mg dm-3 de N-NH4+ g 4 h-1, de tal modo que uma concentração de uréia de 2,5 g L-1 foi suficiente para a saturação dos sítios da enzima.
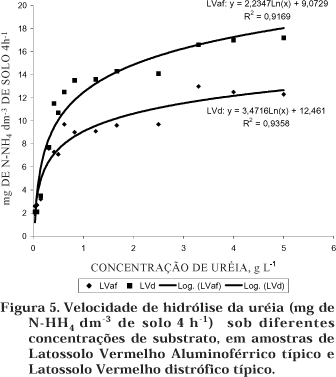
Estudos sobre a concentração de uréia em testes de atividade da urease mostraram que a velocidade de hidrólise é aumentada com o acréscimo na concentração do substrato até atingir uma quantidade de uréia adicionada suficiente para saturar a enzima (Zantua & Bremner, 1977). Os resultados obtidos por Santos et al. (1991) mostraram também comportamento diferenciado entre os solos, tendo o Latossolo Roxo sob vegetação de mata apresentado maior velocidade de hidrólise, enquanto o Latossolo Roxo sob o cultivo de pinus e o Latossolo Vermelho-Amarelo apresentaram as menores.
1. As melhores condições de armazenamento das amostras de solo utilizadas na determinação da velocidade de hidrólise da uréia ocorreram em temperatura ambiente ou 5 ºC, após secagem ao ar, por um período de até 7 dias.
2. Para as condições estudadas, o melhor tempo de incubação foi de uma hora a 25–30 ºC, sem a utilização de tampão para acertar o pH.
3. A concentração de uréia suficiente para soterrar os sítios da enzima foi de 3,30 g L-1, para o Latossolo Vermelho Aluminoférrico típico, e de 2,5 g L-1, para o Latossolo Vermelho distrófico típico.
ARUNACHALAN, A. & MELKANIA, N.P. Influence of soil properties on microbial populations, activity and biomass in humid subtropical mountains ecosystems of India. Soil Bio. Biochem., 30:217-223, 1999.
BENINI, S.; RYPNIEWSKI, W.R.; WILSON, K.S.; MILLETI, S.; CIURLI, S. & MORGANI, S. A new proposal for urease mechanism based on the crystal structures of native and inhibited enzyme from Bassillus pasteurii: why urea hydrolysis costs two nickels. Struct. Fold. Design, 7:205-216, 1999.
BREMNER, J.M. & KEENEY, D.R. Steam distillation methods for determination of ammonium, nitrate and nitriti. Anal. Chim. Acta, 32:485-495, 1965.
BREMNER, J.M. & MULVANEY, R.L. Urease activity in soil. In: Soil enzymes. 1978. p.149.
CONRAD, J.P. Catalytic activity causing the hydrolysis of urea in soil as influenced by several agronomic factors. Soil Sci. Soc. Am. Proc., 5:238-241, 1940a.
CONRAD, J.P. The nature of the catalyst causing the hydrolysis of urea in soils. Soil Sci., 50:119-134, 1940b.
CONRAD, J.P. The occurrence and origin of urease like activities in soil. Soil Sci., 54:357-380, 1942a.
CONRAD, J.P. Enzymatic vs. microbial concepts of urea hydrolysis in soils. J. Agron., 34:1102-1113, 1942b.
CONRAD, J.P. Some effects of developing alkalinities and other factors upon urease like in soils. Soil Sci. Am. Proc., 5:171-174, 1943.
DALAL, R.C. Urease activity in some Trindad soils. Soil Biol. Biochem., 7:5-8, 1975.
DOUGLAS, L.A. & BREMNER, J.M. A rapid method of evaluating different compounds as inhibitors of urease activity in soils. Soil Biol. Biochem., 3:309-315, 1971.
EMPRESA BRASILEIRA DE PESQUISA AGROPECUÁRIA - EMBRAPA. Centro Nacional de Pesquisa de Solos, Rio de Janeiro. Sistema Brasileiro de Classificação de Solos. Brasília, Embrapa produção de Informação; Rio de Janeiro: Embrapa Solos, 1999. 412p.
GOULD, W.D.; COOK, F.D. & WEBSTER, R.G. Factors affecting urea hydrolysis in several Alberta soils. Plant Soil, 38:393-401, 1973.
KLOSE, S. & TABATABAI, M.A. Urease activity of microbial biomassa in soils. Soil Biol. Biochem., 31:205-211, 1999.
LONGO, R.M.; MELO, W.J.; PAVAN, S.A.; CHELLI, R.A. & LEITE, S.A.S. Efeito da secagem, tempo e condições de armazenamento, concentração de uréia, temperatura, pH e tempo de incubação na atividade da urease em dois solos do Estado de São Paulo. In: CONGRESSO BRASILEIRO DE CIÊNCIA DO SOLO, 13., Porto Alegre, 1991. Porto Alegre, Sociedade Brasileira de Ciência do Solo, 1991. p.206.
MARGESIN, R.; ZIMMERBAUER, A. & SCHINNER, F. Monitoring of bioremediation by soil biological activities. Chemospere, 40:339-346, 2000.
MAY, P.B. & DOUGLAS, L.A. Assay for soil urease activity. Plant Soil, 45:301-305, 1976.
MELO, W.J. Variação do N-amoniacal e N-nitrico em um Latossolo Roxo cultivado com milho (Zea mays L.) e com Lablab (Dolichos lablab), Piracicaba, Escola Superior de Agricultura "Luiz de Queiroz", 1974. 104p. (Tese de Doutorado)
PETTIT, N.M.; SNITH, A.R.J.; FREEDMAN, R.B. & BURNS, R.G. Urease: activity, stability and kinetic properties. Soil Biol. Biochem., 8:479-484, 1976.
ROTINI,O. T. La transformazions enzimatica dell-urea nell terreno. Ann. Labor. Ric. Ferm., 3:134-154, 1935.
SANTOS, A.R.; VALE, F.R. & SANTOS, J.A.G. Avaliação de parâmetros cinéticos da hidrólise da uréia em solos do sul de Minas Gerais. R. Bras. Ci. Solo, 15:309-313, 1991.
SILVA, T.; MELO, W.J.; TEIXEIRA, S.T.; LEITE, S.A.S. & CHELI, R.A. Efeito do lodo de esgoto contaminado com doses crescente de crômio sobre a atividade enzimática do solo. In: CONGRESSO BRASILEIRO DE CIÊNCIA DO SOLO, 15., Viçosa, 1995. Anais. Viçosa, Sociedade Brasileira de Ciência do Solo, 1995. p.2325-2330.
SPEIR T.W.; LEE, R.; PANSIER, E.A. & CAIRNS, A. A comparation of sulfhatase, urease and protease actives in planted and in follow soils. Soil Biol. Biochem., 12:281-291, 1980.
TABATABAI, M.A. & BREMNER, J.M. Assay of urease activity in soils. Soil Biol. Biochem., 5:479-487, 1972.
TAYLOR, J.P.; WILSON, B.; MILLS, M.S. & BURNS, R.G. Comparison of microbial numbers and enzymatic activities in surface soils and sub soils using various techniques. Soil Biol. Biochem., 34:387-401, 2002.
ZANTUA, M.I. & BREMNER, J.M. Stability of urease in soils. Soil Biol. Biochem., 9:135-140, 1977.
Regina Marcia LongoI; Wanderley José de MeloII
wjmelo[arroba]fcav.unesp.br
IEngenheira-Agrônoma e Doutora em Engenharia de Água e Solo pela Universidade de Campinas – UNICAMP. Estrada da Rhodia, 5555, cs 91, Barão Geraldo, CEP 13085-850 Campinas (SP). Email: rmlongo[arroba]uol.com.br
IIProfessor Titular do Departamento de Tecnologia, Universidade Estadual Paulista – UNESP/Jaboticabal. Via de Acesso Prof. Paulo Donato Castellane s/n, CEP 14884-900 Jaboticabal (SP). Email: wjmelo[arroba]fcav.unesp.br
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|