 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
No Laboratório de Patologia de Insetos do Centro Nacional de Pesquisa de Arroz e Feijão (CNPAF), da EMBRAPA, foram feitos estudos com três isolados de Z. radicans no tocante à habilidade de infecção sobre ninfas do 5º ínstar de E. kraemeri, obtidas de criação em laboratório. As observações foram feitas no dorso do inseto, separadamente, nas regiões da cabeça, tórax e abdome, tendo sido considerado como infecção a formação de apressórios com grampo de penetração ou crescimento de hifa no hemocele hospedeiro.
Os isolados do fungo utilizados foram o ARS-1590 e o ARS-1229, originados de Empoasca sp., respectivamente dos Estados de Goiás e Santa Catarina, no Brasil, bem como o ARS-1261, originado de E. fabae do Estado de Wisconsin, nos Estados Unidos, os quais foram fornecidos pelo laboratório de Patologia de Insetos do Instituto Boyce Thompson em Ithaca, EUA. Esses foram produzidos na superfície de meio de cultura líquido à base de dextrose (1%) e extrato de levedura (1%) e utilizados na forma de micélio fresco. Para a instalação do experimento, o fungo foi previamente filtrado, pulverizado com maltose a 10% e transferidos para uma câmara úmida formada dentro de uma placa de Petri, contendo papel de filtro umedecido com a mesma solução. Em seguida, a placa de Petri contendo o micélio fresco do patógeno foi acondicionada dentro de geladeira e mantida por aproximadamente 15 horas, visando estimular a conidiogênese.
As inoculações do fungo foram efetuadas mediante a utilização de pequenas gaiolas. Cada gaiola era constituída de uma placa de plástico de 4,0cm de diâmetro e de fundo aberto, contendo apenas um segmento de 0,5cm de largura, ligando as duas extremidades laterais opostas. A placa foi colocada sobre a face inferior de uma folha de caupi, que por sua vez foi estendida com a face superior sobre uma chapa de acrílico (15,5 x 10cm). O conjunto foi fixado com um parafuso ligando o segmento do fundo da placa com a chapa de acrílico. Na parte de dentro da tampa da gaiola foi colocada uma camada de ágar-água com antibiótico. Para a inoculação dos insetos, pequenos círculos de micélio fresco foram distribuídos sobre a camada de ágar-água da tampa, e acondicionados dentro de uma câmara úmida (saco plástico contendo papel toalha umedecido), no interior de uma incubadora regulada a 20 ± 0,5°C, onde foram mantidos por mais quatro horas visando aumentar a conidiogenese do fungo.
Em seguida, as gaiolas e as superfícies expostas das folhas foram umedecidas com uma fina névoa de água destilada, para simular o orvalho natural. Os insetos foram anestesiados com CO2 e colocados na superfície úmida da folha em cada gaiola. As tampas das gaiolas, contendo o fungo em conidiogênese, foram colocadas sobre os insetos e mantidas por aproximadamente cinco minutos (período de duração da anestesia), expondo-os à "chuva" de conídios. Durante cada período de exposição, as tampas contendo o fungo eram constantemente giradas para assegurar uma distribuição uniforme dos conídios.
Após cada inoculação, a tampa com o fungo era removida e substituída por outra limpa. As gaiolas contendo os insetos inoculados foram, então, colocadas dentro de sacos plásticos contendo umidade saturada (produzida através de papel toalha umedecido), e mantidas no escuro a 20 ± 0,5°C. Os estudos foram feitos sobre os insetos, após duas, seis e doze horas da inoculação. No primeiro horário, foram utilizados dez, doze e oito insetos para os isolados ARS-1590, ARS-1261 e ARS-1229, enquanto que, no segundo, foram utilizados 13, 16 e 10 insetos, respectivamente, e, no terceiro, 20, 22 e 20 insetos, respectivamente. Os insetos foram coletados de dentro das gaiolas de inoculação, sendo um deles utilizado para as observações mais imediatas e os demais acondicionados em geladeira, para que o fungo inoculado fosse inativado e pudesse em seguida ser observado.
As observações foram feitas com uma objetiva de 400 x em um microscópio óptico com contraste de fase e fluorescência, tendo sido utilizado um excitador Schott BG-12 (350-490nm), um refletor Dichroic (500mm) e uma barreira Schott 06 515 (525nm). Os insetos foram colocados sobre uma gota de Calcofluor White (Sigma) a 0,5% (W/V) depositada sobre uma lâmina e cobertos, sem serem pressionados, por uma lamínula de vidro.
A formação de apressórios de Z. radicans sobre o inseto iniciou-se dentro do período de duas horas após a inoculação do hospedeiro (Tabela 1), sendo geradas no abdome por 1,2 e 5,1% do inóculo dos isolados ARS-1590 e ARS-1261, respectivamente. As penetrações começaram a ocorrer dentro do período de seis horas após a inoculação, sendo resultantes de 7,3 e 8,3% dos inóculos do ARS-1590 e ARS-1261 no abdome, e de 2,4 e 2,2% dos respectivos inóculos no tórax. Apenas 1,9% do inóculo do isolado ARS-1229 resultou na formação de apressório e no processo de penetração no abdome do inseto. Estudos desenvolvidos por WRAIGHT et al. (1990) mostraram que o fungo inicia a infecção em E. fabae após três a quatro horas da inoculação.
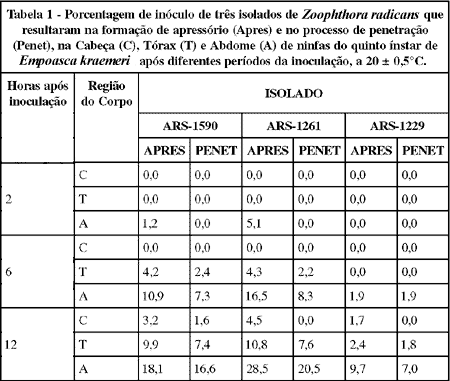
Decorridos doze horas da inoculação, as penetrações foram resultantes de até 16,6, 20,5 e 7,0% dos inóculos no abdome, respectivamente dos isolados ARS-1590, ARS-1261 e ARS-1229. As porcentagens de inóculo resultantes em penetrações, para os isolados ARS-1590 e ARS-1261, podem ser consideradas altas em relação à porcentagem observada por BREY et al. (1986), para o fungo Conidiobolus obscurus Brefeld (1884) sobre A. pisum. Segundo este autor, menos de 10% dos conídios germinados deste fungo resultaram em penetração.
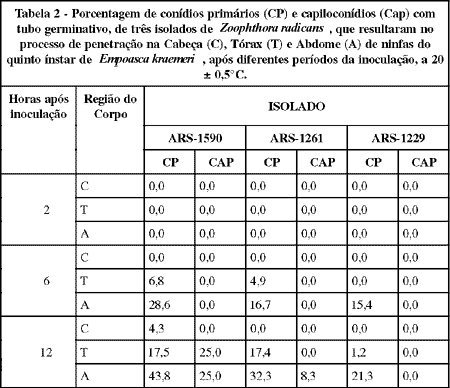
A proporção do inóculo com tubo germinativo, que resultou em penetração (Tabela 2), foi maior para o ARS-1590, sendo resultantes, doze horas da inoculação, de até 43,8, 17,5 e 4,3% dos conídios primários com esta forma, no abdome, tórax e cabeça, respectivamente, e de 25% dos capiloconídios tanto no abdome como no tórax. Esse isolado foi o único que penetrou na cabeça, região muito esclerotizada do corpo do inseto. Segundo TOMIYAMA & AOKI (1982), a cápsula cefálica de larvas de insetos é bastante resistente à penetração de fungos entomopatogênicos, mesmo aqueles com conídios de elevado potencial metabólico.
O abdome do inseto foi a região mais preferida para a penetração do fungo (Tabela 3) com 71,7, 72,1 e 81,3% das penetrações, provocadas respectivamente pelos isolados ARS-1590, ARS-1261 e ARS-1229 no corpo do hospedeiro, seguido do tórax, com 26,1, 27,9 e 18,8%, respectivamente, e da cabeça, com apenas 2,2% das penetrações provocadas pelo isolado ARS-1590. WRAIGHT et al. (1990) obtiveram resultados semelhantes utilizando E. fabae como hospedeiro. Estudos tem mostrado que Entomophthora muscae (C.) Fres.e C. obscurus também penetram com maior frequência através do abdome do hospedeiro (BROBYN & WILDING, 1983; BREY et al., 1986). No entanto, Entomophthora planchoniana Cornu não apresentou preferência de região para penetrar em afídeo (BROBYN & WILDING, 1977).
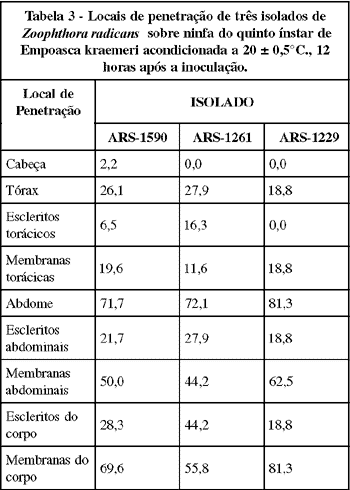
As membranas do inseto foram os locais mais preferidos na penetração do patógeno, com 69,6, 55,8 e 81,3% dos totais de penetrações no corpo, provocados pelos isolados ARS-1590, ARS-1261 e ARS-1229, respectivamente, seguidos dos escleritos, com 28,3, 44,2 e 18,8% dos totais de penetrações provocadas pelos respectivos isolados. O fato do isolado ARS-1261, dentre os três isolados, ter apresentado as maiores porcentagens de penetração no esclerito do inseto demonstra haver uma tendência do mesmo apresentar a menor mobilidade para a localização de membranas. MAGALHÃES et al. (1990) induziram a produção de apressório deste fungo "in vitro", quando inocularam conídios primários em ágar-água, cobrindo-os com caldo nutritivo seguido de uma lâmina de vidro. Este fato indica que estímulos físicos e químicos são importantes fatores para a produção de apressório.
Os apressórios observados foram, na maioria, do tipo alongado (Tabela 4), tendo esta forma representado 82,7, 71,0 e 87,0% dos apressórios produzidos pelos isolados ARS-1590, ARS-1261 e ARS-1229, respectivamente. O tipo globular foi a segunda forma mais produzida, representando 15,4, 25,8 e 13,0% dos apressórios produzidos pelo ARS-1590, ARS-1261 e ARS-1229, respectivamente, enquanto que o tipo bulbo representou baixa porcentagem dos apressórios, ou seja, 1,9 e 3,2% daqueles produzidos pelos dois primeiros isolados, respectivamente. Segundo WRAIGHT et al. (1990), a produção de apressório no final de longas hifas representa um mecanismo apropriado quanto a seleção de pontos específicos para a penetração na cutícula do hospedeiro.
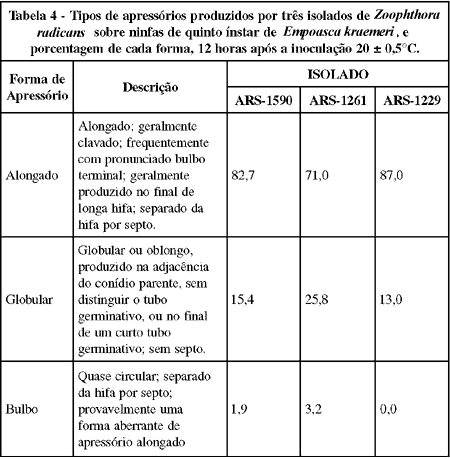
Poucas espécies de fungos Entomophthorales são conhecidas como geradoras de apressórios. As espécies conhecidas inclui N. fresenii (BROBYN & WILDING, 1977) e Entomophaga aulicae (MURRIN & NOLAN, 1987). HYWEL-JONES & WEBSTER (1986) também constataram a formação de apressórios por E. conica. No entanto, BROBYN & WILDING (1977) não constataram a formação de apressório para a espécie Pandora neoaphidis, nem TOMIYAMA & AOKI (1982) para P. blunckii.
A porcentagem de insetos com apressório (Tabela 5) atingiu, duas horas após a inoculação, 10% para aqueles inoculados com o isolado ARS-1590, na dose de 22 conídios por inseto, e 16,7% para os inoculados com o ARS-1261, na dose de 8,3 conídios por inseto.As penetrações do fungo no inseto, embora possam ser resultantes de baixa porcentagem dos inóculos seis horas após a inoculação, abrangeram 69,2% dos insetos inoculados com o ARS-1590, 50% com o ARS-1261 e 10% com o ARS-1229, nas doses de 38,2; 20,0 e 23,0 conídios por inseto, respectivamente. YENDOL & PASCHKE(1965) citaram que Entomophthora spp. penetrou no térmita Reticulitermes flavipes dentro do período de 24 horas após a inoculação. Já C. obscurus penetrou na lagarta Porthetria (=Lymantria) dispar L. somente 22 horas da inoculação (HARTMANN & WASTI, 1974). Por outro lado, a penetração de Erynia blunckii na lagarta Plutella xylostella ocorreu dentro do período de 18 horas após a inoculação (TOMIYAMA & AOKi, 1982). Segundo ALVES (1986), Beauveria bassiana (Bals.) Vuill e Nomurae rileyi (Farlow) Sanson levam cerca de 24 horas após a inoculação para penetrar na cutícula do hospedeiro.
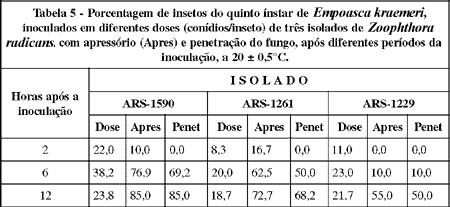
Assim, a ação de Z. radicans para provocar a penetração no hospedeiro é bastante rápida, em relação a de outras espécies de Entomophthorales e Deuteromycota, o que contribui para que o patógeno seja agressivo e provoque elevados níveis de infecção, mesmo em períodos quando as condições favoráveis de umidade limitam-se apenas aos períodos de orvalho durante as noites.
Doze horas após a inoculação, as penetrações abrangeram 85% dos insetos inoculados com o ARS-1590, 68,2% com o ARS-1261 e 50% com o ARS-1229, nas doses de 23,8; 18,7 e 21,7 conídios por inseto, respectivamente. Considerando-se que as doses utilizadas no último tempo foram semelhantes, pode-se afirmar que o isolado ARS-1590 foi o mais patogênico, seguido do ARS-1261 e do ARS-1229. Como mostrado na Tabela 1, a maior patogenicidade do ARS-1590 em relação ao ARS-1261 deveu-se a maior taxa de penetração resultante dos conídios primários e capiloconídios com tubo germinativo. A baixa patogenicidade do isolado ARS-1229 deveu-se, principalmente, à baixa viabilidade do inóculo (observação complementar) e ao baixo poder de penetração resultante dos conídios primários e capiloconídios com tubo germinativo. LATGÉ et al. (1982) verificaram que a patogenicidade de isolados de C. obscurus sobre A. pisum correlacionou-se diretamente com a viabilidade dos mesmos sobre o hospedeiro e produção de tubos germinativos pelos conídios primários germinados.
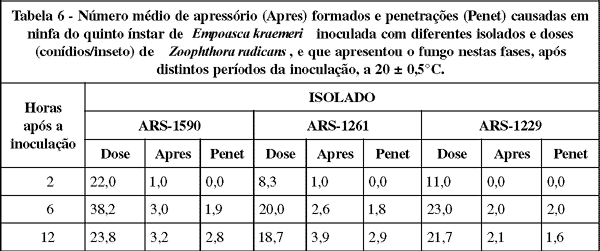
Nos insetos com apressórios do fungo (Tabela 6) foi encontrado uma média de 1,0 apressório por exemplar, duas horas após a inoculação com os isolados ARS-1590 e ARS-1261. Seis horas após, foram encontrados 3,0, 2,6 e 2,0 apressórios por inseto, para os isolados ARS-1590, ARS-1261 e ARS-1229, respectivamente. Nesse mesmo período, a média de penetração por inseto com o fungo nessa fase foi de 1,9 e 1,8 e 2,0 para os isolados ARS-1590, ARS-1261 e ARS-1229, respectivamente, enquanto que 12 horas após foi de 2,8, 2,9 e 1,6, respectivamente. WRAIGHT et al. (1990) verificaram que as porcentagens de conídios com tubo germinativo deste fungo, que resultaram em penetrações no inseto E. fabae, foram de 2,5, 5,0 e 20,0% nos tempos de seis, doze e quarenta e oito horas após a inoculação.
1) A formação de apressório e penetração dos isolados iniciaram dentro do período de seis horas após a inoculação.
2) As penetrações dos isolados ocorreram em maior proporção no abdome, seguido do tórax e cabeça do inseto, tendo sido mais frequente nas membranas do corpo do que nos escleritos.
Ao convênio EMBRAPA/CNPAF-BOYCE THOMPSON INSTITUTE pelo apoio para realização dessa pesquisa.
L. G. Leite1; S. B. Alves2; S. P. Wraight3; S. Galaini-Wraight4; D. W. Roberts4
sebalves[arroba]esalq.usp.br
1. Seção de Controle Biológico das Pragas-IB, C.P. 70, CEP: 13001-970, Campinas, SP.
2. Departamento de Entomologia-ESALQ/USP, C.P. 9, CEP: 13400, Piracicaba, SP.
3. Plant, Soil & Nutritions Lab.-USDA, ARS/US , Ithaca, New York, 14853, USA.
4. Boyce Thompson Institute, Insect Pathology Resource Center, Tower Rd. Ithaca, New York, 14853, USA.
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|