 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Preparo da formulação
A formulação preparada foi do tipo spray on, que segundo Batista Filho et al. (1998) é uma das mais simples para ser elaborada e envolve equipamentos de baixo custo.
O mosto fermentado foi concentrado através de uma centrífuga refrigerada Sorvall-RT 6000, a 6000 rpm, durante 20 minutos e, em seguida, encaminhado ao Centro Piloto de Formulações do Instituto Biológico de São Paulo, a fim de que fosse submetido ao processo específico para o tipo citado.
O inerte, constituído por sabugo de milho, foi previamente moído em moinho de martelo, selecionado e padronizado quanto ao tamanho das partículas em peneira vibratória (6 mesh). A biomassa de B. sphaericus foi suspendida em água destilada, na proporção suficiente para o preparo da formulação, sendo em seguida incorporada aos grânulos, juntamente com um adjuvante, utilizando-se um impregnador. Após a impregnação, procedeu-se a secagem em estufa ventilada até que se atingisse a umidade abaixo de 5%, conforme as recomendações da Associação Brasileira de Normas Técnicas.
Os grânulos, após o preparo foram observados em microscópio estereoscópico sob aumento de 20 e 40 vezes e fotografados, com a finalidade de conhecer em maior detalhe a superfície dos mesmos, visando estabelecer alguma relação com os parâmetros analisados.
Armazenamento em condições ambiente
Amostras de 3 g da formulação granulada e 3 mL do caldo fermentado foram acondicionados, respectivamente, em sacos plásticos de polietileno e frascos de vidro, hermeticamente fechados. Foi também preparado um lote com água destilada estéril, considerado testemunha. O material foi mantido durante 12 meses em um armário de madeira, na ausência da luz. As condições internas foram monitoradas, colocando-se, mensalmente, um termohigrógrafo durante uma semana, junto aos recipientes. As avaliações foram feitas após o preparo e aos 7, 15 e 30 dias e, a partir de então, mensalmente, durante um ano (período mínimo). Para isso, foram retiradas três amostras de cada tratamento, sendo cada uma delas destinadas a uma repetição, e foram determinados o número de esporos viáveis e a atividade larvicida.
a) Viabilidade de esporos
De cada uma das três amostras (repetições) dos diferentes tratamentos, foram retiradas 0,1 g da formulação granulada e 0,1 mL do caldo fermentado e da testemunha. Cada uma das amostras foi adicionada a 9,9 mL de água destilada + espalhante adesivo (Tween 20) 0,1% (denominadas de suspensão estoque). Após serem submetidas ao choque térmico em banho-maria regulado para 80°C por 12 minutos (para que fossem eliminados eventuais microrganismos contaminantes), ultra-som por 10 minutos e agitação durante 2 minutos, foram preparadas diluições seriadas de 10-1 a 10-8 a partir da suspensão estoque. Destas, foram retiradas alíquotas de 5 mL que foram inoculados em oito pontos distintos na superfície do meio ágar nutriente e extrato de levedura (ANY) + sulfato de estreptomicina 0,1%, em placas de Petri, sendo preparadas 2 placas para cada diluição. As placas permaneceram incubadas a 30°C, durante 24 horas, determinando-se, em seguida, o número de colônias (UFC) por ponto de inoculação, usando-se um contador de colônias.
Utilizou-se o delineamento inteiramente casualizado e fatorial, sendo as médias e a interação dos tratamentos x épocas submetidos à análise de variância (teste F) e comparação entre médias pelo teste de Tukey com 5% de significância, usando-se o programa estatístico Sanest.
b) Atividade larvicida
Previamente ao início dos experimentos, foi estimada para a formulação e para o caldo fermentado, a concentração letal próxima de 90% para larvas de Culex quinquefasciatus. Esta foi denominada concentração indicativa, sendo os valores obtidos nas avaliações subsequentes comparados com o valor inicial, visando acompanhar a estabilidade das amostras ao longo do tempo.
Foram preparadas cinco diluições a partir da suspensão-estoque e cada uma delas foi considerada um tratamento. Alíquotas de 1 mL destas foram aplicadas em copos plásticos de 200 mL de capacidade, contendo 100 mL de água destilada e 20 larvas de 3o ínstar de C. quinquefasciatus, provenientes de criação de laboratório, com três repetições para cada tratamento, perfazendo 60 larvas por diluição. As larvas foram alimentadas com ração para ratos, e mantidas a 26°C, 12 horas de fotofase e observadas após 24 e 48 horas, retirando-se os indivíduos mortos com um pincel. A análise dos dados foi a mesma adotada e descrita no item a.
Foram realizados experimentos em casa-de-vegetação, utilizando-se como ambiente de experimentação, baldes plásticos contendo 10 litros de água destilada. Nestes foram aplicadas amostras das preparações armazenadas, na concentração proporcional a de campo (2 kg ou L ha-1), juntamente com 20 larvas de 3o ínstar de C. quinquefasciatus, provenientes da criação de laboratório, sendo preparados três baldes para cada um dos produtos e também para a testemunha. Os dados foram analisados segundo os mesmos procedimentos do item anterior.
A avaliação da mortalidade foi realizada após 24 e 48 horas da inoculação, contando-se o número de insetos mortos.
Armazenamento em temperatura elevada
Foram adotados os mesmos procedimentos do experimento para condições ambiente, porém, as preparações foram armazenadas em estufa regulada para 50°C e em armário protegido da luz (condição ambiente). As avaliações foram realizadas logo após o preparo e aos 7, 15, 30 e 60 dias de armazenamento. Nestas, tanto a viabilidade dos esporos como a atividade larvicida foram avaliadas e os dados obtidos foram analisados seguindo os mesmos critérios descritos no item anterior.
Armazenamento em condições ambiente
O efeito da formulação sobre a viabilidade dos esporos pode ser evidenciado na primeira avaliação após o armazenamento (7 dias). Houve redução de cerca de 65% no número de UFC na formulação, enquanto que para o patógeno não formulado a redução foi de 93% (TABELA 1).
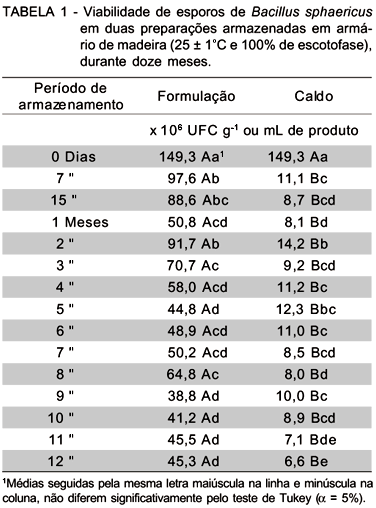
Ao longo do período de armazenamento ocorreram oscilações na concentração de UFC nas amostras, com valores maiores e menores se alternando, principalmente a partir do segundo mês de avaliação. Por outro lado, na formulação a redução foi relativamente gradativa, com exceções de valores mais elevados no 2o, 3o e 8o meses ou menores nos 1o e 5o meses que ocorreram fora da tendência esperada e que se diferenciaram significativamente entre si, provavelmente em decorrência de problemas experimentais.
A manutenção da viabilidade de esporos de bactérias do gênero Bacillus sp. foi também discutida por Couch & Ignoffo (1981) e, segundo os autores, a baixa umidade é essencial para a preservação do patógeno, pois esta pode, quando elevada, favorecer à germinação dos esporos ou ainda permitir o crescimento de microrganismos contaminantes, que contribuem para a redução do número de UFC viáveis no produto.
A ausência de informações na literatura sobre o efeito do período de armazenamento, na viabilidade de esporos de Bacillus sp. dificultam a análise pormenorizada dos resultados obtidos, havendo, contudo, alguns trabalhos realizados, visando-se determinar os efeitos da temperatura elevada sobre o patógeno e que serão posteriormente.
Apesar da redução em cerca de 70% na concentração de esporos no material formulado, este parâmetro permanece com valores elevados ao final do experimento, com cerca de 7 vezes mais esporos viáveis que no caldo não formulado.
Por meio da análise da eficiência dos produtos armazenados, verificou-se não haver diferença significativa para o caldo ao longo do período de armazenamento, embora tenham ocorrido reduções significativas em cerca de 37 e 23%, respectivamente aos 6 e 7 meses de armazenamento (TABELA 2). Por outro lado, a eficiência da formulação, de forma diferente foi reduzida com o armazenamento de 12 meses no ambiente, em 35% do valor original, sendo ainda 29% menos ativa que o caldo concentrado no mesmo período de avaliação.
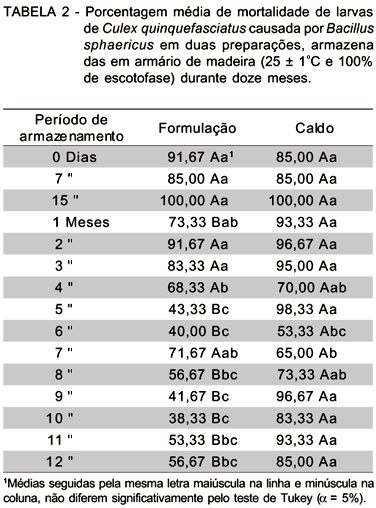
Baseando-se em observações feitas por Elçyn et al. (1995), pode-se explicar a menor atividade larvicida da formulação, principalmente a partir do 5o mês, pelo fato dos grânulos apresentarem uma superfície com depressões que podem abrigar os esporos e cristais do patógeno, que embora garanta a proteção contra as condições adversas do ambiente, leva a liberação lenta dos propágulos. Este efeito pode ainda ter sido agravado por se ter trabalhado com a concentração indicativa e para tal foi necessária a remoção de esporos e cristais para a obtenção da suspensão. Assim, a incorporação de um agregante pode ter causado um provável efeito negativo, dificultando a remoção das estruturas mencionadas.
Evidenciou-se este provável efeito ao se avaliar a eficiência dos produtos em criadouros artificiais (baldes), nos quais os produtos foram aplicados diretamente na água (TABELA 3). Ambos os produtos apresentaram igual desempenho, independente do período de armazenamento, demonstrando ser inadequado o uso apenas do parâmetro viabilidade de esporos como forma de se avaliar a qualidade do produto, uma vez que o cristal se manteve viável, conforme indicam os resultados obtidos.

O uso de uma concentração mínima para se detectar a redução da viabilidade do patógeno formulado foi também testada por Batista Filho (1997) para acompanhar a estabilidade de formulações de Vírus de Poliedrose Nuclear de Anticarsia gemmatalis (Lepidoptera, Noctuidae) e os resultados seguiram a mesma tendência aqui constatada.
Armazenamento em temperatura de 50°C
Normalmente, as baixas temperaturas de armazenamento são condições ideais para a preservação de um produto microbiano. A exposição do mesmo em temperaturas mais elevadas pode levar a ocorrência de distúrbios fisiológicos do patógeno, com reflexos na redução da sua viabilidade, tal como foi constatado nesta pesquisa, independente do patógeno ser ou não formulado (TABELAS 4 e 5).
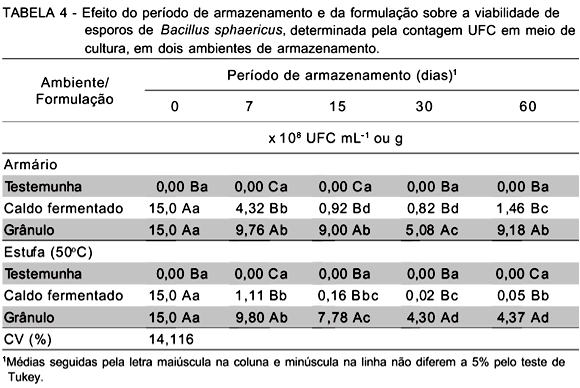
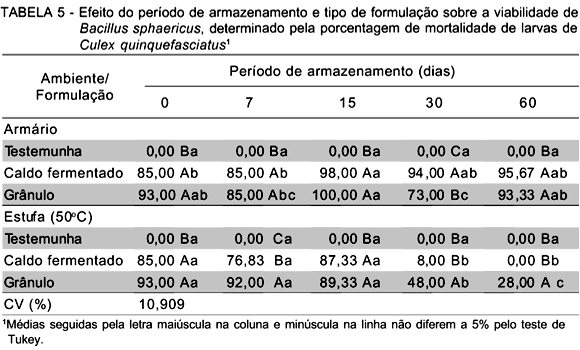
Assim, o patógeno presente no caldo fermentado foi mais suscetível aos efeitos da temperatura, pois mesmo em condições ambiente houve, após 7 dias do início das observações, significativa redução da viabilidade dos esporos em 3,5 vezes, em relação ao valor original (1,5 X 109 UFC mL-1). Esta redução continuou sendo observada nas avaliações subsequentes, alcançando a marca de 300 vezes menos esporos decorridos 60 dias de armazenamento. Na estufa, o caldo fermentado teve sua viabilidade reduzida ainda mais drasticamente na primeira avaliação, com 13,5 vezes menos UFC mL-1, em relação ao original, mantendo-se com baixa viabilidade pelo período de 60 dias.
A formulação, ainda com redução na viabilidade dos esporos, mostrou-se mais estável em condições ambiente. A viabilidade foi mantida em níveis constantes e significativamente diferentes dos observados na primeira avaliação. Apenas que na quarta avaliação, provavelmente, devido a erros durante o preparo da formulação ou na amostragem e na diluição, constatou-se a diminuição da viabilidade, porém, aos 60 dias novamente obteve-se um valor semelhante às outras avaliações prévias.
Quando a formulação foi armazenada a 50°C, a viabilidade dos esporos reduziu-se gradativamente ao longo do período, alcançando cerca de três vezes menos esporos viáveis/g em relação ao seu estado original. No entanto, ainda que tenha sido reduzida, a viabilidade permaneceu superior a observada no caldo, no mesmo período de armazenamento (80 vezes mais que o patógeno não formulado), demonstrando assim uma acentuada ação protetora da formulação aos esporos de B. sphaericus, evitando que a temperatura causasse efeitos danosos sobre as proteínas dos esporos da bactéria, tornando-os inviáveis.
Na análise da atividade larvicida, a formulação e o caldo fermentado, armazenados em condições ambiente, não demonstraram haver qualquer relação entre a viabilidade dos esporos e a atividade larvicida, embora seja evidente o fato dos esporos serem mais suscetíveis que os cristais à temperatura elevada. Assim, independente da viabilidade dos esporos ser alta ou baixa, a mortalidade larval causada tanto pelo produto formulado como não formulado foi elevada, variando entre 70 e 100% (TABELA 5).
Por outro lado, quando armazenados na estufa, verificou-se uma certa relação pois a queda na viabilidade dos esporos foi acompanhada da redução da atividade larvicida, principalmente decorridos trinta dias de armazenamento. Além disso, na comparação entre a mortalidade original e aquela obtida ao final do experimento, diferenças foram significativas, sendo que no caldo fermentado não apresentou toxicidade sobre as larvas testadas. Isto corrobora as observações anteriores sobre o efeito protetor da formulação sobre o complexo esporo-cristal do patógeno.
Confrontando-se os ambientes de armazenamento e a atividade larvicida, o caldo fermentado foi mais suscetível aos efeitos da temperatura. Após 7 dias de armazenamento houve uma significativa redução na atividade em relação à formulação e na seqüência, a redução se manteve até a ausência de atividade, aos 30 dias de armazenamento, tornando-sce claro um padrão de comportamento da redução da atividade larvicida e viabilidade dos esporos, sendo mais drástica e rápida para o caldo e gradativa para o formulado.
Trabalhos desenvolvidos por Elçyn & Öktemer (1995) com formulação encapsuladas à base de caragenina e de alginato de cálcio demonstraram os efeitos da temperatura apenas sobre a viabilidade dos esporos. Em ambos os tipos, tal como aqui constatado, a formulação garantiu maior estabilidade no armazenamento durante 90 dias a 50°C, de forma que as perdas no caldo sempre foram maiores. A viabilidade dos esporos da formulação apresentou, ao longo do período, redução de 10 a 100 vezes, variando diretamente com a concentração dos produtos constituintes da matriz de encapsulação. Ressalta-se que nos dois trabalhos não foram feitas quaisquer referências sobre a atividade larvicida.
Existem poucas informações na literatura que demonstram tais efeitos, no entanto, as pesquisas realizadas por Elçyn et al. (1995), com uma formulação encapsulada de B. sphaericus à base de carboxi metil celulose, armazenada em alta temperatura (50oC) e em condições ambiente, levaram a observações semelhantes, com redução na viabilidade dos esporos, principalmente para o caldo fermentado (cerca de 10000 vezes menos esporos viáveis ao final de 90 dias de exposição). O produto formulado, contudo, sofreu reduções de no máximo 100 vezes no número de esporos viáveis. Entretanto, com relação à atividade larvicida os autores obtiveram a total preservação do patógeno quando formulado após o período de armazenamento de 60 dias em condições de temperatura elevada, o que garantiu 100% de mortalidade das larvas de 3o ínstar de Culex spp.
Embora a temperatura seja um fator importante na viabilidade dos entomopatógenos, deve-se salientar que as respostas em relação a este fator ambiental não podem ser generalizadas, pois a variabilidade genética pode interferir conferindo a um determinado isolado maior capacidade de resistir às condições adversas. Isto foi demonstrado por Karch (1987) que acompanhou a viabilidade e a atividade larvicida dos isolados 2297 e 1593-4 de B. thuringiensis, armazenados a 50°C e verificou que o último foi mais estável, perdendo apenas 10 vezes o número de UFC mL-1 enquanto que o outro isolado sofreu perdas da ordem de 106 UFC mL-1. O mesmo foi observado para a atividade larvicida que foi drasticamente reduzida para o isolado 2297 e mantida para o isolado 1593-4.
A importância da preservação, não somente do cristal, mas também dos esporos no produto armazenado ou no campo pode levar ao prolongamento da persistência, com multiplicação do patógeno nas larvas infectadas (Yousten et al., 1992). Além disso, embora não sejam obrigatoriamente necessários para a atividade larvicida, os esporos participam secundariamente do ciclo de desenvolvimento da doença, pois assim a bactéria se multiplica nas larvas mortas. Desta forma os novos esporos e cristais liberados infectam outros indivíduos, aumentando-se a atividade residual (Davidson et al., 1975; Lacey et al., 1988; Lacey, 1990; Yousten et al., 1992).
A termoestabilidade de B. sphaericus é importante para que a formulação possa ser comercializada. Durante esta fase, o produto necessita ser transportado, podendo ser exposto a condições impróprias e assim, a integridade biológica do produto pode ser preservada mesmo quando transportado em condições não adequadas e por longas distâncias, sem afetar a sua qualidade. Além disso, a formulação em questão trata-se de um grânulo flutuante e pelo fato de permanecer junto à superfície onde, pela incidência de luz solar a temperatura da água é maior, o complexo esporo-cristal pode ser inativado.
Os grânulos apresentavam uma superfície com aparência esponjosa e com cavidades e depressões, criando, desta maneira, um microambiente onde provavelmente os esporos e cristais se alojaram garantindo, no armazenamento ou no campo, o prolongamento da atividade larvicida. Este fato foi também relatado por Elçyn & Öktemer (1995), com relação às observações feitas de grânulos de uma formulação encapsulada de B. sphaericus, à base de caragenina, em microscópio eletrônico de varredura, às quais revelaram uma superfície semelhante a aqui relatada e com reflexos direto na estabilidade do patógeno.
Tanada & Kaya (1993) ressaltaram a necessidade em se manter o produto formulado com baixa umidade. Isto foi levado em consideração no presente trabalho, uma vez que o produto em teste foi armazenado com cerca de 3% de umidade, o que pode ter colaborado para a sua manutenção em tais condições e garantiu a maior atividade, em relação ao caldo onde os efeitos foram mais severos pela presença da água ao redor do complexo esporo-cristal.
Há grande dificuldade entretanto em se comparar efetivamente os resultados aqui obtidos com os demais estudos já efetuados, em função do tipo de formulação desenvolvida. A formulação granulada pode ser efetiva na proteção, uma vez que o patógeno é envolvido totalmente por uma matriz, enquanto que a formulação em teste trata-se do tipo spray on na qual o ingrediente ativo e adjuvantes são aplicados sobre a matriz (inerte) penetrando em seus interstícios. Porém, a vantagem deste tipo de formulação está no seu baixo custo de produção (matéria-prima residual de origem agroindustrial) e na simplicidade da sua manufatura, sendo os ingredientes, inerte e adjuvante biodegradáveis e atóxicos.
Luis Francisco Angeli Alves (2,5)*; Sérgio Batista Alves (3); Rogério Biaggioni Lopes (3); Nílson Toschi Augusto (4)
sebalves[arroba]esalq.usp.br
2. Centro de Ciências Biológicas e da Saúde - UNIOESTE, R. Universitária, 2069 - CEP: 85814-110 - Cascavel, PR.
3. Depto. Entomologia, Fitopatologia e Zoologia Agrícola - USP/ESALQ, C.P. 9 - CEP: 13418-900 - Piracicaba, SP.
4. Instituto Biológico, Centro Experimental de Campinas, C.P. 70 - CEP: 13001-970 - Campinas, SP.
5. Bolsista do CNPq.
*Autor correspondente <lasg[arroba]unimidia.com.br>
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|