 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Os experimentos foram realizados no Laboratório de Biotecnologia da Seção de Viticultura do Instituto Agronômico (IAC) em Campinas-SP.
Os cultivares utilizados foram o `Jales' (IAC 572) e o `Campinas' (IAC 766), que pertencem ao grupo dos porta-enxertos tropicais.
Para o fornecimento contínuo e uniforme de explantes, foi utilizada a metodologia descrita por Goussard (1981). O procedimento envolveu basicamente a coleta e armazenamento de estacas lenhosas em câmara fria e quando houve necessidade de explantes, as estacas foram colocadas para brotar numa bancada com iluminação artificial, dentro de frascos com 100mL de água, sendo as brotações utilizadas como fonte de explantes.
A assepsia das brotações das estacas foi realizada pela lavagem em água corrente durante 30 minutos, seguida pela imersão em solução de hipoclorito de sódio a 1% mais Tween 80 a 0,1% por 15 minutos e 4 lavagens em água esterilizada.
Os segmentos nodais foram obtidos a partir do corte das brotações em pedaços com 1cm de comprimento e com uma gema.
Os ápices meristemáticos foram retirados com o auxílio de um microscópio estereoscópico, possuindo dois ou três primórdios foliares e com tamanho de aproximadamente 0,5mm. Após a extração, os ápices foram imediatamente transferidos para placas de petri contendo meio de cultura MS (Murashige & Skoog, 1962) com a concentração de sais reduzida pela metade, 10g/L de sacarose, 4g/L de carvão ativado e 7g/L de ágar, sendo colocados 12 ápices por placa de petri.
Os ápices permaneceram durante 5 dias nesse meio de pré-incubação, quando foram transferidos individualmente para tubetes (tubos com volume de 32mL e base plana) com 7mL de meio de cultura, sendo eliminados os contaminados e oxidados. O meio de cultura utilizado em todos os experimentos foi o MS com a metade da concentração de sais, 30g/L de sacarose e 6,5g/L de ágar.
Os experimentos foram mantidos dentro de uma sala climatizada, com fotoperíodo de 16 horas de luz, fornecida por lâmpadas fluorescentes do tipo luz do dia e gro-lux, e temperatura em torno de 25 ± 3°C.
Para a avaliação foram considerados ápices com crescimento, aqueles com pelo menos o triplo do tamanho do explante original e ápices com folha, aqueles que apresentaram pelo menos uma folha expandida.
Efeito de concentrações de BAP sobre o crescimento dos ápices meristemáticos: foram instalados dois experimentos, com delineamento experimental em blocos ao acaso, com 4 repetições e 10 frascos por parcela, sendo um com o porta-enxerto `Jales' (IAC 572) e outro com o `Campinas' (IAC 766).
Os tratamentos foram as seguintes concentrações de BAP: 0; 2,5; 5 e 10µM.
O experimento foi avaliado 60 dias após sua instalação.
Efeito do tempo de permanência dos ápices meristemáticos no meio de indução: o delineamento experimental foi inteiramente casualizado, com 3 repetições e 10 frascos por parcela. Os tratamentos testados foram os seguintes períodos de permanência no meio de indução: 14, 21, 28, 35 e 42 dias. O meio de cultura foi acrescido de 10µM de BAP. O experimento foi realizado com o porta-enxerto `Campinas'.
Os isolamentos foram realizados semanalmente e avaliados todos na mesma data, duas semanas após a instalação do último tratamento.
Efeito de concentrações de BAP sobre o crescimento das gemas axilares de segmentos nodais: o delineamento experimental foi inteiramente casualizado com 4 repetições e 10 frascos por parcela. Os tratamentos foram as seguintes concentrações de BAP: 0; 2,5; 5; 10 e 20µM. Neste experimento foi utilizado o porta-enxerto `Jales'.
A avaliação do experimento foi realizada após 40 dias da sua instalação.
Efeito de concentrações de BAP sobre o crescimento dos ápices meristemáticos: o efeito das concentrações de BAP foi significativo para a porcentagem de explantes com crescimento e com folha para os porta-enxertos `Jales' e `Campinas' (Figuras 1 e 2).
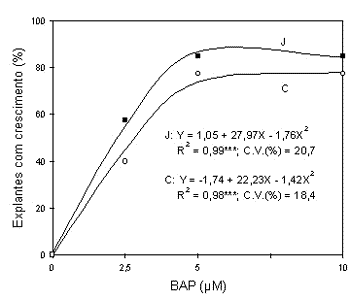
Figura 1 - Efeito da concentração de BAP na porcentagem de ápices meristemáticos com crescimento dos porta-enxertos `Jales' (J)
e `Campinas' (C) aos 60 dias após a instalação do experimento.
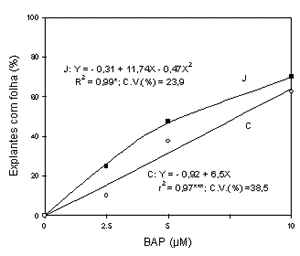
}Figura 2 - Efeito da concentração de BAP na porcentagem de ápices meristemáticos com folha dos porta-enxertos `Jales' (J)
e `Campinas' (C) aos 60 dias após a instalação do experimento.
A porcentagem de ápices meristemáticos com crescimento apresentou um comportamento quadrático, aumentando com a concentração de BAP em ambos porta-enxertos (Figura 1). Esse comportamento era esperado pelo já bem conhecido efeito promotor do BAP sobre o desenvolvimento de meristemas de videira (Krul & Mowbray, 1984; Passos et al., 1985).
O máximo estímulo ao desenvolvimento dos ápices foi estimado pela equação de regressão, cujos valores encontrados foram 7,4µM e 7,8µM de BAP para os porta-enxertos `Jales' e `Campinas', respectivamente. Esses valores são bastante próximos dos obtidos com diversos cultivares por Barlass & Skene (1980a), Duran-Vila et al. (1988), Goussard (1982), Gray & Fisher (1985) e Novák & Juvová (1983), cujas concentrações utilizadas variaram de 5 a 10µM de BAP, o que corresponde a aproximadamente 1,1 a 2,2mg/L.
Em todos os tratamentos testados, alguns ápices permaneceram verdes ou com pequenas porções oxidadas, porém sem apresentar desenvolvimento, fato também verificado com a videira `A Dona' (Passos et al., 1985). Alguns ápices mesmo apresentando crescimento (pelo menos o triplo do tamanho do explante original), não evoluiram ao ponto de possuirem folhas expandidas. Talvez este fato tenha ocorrido devido ao pequeno tamanho dos explantes, já que quanto menor o ápice meristemático, mais difícil é a sua regeneração (Koruza & Jelaska, 1993).
Foi encontrada uma regressão linear significativa entre as concentrações de BAP e a porcentagem de explantes com folhas diferenciadas para o `Campinas' e uma regressão quadrática para o `Jales' (Figura 2). Para ambos porta-enxertos a maior concentração utilizada de BAP, 10µM, promoveu a melhor resposta. Este resultado coincide com o obtido por Barlass & Skene (1980b) para os cultivares Cabernet Sauvignon e Thompson Seedless, cuja adição de 10µM de BAP ao meio de cultura foi ótima para promover o crescimento inicial de folhas a partir de ápices fragmentados e a subseqüente diferenciação de brotações adventícias destas folhas, processo já descrito por Barlass & Skene (1978).
Efeito do tempo de permanência dos ápices meristemáticos no meio de indução: a porcentagem de ápices meristemáticos com crescimento aumentou com o passar do tempo no meio de cultura com 10µM de BAP, até o ponto máximo de 93,2% observado aos 30 dias após o isolamento, quando passou a decrescer. A diminuição do número de explantes em desenvolvimento ocorreu pelo aumento da perda de explantes por oxidação, que atingiu 20% aos 42 dias (Figura 3).
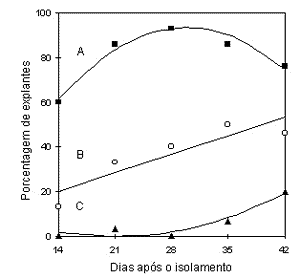
Figura 3 - Efeito do tempo de permanência em meio MS com 10µM de BAP sobre a porcentagem de explantes com crescimento
(A) Y = -19,33 + 7,55X - 0,12X2: R2 = 0,95***, porcentagem de explantes com folha
(B) Y = 3,33 + 1,19X; r2 = 0,82** e porcentagem de explantes oxidados
(C) Y = 18,67 - 1,83X + 0,043X2; R2 = 0,91** do porta-enxerto `Campinas'.
Entretanto, o comportamento da porcentagem de explantes com folhas aumentou linearmente com o tempo (Figura 3). Estes explantes são os desejados nesta fase, pois estão com maior desenvolvimento e mais próximos de regenerar uma nova planta. Portanto, a permanência no meio de indução até 42 dias foi favorável ao desenvolvimento dos explantes. Passos et al. (1985) também observaram que o desenvolvimento de meristemas do cultivar A Dona foi inicialmente lento, encontrando maior crescimento numa avaliação realizada cerca de 60 dias após o isolamento. Meristemas do cultivar Cabernet Sauvignon também apresentaram maior desenvolvimento e proliferação de novas brotações após 2 meses de cultivo (Duran-Vila et al., 1988).
Efeito de concentrações de BAP sobre o crescimento das gemas axilares de segmentos nodais: o aumento da concentração de BAP induziu o crescimento das gemas axilares dos segmentos nodais até a concentração de 11,5µM, estimada pela equação de regressão, quando passou a reduzir seu crescimento (Figura 4).
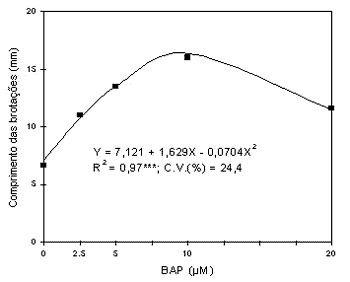
Figura 4 - Efeito de concentrações de BAP no crescimento das gemas axilares de segmentos nodais do porta-enxerto `Jales'.
Concentrações superiores a 10µM deste regulador também apresentaram-se prejudiciais na micropropagação da cultivar Summit (Lee & Wetzstein, 1990) e Remaily Seedless (Chée & Pool, 1985). O uso de concentrações muito elevadas de BAP causam a formação de brotações anormais e vitrificadas (Harris & Stevenson, 1982), podendo também reduzir a proliferação e o crescimento das brotações e provocar a ocorrência de altos índices de mortalidade (Lee & Wetzstein, 1990).
A brotação dos segmentos nodais foi alta, 86%, em meio sem regulador, mas seu crescimento foi muito pequeno. Neste caso também não houve a formação de calo na base dos explantes, que apenas ocorreu com a adição de BAP ao meio de cultura (TABELA 1).
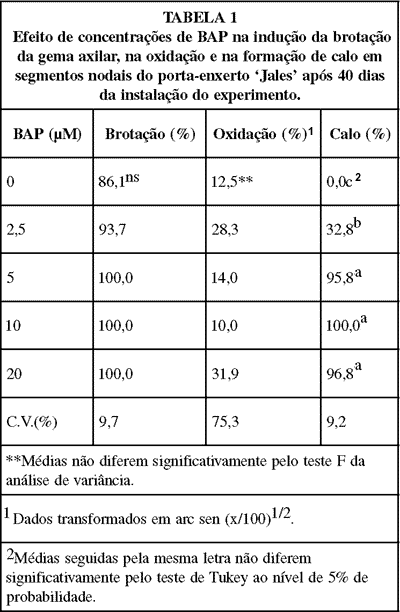
Neste trabalho observou-se que o maior estímulo ao crescimento dos ápices meristemáticos e dos segmentos nodais foi obtido com concentrações de BAP próximas de 10µM. Nessa concentração a ocorrência de vitrificação foi pequena para os porta-enxertos `Jales' e `Campinas', mas esta resposta pode variar com o cultivar, pois Peixoto et al. (1994), trabalhando com o porta-enxerto `1103 Paulsen', obtiveram as maiores brotações utilizando 0,5mg/L de BAP, aproximadamente 2,2µM, e concentrações superiores a esta aumentaram a ocorrência de vitrificação. Portanto, deve-se adequar a concentração ideal de BAP para cada cultivar micropropagado, procurando obter brotações de boa qualidade com o mínimo de vitrificação, mesmo que a taxa de crescimento seja menor, porque o sucesso das fases subsequentes, multiplicação e enraizamento, depende do bom estado fisiológico das brotações.
- O estabelecimento in vitro dos porta-enxertos `Jales' e `Campinas', através de ápices meristemáticos ou segmentos nodais, é obtido em meio de cultura MS, com a concentração de sais reduzida pela metade, suplementado com 10µM de BAP.
C. V. Pommer
pommer[arroba]unb.br
L. A. Biasi2; I. R. Da S. Passos3; C. V. Pommer3,4
1. Parte da tese de doutorado do primeiro autor.
2. Depto. de Fitotecnia e Fitossanitarismo-UFPR, C.P. 2959, CEP: 80001-970 - Curitiba, PR.
3. Seção de Viticultura-IAC, C.P. 28, CEP: 13001-970 - Campinas, SP.
4. Bolsista do CNPq.
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|