 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
Avaliação do Efeito Fungitóxico de Imidacloprid e Fipronil sobre B. bassiana e M. anisopliae. Foram utilizados os isolados 634 (B. bassiana) e E-9 (M. anisopliae), armazenados no Banco de Patógenos do Laboratório de Patologia de Insetos (Departamento de Entomologia, ESALQ/USP). Testaram-se duas formulações comerciais de inseticidas registradas para o controle de cupins na cultura da cana-de-açúcar: imidacloprid (Confidor 700 GrDA, Bayer S.A.) e fipronil (Regent 800 WG, Rhodia Agro Ltda.). Considerando-se a utilização de concentrações subletais dos inseticidas para associação com fungos entomopatogênicos no controle de H. tenuis, as formulações foram testadas na concentração média recomendada e a uma concentração 70% inferior.
Os fungos foram inoculados em placas de Petri com meio BDA (batata-dextrose-ágar), acrescido das duas concentrações de cada produto, e de um tratamento testemunha (sem adição dos produtos), totalizando cinco tratamentos para cada fungo. Foram feitas quatro placas por tratamento, sendo a inoculação realizada por meio de uma alça de platina, em três pontos eqüidistantes por placa, totalizando 12 colônias de fungo, das quais seis colônias foram aleatoriamente selecionadas, resultando em seis repetições por tratamento. A adição dos produtos ao meio de cultura foi feita com o mesmo ainda líquido, a uma temperatura próxima dos 40ºC, após o que, o meio foi vertido nas placas, sendo feita, após a sua solidificação, a inoculação dos entomopatógenos.
Para o cálculo das concentrações proporcionais dos produtos, considerou-se um volume médio de aplicação de 300 litros/ha. Assim, os seguintes tratamentos foram obtidos: testemunha - sem adição de produto; imidacloprid: 33,3 mg p.c./100 ml BDA (concentração média recomendada de 100 g p.c./ha); imidacloprid (-): 9,9 mg p.c./100 ml BDA (concentração 70% inferior); fipronil: 83,3 mg p.c./100 ml BDA (concentração média recomendada de 250 g p.c./ha); fipronil (-): 24,9 mg p.c./100 ml BDA (concentração 70% inferior). Após a inoculação dos entomopatógenos, as placas foram mantidas em estufas incubadoras B.O.D. a 26 ± 0,5ºC e fotofase de 12 h, por um período de 10 dias, quando então foram medidos os diâmetros médios das colônias e feita a contagem do número de conídios produzidos por colônia, em câmara de Neubauer.
Os dados obtidos foram submetidos à análise de variância e teste de Tukey (P < 0,05) para comparação entre as médias, além do cálculo de um fator de compatibilidade (valor "T"), proposto por Alves et al. (1998).
Estudo do Comportamento de Limpeza de H. tenuis na Eliminação do Inóculo de B. bassiana e M. anisopliae, sob o Efeito de Imidacloprid e Fipronil. Os inseticidas foram impregnados em papel de filtro (6,0 cm de diâmetro) nas proporções de 0,01 e 0,001% (peso/peso), por meio de imersão em solução aquosa, utilizando-se um volume de 100 ml de água destilada estéril por tratamento. No tratamento testemunha o papel foi imerso somente em água destilada. Os discos de papel de filtro impregnados foram colocados em placas plásticas de poliestireno de 6,0 cm x 1,5 cm, cobertas com tampa telada, e mantidos para secagem por 24 h, sendo feitas três placas por tratamento.
Em seguida, operários de H. tenuis, coletados por armadilhas de papelão corrugado (Termitrap®), foram inoculados com 0,1 ml de uma suspensão de 109 conídios/ml dos fungos B. bassiana ou M. anisopliae para cada grupo de 20 insetos. Os insetos foram então transferidos para as placas com papel de filtro previamente impregnado com os inseticidas ou com água destilada. Dessa forma, resultaram os seguintes tratamentos: B. bassiana; M. anisopliae; B. bassiana + imidacloprid (0,01%); B. bassiana + imidacloprid (0,001%); B. bassiana + fipronil (0,01%); B. bassiana + fipronil (0,001%); M. anisopliae + imidacloprid (0,01%); M. anisopliae + imidacloprid (0,001%); M. anisopliae + fipronil (0,01%) e M. anisopliae + fipronil (0,001%).
Foram retirados 10 insetos de cada tratamento, preparando-se dois suportes para observação ao microscópio eletrônico de varredura, com cinco insetos cada, nos períodos de 0, 6, 12 e 24 h após a inoculação com os entomopatógenos. Os espécimes foram preparados pela técnica de fixação em vapor de OsO4 (tetróxido de ósmio). Esta consiste na manutenção dos insetos por 48 h em câmara plástica hermética com placa de Petri contendo um filme líquido de OsO4, o qual, ao volatilizar, promove a fixação dos espécimes. Após esse processo, o material foi deixado por 72 h em dessecador de vidro com sílica-gel, para manutenção da umidade relativa próxima a 0%. A última etapa da preparação do material foi a metalização com ouro em Evaporador Balzers, modelo MED 010, por 120 segundos. O material preparado foi observado e fotografado ao microscópio eletrônico de varredura (Zeiss, modelo DMS 940), no Laboratório do Núcleo de Apoio à Pesquisa - Microscopia Eletrônica Aplicada à Pesquisa Agropecuária (NAP-MEPA), da ESALQ/USP.
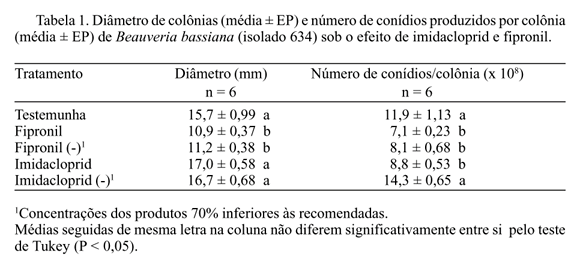
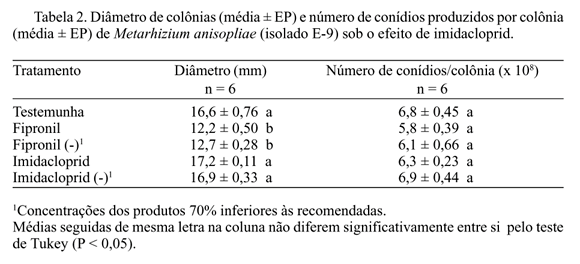
Avaliação do Efeito Fungitóxico de Imidacloprid e Fipronil sobre B. bassiana e M. anisopliae. Com relação a B. bassiana, observou-se que o efeito causado pelo produto imidacloprid foi menor, principalmente no caráter diâmetro de colônias, no qual as médias dos tratamentos imidacloprid e imidacloprid (-) foram semelhantes à média obtida no tratamento testemunha. Quando comparados os valores do número de conídios produzidos por colônia, observa-se que o tratamento imidacloprid (-) foi o que provocou menor efeito, como no parâmetro anterior, sendo que a concentração recomendada do produto provocou efeito semelhante aos tratamentos com fipronil, reduzindo a produção de conídios de B. bassiana em relação à testemunha. O produto fipronil causou maior efeito, tanto no número de conídios produzidos como no diâmetro das colônias do fungo (Tabela 1). Com relação a M. anisopliae, foi obtido um efeito semelhante ao provocado em B. bassiana quanto ao parâmetro diâmetro de colônias. Porém, analisando-se o número de conídios produzidos por colônia, não se constatou diferença entre os tratamentos, indicando um menor efeito dos produtos sobre M. anisopliae (Tabela 2). O imidacloprid, principalmente na concentração 70% inferior à recomendada, reduziu pouco o crescimento vegetativo e a conidiogênese de B. bassiana, quando comparado ao produto fipronil. Para M. anisopliae, os produtos pouco alteraram os dois parâmetros avaliados. Pode-se notar que alguns tratamentos proporcionaram médias de número de conídios produzidos por colônia e/ou diâmetro médio de colônias superiores às obtidas no tratamento testemunha. Aparentemente conflitantes, esses números reforçam um aspecto que tem sido comum em trabalhos que seguem essa metodologia de avaliação do efeito tóxico de produtos fitossanitários sobre entomopatógenos in vitro (Alves et al. 1998). Uma hipótese a ser levantada é o fato de que o microrganismo, ao metabolizar os princípios tóxicos do ingrediente ativo, num mecanismo de resistência fisiológica, provoque a liberação no substrato (meio) de moléculas que posssam utilizar como nutrientes secundários, promovendo seu crescimento vegetativo e conidiogênese. Outra possibilidade é de que o fungo, numa atividade comparável ao que ocorre com seres vivos em geral, utilize todo seu esforço reprodutivo quando em presença de um princípio tóxico que altere seu ambiente, prejudicando o seu desenvolvimento, resultando assim, em maiores níveis de crescimento vegetativo e conidiogênese.
Alves et al. (1998) desenvolveram um modelo de classificação de produtos químicos quanto à toxicidade sobre fungos entomopatogênicos. Esse sistema baseia-se em valores médios de porcentagem de conidiogênese e crescimento vegetativo das colônias dos fungos, para testes in vitro, realizados em meio de cultura sólido. O índice leva em conta a produção de conídios como fator mais importante, quando comparado com o crescimento vegetativo, já que são os propágulos do fungo que vão atuar no desenvolvimento da doença. Assim, se uma colônia cresce pouco, mas produz muitos conídios, a taxa de disseminação da doença tende a ser maior que a de uma colônia bem desenvolvida, mas com menor conidiogênese. Outro aspecto relevante desse modelo é a tentativa de padronização dos testes de avaliação do efeito de produtos fitossanitários sobre fungos entomopatogênicos in vitro. No modelo proposto, calculam-se valores percentuais com relação à testemunha (100%), aplicando-se, em seguida, para cada produto testado, a seguinte fórmula:
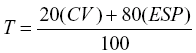 , onde:
, onde:
T = valor corrigido para classificação do produto; CV = porcentagem de crescimento vegetativo relativo à testemunha; ESP = porcentagem de esporulação (conidiogênese) relativa à testemunha.
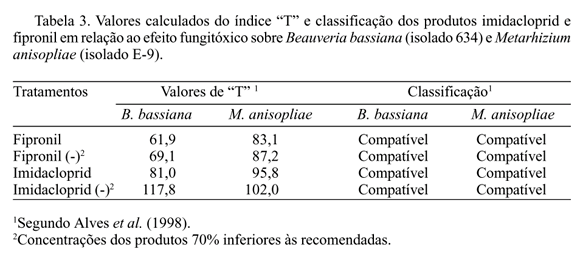
Os valores de T são classificados pelos seguintes limites: 0 a 30 = muito tóxico; 31 a 45 = tóxico; 46 a 60 = moderadamente tóxico; > 60 = compatível. A classificação dos produtos imidacloprid e fipronil, com relação à sua toxicidade aos fungos B. bassiana e M. anisopliae, de acordo com esse modelo encontra-se na Tabela 3. Os estudos in vitro têm a vantagem de expor ao máximo o microrganismo à ação do produto químico, fato que não ocorre em condições de campo, onde vários fatores servem de obstáculo a essa exposição. Assim, constatada a inocuidade de um produto em laboratório, não há dúvidas sobre a sua seletividade em campo. Por outro lado, a alta toxicidade de um produto in vitro nem sempre indica a sua elevada toxicidade em campo, mas sim a possibilidade da ocorrência de danos dessa natureza (Alves et al. 1998). No caso dos produtos imidacloprid e fipronil, a despeito de haver diferenças médias de até cerca de 30% no crescimento vegetativo e conidiogênese de B. bassiana e M. anisopliae, pode-se considerar as duas formulações como compatíveis com esses entomopatógenos, quando utilizadas nas concentrações médias recomendadas ou em concentrações subletais (Tabela 3).
A utilização de iscas atrativas com patógenos associados a produtos fitossanitários compatíveis é uma estratégia que pode viabilizar o uso desses microrganismos, tornando as aplicações mais eficientes e econômicas. Assim, Almeida & Alves (1996) estudaram a utilização de imidacloprid em associação com B. bassiana para o controle do cupim H. tenuis com iscas atrativas. Foram utilizadas concentrações subletais do produto químico, com a finalidade de provocar um estresse na praga, tornando-a mais sensível à ação do patógeno, visando diminuir e racionalizar o número de aplicações e a quantidade do produto necessária ao controle da praga. Nesse trabalho, os autores constataram a compatibilidade entre o fungo B. bassiana e o imidacloprid, de forma indireta, pois a presença do produto nas iscas não afetou a mortalidade dos cupins causada pelo entomopatógeno. Boucias et al. (1996b), em bioensaios realizados visando o controle do cupim Reticulitermes flavipes (Kollar), demonstraram que o produto imidacloprid foi inócuo a B. bassiana, não interferindo nos diversos aspectos do desenvolvimento desse fungo. Batista F° et al. (1996) avaliaram a compatibilidade do produto fipronil com o fungo B. bassiana, visando sua utilização conjunta para o controle de Cosmopolites sordidus Germar. Mostraram que fipronil não provocou redução significativa na produção de conídios, apesar de ter afetado ligeiramente o diâmetro médio da colônia quando comparado à testemunha, além de não ter havido alterações na viabilidade dos conídios produzidos. Comparando os resultados obtidos por esses autores com os obtidos no presente trabalho, alguns pontos devem ser ressaltados. Além do efeito do ingrediente ativo (no caso, fipronil), pode haver um efeito secundário ou, em alguns casos, até mais significativo, um efeito do inerte adicionado à formulação comercial. Assim sendo, algumas restrições devem ser feitas na comparação referida, pois no trabalho de Batista F° et al. (1996) foi usada a formulação 20 G do produto fipronil, enquanto que, no presente estudo, utilizou-se a formulação 800 WG (grânulos dispersíveis em água).
Torna-se importante, também, a realização de testes de patogenicidade com o microrganismo que cresceu no meio de cultura sob a influência do produto químico, com vistas à detecção de alterações que levem a perdas de patogenicidade e virulência do patógeno quando da aplicação do defensivo. Isso pode ser feito com qualquer inseto-teste, dando-se preferência a espécies suscetíveis ao patógeno e de fácil criação em laboratório, como Diatraea saccharalis (Fabricius) e Galleria mellonella L., para que seja possível a realização de bioensaios padronizados.
Estudo do Comportamento de Limpeza de H. tenuis na Eliminação do Inóculo de B. bassiana e M. anisopliae, sob o Efeito de Imidacloprid e Fipronil. O efeito no comportamento de limpeza de H. tenuis pode ser observado, comparando-se a quantidade de conídios depositada na superfície do tegumento dos insetos logo após a inoculação com B. bassiana ou M. anisopliae (Fig. 1 A, G) com a quantidade presente no tegumento, decorridas 6 h após a inoculação (Fig. 1 B, H). A assepsia é feita pelos operários de H. tenuis, provavelmente, por meio do mecanismo conhecido por "grooming", ou lambimento, e também pela remoção utilizando os tarsos e garras, fato que pode explicar a grande quantidade de conídios observada nessas estruturas. Considerando-se a hipótese da assepsia por lambimento, pode-se inferir que ocorre a ingestão e desativação dos conídios no aparelho digestivo dos cupins. Boucias et al. (1996a), trabalhando com R. flavipes, verificaram que os conídios ingeridos pelos cupins não causaram infecção, além do que, em estudos complementares, esses autores detectaram que a flora microbiana existente em R. flavipes possui alta atividade fungistática para B. bassiana, promovendo a inibição da germinação de conídios. No entanto, Bao & Yendol (1971) verificaram que conídios de B. bassiana haviam perdido sua integridade no aparelho digestivo de R. flavipes, porém, em alguns deles, em pequena quantidade, foi observada a ocorrência de germinação e penetração no epitélio do mesêntero. Considerando-se a segunda hipótese, a da remoção dos conídios sem ingestão dos mesmos, pode-se afirmar que esses devem ser depositados em outros lugares, evitando-se, assim, a contaminação do resto da colônia. Para R. flavipes, Boucias et al. (1996a) observaram a utilização das galerias e túneis desses cupins subterrâneos para a desativação dos conídios, provavelmente pela atividade antimicrobiana existente no solo, bem como pela adição de substâncias pelos próprios cupins, através da saliva, que contêm microrganismos antagônicos no seu aparelho digestivo.

No presente trabalho, quando se utilizou o produto imidacloprid, observou-se, nas duas concentrações estudadas, uma grande alteração no comportamento de limpeza dos cupins. As concentrações utilizadas apresentaram efeitos subletais, ocorrendo a morte dos insetos depois de um período de mais de 24 h do contato com o produto. Almeida & Alves (1996) já haviam selecionado essas duas concentrações para a utilização associada de imidacloprid e B. bassiana em iscas de papelão, para o controle de H. tenuis. Essa alteração no comportamento de limpeza foi observada para B. bassiana (Fig. 1 C, D) e M. anisopliae (Fig. 1 I, J), comparando-se os insetos nos tratamentos imidacloprid (0,001%) e imidacloprid (0,01%) com a testemunha, 6 h após a inoculação. Segundo Boucias et al. (1996b), 72% dos conídios de B. bassiana foram removidos nas 2 h após a inoculação, em R. flavipes, sendo que, depois de 24 h, praticamente não foram observados conídios sobre os insetos. Dessa forma, o produto imidacloprid altera a resistência comportamental observada naturalmente nos cupins. Aliado ao entomopatógeno, esse produto pode agir de forma sinérgica, permitindo que uma maior quantidade de conídios possa germinar e iniciar o processo infectivo. Essa associação pode assegurar que tanto o produto como o patógeno possam ser utilizados em concentrações reduzidas, diminuindo custos e aumentando a segurança e a eficiência do controle. Além disso, como demonstrado no item anterior, o imidacloprid é compatível com o entomopatógeno, favorecendo a sua utilização associada ao patógeno.
O produto fipronil não provocou alteração alguma no comportamento de limpeza dos insetos, nas duas concentrações utilizadas. Comparando-se a quantidade de conídios de B. bassiana depositados sobre os insetos, decorridas 6 h da inoculação com a testemunha, percebe-se que houve a retirada quase total dos conídios (Fig. 1 E, F). Não foram feitos registros com relação ao fungo M. anisopliae, pois não houve conídios depositados na superfície dos insetos, nas 6 h após a inoculação, sendo o material idêntico à testemunha. Essa diferença entre os dois produtos pode estar ligada ao modo de ação de cada ingrediente ativo sobre o inseto. Imidacloprid é um inseticida sistêmico do grupo das nitroguanidinas, com ação de contato e ingestão que atua como uma neurotoxina, ligando-se ao receptor nicotínico da acetilcolina (Boucias et al. 1996b). Fipronil é um inseticida do grupo fenil pirezol, que também atua sobre o sistema nervoso central, porém, como um inibidor reversível do receptor GABA (ácido gama-aminobutírico) (Andrei 1996). Analisando-se bioensaios preliminares, e observando-se o comportamento dos insetos após o contato com os dois inseticidas, percebe-se que, nas concentrações utilizadas, fipronil parece ser bem mais tóxico, alterando rapidamente a mobilidade dos insetos e provocando mortalidade mais precocemente. Porém, esse efeito não se notabilizou por alterar o comportamento de limpeza dos insetos na presença desse produto, ao contrário do que ocorre com imidacloprid. Dessa forma, não se pode considerar o produto fipronil, nas concentrações analisadas, como sendo um estressor, que venha a ser utilizado na estratégia preconizada, em associação ao entomopatógeno para o controle de H. tenuis.
À FINEP, pelo suporte financeiro para a realização desta pesquisa. Ao Prof. Elliot W. Kitajima e à técnica Silvania Machado, do NAP-MEPA (ESALQ/USP), pela oportunidade e apoio na utilização do microscópio eletrônico de varredura.
Alcides Moino Jr.I; Sérgio B. AlvesII
sebalves[arroba]esalq.usp.br
I. Departamento de Entomologia, UFLA, Caixa postal 37, 37200-000, Lavras, MG
II. Departamento de Entomologia, ESALQ/USP, Caixa postal 9, 13418-900, Piracicaba, SP
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|