 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
º
Algumas espécies de tripes podem ser criadas em gaiolas sobre plantas inteiras em casa-de-vegetação (Tanigoshi & Nishio-Wong 1981, Nugaliyadde & Heinrichs 1984) e em condições de laboratório (Kinzer et al. 1972), ou sobre determinada parte vegetal (Bailey 1932, Lewis 1973). Em função de aspectos morfológicos e comportamentais da espécie, as gaiolas devem apresentar características que permitam a ventilação, visualização e iluminação, além de possibilitarem o controle das condições de umidade e temperatura e possuírem locais de pupação (Leiws 1973, Parra 1996).
Para a criação bem sucedida de tripes é necessário o conhecimento de alguns aspectos básicos da biologia da espécie, que auxiliam na compreensão e programação de estratégias de controle da praga. Neste caso, a busca destas informações só é possível quando se conhece a identidade específica do organismo. No Brasil, a espécie Frankliniella occidentalis (Pergande) foi registrada, pela primeira vez, na cultura de crisântemo, contudo, possivelmente, já ocorria no país atacando outras culturas (Monteiro 1994). É praga importante de diversas culturas, principalmente plantas ornamentais e hortícolas. Altas infestações dessa espécie podem provocar consideráveis perdas de produção, pelo dano direto e pela transmissão de vírus, afetando também a qualidade dos produtos e sua comercialização (Fransen 1990).
O objetivo do presente trabalho foi desenvolver um sistema de criação de F. occidentalis em condições de laboratório, com observações preliminares da biologia da espécie, oferecendo uma alternativa prática e eficiente para o fornecimento de um grande número de insetos para estudos de biologia e controle.
Sistema de criação de F. occidentalis em laboratório. A criação de F. occidentalis foi desenvolvida no Departamento de Entomologia, Fitopatologia e Zoologia Agrícola da Escola Superior de Agricultura "Luiz de Queiroz" (ESALQ) da Universidade de São Paulo (USP) em Piracicaba-SP. Adultos e ninfas de F. occidentalis foram coletados em estufas de produção de alface hidropônico no município de Holambra-SP, sendo a espécie confirmada pela especialista Renata Chiarini Monteiro. Os insetos foram, inicialmente, multiplicados em casa-de-vegetação, também sobre alface, sob condições semelhantes às encontradas no local de origem (26 ± 50C; 80 ± 10% UR). Grupos de insetos adultos, com prévia identificação de amostras, foram transferidos para o sistema de criação em laboratório até o estabelecimento da colônia.
A colônia estoque foi obtida pela multiplicação dos insetos sobre plantas de feijão-de-porco Canavalia ensiformis (L.), colocadas dentro de um recipiente de criação. Esse recipiente consistiu de uma caixa de acrílico (50,0 cm de altura x 40,0 cm de largura x 80,0 cm de comprimento), totalmente vedada para evitar a fuga dos insetos, com duas tampas circulares (25 cm de diâmetro) presas por parafusos de aço e porcas de nailon na parte superior. O contato entre a tampa e a parte superior do recipiente foi protegido por uma tira de espuma densa de, aproximadamente, três milímetros de espessura. O fechamento da tampa sob pressão foi obtido pelos parafusos sobre a espuma, impossibilitando a fuga dos insetos (Fig. 1). A troca contínua de ar com o exterior foi possível através de orifícios laterais de 2,5 cm de diâmetro, protegidos com tecido tipo "voil". Um sistema de ventilação forçada através de pequenos compressores (Betta Silente - Glauber R.C.A. & Cia Ltda.), instalados na lateral inferior do recipiente, contribuiu para a retirada do excesso de umidade do interior. Placas de Petri (15 cm de diâmetro) com vermiculita esterilizada foram colocadas no fundo do recipiente sob os vasos, fornecendo locais adequados para pupação, que para esta espécie, geralmente, ocorre no solo. Ninfas de segundo ínstar completamente formadas se jogam das folhas em busca de locais seguros e escuros para os estágios de pré-pupa e pupa.
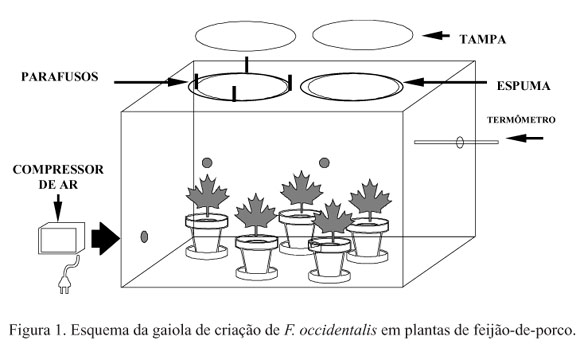
A temperatura e a umidade da sala foram controladas, mantendo-se constantes as condições dentro do recipiente de criação (27 ± 1ºC; 98 ± 2% UR). A transparência do acrílico e a permanência do recipiente próximo às janelas na sala, permitiram a entrada de luz natural para o bom desenvolvimento das plantas e dos insetos. A proteção contra luz, fornecida pelos locais para pupação, proporciona um desenvolvimento mais rápido e maior viabilidade da fase pupal (Brodsgaard 1994).
As plantas foram cultivadas em copos plásticos com latossolo vermelho mais areia (1:1) esterilizados e mantidas em casa-de-vegetação por um período de aproximadamente 10 dias após a semeadura, quando atingiram 20 cm de altura e apresentaram o primeiro par de folhas completamente desenvolvido. Em cada copo plástico foram colocadas de sete a oito sementes, mantendo-se apenas cinco ou seis plantas após o desbaste. No recipiente de criação, foram mantidos cinco a oito vasos e a substituição de plantas secas (já atacadas) por outras novas, ocorreu a cada dois dias ou quando necessário, a fim de manter a qualidade do substrato alimentar. Cada planta foi lavada com hipoclorito de sódio 0,5% e água destilada antes de passar para a colônia estoque, evitando-se contaminações fúngicas por possíveis microrganismos entomopatogênicos.
As folhas de feijão-de-porco constituíram o substrato de oviposição e alimentação de adultos e ninfas de tripes. O fornecimento de pólen a cada dois dias, como alimentação suplementar de adultos, teve como objetivo aumentar a capacidade reprodutiva da colônia (Annadurai & Morrison 1987, Trichilo & Leigh 1988). A pasta de pólen foi preparada com água destilada e pólen seco, coletado por Apis mellifera L., sendo oferecida na base do limbo foliar e na lateral interna da parede do recipiente. Amostras de pólen foram preparadas em lâminas pelo método direto, em gelatina glicerinada (Barth 1989). Através da identificação e contagem das amostras foi determinada a predominância de grãos de pólen de Bidens sp. (89%), ocorrendo também pólen de milho (2%), eucalipto (3,3%) e tipo Graminae (3,7%) e Arecaceae (2%).
Avaliação de parâmetros biológicos de F. occidentalis - Criação individual. Inicialmente, ninfas de segundo ínstar foram coletadas na colônia estoque e separadas em placas plásticas (6 cm de diâmetro), sendo alimentadas em folhas novas de feijão-de-porco até atingirem o estágio de pupa, quando já foi possível a determinação do sexo dos indivíduos, baseado no tamanho das pupas (Lewis 1973, Palmer et al. 1989). Assim, pupas que originariam fêmeas foram, posteriormente, individualizadas em placas plásticas transparentes (6 cm de diâmetro) com o auxílio de um pincel umedecido, contendo um disco de folha (3,5cm de diâmetro) de plantas de feijão-de-porco com 10 a 15 dias de idade, e pólen sobre um gel ágar-água 1% (metodologia adaptada de Vestergaard et al. 1995). Após a infestação dos discos, os insetos foram mantidos em câmara climatizada a 27 ± 1 oC e fotofase de 12 horas, sob condições semelhantes às fornecidas no sistema de criação citado anteriormente. Este sistema permite a troca constante de água entre o disco foliar e o gel, evitando o ressecamento precoce da folha e a morte dos insetos por afogamento.
Adultos recém-emergidos foram separados em casais. Cada casal foi mantido junto por 72 horas para o acasalamento. Após este período, os machos foram removidos e as fêmeas observadas durante toda sua vida. Ocorrendo a morte do macho nessa fase, procedeu-se à substituição imediata por outros machos mantidos na criação. Quatro dias após a retirada do macho, cada fêmea e as ninfas foram transferidas, com um pincel umedecido, para novos discos foliares, evitando-se qualquer interferência nos resultados em função da deterioração da folha.
Foram avaliados dados biológicos obtidos de 15 fêmeas. A fase de ovo do ciclo biológico da espécie não foi determinada neste estudo, em função de a oviposição ser endofítica, o que dificulta as observações de viabilidade e contagem dos ovos.
Foram avaliados, diariamente, o número de descendentes por fêmea, a duração e a viabilidade de cada fase e a razão sexual.
Estimativa de produção do sistema de criação. Para a avaliação do potencial do sistema de criação, foi instalada uma unidade semelhante à original, porém em menor escala. Uma cuba cilíndrica de vidro com 20 cm de diâmetro e 42 cm de altura, invertida sobre um disco plástico de apoio, recebeu um vaso contendo cinco plantas de feijão-de-porco, com o primeiro par de folhas completamente desenvolvido (aproximadamente 20 cm de altura). A ventilação foi proporcionada pela abertura de orifícios laterais de 2,5 cm de diâmetro no recipiente e auxiliada por um pequeno compressor de ar.
Quinze casais oriundos da criação foram liberados no recipiente, permanecendo por 96 horas para acasalamento e oviposição, sendo os adultos removidos após este período. Nesta fase, os adultos também receberam alimentação suplementar de pólen a cada dois dias. O estudo foi desenvolvido na mesma sala de criação, fornecendo-se condições de temperatura, umidade e fotoperíodo semelhantes ao do sistema original descrito anteriormente. Nessa fase, foi avaliado o comportamento de 15 casais, número correspondente ao estudo de biologia individual em placas.
Foi avaliado o número médio de descendentes por planta, contando-se os insetos na fase imatura (ninfas). A eficiência do sistema de criação foi estimada a partir da análise dos parâmetros obtidos na biologia de casais e plantas inteiras.
Avaliação de parâmetros biológicos da espécie F. occidentalis. Ninfas de primeiro ínstar (ninfas 1) foram visíveis na superfície do disco foliar quatro dias após a formação dos casais (Fig. 2). Nesta fase, as ninfas são pequenas e brancas, iniciando a alimentação logo após a eclosão. As ninfas de segundo ínstar (ninfas 2) começaram a surgir a partir do sexto dia, quando se constatou a maior concentração de ninfas 1. São maiores, possuem coloração amarelada e, geralmente, apresentam a porção intestinal esverdeada, em função da alimentação constante em tecido foliar. Após o desenvolvimento completo, as ninfas de segundo ínstar esvaziam todo o trato digestivo antes de tornarem-se pré-pupa (Gaum et al. 1994), assumindo coloração amarelo-pálida. A fase de ninfa, principalmente a de segundo ínstar, causa na planta, em função do processo alimentar do inseto, os danos mais significativos. A ninfa de segundo ínstar, por ser o estágio que se alimenta mais intensamente, causa os danos mais significativos, representados por manchas deprimidas e prateadas no limbo foliar, que reduzem a capacidade fotossintética da folha.
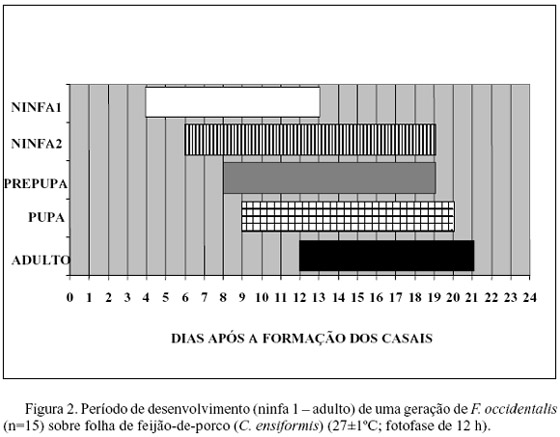
As pré-pupas foram observadas oito dias após a formação dos casais e as primeiras pupas nove dias após essa data. Os dois ínstares pupais (pré-pupa/pupa) são praticamente imóveis e não se alimentam, diferenciando-se pelo tamanho das tecas alares e das antenas e sua posição em relação à cabeça. As pré-pupas apresentam tecas alares pequenas e as antenas voltadas para frente, enquanto que as pupas possuem tecas alares maiores e as antenas sobre a cabeça.
Os primeiros adultos emergiram 12 dias após a formação dos casais, mas a maioria teve sua emergência 14 dias após. O tempo de desenvolvimento médio para a espécie, da eclosão das primeiras ninfas até a emergência dos primeiros adultos, foi em torno de nove dias e toda a descendência de cada casal demorou em média 18 dias, da eclosão da primeira ninfa até a emergência do último adulto.
Resultados semelhantes foram encontrados por Gaum et al. (1994) e Van Rijn et al. (1995), com o tempo de desenvolvimento médio da fase imatura em plantas de pepino (Cucumis sativus), excluindo a fase de ovo, sendo em torno de 10 dias, a 25ºC. Também Gerin et al. (1994) obtiveram dados correspondentes em feijão (Phaseolus vulgaris var. Flotille), com aproximadamente 10,3 dias, a 25ºC. Sabe-se, contudo, que a diminuição da temperatura provoca o alongamento do ciclo biológico do inseto. A temperatura em que foram conduzidos os experimentos foi de 27±1ºC provocando a redução do ciclo biológico da espécie. Lowry et al. (1992) observaram resultados ligeiramente inferiores em plantas de amendoim (Arachis hypogaea), em torno de 7,5 dias, a 25ºC, e Teulon (1992) em pimentão (Capsicum annuum), com 7,3 dias, a 27ºC. Esta pequena variação entre autores, e a viabilidade das diferentes fases imaturas, podem estar relacionadas às características nutricionais da planta hospedeira, bem como às diferentes populações utilizadas e metodologia de criação, entre outros.
A longevidade média das fêmeas foi 8,3 dias, com o mínimo de cinco e máximo de 12 dias. O número médio de descendentes produzidos por fêmea, não sendo observada a fase de ovo, foi de 14,3 ninfas. A viabilidade dos estádios de ninfa (ninfa 1 + ninfa 2) e pupa (pré-pupa + pupa) foi em torno de 83 e 90%, respectivamente (Tabela 1).

Diversas pesquisas relatam que a longevidade de adultos decresce com o aumento da temperatura, possivelmente pelo maior esforço reprodutivo em temperaturas elevadas, o que resulta também em maior oviposição e, consequentemente, maior número de ovos por fêmea (Lowry et al. 1992, Gaum et al. 1994). A 25ºC, a longevidade de fêmeas criadas sobre pepino foi de 12,8 dias, produzindo 9,65 ovos (Gaum et al. 1994). Lowry et al. (1992) observaram, sob a mesma temperatura, uma longevidade muito menor em insetos criados em amendoim, de apenas 2,3 dias e uma postura de 9,4 ovos por fêmea. Apesar da menor longevidade de fêmeas obtida no presente estudo, o número de descendentes produzidos foi maior para a espécie criada sobre feijão-de-porco (Tabela 1).
A elevada emergência de machos em relação às fêmeas possivelmente ocorreu em função de algumas fêmeas (sete fêmeas) não terem copulado no período de acasalamento, produzindo somente descendentes machos (Tabela 1). Na ausência de machos, fêmeas de F. occidentalis apresentam reprodução partenogenética arrenótoca (Palmer et al. 1989). Contudo, fêmeas fertilizadas produzem descendentes de ambos os sexos, com o número de fêmeas sendo de duas a três vezes maior que o número de machos (Gerin et al. 1994, Van Rijn et al. 1995). Parte da grande variação encontrada na longevidade das fêmeas e na viabilidade das fases imaturas pode estar relacionada à planta hospedeira adotada nos testes e a manipulação constante, considerando-se a fragilidade dos insetos. Contudo, a metodologia de discos foliares sobre ágar-água mostrou-se prática e adequada para estudos de biologia.
Estimativa de produção do sistema de criação e determinação do número de descendentes. O número total de insetos produzidos, após o período de acasalamento e oviposição de 96 horas, foi de 338 ninfas. A maioria das ninfas (83,2%) encontrava-se no segundo ínstar oito dias após a liberação dos casais nas plantas, o restante das ninfas encontrava-se no primeiro ínstar. Não foram observadas as fases de pré-pupa e pupa. O número médio de descendentes produzidos por fêmea foi de 22,5 ninfas, valor maior do que o observado na avaliação individual de casais, onde as fêmeas permaneceram para oviposição no disco foliar durante toda a vida. A produção média obtida no sistema foi de 67,6 (31-105) insetos em cada planta.
Nos testes de biologia individual de casais em placas, cada fêmea produziu, em média, 14,3 ninfas, valor 36,4% inferior ao observado na criação em plantas inteiras. Gaum et al. (1994) também obtiveram números inferiores para fêmeas de F. occidentalis criadas em discos foliares de pepino. O maior número de descendentes observado neste experimento, mesmo com período de oviposição de apenas quatro dias, provavelmente esteja relacionado com condições mais adequadas para reprodução dos insetos encontradas neste sistema. Características físicas do substrato de alimentação e oviposição, o comportamento sexual dos insetos, como a importância do vôo no acasalamento (Van Rijn et al. 1995), e principalmente as condições microclimáticas no recipiente, mostraram-se importantes para o aumento da produção em criações em laboratório. A ventilação constante do sistema foi essencial na retirada do excesso de umidade do interior do recipiente. A alta umidade promove a condensação de água nas paredes, o que causa a morte dos insetos adultos por afogamento, além de favorecer o desenvolvimento de doenças fúngicas sobre as folhas.
A não avaliação dos estágios imaturos de pré-pupa e pupa, bem como de adultos, no teste de produção foi devido à dificuldade de observação e contagem dessas fases, visto que as pré-pupas se jogam das folhas. Como foi observado na biologia individual de casais, as pré-pupas começam a surgir após o oitavo dia da formação dos casais e os adultos, 12 dias após. Para o estudo mais completo do ciclo de desenvolvimento da espécie F. occidentalis, testes semelhantes devem ser conduzidos por um período de avaliação maior.
Estima-se que, nas condições oferecidas pelo sistema de criação original, o número de insetos produzidos por planta seja ainda maior, principalmente em função do grande número de fêmeas aptas a ovipositar em plantas novas durante a manutenção da colônia. Em observações periódicas, foram quantificadas entre 50 e 150 ninfas de segundo ínstar por folha de feijão-de-porco, sete dias após a introdução da planta no recipiente. Como há cerca de 70 folhas nesse período, o número de indivíduos disponíveis em todo o recipiente poderá ser de aproximadamente 3.500 a 10.000 tripes, envolvendo imaturos e adultos. A fecundidade e o aumento populacional parecem ser bastante influenciados pela densidade de adultos e condições da planta hospedeira. A seleção de plantas sadias e a freqüência de fornecimento de novas plantas são importantes para a obtenção de um número elevado de descendentes por fêmea na criação.
O presente método de criação do tripes F. occidentalis em laboratório é adequado, fornecendo de forma prática um grande número de insetos para experimentos de biologia e controle da praga. Desta forma, todos os insetos originam-se da mesma colônia estoque, gerando indivíduos de espécie determinada e populações geneticamente homogêneas. Outros métodos de criação necessitam de muito tempo e trabalho de manutenção, nem sempre fornecendo um grande número de insetos nas diferentes fases do ciclo biológico da espécie. Neste sistema, a manutenção e monitoramento da colônia, com um gasto máximo de duas horas de trabalho por dia, ocorre apenas a cada dois dias, envolvendo basicamente a troca de plantas no recipiente.
Ao Prof. José R.P. Parra do Departamento de Entomologia, Fitopatologia e Zoologia Agrícola (ESALQ/USP), pelas valiosas sugestões durante o desenvolvimento da pesquisa.
Rogério B. Lopes; Sérgio B. Alves
sebalves[arroba]esalq.usp.br
Departamento de Entomologia, ESALQ/USP, Caixa postal 9, 13418-900, Piracicaba, SP
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|