 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
O experimento foi realizado na Fazenda Piratininga, localizada no município de Monte Azul Paulista (SP) (48 º 39 ' W e 20 º 54 ' S), cujo clima é do tipo CWa, segundo Köppen, ou seja, inverno seco e precipitação anual de 1.000 a 1.400 mm. A área vem sendo cultivada com Citrus sinensis (L.) Osbeck, variedade Hamlim, há 12 anos. Anualmente, são efetuadas fertilizações orgânicas, constituídas por 80 % de pelete de polpa cítrica (CPP) e 20 % de esterco de galinha, e foliares, com sulfato de zinco e ácido bórico. O adubo orgânico é incorporado superficialmente (0—10 cm) na linha de projeção da copa, sendo parcelado em três vezes (setembro, novembro e dezembro). Na época das chuvas, realiza-se o cultivo de soja (Glicine max (L.) Merrill) em entrelinhas alternadas (linha sim, outra não, com alternância de ano para ano). Os restos culturais da soja são incorporados com grade após a colheita.
O Latossolo Vermelho distrófico apresentava os seguintes atributos químicos (camada de 0—20 cm) em setembro/98, antes do início do experimento: pH (CaCl2) 5,2, 18 g dm-3 de matéria orgânica, 87 mg dm-3 de P (resina), 2,1 mmolc dm-3 de K, 29 mmolc dm-3 de Ca, 9 mmolc dm-3 de Mg, 22 mmolc dm-3 de H + Al e 65 % de saturação por bases.
Os tratamentos avaliados foram: local de amostragem (linha de projeção da copa e entrelinhas), profundidade de amostragem (0—10 e 10—20 cm) e época de amostragem (novembro e dezembro/98, fevereiro e março/99). Os atributos analisados foram: N-amoniacal, N-nitrato, N-total, N-amoniacal extraído por solução de CaCl2 (0,005 mol L-1) sob autoclavagem (N-autoclave), N-amoniacal extraído após incubação anaeróbia (N-pot) e atividade de proteases. Também se avaliou o teor de N-total em amostras foliares.
Cada parcela foi constituída por seis plantas vizinhas, com 12 anos de idade, localizadas na mesma linha. Em cada parcela, foram coletadas quatro amostras compostas de solo (0—10 e 10—20 cm na linha de projeção da copa e nas entrelinhas), cada uma formada por seis amostras simples, uma em cada planta da parcela.
Na época indicada para diagnose foliar (março/99), coletaram-se a 3ª e a 4ª folha, a partir da ponta de ramos que continham frutos com diâmetro médio de 12 cm, geradas na primavera e com seis meses de idade (Malavolta et al., 1989). Foram colhidas oito folhas por planta, localizadas na altura média e dispostas segundo os pontos cardeais. As folhas assim obtidas foram lavadas com solução de HCl 0,1 mol L-1, água, água destilada e água deionizada. Após a lavagem, foram secas em estufa com circulação forçada de ar (60—70 °C), moídas em moinho tipo Willey com peneira de 40 mesh e acondicionadas em sacos de papel.
O N-foliar foi determinado pelo método microKjeldahl (Sarruge & Haag, 1974).
A atividade de proteases foi determinada pelo método proposto por Alef & Nannipieri (1995), que consiste na incubação da amostra de solo com solução de caseína (substrato) por 2 h em pH 8,1 e a 50 ºC, seguindo-se a determinação da quantidade de tirosina liberada por meio da reação com o reagente Folin-Ciocateau (formação de um complexo de cor azul, cuja absorbância foi lida em comprimento de onda de 700 nm). A atividade de proteases foi expressa em mg tirosina g-1 terra h-1 (base seca).
O teor de N-total nas amostras de terra foi determinado conforme o método descrito em Melo (1974), que consiste em oxidar o N-orgânico a N amoniacal pelo ácido sulfúrico em presença de catalisadores e elevadores de temperatura. O N amoniacal produzido foi determinado por destilação a vapor.
As formas nitrogenadas de N-amoniacal e N-nitrato foram determinadas conforme Bremner & Keeney (1965), cujo método consiste em extrair o N amoniacal e o N nitrato com solução de KCl 2 mol L-1. O N-amoniacal extraído foi determinado por destilação a vapor, após alcalinização do meio com MgO. Após a destilação da amônia, o extrato foi tratado com uma liga, segundo Devarda, que reduziu o íon nitrato a amônia, que foi então determinada por nova destilação a vapor.
O teor de N-pot foi determinado segundo Keeney (1982), método biológico, que consiste em incubar a amostra de solo em condições anaeróbias por um período de sete dias, avaliando-se, então, o N-amoniacal produzido.
O N-autoclave foi determinado pelo método descrito por Keeney (1982), o qual utiliza solução de CaCl2 sob autoclavagem por 16 h a 121 °C como agente de hidrólise do N-orgânico. O N-amoniacal extraído foi determinado por destilação a vapor.
Os resultados das quatro épocas de amostragem foram submetidos à análise de variância pelo Teste F. O Teste de Tukey foi usado para comparação das médias nos casos em que o teste F foi significativo. Também foram calculados os coeficientes de correlação entre as variáveis estudadas.
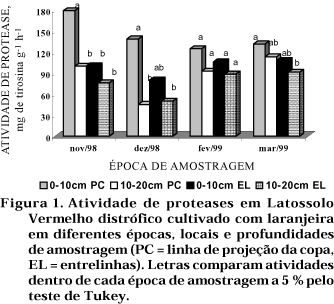
A atividade de proteases foi mais elevada em amostras de terra obtidas na linha de projeção da copa das plantas de laranjeira e na camada de 0—10 cm (Figura 1), o que também foi observado por Pansombat et al. (1997). Segundo Badalucco et al. (1997), teores mais elevados de matéria orgânica e os exsudatos radiculares podem favorecer a atividade microbiana e, conseqüentemente, aumentar a atividade de proteases nesta região. Nas amostragens realizadas em novembro/98, ou seja, logo após a adubação orgânica, a atividade foi mais elevada, o que também pode ser explicado por maior atividade microbiana. Kandeler et al. (1999) também observaram aumento da atividade de proteases após adição de compostos orgânicos ao solo.
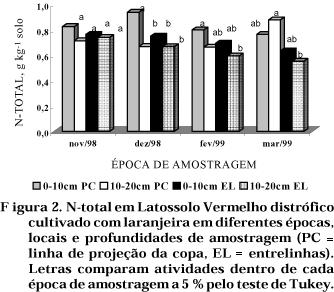
A concentração de N-total nas amostras de solo tendeu a diminuir do início para o final do experimento, o que pode ser atribuído a um intenso processo de mineralização (Figura 2). Em novembro/98, não se detectou efeito de tratamento, tendo sido, nas demais épocas, o teor mais baixo observado na profundidade de 10—20 cm e entrelinhas. De modo geral, o teor mais elevado de N-total ocorreu na profundidade de 0—10 cm e linha de projeção da copa, exceto na amostragem realizada em março/99. Todavia, nem sempre, as diferenças foram significativas, o que se explica pelo tipo de manejo adotado.
Não se detectou efeito de tratamento sobre o teor de N-amoniacal, o que pode ser atribuído à elevada variabilidade nos resultados obtidos (resultados não apresentados).
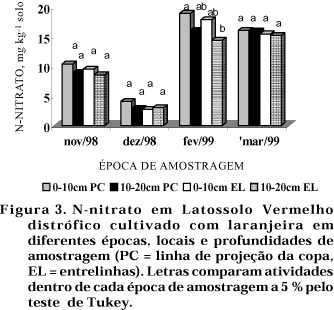
A concentração de N-nitrato variou com a época de amostragem, apresentando valores mais elevados em fevereiro e março/99 e valores mais baixos em dezembro/98. Em fevereiro/99, detectou-se efeito de tratamentos, sendo os valores mais altos obtidos na profundidade de 0—10 cm e projeção de copa, e os mais baixos, na profundidade de 10—20 cm e entrelinhas (Figura 3). Isso deve estar relacionado com a boa precipitação atmosférica no mês de fevereiro (102,3 mm), associada à temperatura (média de 26 ºC) e à adubação orgânica na linha de projeção da copa das plantas. Em Latossolo Vermelho eutroférrico cultivado com milho, Melo et al. (1975) constataram que o teor de N-amoniacal diminuiu de dezembro a março, enquanto o teor de N-nitrato diminuiu do início ao final de dezembro, para depois aumentar, sempre na forma de variações bruscas em intervalos de amostragem de 15 dias. Suhet et al. (1985) também observaram picos de N-nitrato em Latossolo Vermelho distrófico de cerrado no período das chuvas.
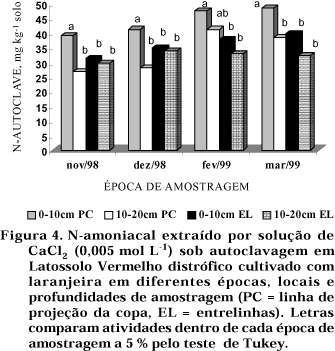
Amostras de solo na profundidade de 0—10 cm e linha de projeção da copa apresentaram os maiores teores de N-autoclave, diferindo dos demais tratamentos (exceto em fevereiro/99 para amostras obtidas na profundidade de 10—20 cm e linha de projeção da copa). Os demais tratamentos não diferiram entre si (Figura 4). Segundo Sanches et al. (1999), as maiores alterações químicas em solo cultivado com laranjeira ocorreram na região da linha de projeção da copa, local onde foram realizadas as adubações. Por outro lado, o uso da grade, que acelera a decomposição da matéria orgânica e aumenta os processos de lixiviação e de erosão, pode ter contribuído para acentuar as diferenças entre as camadas do solo.
Exceto para as amostras de março/99, que não apresentaram diferenças entre tratamentos, o teor de N-pot foi maior nas amostras obtidas na profundidade de 0—10 cm e linha de projeção da copa, porém não diferiu dos demais tratamentos, exceto para a profundidade de 10—20 cm e entrelinhas onde o teor de N-pot foi menor (Figura 5). Os valores mais baixos para N-pot foram obtidos na amostragem de fevereiro/99.
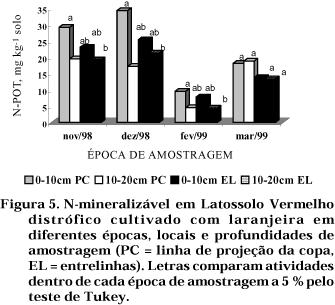
Tanto para a atividade de proteases quanto para os demais métodos utilizados na avaliação da disponibilidade do N, observou-se tendência para valores maiores na camada de 0—10 cm, concordando com as observações realizadas por outros pesquisadores (Ambroz, 1970; Alef et al., 1988; Bohm & Ahrens, 1990; Tate et al., 1991).
A correlação entre a atividade de proteases e outros métodos para avaliação da disponibilidade de N (Quadro 1) resultou em valores significativos, dependendo do método, da época, do local e da profundidade de amostragem. Para amostras obtidas em novembro/98, encontrou-se correlação positiva entre a atividade de proteases e o N-nitrato (r = 0,92**) e negativa com o N-total (r= -0,87*), para as amostras obtidas na projeção de copa (0—10 cm), e correlação positiva com o N-pot (r= -0,83*), para amostras obtidas nas entrelinhas (10—20 cm). Em dezembro/98, foram obtidas correlações positivas entre a atividade de proteases, N-pot e o N-autoclave em amostras obtidas na linha de projeção da copa (0—10 cm) (r = 0,89* e 0,96**, respectivamente), e N-amoniacal (r = 0,93**) nas entrelinhas (0—10 cm). Na amostragem de fevereiro/99, correlação positiva foi obtida para N-pot em amostras obtidas na entrelinha e 0—10 cm (r = 0,85*). Finalmente, na amostragem de março/99, época indicada para fins de diagnose foliar, correlações significativas foram obtidas para N-pot (r = 0,94**), para amostras obtidas na linha de projeção da copa de 0—10 cm e para N-total (r = 0,85*), para amostras obtidas nas entrelinhas de 10—20 cm.
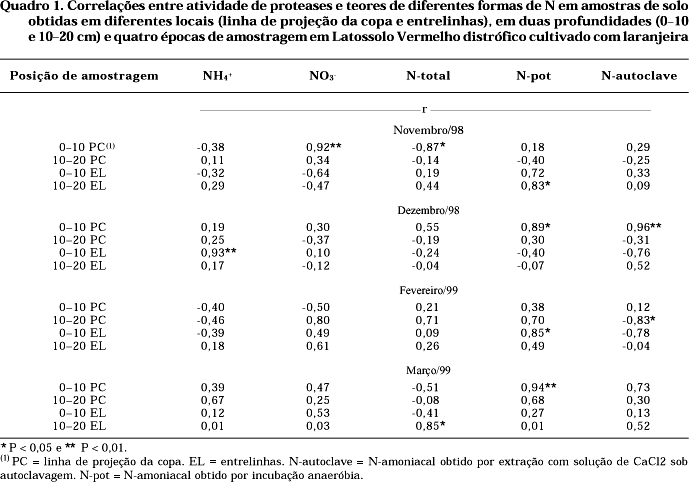
Os melhores coeficientes de correlação entre a atividade de proteases e os teores de N-pot e N-autoclave foram obtidos para as amostras coletadas na linha de projeção da copa (0—10 cm), em dezembro/98 e março/99 (Quadro 1). Constatou-se estreita relação entre a atividade de proteases e o N-pot, o que pode ser atribuído à participação destas no primeiro passo do processo de mineralização do N-protéico. Desta forma, a maior freqüência de correlações significativas e positivas foi obtida para o N-pot em amostras obtidas na linha de projeção da copa (0—10 cm).
Vários autores têm encontrado correlações entre a atividade de proteases e o teor de N-pot (Yamada & Okino, 1989; Bohm & Ahrens, 1990; Bonmati et al., 1991; Shindo, 1995; Pansombat et al., 1997; Silva et al., 1998). A variabilidade dos resultados, considerando o local, profundidade e época de amostragem, é devida às condições climáticas, edáficas e culturais (Ross & Macneilly, 1975; Hadas et al., 1996; Badalucco et al., 1997).
Considerando que a avaliação da atividade de proteases é muito mais rápida que a avaliação de N-pot (1 h e sete dias, respectivamente), a substituição do N-pot pela atividade de proteases seria interessante. Todavia, há necessidade de mais estudos a fim de calibrar esta avaliação como método para estimar a disponibilidade de N para plantas de laranjeira.
Os coeficientes de correlação entre a atividade de proteases, os teores de N no solo das amostras de março/99 (época da diagnose foliar) e as demais épocas de amostragem foram baixos (Quadro 2). Isso se deve à alta variância não explicada dos dados, ocasionada pela ampla variação entre épocas, locais e profundidades de amostragem.
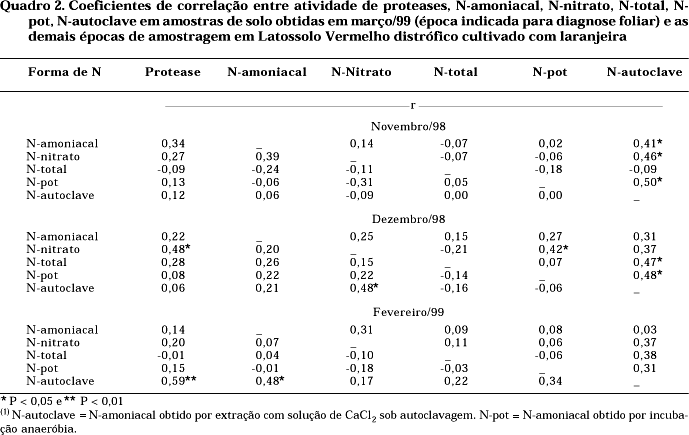
Os coeficientes de correlação entre a atividade de proteases, os teores de N no solo obtidos por diferentes métodos e o teor de N-foliar, em novembro/98, foram significativos e positivos para o N-amoniacal em amostras coletadas nas entrelinhas (0—10 cm) (r = 0,88*) e significativos e negativos para o N-total em amostras obtidas nas entrelinhas (10—20 cm) (r = -0,89*). Em dezembro/98, os coeficientes de correlação foram significativos e positivos para a atividade de proteases e o N-foliar em amostras obtidas na projeção da copa e nas entrelinhas (ambas a 0—10 cm) (r = 0,66* e r = 0,90*, respectivamente), para o N-amoniacal em amostras obtidas na linha de projeção da copa e nas entrelinhas (ambos a 0—10 cm) (r = 0,74* e r = 0,97**, respectivamente) e para o N-total em amostras obtidas na linha de projeção da copa (0—10 cm) (r = 0,74*) (Quadro 3).
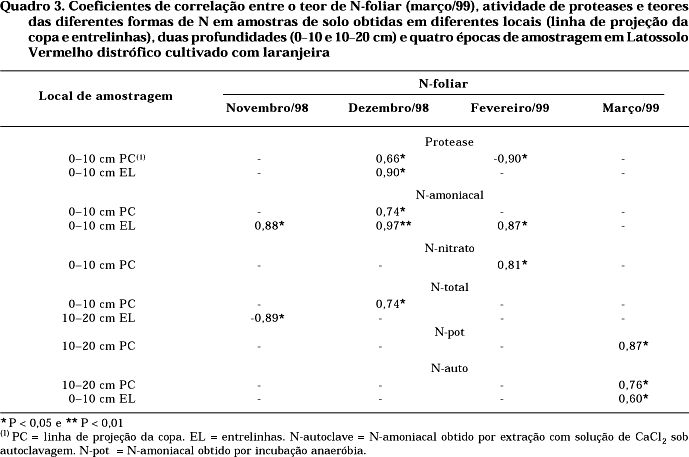
Em fevereiro/99, os coeficientes foram significativos e positivos para o N-amoniacal em amostras obtidas nas entrelinhas (0—10 cm) e para o N-nitrato em amostras obtidas na linha de projeção da copa (0—10 cm) (r = 0,87* e r = 0,81*, respectivamente), enquanto coeficiente significativo e negativo foi obtido para atividade de proteases (r = -0,90*) (Quadro 3).
Finalmente, na amostragem realizada em março/99, coeficientes de correlação significativos e positivos foram obtidos para o N-autoclave em amostras obtidas na linha de projeção da copa (10—20 cm), e para o N-autoclave em amostras obtidas na linha de projeção da copa (10—20 cm) e entrelinhas (0—10 cm) (r = 0,87*, r = 0,76* e r = 0,60*, respectiva-mente).
Correlações significativas entre o N-foliar e o N-autoclave também foram observadas por Campbell et al. (1993) e Gianello et al. (2000).
Correlações significativas entre N foliar, obtido no momento da diagnose foliar, atividade de proteases e outros métodos de avaliação de disponibilidade de N ocorreram, com maior freqüência, em amostras obtidas na profundidade de 0—10 cm, o que se atribui à maior atividade dos microrganismos decorrente do maior aporte de material orgânico.
Como o que se busca é um método que permita estimar a disponibilidade de N para a laranjeira em avaliação que anteceda a aplicação do fertilizante nitrogenado, 40 % em setembro-outubro, 30 % em dezembro-janeiro e 30 % em março-abril, segundo Malavolta et al. (1994), pode-se concluir que o N-amoniacal e a atividade de proteases em virtude das correlações obtidas com o N-foliar (Quadro 3), seriam métodos que, devidamente calibrados, poderiam atingir aquele escopo.
O N-autoclave e o N-pot, por terem apresentado correlações com o N-foliar em amostras obtidas no momento da diagnose foliar, quando já seria tarde a aplicação do fertilizante nitrogenado para a produção do ano, talvez possam ser de utilidade na programação da fertilização para o ano agrícola seguinte. Há que considerar, contudo, que são métodos demorados.
1. A atividade de proteases variou com o local e com a profundidade de amostragem, tendo sido mais alta na linha de projeção da copa e profundidade de 0—10 cm.
2. A aplicação de fertilizante orgânico causou aumento na atividade de proteases, principalmente na camada de 0—10 cm.
3. O grau de correlação entre a atividade de proteases e os outros métodos para avaliação da disponibilidade de N dependeu da época, do local e da profundidade de amostragem.
4. As correlações entre a atividade de proteases, as várias formas de N do solo (N-amoniacal, N-nitrato, N-autoclave e N-pot) e o N-foliar no momento da diagnose variaram com a época de amostragem.
5. A atividade de proteases poderá vir a ser um método para programação da fertilização nitrogenada para a cultura do citros, uma vez que se correlaciona com o N-foliar usado para fins de diagnose.
Os autores agradecem à FAPESP (Fundação de Amparo à Pesquisa do Estado de São Paulo), pelo apoio financeiro; ao citricultor, Engº-Agrº Wanderley Zucchi Rodas, em cuja propriedade a pesquisa foi desenvolvida; à CAPES, pela bolsa de mestrado concedida ao primeiro autor, e à Engª.-Agrª. Andréa Cristiane Sanches, pela colaboração nos trabalhos de campo.
ALEF, K. & NANNIPIERI, P. Protease activities. In: ALEF, K. & NANNIPIERI, P., eds. Methods in applied soil microbiology and biochemistry. New York, Academic Press, 1995. p.313-315.
ALEF, K.; BECK, T.; ZELLES, L. & KLEINER, D. A comparasion of methods to estimate microbial biomass and N-mineralization in agricultural and grassland soils. Soil Biol. Biochem., 20:561-565, 1988.
AMBROZ, Z. Factors influencing distribuition of some proteolytic enzyme in soils. Zentr. fur Bakt.,125:433-437, 1970.
BADALUCCO, L.; KUIKMAN, P.J. & NANNIPIERI, P. Protease and deaminase activities in wheat rhizosphere and their relation to bacterial and protozoan populations. Biol. Fert. Soils, 23:99-104, 1997.
BOHM, H. & AHRENS, E. The influence of different tillage method on nitrogen mineralization and protease activity — long term experiments at 5 sites. Verb. Deut. Landwirt. Unters. und Forschung, 32:683-688, 1990.
BONMATI, M.; CECCANTI, B. & NANNIPIERI, P. Spatial variability of phosphatase, urease, protease, organic carbon and total nitrogen in soil. Soil Biol. Biochem., 23:391-396, 1991.
BREMNER, J.M. & KEENEY, D.R. Steam-destillation methods for determination of ammonium, nitrate and nitrite. In: BLACK, C.A., ed. Methods of Soil Analyses: part 2. Madison, American Society of Agronomy, 1572p. 1965.
BURNS, R.G. Enzyme activity in soil: location and possible role in microbial ecology. Soil Biol. Biochem., 14:423-427, 1982.
CAMPBELL, C.A.; ELLERT, B.H. & JAME, Y.W. Nitrogen mineralization potential in soils. In: CARTER, M.R., ed. Soil Sampling and Methods of Analysis. Canadian Society of Soil Science, Lewis Publisher, 1993. p.341-349.
GIANELLO, C.; CAMARGO, F.A.O.; REICHMANN, E. & TEDESCO, M.J. Avaliação da disponibilidade do N do solo estimada por métodos químicos. R. Bras. Ci. Solo, 24:93-101, 2000.
HADAS, A.; KAUTSKY, L. & PORTNOY, R. Mineralization of composted manure and microbial biomass dynamics in soil as affected by long-term nitrogen management. Soil Biol. Biochem., 28:733-738, 1996.
HAYNES, R.J. & SWIFT, R.S. Effects of lime and phosphate additions on changes in enzyme activities, microbial biomass and levels of extractable nitrogen, sulphur and phosphorus in an acid soil. Biol. Fert. Soils, 6:153-158, 1988.
KANDELER, E.; PALLI, S.; STEMMER, M. & GERZABEK, M.H. Tillage changes, microbial biomass and enzyme activies in particle-size fractions of a Haplic Chernozem. Soil Biol. Biochem., 31:1253-1264, 1999.
KEENEY, D.R. Availability index. In: PAGE, A.L.; MILLER, R.H. & KEENEY, D.R., eds. Methods of soil analisys. America Society of Agronomy, 1982, p.711-733.
KEENEY, D.R. & BREMNER, J.M. A chemical index of soil nitrogen availability. Nature, 211:892-893, 1966.
[ Medline ]
MALAVOLTA, E.; PRATES, H.S.; CASALE, H. & LEÃO, H.C. Seja o doutor de seus citros. Info. Agron., 65:1-22, 1994.
MALAVOLTA, E.; VITTI, G.C. & OLIVEIRA, S.A. Avaliação do estado nutricional das plantas: princípios e aplicações. Piracicaba, Associação Brasileira para Pesquisa da Potassa e do Fosfato, 1989. 201p.
MELO, W.J. Variação do N-amoniacal e N-nítrico em um Latossolo Roxo cultivado com milho (Zea mays L.) e com lablab (Dolichos lablab L.). Piracicaba, Escola Superior de Agricultura "Luiz de Queiroz" 1974, 104p. (Tese de Doutorado)
MELO, W.J.; CARDOSO, E.J.B.N. & SUZUKI, J. Variação do N-nítrico e N-amoniacal em um Latossolo Roxo cultivado com Zea mays, L. (milho). Científica, 3:263-276, 1975.
PANSOMBAT, K.; KANAZAWA, S. & HORIGUCHI, T. Microbial ecology in tea soils. Soil Sci. Plant. Nutr., 43:431-438, 1997.
QUAGGIO, J.A.; RAIJ, B. van; CANTARELLA, H.; TEÓFILO SOBRINHO, J.; RODRIGUES, O.; BATAGLIA, O.C.; SANCHES, A.C.; BLASCO, E.E.A.; NEGRI, J.D.; MALAVOLTA, E. & VITTI, G.C. Citros: laranja, limão, tangerina, murcota. In: RAIJ, B. van; CANTARELLA, H.; QUAGGIO, J.A. & FURLANI, A.M.C. Recomendações de adubação e calagem para o estado de São Paulo. 2.ed. Campinas, Instituto Agronômico e Fundação, IAC. 1996. 285p. (Boletim Técnico, 100)
ROSS, D.J. & MACNEILLY, B.A. Studies on a climosequence of soils in Tussock grassland. 3. Nitrogen mineralization and protease activity. N. Zealand. J. Sci., 3:134-147, 1975.
SANCHES, A.C; SILVA, A.P.; TORMENA, C.A. & TRIGOLIN, A.T. Impacto do cultivo de citros em propriedades químicas, densidade do solo e atividade microbiana de um Podzólico Vermelho-Amarelo. R. Bras. Ci. Solo, 23:91-99, 1999.
SARRUGE, J.R. & HAAG, H.P. Análises químicas em plantas. Piracicaba, ESALQ/USP, 1974. 56p.
SHINDO, H. Effect of continuous compost application on the activities of protease, beta-acetylglucosaminidase, and adenosine deaminase in soils of upland fields and relationship between the enzyme activities and the mineralization of organic nitrogen. Jap. J. Soil Scie. Plant. Nutr., 63:190-195, 1995.
SHUET, A.R.; PERES, J.R.R. & VARGAS, M.A.T.N. In: Solos dos cerrados: tecnologias e estratégias de manejo. GOEDERT, W.J., ed. São Paulo, Nobel, 1985. p.167-202.
SILVA, E.T.; MELO, W.J. & TEIXEIRA, S.T. Soil protease activity and nitrogen availability to sorghum. In: CONGRES MONDIAL DE SCIENCE DU SOL, 16., Montepellier - França, 1998. Summaries. Montepellier, 1998, p.1-234.
SUTTNER, T. & ALEF, K. Correlation between the arginine ammonification, enzyme activities, microbial biomass, physical and chemical properties of diferent soils. Zentra. Mikrob., 143:569-573, 1988.
TATE, R.L.III; PARMELEE, R.W.; EHRENFELD, J.G. & O'REILLY, L. Nitrogen mineralization: root and microbial interaction in pitch pine microcosms. Soil Scie. Soc. Am. J., 55:1004-1008, 1991.
YAMADA, R. & OKINO, H. Soil enzyme activities in three kinds of soils with successive application of organic matter. Relationship between soil enzyme activities (cellulase, beta-glucosidase, protease and phosphatase) and natural substrate content. Res. Bul. Aichi Ken Agri. Res. Center, 21:273-280, 1989.
1. Parte da Tese de Mestrado do primeiro autor apresentada na Faculdade de Ciências Agrárias e Veterinárias — FCAV/UNESP.
E. T. SilvaI; W. J. MeloII
wjmelo[arroba]fcav.unesp.br
IPós-Graduanda da Faculdade de Ciências Agrárias e Veterinárias — FCAV/UNESP. Rodovia Carlos Tonani, Km 5, CEP 14870-000 Jaboticabal (SP). E-mail: ericatome[arroba]bol.com.br
IIProfessor Titular em Bioquímica do Departamento de Tecnologia, FCAV/UNESP. E-mail: wjmelo[arroba]fcav.unesp.br
 Página anterior Página anterior |   Voltar ao início do trabalho Voltar ao início do trabalho | Página seguinte  |
|
|
|